全球变暖日益明显,将导致全球范围内有关环境、科学、经济以及政治等一系列相关问题[1],而CO2作为对温室效应影响最大的气体物质[2]得到广泛关注. 化学吸收法是行之有效的碳捕集技术[3-4],氨法脱碳技术作为化学吸收法的一种,具有吸收剂不易被氧化降解,较高CO2吸收载荷[5],能耗远低于Mono Etobaccool Amine(MEA)[6],无腐蚀性问题,且有望实现各酸性气体的联合脱除[7]等优点. 氨法捕集CO2因其独到的优势和广阔的研究前景而被众多研究者所青睐. 但是该技术尚存在如下问题:1) 氨逃逸问题,Corti等[8]使用Aspen PlusTM模拟加压氨水脱碳系统,在氨水质量分数为2%~4%时,系统尾部烟气中NH3体积分数达0.4%~1.2%,且随着氨水浓度的增大,氨的逃逸量会进一步增大. 2) 吸收速度慢,虽然氨水吸收CO2的吸收速率比较高,但是反应后期由于水解速度慢造成整个过程吸收速率均降低. 在室温条件下,乙醇胺吸收CO2平均反应速率比氨法高9倍左右,氨法吸收速率要低于羟乙基乙二胺(AEEA)、二乙烯三胺(DETA)及吡嗪酰胺(PZ)等其他吸收剂的反应速率[9-10]. 由实验室的实验数据可知,CO2的氨水吸收速率跟液相NH3浓度的二次方成正相关关系[11]. 3) 能耗高. Yeh[12]等认为,以当前热再生技术为标准,经过再生的吸收剂其吸收效率及担载能力并不理想,尚不能达到“高效脱除”及“低损失循环”的要求.
针对以上问题,本文提出了低碳化度氨水强化结晶工艺. 当碳化氨水达到0.45时,将其引入到结晶器中,通过添加溶析剂的方法强化碳化液结晶. 经过固液分离装置分离,晶体被送至再生塔进行解吸,解吸后的混合气体经过氨碳分离装置进行分离,NH3被分离出来与固液分离装置分离后的溶液一起送回吸收装置中作为吸收剂循环使用. 晶体被送至再生塔进行解吸,解吸后的混合气体经过氨碳分离装置进行分离,NH3被分离出来送回吸收装置中作为吸收剂循环使用.
1 实验系统及测量方法 1.1 试验系统新工艺以250 mL洗气瓶作为鼓泡反应器的主体. 配气装置由N2与CO2气瓶组成,产生一定配比的模拟烟气,通入恒温水浴中的反应器,然后依次经两次水洗处理尾气后,排入大气. 经过碳化后的富液以及晶体产物由去离子水溶解后由自动滴定仪进行滴定分析.
1.2 液相分析采用上海精密科学仪器有限公司雷磁仪器厂生产的ZDJ-5型自动滴定仪. 滴定过程中电脑会记录整个过程的pH值和pH值的变化率(Exponent Rate of Change,ERC),并根据变化率给出滴定过程的平衡点[13].
2 实验结果与讨论氨水吸收CO2的过程变得十分复杂,影响因素较多,如浓度、温度、压力等[14-16]. 碳化氨水是成分复杂的混合物,分子状态主要有大量水分子、少量氨分子以及NH2COONH4分子,离子状态的主要有NH4+、HCO-3、CO2-3、NH2COO-[17-18]. 不同的反应条件在相同反应时间内产生碳化液中组分会有所不同,所以结晶规律会随之改变.
实验参数如下:水浴温度30 ℃,氨水质量分数10%,气体流量1 L/min,吸收液体积100 mL,CO2的体积分数14%,碳化时间2 h. 每组实验选取的碳化液为5 mL,添加方式默认为反添加(将碳化液加入到溶析剂中).
2.1 不同反应温度产生碳化液的结晶规律 2.1.1 反应温度对于吸收过程的影响溶液中N只存在于游离氨以及各类铵根离子中,而C全部来源于CO2的吸收过程,因此溶液中C、N的含量可以表征溶液中含碳离子以及游离氨和各类铵离子的多少. 由图 1发现,温度对于碳化液的影响是双面的,随着温度的升高,碳化液中氨以及各类铵盐的含量越来越少,意味着氨逃逸量越来越多. 温度对氨逃逸的作用主要体现在以下方面:首先,作用于游离氨的离子化程度,如图 1所示,随着温度的上升,离子化程度变大,导致游离氨数量减少,解吸速率下降;其次,温度可以影响气液平衡. 温度升高,导致亨利系数变大[19],在氨浓度相同时,平衡分压增大,将导致传质推动力增大,使传质速率变大,促使液相氨不断逃逸到气相.
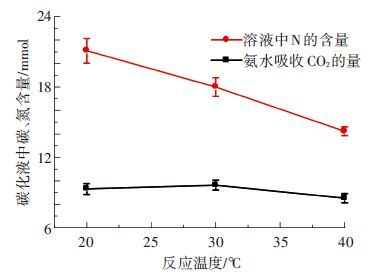
|
图 1 碳化液中碳氮含量随反应温度的变化 |
从图 1中可知,当反应温度为30 ℃时,其捕碳量最高,这与马双忱等[20]的研究结果一致. CO2的吸收效果随着温度的升高总体上呈上升趋势,因为反应的标准摩尔生成焓为正值,随着温度升高反应向吸收CO2的方向进行. 但氨逃逸量随着温度的升高呈增加趋势,因此高温时虽然吸收效果好,但由于氨逃逸量增加,使得后期有效吸收剂减少,造成反应后期对CO2的吸收量下降. 反应温度为30 ℃既能满足吸收效率,又可以将氨逃逸量控制在一定范围内,所以此时对CO2的捕集效果更好.
2.1.2 反应温度对于后期结晶过程的影响由图 2可见,20 ℃水浴温度下结晶中碳和氮的含量均明显高于其他两者. 主要原因是40 ℃水浴温度时,由于温度高造成氨大量逃逸,使得碳化液中氨分子以及相应铵盐减少,对于结晶过程相当于溶质浓度较低,造成结晶较少,当碳化液中有足够的氨分子不断水解补充因结晶而减少的铵离子时,会使结晶出来的铵根离子增多,符合实验所得趋势. 由2.1.1可知,30 ℃水浴温度对于CO2的吸收有一定促进作用,因此在30 ℃水浴条件下产生的碳化液中含碳离子要高于其他条件时,因此晶体中含碳量高于40 ℃水浴条件下晶体中含碳量. 与20 ℃水浴条件下碳化液比较,由于其CO2吸收量差距较小,但是碳化液中氨及各铵离子差距较大,在两者的综合作用下,导致20 ℃水浴温度条件下结晶中含碳量高于其他工况.
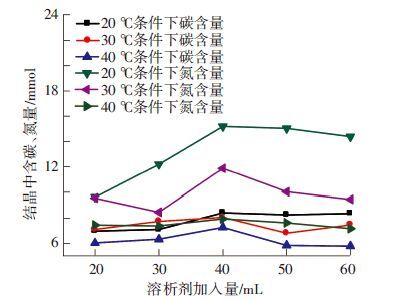
|
图 2 不同水浴温度下产生碳化氨水结晶中含碳、氮量随溶析剂量的变化 |
如图 3可见,不同水浴温度下碳化氨水碳和氮的收率随溶析剂量的变化情况与结晶中含碳量和含氮量的变化大体相同. 不同水浴温度下,产生的碳化液中含碳离子和含氮离子的量不同,因此只有进一步比较碳和氮的收率才能更准确的分析结晶过程. 当碳化液的捕碳量相差不多时,碳化液中氨分子以及氨类离子量的增多,对于结晶有促进作用. 阴离子含量相近,阳离子增多使得溶质的质量增多,促进结晶,而氨分子又可以不断水解补充阳离子的消耗,因此可以进一步促进结晶.
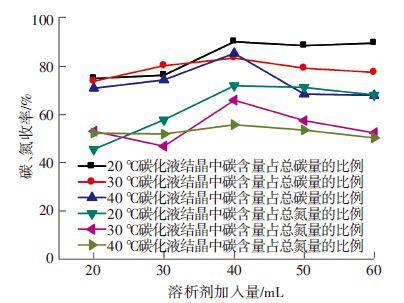
|
图 3 不同水浴温度下碳化氨水中碳、 氮收率随溶析剂量的变化 |
图 4为不同烟气流量条件下溶液吸收CO2的量以及游离氨和含氨离子总量随气体流量的变化. 模拟烟气流量与CO2吸收量呈正相关趋势,但是在气体流量从1.5 L/min上升到2.0 L/min的过程中,其吸收量的上升趋势变缓,因为大烟气流量带来大量CO2,可以在一定程度上促进吸收. 烟气流量主要在气液两相之间的接触效果方面起作用[21],表现在以下方面:首先由于烟气流量变大,CO2与吸收剂之间两相接触时间变小,阻碍反应的进一步进行;其次是由于气体流量变大,使得气体在液相造成强烈湍动,易于CO2吸收过程的进行. 与此同时,气体流量的上升使得单位时间进入吸收液的CO2量增大,进一步强化了CO2的吸收过程.
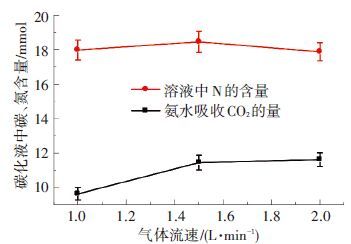
|
图 4 碳化液中碳氮含量随气体流量的变化 |
气体流量对于氨逃逸的影响主要体现在以下方面:首先,由于烟气流量增大,加快了反应中气相的更新,不断将已经逃逸出来的氨气带走,使得气相的氨气分压降低,使液相到气相的传质推动力增大,因此加速了氨的逃离;其次,烟气流量增大,使得气流携带能力增强,在相同时间内携带出来的氨量增多. 但由于气体流量增大也会使CO2的吸收量增大,使得溶液中游离氨降低,产生铵离子,在一定程度上固定了氨,降低了液相氨的分压,所以在一定程度上又降低了传质推动力. 因此由上述因素综合作用使得溶液中游离氨和含氨离子随烟气流量的增多呈先上升后下降的趋势.
2.2.2 气体流量对于后期结晶过程的影响由图 4可以发现,随着气体流量的增大,碳化液中碳酸根离子不断增大. 由图 5可见,碳化液中碳酸根离子不断增多促进结晶进程,使得以结晶形式析出的含碳离子量跟碳化液中含碳离子含量成正比关系. 随着气体流量的增大,含碳离子的结晶量不断变大. 由于吸收CO2的增多,使得液中游离氨减少,离子状态氨增多,一方面可以起到对于氨的固定作用,另一方面铵根离子和含碳离子的增多使得碳化液中溶质质量增多,促进结晶析出. 因此,氨以及铵根离子析出量的趋势如图 5所示,在不同溶析剂加入量的条件下,高气体流速工况下产生碳化氨水的铵根离子等的析出量均高于其他两种气体流速的工况.
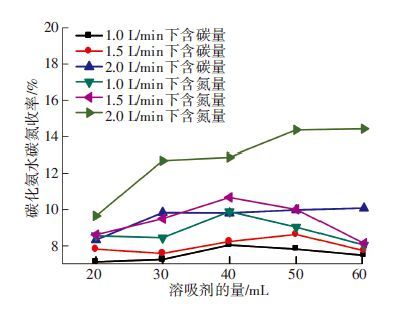
|
图 5 不同气体流速下产生碳化氨水结晶中含碳、氮量随溶析剂量的变化 |
由上面分析可知,在1.5 L/min气体流量条件下碳化氨水产生结晶中碳的含量高于1.0 L/min. 但是,如图 6可见,对于结晶过程中碳收率来说前者却低于后者. 气体流速为2.0 L/min时,虽然碳化氨水中总碳量很高,其碳收率也是最高的. 由于3种工况下碳化液中铵根离子等的含量相差不多,所以与图 6相差无几. 当吸收剂等其他工况相同时,高气体流量工况下产生的碳化液对于结晶过程有促进作用. 但是对于碳和氮的结晶收率来说其影响因素还有待进一步研究.
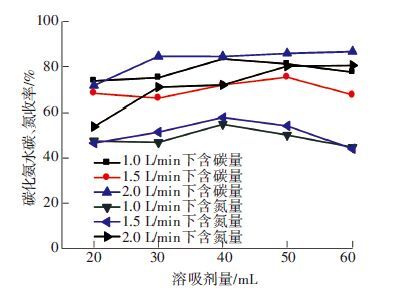
|
图 6 不同气体流速下碳化氨水碳、氮收率随溶析剂量的变化 |
如图 7所示,随着模拟烟气中CO2体积分数变大,CO2的吸收量逐渐变大. 模拟烟气中CO2所占百分比主要作用于吸收过程中气相的CO2分压力,影响气相CO2向液相传质过程. 因此,随着模拟烟气中CO2体积分数的变大,CO2在气相的分压也越来越大,增大了气液两相的传质推动力,使得吸入液相中的CO2增多. 吸收液中的氨随着烟气中CO2体积分数的增大而增大,也就是说在一定程度上抑制了氨逃逸.
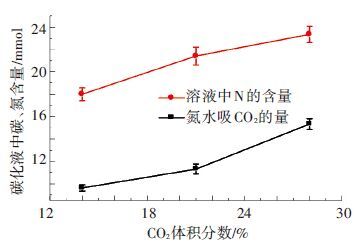
|
图 7 碳化液中碳氮含量随着烟气中CO2体积分数的变化 |
由上面分析可知,随着模拟烟气中CO2气体分数的增多,碳化液中含碳离子和游离氨以及铵根离子的量均升高,使得溶质量增多,结晶过程直接推动力增大,使得结晶出的含碳离子和含氮离子均增多. 与图 8所描述的变化一致. 从图 8中同样可以发现,模拟烟气CO2体积分数高时所产生碳化液对于含碳离子结晶的影响是直接的,其影响作用要高于对含氨离子的结晶情况,因为CO2体积分数的升高,碳化液中碳的升高量高达59.3%,而对于碳化液中游离氨以及铵根离子的提高仅为29.7%.
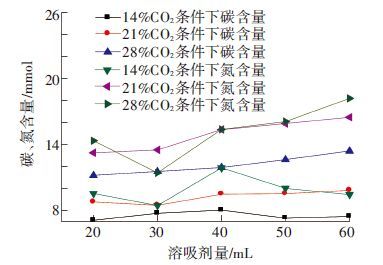
|
图 8 不同CO2体积分数条件下产生碳化氨水结晶中碳氮含量随溶析剂量的变化 |
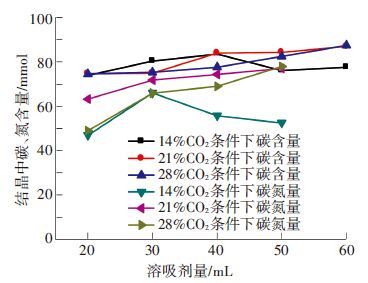
不同体积分数CO2的烟气对于结晶过程中碳和氮收率的影响比较复杂,见图 9.
|
图 9 不同CO2体积分数条件下产生碳化氨水碳、氮收率随溶析剂量的变化 |
由图 9可知,当加入溶析剂的量最大时,高CO2体积分数烟气条件下产生碳化液碳和氮的收率很高,但是在其他溶析剂量的工况下,高CO2体积分数烟气条件下产生碳化液对于碳和氮的收率没有明确的促进效果,主要原因是CO2体积分数的升高导致碳化液中碳的升高量高达59.3%,使得少量的溶析量无法使溶析结晶效果发挥充分.
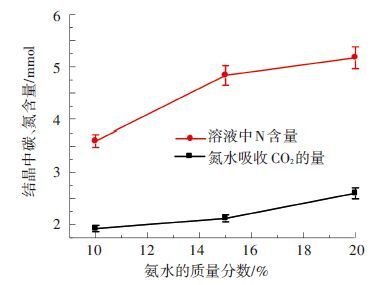
2.4 不同氨水浓度产生碳化液的结晶规律 2.4.1 不同氨水浓度对于吸收过程的影响如图 10所示,随着氨水浓度的升高,CO2的吸收量增多,吸收液中游离氨以及含氨离子同时增多. 原始吸收液的氨浓度高,游离氨的量也高,游离氨的增多有利于反应正向移动,促进了CO2的吸收过程,同时提高了CO2的吸收速率以及整个吸收过程的吸收量. 但是,由于高氨水浓度使得液相的游离氨增多,使得氨在液相的分压升高,液相到气相传质推动力增大,促进了氨逃逸,造成吸收剂的浪费,因此综合考虑,对于吸收过程来说不建议选取过高氨水浓度的吸收剂[22].
|
图 10 碳化液中碳、氮含量随着氨水质量分数的变化 |
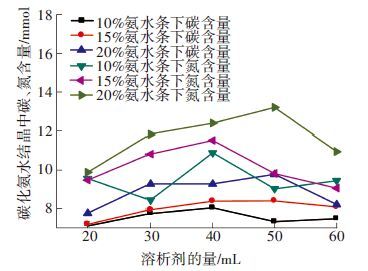
如图 11所示,随着氨水浓度的升高,结晶中碳和氮的含量均呈上升趋势,主要原因是吸收液浓度升高促进了CO2的吸收过程,使溶质量升高,混合溶剂中过饱和度增大,结晶过程得到促进,因此析出结晶中碳氮含量均增大.
|
图 11 不同氨水质量分数条件下产生碳化氨水结晶中碳、氮含量随溶析剂量的变化 |
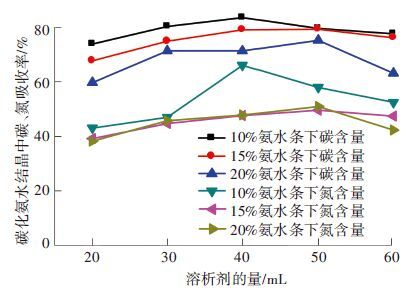
比较图 12与图 11可发现,结晶中含碳氮量的变化趋势与结晶过程碳和氮收率呈完全相反的变化,碳和氮的收率均随着氨水浓度的升高而降低. 主要原因是随着氨水浓度的升高,在相同反应时间内,吸收剂未得到充分反应. 具体原因如下[23]:氨基甲酸铵(NH4COONH2)、碳酸铵((NH4)2CO3)、碳酸氢铵(NH4HCO3)分别为氨水与CO2反应过程中的产物. 当碳担载度低时,溶液主要存在的是氨基甲酸铵(NH4COONH2),随着碳担载度的进一步提高,溶液中碳酸氢铵(NH4HCO3)和碳酸铵((NH4)2CO3)含量逐渐提高. 氨基甲酸铵(NH4COONH2)在水溶液和乙醇溶液中的溶解度均高于碳酸氢铵(NH4HCO3)和碳酸铵((NH4)2CO3),因此氨基甲酸铵在水和乙醇的混合吸收剂中的溶解度也要高于其他两种产物,由此可见碳化程度高有利于结晶过程. 因此高氨水浓度的吸收液在同样的反应时间内其碳的担载度比较低,不利于结晶.
|
图 12 不同氨水质量分数条件下产生碳化氨水碳、氮收率随溶析剂量的变化 |
1) 在较低的吸收温度条件下,可以有效地控制氨的逃逸量,可以在一定程度上提高CO2的吸收. 从结晶过程来看,低吸收温度使得液相氨以及各类含氨离子高于其他工况,可以促进结晶过程,建议吸收温度为20 ℃.
2) 高气体流量有利于CO2的吸收,但当气体流量过大时又会在一定程度上增加氨逃逸. 高气体流速可以使得碳化液碳化程度升高,而高碳化度的碳化液有利于后期的结晶过程.
3) 高CO2体积分数工况既可以促进CO2的吸收过程,使捕碳量增多59.3%,同时又可以起到对于氨的固定作用. 高CO2体积分数工况下产生的碳化液,有利于结晶过程. 在溶析剂充分多的情况下,高CO2体积分数工况下产生碳化液对于碳和氮的收率有促进作用.
4) 高浓度氨水作为吸收剂在相同反应时间内,促进结晶,但是对于结晶碳和氮收率,其趋势却恰恰相反.
| [1] |
GEORGIOS A, PAUL C. Global warming and carbon dioxide through sciences[J].
Environ Int,2009 (35) : 390-401.
( 0) 0)
|
| [2] |
ZHAO B T, Su Y X, Tao W W, et al. Post-combustion CO2 capture by aqueous ammonia: A state-of-the-art review[J].
International Journal of Greenhouse Gas Control,2012 (9) : 355-371.
( 0) 0)
|
| [3] |
TOBIESEN F A, JULIUSSEN O, SVENDSEN H F. Experimental validation of a rigorous desorber model for CO2 post-combustion capture[J].
Chemical Engineering Science,2008, 63 (10) : 2641-2656.
( 0) 0)
|
| [4] |
CHEN E. Carbon dioxide absorption into piperazine promoted potassium carbonate using structures packing[D]. Austin: the University of Texas at Austin, 2007.
( 0) 0)
|
| [5] |
YEH A C, BAI H. Comparison of ammonia and monoethanomine solvents to reduce CO2 greenhouse gasemissions[J].
The Science of the Total Environment,1999 (228) : 121-133.
( 0) 0)
|
| [6] |
晏水平, 方梦祥, 张卫风, 等. 烟气中CO2化学吸收法脱除技术分析与进展[J].
化工进展,2006 (9) : 1018-1024.
( 0) 0)
|
| [7] |
KIM Y J, YOU J K, HONG W H, et al. Characteristics of CO2 absorption into aqueous ammonia[J].
Separation Science Technology,2008, 43 (4) : 766-777.
( 0) 0)
|
| [8] |
CORTI A, LOMBARDI L. Reduction of carbon dioxide emissions from a SCGT/ CC by ammonia solution absorption —preliminary results[J].
International Journal of Thermodynamics,2004 (7) : 173-181.
( 0) 0)
|
| [9] |
QIN F, WANG S J, HARTONO A, et al. Kinetics of CO2 absorption in aqueous ammonia solution[J].
International Journal of Greenhouse Gas Control,2010, 4 (5) : 729-738.
( 0) 0)
|
| [10] |
PUXTY G,ROWLAND R,ATTALLA M.CO2 absorption rate measurements for aqueous ammonia[C]//Joint Seminar on CO2 Absorption Fundamentals. Trondheim: NTNU, 2009.
( 0) 0)
|
| [11] |
许家豪.烟气中CO2化学吸收法的研究 [D].台北:台湾国立成功大学,2003.
( 0) 0)
|
| [12] |
YEH J T, RESNIK K P, PYGLE K, et al. Semi-batch absorption and regeneration studies for CO2 capture by aqueous ammonia[J].
Fuel Processing Technology,2005 (86) : 1533-1546.
( 0) 0)
|
| [13] |
秦锋, 王淑娟, HALLVARDF S, 等. 碳化氨水中含碳量的分析及测量[J].
清华大学学报(自然科学版),2011 (4) : 488-492.
( 0) 0)
|
| [14] |
EDWARDS T J, NEWMAN J, PRAUSNITZ J M. Thermodynamics of aqueous solutions containing volatile weak electrolytes[J].
AIChE Journal,1975, 21 (2) : 248-259.
( 0) 0)
|
| [15] |
EDWARDS T J, NEWMAN J, PRAUSNITZ J M. Vapor-liquid-equilibria in multi-component aqueous-solutions of volatile weak electrolytes[J].
AIChE Journal,1978 (24) : 966-976.
( 0) 0)
|
| [16] |
PAZUKI G R, PAHLEVANZADEH H, MOHSENI A A. Solubility of CO2 in aqueous ammonia solution at low temperature[J].
Computer Coupling of Phase Diagrams and Thermochemistry,2006 (30) : 27-32.
( 0) 0)
|
| [17] |
WEN N P, MURRAY H B. Ammonium carbonate,ammonium bicarbonate,and ammonium carbamate equilibria: a raman study[J].
J Phys, Chem,1995, 99 (1) : 359-368.
( 0) 0)
|
| [18] |
HOLMESⅡP E, NAAZ M, POLING B E. Ion concentrations in the NH3-CO2-H2O system from 13C NMR spectroscopy[J].
Ind Eng Chem Res,1998 (37) : 3281-3287.
( 0) 0)
|
| [19] |
季广祥. 提高以氨作碱源焦炉煤气氧化法脱硫效率的必要条件[J].
煤化工,2009 (1) : 57-60.
( 0) 0)
|
| [20] |
马双忱, 孙云雪, 赵毅, 等. 氨水捕集模拟烟气中二氧化碳的实验与理论研究[J].
化学学报,2011 (12) : 1469-1474.
( 0) 0)
|
| [21] |
司南. 乙醇胺(MEA)溶液吸收CO2的试验研究[D]. 哈尔滨: 哈尔滨工业大学, 2009.
( 0) 0)
|
| [22] |
MANI F, PERUZZINI M, BARZAGLI F. The role of zinc (II) in the absorption-desorption of CO2 by aqueous NH3, a potentially cost-effective method for CO2 capture and recycling[J].
ChemSusChem,2008 (3) : 228-235.
( 0) 0)
|
| [23] |
DARDE V, THOMSEN K, WILLY J M, et al. Chilled ammonia process for CO2 capture[J].
Energy Procedia,2009 (1) : 1035-1042.
( 0) 0)
|
 2016, Vol. 48
2016, Vol. 48


