近年来,单壁碳纳米管(SWNTs)由于其独特的电学性质被广泛应用于电化学免疫传感器中[1-5],为实现现场低成本的快速、灵敏、准确的有害有毒物质的残留检测以及疾病的诊断提供了一种新方法,在生物医学、环境监测、食品安全和医药等领域有着广泛的应用前景.在电化学免疫传感器中,SWNTs在固定生物分子后必须保证生物分子的构型及活性,以完成抗原和抗体接触的特异性反应,但由于原始SWNTs的生物相容性及在溶剂中的分散稳定性较差[6-7],常需要对其表面进行功能化改性.目前,利用各种共价和非共价修饰方法得到的SWNTs分散液的浓度普遍偏低,而相比于共价修饰,非共价修饰利用两性分子对SWNTs的包覆[8-9],具有不破坏SWNTs本身结构和性能的优点.其中,两亲性嵌段共聚物非共价修饰碳纳米管的研究在国内比较少见,这类聚合物由于其疏水基团可以吸附在SWNTs表面,同时亲水基团伸向水溶液中产生空间位阻作用阻止碳管之间的聚集从而表现出优秀的分散性能[10-11].三嵌段共聚物Pluronic F108是一种生物相容性好的高分子聚合物,利用F108对SWNTs进行改性,不仅可以提高SWNTs的生物相容性,同时可以提高SWNTs在水中的分散效果和稳定性.
本文首先对F108修饰SWNTs的最适比例进行了探索,然后利用F108非共价改性混酸处理过的SWNTs,并利用各种表征手段对比了SWNTs、F108修饰SWNTs、羧基化SWNTs、F108修饰羧基化SWNTs在水中的分散性能,系统阐述了一种实现SWNTs在水中高效稳定分散的方法.制备的SWNTs分散液在快速检测方面的应用,有待做进一步的研究.
1 实 验 1.1 试剂与仪器单壁碳纳米管,直径1~2 nm,长度5~30 μm,纯度>95%,中科院成都有机所;三嵌段共聚物Pluronic F108(PEO136-PPO45-PEO136,Mw=14 600) ,Fluka公司;HNO3(浓度为68%)、H2SO4(浓度为98%)均为分析纯,国药集团化学试剂有限公司;实验用水为超纯水.
BS 224 S型电子天平,德国赛多利斯公司;MH-2微量振荡器,海门市其林贝尔仪器制造有限公司;KQ-500DE型超声清洗仪,昆山市超声仪器有限公司;85-2数显恒温磁力搅拌器,金坛市盛威实验仪器厂;砂芯抽滤装置,姜堰市夏南生化器械厂;UV-vis 2450紫外吸收光谱仪,日本岛津公司;HT 7700型透射电子显微镜,日本日立公司;Vertex 70型傅里叶变换红外光谱仪,德国BRUKER公司;HR 800型激光拉曼光谱仪,法国JOBINYVON公司;Zetasizer Nano ZS型激光粒度分析仪,英国Malvern Instrument公司.
1.2 F108修饰单壁碳纳米管最适比例的确定分别称取5.0 mg SWNTs与10 mL质量浓度依次为0.01、0.05、0.1、0.25、0.5、0.75、1、2、3、4 wt%的F108溶液混合.混合液首先置于微量振荡器震荡30 min,令碳管与F108充分接触.接下来在40 kHz条件下超声4 h,温度控制在25 ℃,即得不同浓度F108溶液修饰的SWNTs分散液.室温下静置两周后进行表征.
1.3 羧基化单壁碳纳米管的制备准确称取150 mg SWNTs置于150 mL浓硝酸和浓硫酸(体积比为3∶1) 混合液中,60~80 ℃搅拌20~60 min,50 ℃低功率超声1 h. 混合液经水稀释、过滤、反复洗至pH中性,室温干燥备用,记为SWNTs—COOH.
1.4 F108改性单壁碳纳米管分散液的制备分别称取10 mg SWNTs、SWNTs—COOH直接溶于10 mL水中,制成两份溶液.再分别称取10 mg SWNTs、SWNTs—COOH溶于10 mL的F108溶液中,制成两份溶液,F108溶液的浓度由2.2中选出的F108最适浓度决定.将四份溶液同时在微量振荡器上震荡30 min后超声分散4 h制成相同浓度的悬浮液.通过以上处理,得到SWNTs、SWNTs/F108、SWNTs—COOH、SWNTs—COOH/F108的四种水分散液,室温下静置两周后进行表征.
1.5 样品的表征利用紫外吸收光谱仪测量样品的光吸收性,测量时以分散剂F108的水溶液作紫外吸收的空白,波长扫描范围200~900 nm;利用透射电子显微镜观察样品的微观结构,样品均采用溶液法制样;红外光谱测试采用KBr压片法制样,扫描范围400~4 000 cm-1;拉曼光谱测试激发波长为514 nm,输出功率20 mW;有效粒径和Zeta电位测试时,悬浮液的pH值为中性;此外,把制得的碳纳米管分散液静置在水平的桌面上,用数码照相机拍照记录碳纳米管在水溶液中的分散稳定情况.
2 结果与讨论 2.1 不同质量浓度F108溶液对SWNTs分散的影响紫外-可见吸光光谱常被用来表征SWNTs分散体系的性质,它可以实时地反映出SWNTs分散体系性质的变化[12-13].图 1为SWNTs在不同浓度F108溶液中的UV-vis光谱图.
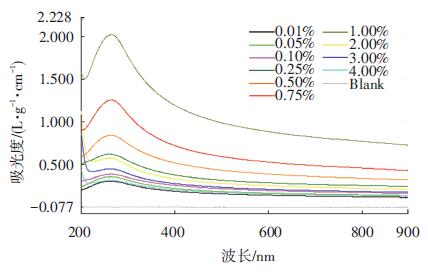
|
图 1 不同浓度的F108溶液对SWNTs分散效果影响的UV-vis光谱图 |
由图可见,样品在200~900 nm间有连续的吸收曲线,其中在260 nm附近为SWNTs苯环结构的特征吸收峰.在整个波长范围内,SWNTs在分散液中的浓度是随F108浓度的增加呈现先增加后降低的规律,在F108溶液质量浓度为1wt%时,碳管溶液在整个波长范围内的UV-vis吸光度最大,分散效果最好.据相关文献报道[14],当加入的表面活性剂浓度较低时,它对SWNTs起到分散作用;但当表面活性剂浓度达到一定值时,体系中的表面活性剂开始聚集成胶束,无法充分包裹在碳管表面,由于排空作用的影响,胶束的形成会使分散的SWNTs重新聚集,从而使得体系中分散的SWNTs量降低.
2.2 电镜表征利用透射电镜观察SWNTs、SWNTs/F108、SWNTs—COOH、SWNTs—COOH/F108的微观形貌,如图 2所示.TEM可以观察到SWNTs是中空的结构,SWNTs的中空结构使其TEM照片中两管壁的中间区域颜色较浅. 从图 2(a)中可以清楚地看到原始碳管长且相互缠绕,表面存在着金属催化剂及无定形碳等杂质.图 2(b)是SWNTs/F108的TEM,从图中可以看出SWNTs在F108溶液中多是以碳纳米管束(25~30 nm)的形态存在,图中的黑色物质据推测应为F108的结晶.图 2(c)为经过氧化改性的SWNTs,与原始SWNTs相比,SWNTs—COOH的缠绕程度得到明显改善,管束之间变得松散,有的SWNTs出现开口,因范德华力的存在,SWNTs仍是聚集成束存在.图 2(d)是SWNTs—COOH/F108的TEM,可以观察到经过羧基化的SWNTs在F108溶液中呈现单根或小管束的分散状态,分散的碳管直径大约为5 nm左右,碳管均匀分散在悬浮液中并且不再呈现聚集状.

|
图 2 不同化学处理的单壁碳纳米管的透射电镜图 |
为清楚地了解混酸处理前后SWNTs表面基团的变化,并证明F108成功地包覆到SWNTs表面,对样品进行了红外光谱表征.SWNTs—COOH/F108、F108和SWNTs—COOH的红外谱图如图 3所示,其中经过混酸处理后的SWNTs在3 421 cm-1,1 689 cm-1,1 631 cm-1和1 129 cm-1处的吸收带可分别归属于SWNTs表面上羟基—OH、羧基中CO的特征吸收峰、SWNTs的CC键骨架振动峰和羧基中C—O的特征吸收峰,这表明混酸处理在SWNTs的表面成功引入羧基.F108在2 970 cm-1和2 878 cm-1、1 252 cm-1和1 101 cm-1处的吸收带可分别归属于本身结构中的—CH3和C—O—C的反对称伸缩振动和对称伸缩振动.在SWNTs—COOH/F108的红外光谱中可以清楚地观察到F108的特征峰,这说明F108已经成功地包覆到了SWNTs上.
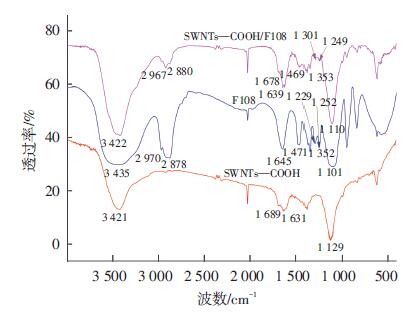
|
图 3 SWNTs—COOH/F108、F108和SWNTs—COOH的红外光谱图 |
为进一步比较不同化学处理对SWNTs结构的影响,采用拉曼光谱对样品进行表征.典型的SWNTs拉曼光谱图有三个主要的特征区域:在100~300 cm-1范围内存在的与SWNTs直径分布和聚集状态相关的径向呼吸模(RBM)、在1 250~1 450 cm-1范围内存在的与SWNTs晶格缺陷以及管壁上吸附的无定形碳等纳米尺寸的微晶存在有关的一个弱峰(D模)和1 550~1 600 cm-1范围内存在的管状石墨结构振动峰(G模)[15].D模和G模的强度比(ID/IG,I为特征峰的积分面积)常用来表征SWNTs的破损程度[16-17],ID/IG比值越大,SWNTs的破损程度越高.
图 4为SWNTs、SWNTs/F108、SWNTs—COOH、SWNTs—COOH/F108的拉曼光谱图.从图中可以看出,原始SWNTs的RBM峰的位置位于163 cm-1和263 cm-1处,根据公式d=223.75/RBM[15],可以求出SWNTs的平均直径分别为1.37 nm和0.85 nm.原始SWNTs的D峰不明显,说明原始SWNTs几乎没有缺陷.当SWNTs被分散到F108溶液中时,光谱图中仍然出现两个RBM峰,这说明F108可以分散两种不同直径的SWNTs.SWNTs/F108的D峰强度和锐度相较于原始SWNTs都发生了一些变化,但峰位移几乎不变,同时,两者在1 592 cm-1处的G峰相比,峰位置不变,峰强度有了明显的增加.为确定F108的包覆对SWNTs结构的影响,分别对SWNTs/F108的D峰和G峰的峰面积进行积分后计算相对强度,结果如表 1所示,由表可知F108包覆前后SWNTs的相对强度并没有太大的变化[18],这表明实验中所采用的超声条件与F108的包覆并没有对SWNTs的结构造成明显的破坏,生成的复合物很好地保留了SWNTs的一维纳米结构.相比于原始SWNTs,SWNTs—COOH的D模与G模的强度都有所增强,反映了碳管中sp2杂化的C—C键的振动在经过羧基化处理后得到了加强,说明了样品中所含杂质的减少.从表 1中可以看出,SWNTs—COOH的D模与G模的峰位移向高频方向移动,ID/IG的比值变大,说明SWNTs结构发生了变化,这是因为混酸处理使得SWNTs的端口被打开并且被截短,管壁上接枝了羧基和羟基,破坏了原始SWNTs的有序度.当SWNTs—COOH被分散到F108溶液中时,其ID/IG的值与SWNTs—COOH相比变化不大,说明F108的包覆并没有对碳管的结构造成明显的破坏,这与之前的结论是一致的.
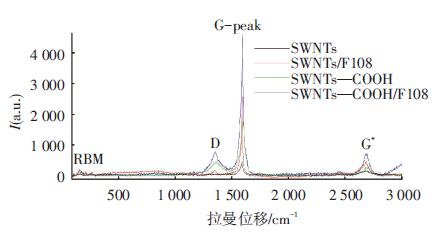
|
图 4 不同化学处理的单壁碳纳米管的拉曼光谱图 |
| 表 1 不同样品的散射峰位置和相对强度 |
随着纳米技术的发展,纳米材料的颗粒分布以及颗粒大小也是纳米材料表征的重要指标,激光粒度分析法因具有测量精度高、速度快、重复性好、可测的粒径范围广等特点已得到广泛应用.粒度分布可以用来判断分散系中颗粒所在范围的大小和相对的比例,是判断分散系是否稳定的重要参数;Zeta电位指的是分散粒子之间互相排斥的静电力,与分散系的稳定性也有密切的关系.
表 2是SWNTs、SWNTs/F108、SWNTs—COOH、SWNTs—COOH/F108悬浮液的平均粒径及Zeta 电位值.从表中可以看出,在pH为7时,原始SWNTs的平均粒径最大,为1 347 nm,而Zeta测试结果表明其负电位很小,这说明原始SWNTs之间相互缠绕(图 2a),并且碳管间的静电排斥作用很弱,非常易于形成大的团聚体.样品SWNTs/F108的Zeta电位较大,这是因为通过超声使团聚的原始碳管暂时的脱附和解聚,然后通过嵌段共聚物F108的包覆可以得到较稳定的管束(图 2b),并且使得悬浮液中粒子的平均粒径大大小于原始SWNTs.在样品SWNTs—COOH中,混酸处理减弱了碳管间的相互缠绕程度(图 2c),同时红外图谱(图 3)表明碳管表面修饰上了羧基和羟基基团,在水溶液中,由于羧基的解离,使得碳管表面带上了更多的负电荷,促使碳管之间形成较强的静电排斥力,所以悬浮液的Zeta电位由-2.2 mV降至-16.8 mV左右,较强的静电斥力有利于克服碳管之间的范德华引力,使的碳管间的缠绕程度进一步减弱,亲水性增强,在水中的分散更加均匀,相互之间不易形成大的聚集体,从而使平均粒径降至239.8 nm.SWNTs—COOH经F108包裹后粒径最小(图 2d),稳定性最好,这是由于其具有前两者的共同优势.
| 表 2 不同功能化处理对单壁碳纳米管平均粒径和Zeta电位的影响 |
图 5为SWNTs、SWNTs/F108、SWNTs—COOH、SWNTs—COOH/F108的水溶液静置一个月后的光学照片.如图所示,静置一个月后的原始SWNTs由于其容易团聚,表面静电排斥作用弱,均沉淀至试管底部,上层溶液完全澄清(图 5a).静置一个月后的SWNTs/F108有大量的析出(图 5b),说明随着时间的延长,大量SWNTs之间由于范德华力持续的相互吸引,会再次发生团聚.SWNTs—COOH在水中超声分散后能够持续稳定状态数十小时,但静置一个月后SWNTs—COOH从体系中几乎全部析出(图 5c),这是因为SWNTs—COOH表面存在着羧基等亲水性基团,这些基团在水中电离后于SWNTs表面形成负电静电层,亲水基的存在与强静电层排斥的双重作用使得SWNTs—COOH能够暂时的均匀、稳定的分散在水溶液中,但由于没有分散剂的存在,在其彼此间强大的范德华力及疏水相互所用力的作用下,分散的碳管再次重新聚集,最终形成沉淀.而SWNTs—COOH/F108的分散液在一个月后仍稳定存在(图 5d),是四者当中稳定性最好的.

|
图 5 不同化学处理的单壁碳纳米管在水中的分散性照片 |
总之,从分散液的浓度和稳定时间来看,SWNTs在水中的分散效果由好至差依次是SWNTs—COOH/F108、SWNTs/F108、SWNTs—COOH、SWNTs.其中未加入F108的SWNTs和SWNTs—COOH很快会发生团聚沉降.加入F108后,碳管的分散状况有明显的改善,但SWNTs—COOH/F108分散液的稳定时间远长于SWNTs/F108,这是因为在超声作用下SWNTs主要以管束为基本单位逐步解离,通过F108的包覆使得小碳纳米管束得以稳定的存在于水溶液中(图 2b),而SWNTs—COOH表面修饰了亲水基团,分散性得到了更好的改善,和原始SWNTs相比,SWNTs—COOH的整体结构更加疏松,加入F108超声处理后,更加有利于单根碳管的解离和F108分子的缠绕(图 2d),分散性能得以进一步的提高.
3 结 论利用混酸处理和超声解离SWNTs团聚体、F108保持SWNTs分散状态等多种处理方法的综合使用,实现了SWNTs在水中的高效、稳定分散.由于分散剂F108具有很好的生物相容性,对生物分子有一定的保护作用,使得这种分散性良好的SWNTs分散液有望广泛应用于生物传感器中.
| [1] |
PARK M, CELLA L N, CHEN W, et al. Carbon nanotubes-based chemiresistive immunosensor for small molecules: Detection of nitroaromatic explosives[J]. Biosensors & Bioelectronics, 2010, 26 (4) : 1297 –1301.
( 0) 0)
|
| [2] |
ZHANG L, LI C, ZHAO D, et al. An electrochemical immunosensor for the tumor marker ±-fetoprotein using a glassy carbon electrode modified with a poly(5-formylindole), single-wall carbon nanotubes, and coated with gold nanoparticles and antibody[J]. Microchimica Acta, 2014, 181 (13-14) : 1601 –1608.
DOI: 10.1007/s00604-014-1313-7 ( 0) 0)
|
| [3] |
CHEN H, MEI Q, HOU Y, et al. Building a sensitive immunosensing platform based on oriented immobilization of histidine-tagged antibody on NiO-decorated swnts[J]. Sensors & Actuators B Chemical, 2013, 181 (5) : 38 –43.
( 0) 0)
|
| [4] |
LUO R, ZHANG W, CHENG W, et al. A novel electrochemical immunosensor for detection of angiotensinII at a glass carbon electrode modified by carbon nanotubes/chitosan film[J]. International Journal of Electrochemical Science, 2013, 8 (3) : 3186 –3196.
( 0) 0)
|
| [5] |
SINGH M, HOLZINGER M, TABRIZIAN M, et al. Layer-by-layer scaffold formation using magnetic attraction between HiPCO single-walled carbon nanotubes and magnetic nanoparticles: Application for high performance immunosensors[J]. Carbon, 2015 : 731 –738.
( 0) 0)
|
| [6] |
AJAYAN P M, TOUR J M. Materials science: Nanotube composites[J]. Nature, 2007, 447 (7148) : 1066 –1068.
DOI: 10.1038/4471066a ( 0) 0)
|
| [7] |
TASIS D, TAGMATARCHIS N, GEORGAKILAS V, et al. Soluble carbon nanotubes[J]. Chemistry, 2003, 9 (17) : 4000 –4008.
DOI: 10.1002/(ISSN)1521-3765 ( 0) 0)
|
| [8] |
KANG Y K, LEE O, DERIA P, et al. Helical wrapping of single-walled carbon nanotubes by water soluble poly(p-phenyleneethynylene)[J]. Nano Letters, 2009, 9 (4) : 1414 –1418.
DOI: 10.1021/nl8032334 ( 0) 0)
|
| [9] |
RUNGROTMONGKOL T, ARSAWANG U, IAMSAMAI C, et al. Increased dispersion and solubility of carbon nanotubes noncovalently modified by the polysaccharide biopolymer, chitosan: MD simulations[J]. Chemical Physics Letters, 2011, 507 (1) : 134 –137.
( 0) 0)
|
| [10] |
SZLEIFER I, YERUSHALMI-ROZEN R. Polymers and carbon nanotubes-dimensionality, interactions and nanotechnology[J]. Polymer, 2005, 46 (19) : 7803 –7818.
DOI: 10.1016/j.polymer.2005.05.104 ( 0) 0)
|
| [11] |
SHIN H, MIN B G, JEONG W, et al. Amphiphilic block copolymer micelles: New dispersant for single wall carbon nanotubes[J]. Macromolecular Rapid Communications, 2005, 26 (18) : 1451 –1457.
DOI: 10.1002/(ISSN)1521-3927 ( 0) 0)
|
| [12] |
BLANCH A J, LENEHAN C E, QUINTON J S. Optimizing surfactant concentrations for dispersion of single-walled carbon nanotubes in aqueous solution[J]. Journal of Physical Chemistry, 2010, 114 (30) : 96805 –9811.
( 0) 0)
|
| [13] |
VICHCHULADA P, CAUBLE M A, ABDI E A, et al. Sonication power for length control of single-walled carbon nanotubes in aqueous suspensions used for 2 dimensional network formation[J]. Journal of Physical Chemistry C, 2010, 114 (29) : 12490 –12495.
DOI: 10.1021/jp104102t ( 0) 0)
|
| [14] |
WANG H, ZHOU W, HO D L, et al. Dispersing single-walled carbon nanotubes with surfactants: a small angle neutron scattering study[J]. Nano Letters, 2004, 4 (9) : 1789 –1793.
DOI: 10.1021/nl048969z ( 0) 0)
|
| [15] |
SAITO R, DRESSELHAUS G, DRESSELHAUS M S. Trigonal warping effect of carbon nanotubes[J]. Physical Review B, 2000, 61 (4) : 2981 –2990.
DOI: 10.1103/PhysRevB.61.2981 ( 0) 0)
|
| [16] |
GENG J, KONG B, YANG S B, et al. Effect of SWNT Defects on the Electron Transfer Properties in P3HT/SWNT Hybrid Materials[J]. Advanced Functional Materials, 2008, 18 (18) : 2659 –2665.
DOI: 10.1002/adfm.v18:18 ( 0) 0)
|
| [17] |
DILLON A C, PARILLA P A, ALLEMAN J L, et al. Systematic inclusion of defects in pure carbon single-wall nanotubes and their effect on the Raman D-band[J]. Chemical Physics Letters, 2005, 401 (4) : 522 –528.
( 0) 0)
|
| [18] |
SINANI V A, WCHSTED J P, RAKHNYANSKAYA A A, et al. Aqueous dispersions of single-wall and multiwall carbon nanotubes with designed amphiphilic polycations[J]. Journal of the American Chemical Society, 2005, 127 (10) : 3463 –3472.
DOI: 10.1021/ja045670+ ( 0) 0)
|
 2016, Vol. 24
2016, Vol. 24


