2. 大连理工大学 化工机械与安全学院,辽宁 大连 116023
2. School of Chemical Machinery and Safety, Dalian University of Technology, Dalian 116024, China
LiFePO4具有较高的理论容量、适中的电压平台、良好的循环寿命和支持大电流放电能力,使其自1997年Goodenough等[1]首次报道以来便备受关注[2].同时,LiFePO4还不含贵重、有毒金属,价格低廉,对环境无污染,且热稳定性优异.然而,较低的电子电导率 (10-9 S/cm) 和离子扩散率 (<10-14 cm2/S)[3]限制了其在大倍率条件下的使用,为克服这两大缺陷,学者们开展了大量的研究,如进行颗粒表面碳包覆[4]、掺杂阳离子[5]、减小颗粒粒径[6]等.
目前,在众多LiFePO4的制备方法中,高温固相法最为成熟[7],该方法工艺简单,易于工业化生产,但是合成过程需要多步混合球磨,耗能费时,且制备出的颗粒粒径不一,批量生产的稳定性差.除固相法外,还有超声波辅助沉淀法[8]、水热合成法[9]、溶剂热合成法[10]等制备方法. Talebi-Esfandarani等[11]利用溶胶凝胶法制备出纳米级LiFePO4/C和LiFe0.96Pt0.04PO4/C正极材料,1 C首次放电比容量分别为150和156 mAh/g,展现了较好的电化学性能,但是制备工艺较复杂,且费时.Wang等[12]以乙二醇为溶剂,蔗糖为碳包覆剂,用溶剂热合成法制备出了橄榄石型纳米级碳包覆LiFePO4/C,具有突出的容量保持率,但合成时间相对较长.Chang等[13]对水热合成出的高纯LiFePO4/C粉末进行双层碳包覆,得到的样品0.1 C首次充放电比容量为133 mAh/g,倍率增至10 C时,比容量仍有83 mAh/g.与常规水热合成法相比,超临界水热法能够大幅度缩短材料合成时间[14],并且可以制备出粒径更为均匀的纳米级颗粒.近些年来,国内外研究人员对超临界水热合成LiFePO4做了大量的基础研究工作[15],但是对合成过程中影响因素的研究仍不够全面,尤其是热处理方面更是鲜有报道.
本文在以往课题组研究的基础上[16],对超临界水热合成的LiFePO4进行固相煅烧碳包覆改性,用以进一步提升材料的电化学性能,增强其实用性.
1 实验 1.1 LiFePO4/C制备将FeSO4·7H2O、H3PO4和LiOH·H2O按物质的量比1:1:3溶于高纯水中,加入适量的抗坏血酸 (VC) 防止二价铁氧化,添加聚乙烯吡咯烷酮 (PVP) 作为模板剂,搅拌均匀配得悬浮液.将悬浮液转移至高温高压反应釜中,并于400 ℃、25 MPa下反应1 min,反应结束后冷却抽滤,然后在90 ℃真空干燥得到LiFePO4样品,标记为LFP.将LiFePO4粉末放入管式炉中,在Ar-H2(H2体积分数10%) 气氛下于700 ℃煅烧1 h,煅烧结束后得到LiFePO4/C样品,标记为LFP-A.称取适量的蔗糖与LiFePO4粉末共混,混合均匀后置于管式炉中,同样在Ar-H2(H2体积分数10%) 气氛下于700 ℃煅烧1 h,此时得到LiFePO4/C样品标记为LFP-B.
1.2 材料表征采用PW1830型X射线衍射仪 (Philips,荷兰) 和JSM-6390型扫描电子显微镜 (JEOL,日本) 来表征材料的结构、相组成及其微观形貌.
采用AUT0S0RB-1型激光粒度分布测试仪 (Marivern,英国) 对制备的样品颗粒粒度进行表征.采用vario EL cube红外碳硫检测仪 (Eltar,德国) 测试样品的碳含量.
1.3 电化学性能测试按质量比8:1:1称取LiFePO4、乙炔黑和聚偏氟乙烯 (PVDF),以N-甲基吡络烷酮 (NMP) 为溶剂,混合均匀涂覆在铝箔上制得正极片.以金属锂为负极,电解液为1 mol/L LiPF6/EC+DEC+EMC (体积比1:1:1),Celgard 2400为隔膜,于氩气手套箱内装配成CR2025型扣式电池.采用新威电池测试系统于2.0~4.2 V电压内对电池进行恒流充放电测试,测试前采用小电流密度对电池进行活化.采用Zahner Zennium电化学工作站 (Zahner,德国) 对材料的循环伏安 (CV) 性能进行测试,研究电极为制备的正极材料,辅助电极和参比电极为金属锂片,电压扫描范围设定为2.0~4.2 V,扫描速度为0.1 mV/s.同样采用Zahner Zennium电化学工作站 (Zahner,德国) 测试交流阻抗谱 (EIS),交流激励信号振幅为10 mV,频率范围为10 mHz~100 kHz.
2 结果与讨论图 1是LiFePO4/C材料的XRD谱图.由图 1可见:各样品衍射峰尖锐,且半高宽较窄,说明超临界水热制备的LiFePO4结晶较好;同时,各样品的物相与LiFePO4标准卡 (JCPDS卡83-2092) 的均对应,衍射峰的峰位一致,且无杂峰,证明制备的样品较纯.碳元素分析测试表明,样品LFP-A和LFP-B实际含碳质量分数分别为0.62%和4.20%,然而XRD谱图中未发现包覆碳的谱峰,说明前驱体中添加的VC、PVP及煅烧时共混的蔗糖分解出的碳以无定形的形式存在.样品LFP-A和LFP-B的衍射峰强度明显高于LFP,这表明煅烧过程能够显著改善LiFePO4的晶型结构和结晶性能.

|
图 1 LiFePO4/C材料的XRD谱图 Figure 1 XRD patterns of LiFePO4/C |
图 2是LiFePO4/C材料的SEM照片.由图 2可以看出,未进行煅烧的样品LFP呈现块状,颗粒大小在400~800 nm,粒度分布较均匀,颗粒间没有团聚现象.经过煅烧处理的样品LFP-A颗粒粒径均匀,粒度分布于200~600 nm,且有轻微的团聚现象出现.将LFP与蔗糖共混再煅烧得到的样品LFP-B仍呈现出块状形状,但是颗粒粒径大小明显减小,且粒度分布更加均匀,没有明显的颗粒团聚现象出现.

|
图 2 LiFePO4/C材料的SEM照片 Figure 2 SEM images of LiFePO4/C |
粒度分析测试表明,样品LFP、LFP-A和LFP-B的平均粒径分别为616、545和366 nm.可见, 后续煅烧碳包覆可减小LiFePO4的颗粒粒径,增大其比表面积,结合XRD和SEM的研究结果分析可知,将超临界水热合成的LiFePO4粉末与适量的蔗糖共混煅烧可以有效改善材料的结晶性能,抑制晶粒的长大及团聚,减小颗粒粒径大小,并使粒径分布趋向均匀.
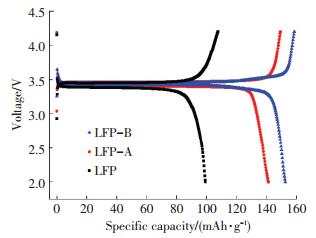
图 3为样品0.2 C倍率下的首次充放电曲线.由图 3可见,样品放电电压平台均在3.4 V,经过煅烧碳包覆处理后,充放电平台延长,充放电平台间的电压差减小.样品LFP、LFP-A和LFP-B在0.2 C倍率下的首次放电容量分别为99.2、141.2和152.5 mAh/g,充放电效率分别为92.2%、94.6%和95.7%.这说明煅烧碳包覆处理显著提高了材料的放电容量和库伦效率.
|
图 3 在0.2 C倍率下LiFePO4/C材料的首次充放电曲线 Figure 3 Charge-discharge curves of LiFePO4/C at 0.2 C |
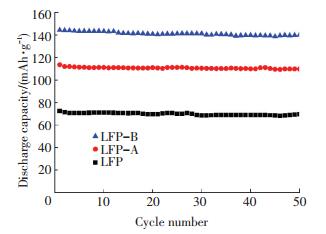
图 4是各样品在1 C倍率下的循环性能曲线.1 C倍率下的首次放电比容量分别为72.7、113.6和144.4 mAh/g,循环50次,容量保持率分别为95.7%、96.6%和97.1%.这表明固相煅烧碳包覆对材料的充放电性能有很大的提升作用.经过煅烧处理之后,LiFePO4的晶格结构更加完善,而且煅烧过程中适量蔗糖的掺入又细化了颗粒粒径,增加了碳包覆含量,缩短了Li+迁移距离,增强了颗粒间的导电性,减弱了极化作用,因此放电容量和循环性能得到较大提升.
|
图 4 在1C倍率下的LiFePO4/C材料的循环性能曲线 Figure 4 Cycling performances of LiFePO4/C at 1 C |
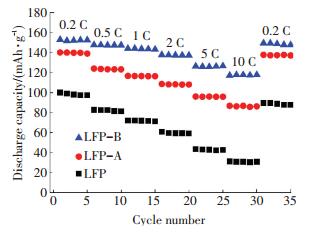
将电池先后分别在0.2 C、0.5 C、1 C、2 C、5 C和10 C倍率下循环5圈,再返回到0.2 C倍率下循环5圈,最后得到LiFePO4/C样品的倍率循环性能曲线,如图 5所示.由图 5可见:随着放电倍率的不断增大,各样品的极化程度也越来越大,导致放电比容量不断下降;样品LFP-B在2 C、5 C和10 C倍率下的放电比容量分别为137.6、126.1和117.7 mAh/g,并且经过10 C循环后返回到0.2 C条件下放电,样品LFP-B的放电比容量还能达到149.2 mAh/g,容量保持率达到97.8%,说明该样品的循环性能比较稳定,倍率性能非常优异,也表明超临界水热合成的LiFePO4材料经过煅烧碳包覆处理展示出了非常好的Li+嵌入脱出能力和稳定的充放电循环性能.
|
图 5 LiFePO4/C材料的倍率性能曲线 Figure 5 Rate performances of LiFePO4/C |
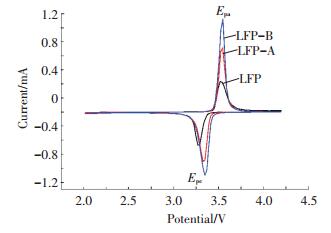
图 6为各样品的循环伏安曲线,相应的测试结果列于表 1中.由图 6可以看出,样品LFP-B的峰形最尖锐,峰电流密度最高,氧化还原峰之间的电位差最小,峰面积最大,峰对称性最好,这些说明该样品的极化程度最小,循环可逆性最高.因此可以得出,经过煅烧碳包覆制备的LiFePO4/C具有良好的电化学可逆性.此循环伏安测试结果与上述充放电循环性能测试结果是相一致的.
|
图 6 LiFePO4/C材料的CV曲线 Figure 6 CV curves of LiFePO4/C |
| 表 1 LiFePO4/C的循环伏安测试结果 Table 1 Summary of the CVs results of LiFePO4/C |
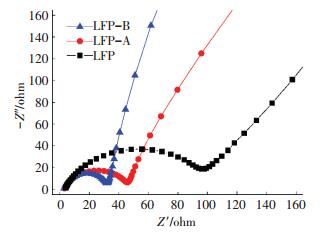
测得各样品的交流阻抗谱图是由高频区的一个半圆弧和低频区的一条斜直线两部分构成的,如图 7所示.其中,高频区的半圆弧代表界面传荷阻抗,半圆的直径直接反映了电极和电解液界面之间的电荷传递阻抗;而低频区的斜线反映的则是Li+在固态活性物质中扩散时的Warburg阻抗[17].由图 7可见,样品LFP的高频区半圆弧直径最大,低频区直线斜率最小,表明样品LFP的电荷传递阻抗最大,Li+不容易脱嵌;而样品LFP-B拥有最小的高频区半圆弧直径和最大斜率的低频区直线,表明其电荷传递阻抗值最小,Li+内部扩散容易,电化学性能优异.这是因为样品LFP-B的颗粒粒径较小,缩短了Li+脱嵌路径,提高了Li+的扩散系数;同时,增大的比表面又增加了材料与电解液的接触面积,从而扩大了Li+的相间扩散面积;并且样品LFP-B表面包覆的导电碳大幅度提高了颗粒间的电导率,减小了极化作用.因此,样品LFP-B的阻抗值小,电子导电率高,表现出了较高的放电容量和良好的循环及倍率性能.
|
图 7 LiFePO4/C材料的EIS谱图 Figure 7 Electrochemical impedance spectra of LiFePO4/C |
对超临界水热制备的LiFePO4材料进行煅烧碳包覆处理可显著增强其物理及电化学性能.后续固相煅烧处理没有改变LiFePO4的橄榄石结构,但是改善了材料的晶型结构和结晶性能,从而提高了电化学性能;而煅烧过程中掺入适量的蔗糖后,细化了颗粒粒径,减小了电荷传递阻抗,增强了颗粒间的电导率,进一步提升了放电容量、循环及倍率性能.
| [1] | PADHI A K, NANJUNDASWARNY K S, GOODENOUGH J B. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J]. J Electrochem Soc, 1997, 144(4): 1188–1194. DOI: 10.1149/1.1837571 |
| [2] | 张克宇, 姚耀春. 锂离子电池磷酸铁锂正极材料的研究进展[J]. 化工进展, 2015, 34(1): 166–172. ZHANG Keyu, YAO Yaochun. Research progress in LiFePO4 cathode material for lithium-ion batteries[J]. Chemical Industry and Engineering Progress, 2015, 34(1): 166–172. |
| [3] | WANG Yonggang, HE Ping, ZHOU Haoshen. Olivine LiFePO4 development and future[J]. Energy & Environmental Science, 2011, 4(3): 805–817. |
| [4] | CHENG Ke, WANG Xiaodong, LAN Yachao, et al. Preparation and characterization of LiFePO4/C cathode materials with high-rate performance[J]. Acta Materiae Compositae Sinica, 2013, 30(1): 135–140. |
| [5] | 伊廷锋, 朱彦荣, 沈浩宇, 等. Mn2+掺杂对LiFePO4性能正极材料结构、性能及嵌锂动力学的影响[J]. 哈尔滨工业大学学报, 2013, 45(7): 121–125. YI Tingfeng, ZHU Yanrong, SHEN Haoyu, et al. Effects of Mn2+ doping on structure performance and kinetic of lithium-ion insertion of LiFePO4 positive-electrode material[J]. Journal of Harbin Institute of Technology, 2013, 45(7): 121–125. DOI: 10.11918/j.issn.0367-6234.2013.07.022 |
| [6] | 郭孝东, 钟本和, 唐艳, 等. 一次粒径和二次粒径对LiFePO4性能的影响[J]. 高校化学工程学报, 2013, 27(5): 884–888. GUO Xiaodong, ZHONG Benhe, TANG Yan, et al. The Influence of primary particle size and secondary particle size on performances of LiFePO4[J]. Joural of Chemical Engineering of Chinese Universities, 2013, 27(5): 884–888. |
| [7] | 陈晗, 龚文强, 向楷雄, 等. 固化过程对LiFePO4/C复合材料形貌和电化学性能的影响[J]. 粉末冶金材料科学与工程, 2011, 16(4): 575–579. CHEN Han, GONG Wenqiang, XIANG Kaixiong, et al. Effect of solidifying process on morphology and electrochemical performance of LiFePO4/C composites[J]. Materials Science and Engineering of Powder Metallurgy, 2011, 16(4): 575–579. |
| [8] | 张佳峰, 王健龙, 陈核章, 等. 复合金属掺杂的LiFePO4/C复合材料的制备与电化学性能研究[J]. 稀有金属材料与工程, 2014, 43(1): 172–177. ZHANG Jiafeng, WANG Jianlong, CHEN Hezhang, et al. Preparation and characterization of LiFePO4/C composite doped with various metals[J]. Rare Metal Materials and Engineering, 2014, 43(1): 172–177. |
| [9] | YANG S, ZAVALIJ P Y, WHITTINGHAM M S. Hydrothermal synthesis of lithium iron phosphate cathodes[J]. Electrochem Commun, 2011, 3: 505–508. |
| [10] | YANG H, WU X L, CAO M H, et al. Solvothermal synthesis of LiFePO4 hierarchically dumbbell-like microstructures by nanoplate self-assembly and their application as a cathode material in lithium-ion batteries[J]. Journal of Physical Chemistry C, 2009, 113: 3345–3351. DOI: 10.1021/jp808080t |
| [11] | TALEBI-ESFANDARANI M, SAVADOGO O. Synthesis and characterization of Pt-doped LiFePO4/C composites using the sol-gel method as the cathode material in lithium-ion batteries[J]. J Appl Electrochem, 2014, 44: 555–562. DOI: 10.1007/s10800-014-0675-1 |
| [12] | WANG Li, SUN Wenting, TANG Xianyi, et al. Nano particle LiFePO4 prepared by solvothermal process[J]. Journal of Power Sources, 2013, 244: 94–100. DOI: 10.1016/j.jpowsour.2013.03.101 |
| [13] | CHANG Y C, PENG C T, HUNG I M. Effects of particle size and carbon coating on electrochemical properties of LiFePO4/C prepared by hydrothermal method[J]. J Mater Sci, 2014, 49: 6907–6916. DOI: 10.1007/s10853-014-8395-9 |
| [14] | YU Wenli, ZHAO Yaping, RAO Qunli. Rapid and continuous production of LiFePO4/C nanoparticles in super heated water[J]. Chinese Journal of Chemical Engineering, 2009, 17(1): 171–174. DOI: 10.1016/S1004-9541(09)60051-3 |
| [15] | KIM J K. Supercritical synthesis in combination with a spray process for 3D porous microsphere lithium iron phosphate[J]. Cryst Eng Comm, 2014, 16: 2818–2822. DOI: 10.1039/c3ce42264j |
| [16] | LIU Xuewu, WEI Hao, DENG Yuanfu, et al. Synthesis of sub-micrometer lithium iron phosphate particles using supercritical hydrothermal method for lithium ion batteries[J]. J Shanghai Jiaotong Univ, 2012, 17(5): 517–522. DOI: 10.1007/s12204-012-1317-6 |
| [17] | 庄全超, 徐守冬, 邱祥云, 等. 锂离子电池的电化学阻抗图谱分析[J]. 化学进展, 2010, 22(6): 1047–1057. ZHUANG Quanchao, XU Shoudong, QIU Xiangyun, et al. Diagnosis of electrochemical impedance spectroscopy in lithium ion batteries[J]. Progress in Chemistry, 2010, 22(6): 1047–1057. |
 2017, Vol. 25
2017, Vol. 25


