生物医用材料主要分为以羟基磷灰石(Hydroxyapatite, HA)为代表的生物陶瓷材料和以钛及钛合金为代表的生物金属材料两种.钛及钛合金由于具有高的比强度和良好的生物相容性,常作为人体硬组织的代替材料应用于生物医学领域,但因其是生物惰性金属材料,与新生骨之间只能形成机械锁合,且钛与人体骨的力学性能相差较大,造成植入体周围出现骨应力吸收,最终引起植入体松动或自体骨断裂,这成为钛作为骨修复材料应用的最大障碍.多孔钛及其合金具有开放的多孔状结构,有利于体液的传输,促进成骨细胞在植入材料表面和孔隙中生长且多孔钛在弹性变形后有一个较长的应力平台,可起到缓冲外来冲击力的作用.因此,多孔钛被认为是目前最有应用前景的生物医用材料之一[1].羟基磷灰石是人体天然骨组织中最主要的无机成分之一,具有良好的生物相容性,但HA强度低、脆性大,难以植入承重部位作为替代材料[2].针对以上问题,研究者在多孔钛及其合金表面通过多种方法制备HA涂层,如微弧氧化法[3-4],溶胶凝胶法[5-7],水热法[8]等,考虑到用于骨移植手术的可植入生物材料必须满足有接近于天然骨的结构特征,因此,仿生矿化法常被用于制备HA涂层[9].李若琳[10]等研究了预钙化处理对HA涂层沉积的影响,利用碱热处理+模拟体液浸泡等方法在多孔钛表面沉积涂覆羟基磷灰石涂层,研究表明,预钙化处理对HA有诱导沉积作用,可获得均匀涂层.Ribeiro [11]等使用简化的钙磷溶液在钛基体上仿生涂覆羟基磷灰石涂层,形成球状、片状的HA和OCP相,表明简化的钙磷溶液可在钛基板上仿生制备出钙磷涂层.但以上研究主要集中于材料表面不同HA形貌,对于沉积过程中影响因素的研究较少.为此,本文将采用仿生矿化法在钛及不同孔径的多孔钛表面制备HA钙磷涂层,主要研究不同沉积温度下的涂层生长,分析温度对涂层生长形貌的影响,探究不同孔径的多孔钛基体表面HA涂层的生长机理.
1 试验 1.1 试样前处理试验所用基体为商业纯钛(CPTi)和孔隙率为35%~45%的多孔钛,最大孔径分别为30 μm(mTi)和160 μm(MTi),如图 1所示.将基体板切割成10 mm×10 mm×1.5 mm的试样,依次用400#、600#、800#金相砂纸磨光,分别在无水乙醇、蒸馏水中进行超声波清洗.各次清洗加热温度均为20 ℃、超声功率80 W、清洗时间30 min,在室温下进行干燥.干燥后试样在混合酸溶液(质量分数18 %的HCl和48 % H2SO4)中浸泡30 min,用恒温水浴锅将温度控制在60 ℃,而后用去离子水超声波清洗,试样干燥后放入10 mol/L的NaOH溶液处理18 h.清洗干燥后,试样在饱和的Ca(OH)2溶液中室温浸泡24 h进行预钙化处理.

|
图 1 不同孔径钛基体的表面形貌 Figure 1 SEM surface morphology of samples with different pore sizes: (a) CPTi; (b) mTi; (c) MTi |
将HA粉末溶解于0.1 mol/L HCl溶液中,离心处理,取上清液,用三羟甲基氨基甲烷和0.1 mol/L的HCl溶液将HA上清液pH值调节至7.4.为了研究沉积液温度对涂层生长的影响,将溶液分为A、B、C的3组,并将钛片及孔径不同的多孔钛片分别放入3组溶液中浸泡5 d,通过恒温培养箱控制溶液温度,其中,A组沉积液温度为30 ℃,B组沉积液温度为37 ℃,C组沉积液温度为44 ℃.为对比不同温度和不同钛基体对涂层生长的影响,将试样分组如表 1所示.
| 表 1 试样分组情况 Table 1 Experimental grouping |
将各组试样分别浸泡在沉积液中,首先在4 ℃下恒温浸泡24 h以获得晶种[12-13],然后,分别转移至30、37、44 ℃下浸泡获得涂层,每天更换沉积液,每隔8 h测量1次pH值.浸泡完成后,用蒸馏水小心清洗样品表面,然后,在真空干燥箱37 ℃恒温干燥12 h.
1.3 模拟体液浸泡将经沉积液浸泡后的样品分别浸泡在标准模拟体液(Simulation of body fluid, SBF)中,每2 d更换1次溶液,每次溶液的加入量为50 mL,浸泡20 d后取出干燥.
1.4 表面检测用金相显微镜,环境扫描电子显微镜(FEI Q45+EDAX)观察涂层表面形貌并用设备自带的能谱分析仪对涂层进行能谱分析,计算钙磷比,用X射线衍射仪(D/max2200PC)进行物相结构分析.
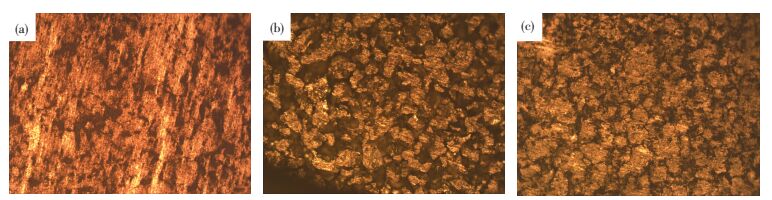
2 结果与分析 2.1 试样前处理分析钛金属表面有一层致密的二氧化钛钝化膜,导致其诱导钙磷涂层的能力变差.为了提高钛表面诱导钙磷涂层的能力,常对试样进行各种前处理.打磨基体可去除表面杂质,进而减少二氧化钛钝化膜对钙磷涂层沉积的影响.图 2是前处理后mTi基体的表面形貌(CPTi,MTi除孔径外,经过前处理后,形貌趋于一致),其中,图 2(a)是在金相显微镜下观察经金相砂纸打磨后的mTi,可见试样表面呈现清晰的直线状平行结构,相对于图 1,凹坑已明显被磨平.Snel [14]等人的研究认为,相对于比较平坦的表面,粗糙度越高的表面可以更快生长质量较好的HA钙磷涂层.本实验采用硫酸和盐酸配置的混合酸可以使基体表面产生大量的酸蚀凹点或沟槽,增大钛基体的表面粗糙度,同时基体的表面积增大(图 2(b)),为HA的生长提供了更大的空间.碱处理会使钛基体表面产生纳米级微孔,有利于HA涂层的沉积[15].图 2(c)是碱处理后的表面形貌,对比图 2(a)、(b)可以看出,钛基体的表面变得粗糙,同时,碱溶液中产生的OH-在钛基体表面形成Ti-OH基团[15],有利于HA的形成.预钙化处理,促使Ca2+吸附到基体表面,可加速沉积液中培养时HA的成核长大.
|
图 2 前处理后试样的表面形貌 Figure 2 Surface of the sample after the pretreatment: (a) polished; (b) acid treatment; (c) alkali treatment |
图 3是不同培养温度下的试样表面形貌.由图 3(a)可以看到,当沉积温度为30 ℃时,在CPTi表面有少量的颗粒状HA沉积物;图 3(b)中mTi表面和孔隙处均有颗粒状HA沉积物,且HA沿着孔隙边缘呈团簇状生长;图 3(c)是MTi,孔径较大,表面覆盖了一层较为致密的HA涂层.当沉积温度为37 ℃时,由图 3(d)可以看出,CPTi表面较粗糙,HA沉积物较少;图 3(e)中HA沉积物的表面还可以看到小的HA晶核,这使得涂层表面整体呈现疏松的结构,而图 3(f)MTi表面呈细致均匀的涂层.这是因为在一定范围内,孔径增大基体的表面积相对变大,使得涂层生长的空间增大,沉积物增多,涂层变得均匀而致密.与30 ℃下的试样相比,37 ℃时试样表面HA涂层的量明显增多,且涂层分布均匀.图 3(g)、(h)、(i)是沉积温度为44 ℃时的CPTi,mTi,MTi试样沉积浸泡后的SEM观察结果,可以看出,表面涂层结构与37 ℃时相比变得疏松,HA晶粒变大.对比3种温度可以发现,当培养温度升高时,涂层变得疏松,晶粒尺寸变大.

|
图 3 沉积液浸泡后试样的表面形貌 Figure 3 SEM images for surface morphology of sample after immersion: (a) CPTi-30; (b) mTi-30; (c) MTi-30; (d) CPTi-37;(e) mTi-37;(f) MTi-37;(g) CPTi-44; (h) mTi-44; (i) MTi-44 |
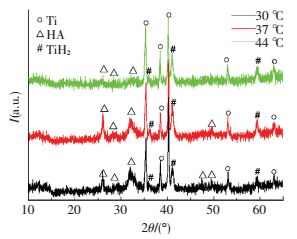
图 4是MTi基体经不同温度沉积液浸泡后的XRD谱图.由图 4可以看到,3条曲线中均可看到TiH2相,这是由于前处理时在强碱溶液加热条件下金属钛电解反应会生成TiH2[16].对比羟基磷灰石标准XRD衍射PDF图片可知,在2θ=26°、28°、32°、46°、49°附近出现羟基磷灰石HA的特征峰,这说明沉积液浸泡后基体表面生成羟基磷灰石相.对比3种温度下的曲线可知,由30 ℃升高到37 ℃时,HA的特征峰变强,再升高到44 ℃时,HA的某些特征峰消失明显,说明44 ℃时HA晶体结构发生了变化.这说明温度升高有利于HA的沉积,但温度过高,反而会影响HA的生长.
|
图 4 不同沉积温度下的XRD谱图 Figure 4 XRD at different deposition temperatures |
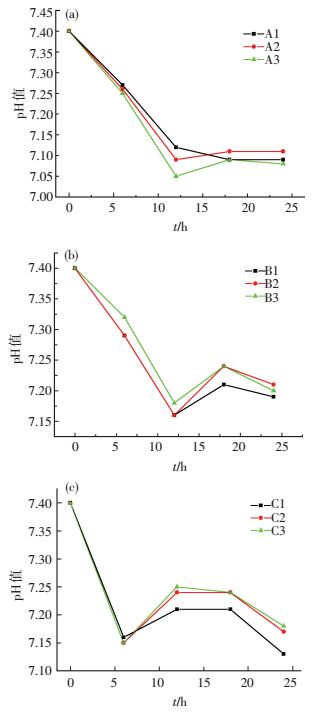
在仿生沉积过程中,对各组样品每隔6 h检测溶液的pH值,图 5是沉积液pH值变化曲线图,可以看到,pH值随沉积时间延长呈现先降低后增加,最后又降低的趋势,且随着沉积液温度的升高pH值的变化速度逐渐变快.
|
图 5 不同温度的沉积液pH值变化曲线 Figure 5 Variation tendency of pH under different culture temperature |
经前处理后的钛基体表面会形成碱性钛凝胶层,将基体放入HA过饱和沉积液后,该碱性凝胶层会释放出碱性离子,并与周围溶液中的H+离子发生交换反应,导致凝胶层附近溶液的pH值升高,pH值的升高引起离子活性增加,溶液中Ca2+、PO43-和OH-将发生如下反应,形成HA涂层[17].
| $\begin{array}{l} 10{\rm{C}}{{\rm{a}}^{2 + }} + 6{\rm{PO}}_4^{3 - } + 2{\rm{O}}{{\rm{H}}^ - } \to \\ \quad \quad {\rm{C}}{{\rm{a}}_{10}}{\left( {{\rm{P}}{{\rm{O}}_4}} \right)_6}{\left( {{\rm{OH}}} \right)_2} \downarrow . \end{array}$ | (1) |
由式(1)可知,HA钙磷涂层的沉积反应会消耗沉积溶液中的OH-离子,使沉积液中OH-和H+的浓度发生变化,即溶液pH发生变化.OH-离子的消耗会伴随着沉积液整体pH值的降低.而在一定范围内,升高沉积液温度会加快反应向右进行,进而加速涂层的沉积.但由于所有的化学反应都是可逆反应,当溶液中的离子得不到补充反应就会逆向进行,使得pH值升高.但这并不影响HA涂层的正常生长,因为植入体进入人体后其表面的HA涂层会先慢慢消失,使得人体组织长入后再生成新的HA.
2.4 模拟体液浸泡结果分析模拟体液是对人体体液成分和离子浓度的模拟,其离子组成及浓度均接近于人体指标,体外模拟体液浸泡实验是评价材料生物活性的重要方法[18].图 6是模拟体液浸泡后表面涂层的形貌,可以看出,经沉积浸泡后的试样在模拟体液中浸泡20 d后,涂层表面被新的HA涂层物质覆盖,且在复合试样表面呈球状集聚生长,模拟体液浸泡后试样表面的磷灰石聚集越来越密集,同时可以发现,球状聚集的磷灰石层是由细针状的羟基磷灰石晶体层层交错堆积而成的.

|
图 6 模拟体液浸泡后表面涂层的ESEM图 Figure 6 ESEM images of surface coating after immersion in simulated body fluid: (a) mTi-37;(b) MTi-37; (c) mTi-44; (d) MTi-44 |
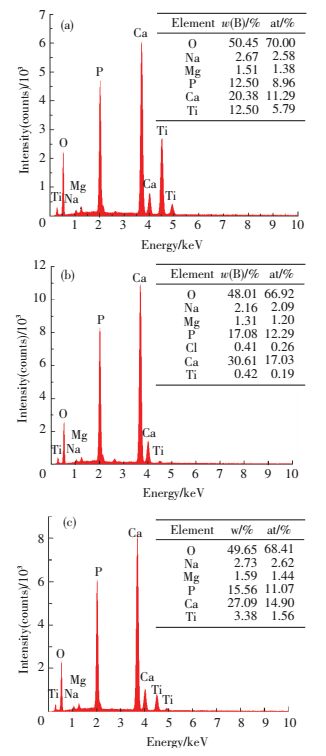
图 7是模拟体液浸泡20 d后不同沉积温度试样表面涂层的EDS能谱图,计算其Ca/P比分别是1.63、1.79、1.74,比较羟基磷灰石(Ca10(PO4)6(OH)2)的化学计量比1.67,可见:30 ℃时多孔钛基体上沉积的是缺钙型羟基磷灰石;温度升高后,钙磷比高于1.67,这可能是因为含有CaO.说明沉积液温度升高有利于HA的生长,同时也表明该涂层试样具有良好的生物活性.
|
图 7 模拟体液浸泡后钛表面涂层EDS能谱图 Figure 7 EDS spectrums of titanium surface coating after immersion in simulated body fluid: (a) 30 ℃; (b) 37 ℃; (c) 44 ℃ |
由图 3可以看出,由纯钛到多孔钛,基体表面HA沉积物增多且空隙中也有均匀的HA涂层.这主要是因为相对于纯钛基体而言,多孔钛基体的表面积变大,比表面积也相对增大,从而增大了基体与沉积液的接触面积,有利于HA涂层的沉积.对多孔钛而言,基体孔径尺寸增大,表面涂层变得均匀致密.这是由于:经前期酸碱处理后,多孔钛的腐蚀效果比相应致密材料腐蚀效果明显,孔径大的比孔径小的腐蚀效果明显,从而使得表面更加粗糙,表面积更大,为HA形核提供更大的空间;另外,在满足孔深的前提下,孔径尺寸增大有利于沉积液进入到孔隙深处,在孔中形成较高的离子浓度区,有助于HA的成核长大.经研究证实,当孔径为10 μm时,将允许细胞向其内部长入;当孔径为10~50 μm时,则有利于纤维组织长入.对于新的骨组织的形成,通常认为孔径应在100~500 μm才有利于使新生骨组织长入[19-20].因此,适当增大基体孔径不仅有利于HA生物活性涂层的沉积,还可以使植入体与新生组织更好地结合.
3.2 沉积温度对HA涂层生长的影响根据沉积原理,HA晶体生长过程是体系成核自由能降低的过程,过饱和度是结晶过程的驱动力.HA沉积原理可由Gibbs Thompson[13]等式表示.
| $\Delta G = - KT{\rm{ln}}S + \gamma A.$ | (2) |
式中:△G为成核自由能;S为溶液过饱和度;γ为成核的净界面能;A为颗粒的表面积;K为Boltzmann常数; T为温度, K.
由式(2)可知,溶液过饱和度增加有利于HA晶体的生长,当沉积液的饱和度增大时,晶体生长变快,晶粒尺寸变大.又因为HA的溶解度随温度的升高而降低,在低温条件下,HA溶解度增大[13],溶液过饱和度下降,△G增大,成核动力不足,晶核只在钛表面的活性位点上形成,不利于HA晶体的大量生长,因此,可以通过提高沉积液温度来促进HA晶体的生长,温度升高HA的溶解度降低,溶液的过饱和度增大,成核自由能降低,有利于晶体的生长,但培养温度越高,HA晶体的生长速度变快,晶体越粗大,涂层越疏松,形成的晶粒数越少.
4 结论1) 在满足孔深的前提下,基体孔径尺寸增大有利于沉积液进入到孔隙深处,在孔中形成较高的离子浓度区,有助于HA的成核长大;在一定范围内,孔径增大,表面积变大,经酸碱处理后,其表面粗糙度也随之增大,基体表面的成核活性位点增多,更有利于磷灰石涂层均匀致密的生长.
2) 沉积液的温度会影响羟基磷灰石涂层在仿生矿化过程中的生长,当沉积液温度由30 ℃升高到37 ℃时,表面涂层增厚且均匀致密,温度再升高到44 ℃时,HA晶粒变粗大,涂层相对疏松化.因此,沉积温度升高有利于HA的生长,但温度越高,HA晶粒越粗大,涂层变得越疏松,晶粒数越少.
3) 经模拟体液浸泡后的Ti/HA涂层试样表面有新的HA生成,表明该Ti/HA涂层试样具有良好的生物活性.
| [1] | TOPTAN F, ALVES A C, PINTO A M, et al. Tribocorrosion behavior of bio-functionalized highly porous titanium[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2017, 69: 144–152. DOI: 10.1016/j.jmbbm.2017.01.006 |
| [2] | ALMORA-BARRIOS N, De LEEUW N H. A density functional theory study of the interaction of collagen peptides with hydroxyapatite surfaces[J]. Langmuir, 2010, 26(18): 14535–14542. DOI: 10.1021/la101151e |
| [3] | ZHAO Guoliang, XIA Long, ZHONG Bo, et al. Effect of alkali treatments on apatite formation of microarc-oxidized coating on titanium alloy surface[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(4): 1151–1157. DOI: 10.1016/S1003-6326(15)63710-4 |
| [4] | TANG H, HAN Y, WU T, et al. Synthesis and properties of hydroxyapatite-containing coating on AZ31 magnesium alloy by micro-arc oxidation[J]. Applied Surface Science, 2016, 400: 391–404. |
| [5] | USINSKAS P, STANKEVICIUTE Z, BEGANSKIENE A, et al. Sol-gel derived porous and hydrophilic calcium hydroxyapatite coating on modified titanium substrate[J]. Surface & Coatings Technology, 2016, 307: 935–940. |
| [6] | CHOUDHURY P, AGRAWAL D C. Sol-gel derived hydroxyapatite coatings on titanium substrates[J]. Surface & Coatings Technology, 2011, 206(2): 360–365. |
| [7] | SIDANE D, RAMMAL H, BELJEBBAR A, et al. Biocompatibility of sol-gel hydroxyapatite-titania composite and bilayer coatings[J]. Materials Science & Engineering C Materials for Biological Applications, 2017, 72: 650–658. |
| [8] | WANG Jinyu, XUE Caibao, ZHU Peizhi. Hydrothermal synthesis and structure characterization of flower-like self assembly of silicon-doped hydroxyapatite[J]. Materials Letters, 2017, 196: 400–402. DOI: 10.1016/j.matlet.2017.03.062 |
| [9] | TSIOURVAS D, TSETSEKOU A, KAMMENOU M I, et al. Biomimetic synthesis of ribbon-like hydroxyapatite employing poly(l-arginine)[J]. Materials Science & Engineering C Materials for Biological Applications, 2016, 58: 1225–1231. |
| [10] |
李若琳, 寇宏超, 徐广胜, 等. 多孔钛表面羟基磷灰石形貌及形成机理[C]//全国钛及钛合金学术交流会. 2013, 23: 331-335. LI Ruolin, KOU Hongchao, XU Guangsheng, et al. Morphology and formation mechanism of hydroxyapatite on porous titanium surface[C]//The Fifteenth National Conference on titanium and titanium alloys, 2013, 23:331-335. |
| [11] | RIBEIRO A A, BALESTRA R M, ROCHA M N, et al. Dense and porous titanium substrates with a biomimetic calcium phosphate coating[J]. Applied Surface Science, 2013, 265(1): 250–256. |
| [12] |
胡海波, 刘会群, 王杰恩, 等. 生物医用多孔钛及钛合金的研究进展[J]. 材料导报, 2012(S1): 262–266.
HU Haibo, LIU Huiqun, WANG Jieen, et al. Research progress of biomedical porous titanium and its alloys[J]. Mater Rev, 2012(S1): 262–266. |
| [13] |
张其翼, 陈继镛, 张兴栋. 多孔钛的制备及磷灰石涂层的仿生沉积[J]. 四川大学学报(自然科学版), 2003, 40(4): 700–703.
ZHANG Qiyi, CHENG Jiyong, ZHANG Xingdong. Fabrication of porous titanium and biomimetic deposition of apatite catings[J]. Journal of Sichuan Univeisity(Natural Science Edition), 2003, 40(4): 700–703. |
| [14] | SNEL M, BLITTERSWIJK C V, GROOT K D, et al. Nano-scale study of the nucleation and growth of calcium phosphate coating on titanium implants[J]. Biomaterials, 2004, 25(14): 2901–2910. DOI: 10.1016/j.biomaterials.2003.09.063 |
| [15] |
杨辉, 肖兵娟. 碱处理法制备钛合金表面羟基磷灰石涂层[J]. 硅酸盐通报, 2009, 28(1): 84–89.
YANG hui, XIAO Bingjian. Preparation of hydroxyapatite coating on titanium alloy surface activated with alkali processing[J]. Bulletn of the Chnese Ceramic Society, 2009, 28(1): 84–89. |
| [16] |
张怀法, 赵朝勇, 朱向东, 等. 多孔钛表面改性对其蛋白质吸附行为的影响[J]. 稀有金属材料与工程, 2011, 40(8): 1488–1491.
ZHANG Huaifa, ZHAO Chaoyong, ZHU Xiangdong, et al. Effect of surface modification of porous titanium on protein adsorption behavior[J]. Rare Metal Materials and Engineering, 2011, 40(8): 1488–1491. |
| [17] |
曹鑫. 钛基羟基磷灰石涂层的仿生制备与性能研究[D]. 陕西: 陕西科技大学, 2015. CAO xin. Research of biomimetic preparation and characterization of hydroxyapatite coating on titanium matrix surface[D]. Shanxi:Shanxi University of Science and Technology, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10708-1015325215.htm |
| [18] |
孙圣淋, 吕宇鹏. 模拟体液浸泡法评价生物材料的研究与问题[J]. 材料导报, 2011, 25(19): 96–99.
SUN Shenglin, LV Yupeng. Research and drawbacks of the simulated body fluid immersion method in evaluating the biomaterials[J]. Mater Rev, 2011, 25(19): 96–99. |
| [19] |
刘珏, 李婧, 刘超, 等. 多孔TiNi合金表面沉积羟基磷灰石与表征[J]. 稀有金属材料与工程, 2016(2): 470–476.
LIU Jue, LI Jing, LIU Chao, et al. Calcium phosphate deposition on the surface of porous tini alloys with different sintering temperatures in simulated body fluid[J]. Rare Metal Materials and Engineering, 2016(2): 470–476. |
| [20] |
李永华, 范涛, 陈睿博. 多孔形状记忆合金表面羟基磷灰石涂层的沉积[J]. 沈阳理工大学学报, 2010, 29(4): 44–46.
LI Yonghua, FAN Tao, CHEN Ruibo. Deposition of hydroxyapatite coating on surface of porous shape memory alloy[J]. Journal of Shenyang Ligong University, 2010, 29(4): 44–46. |
 2017, Vol. 25
2017, Vol. 25


