随着陆地油气资源的缺乏,世界各国纷纷将发展的目光投向海洋.然而,海洋资源开采所面临的环境远远比陆地环境更加复杂苛刻,由之所引发的问题也逐渐增多,其中腐蚀问题最为严重.海洋环境对油气资源勘探、钻采和输运所用的材料提出了更高的要求,然而在实际开采过程中,为了提高油气井的产量,还经常采用高温酸化处理工艺对油气进行酸化处理,从而造成了井内温度和酸性的增加, 同样对材料造成了严重的腐蚀破坏[1-2].因此,探索开发耐海洋环境用的油气田钻采和输运材料,研究其耐腐蚀性能成为当前能源开采行业关注的热点[3].
PH13-8Mo是一种采用双真空冶炼的高纯净度马氏体沉淀硬化不锈钢,其不仅具有高的强度、优良的断裂韧性,而且具有良好的横向力学性能和在海洋环境中的耐应力腐蚀性能,因此广泛应用于宇航、核反应堆和石油化工等领域[4-6].由于不同的固溶和时效处理会影响其组织结构及相分布等,进而影响其强度、硬度、塑性及冲击韧性等性能.因此,目前对该不锈钢的研究多集中在热处理工艺对其微观组织及力学性能的影响等方面[7-11],而且相对较成熟.沉淀硬化不锈钢虽然具有较好的耐腐蚀性能,但与普通的不锈钢类似,在含有Cl-的环境中,不可避免地会面临点蚀问题,而海洋环境中存在大量的Cl-,能够穿透不锈钢的钝化膜使不锈钢发生点蚀.在含有氯离子的酸性环境中,对该钢耐腐蚀性能的报道还不多见.
本文采用极化曲线、循环极化曲线、电化学阻抗谱(EIS)和SEM方法,研究了在pH值为3的Na2SO4+H2SO4溶液中,Cl-的质量分数和溶液温度对马氏体沉淀硬化不锈钢PH13-8Mo腐蚀行为的影响,并探讨了Cl-的质量分数和溶液温度对PH13-8Mo电化学腐蚀行为的影响机制.
1 实验 1.1 实验材料及处理实验用材料为马氏体沉淀硬化不锈钢PH13-8Mo,其化学成分(质量分数/%)为:C,≤0.05;Mn,≤0.10;Si,≤0.10;P,≤0.10;S,≤0.002;N,≤0.003;Cr,12.25~13.25;Ni,7.50~8.50;Mo,2.00~2.50;Al,1.0.热处理制度为950 ℃调整,0 ℃深冷,510 ℃回火.将热处理后的钢板线切割为10 mm×10 mm×5 mm的试样,静态浸泡试样经耐水砂纸逐级打磨至1500#,去离子水清洗,酒精除油,冷风吹干后置于干燥皿中待用.电化学试样经耐水砂纸打磨至400#后,选择其中1个面为工作面,背面用铜导线焊接,除工作面外其余表面用环氧树脂封装在聚四氟乙烯管中,干燥后进一步打磨至1000#,然后用去离子水清洗,无水乙醇中超声10 min去油干燥后备用.
1.2 腐蚀形貌观察腐蚀介质为0.5 mol/L的Na2SO4溶液,滴加H2SO4调整其pH值至3,然后添加NaCl配制成质量分数为1%、3.5%和7%的溶液,温度25 ℃,将试样浸泡其中,7 d后取出,用去离子水清洗后冷风吹干.上述3.5%的NaCl溶液,调节其温度分别为4、50和80 ℃,将试样浸泡其中,7 d后取出,用去离子水清洗后冷风吹干.将上述干燥后的试样,在JSM-7500F型扫描电镜(SEM)下观察试样表面的腐蚀形貌.
1.3 电化学测试用瑞士万通Autolab PTN320电化学工作站和传统的三电极体系测试马氏体沉淀硬化不锈钢PH13-8Mo的电化学性能,所用溶液与浸泡实验用的溶液相同.参比电极为饱和甘汞电极(SCE),辅助电极为Pt电极(15 mm×15 mm).极化曲线和电化学阻抗谱均在开路电位下浸泡60 min后使其腐蚀电位基本达到稳定后进行测试,极化曲线和循环极化曲线测试的扫描速率为2 mV/s;电化学阻抗谱测试的激励信号是幅值为10 mV的正弦波,在自腐蚀电位下进行测量,测量频率范围为10-2~104 Hz.利用Zsimpwin软件分析阻抗数据.所有电化学测试均在恒温水浴装置中进行,且溶液未除氧处理.
2 结果及分析 2.1 Cl-质量分数的影响 2.1.1 腐蚀形貌观察为了考察溶液Cl-的质量分数对马氏体沉淀硬化不锈钢PH13-8Mo腐蚀行为的影响,对比了样品在不同Cl-质量分数的pH为3的Na2SO4+H2SO4溶液中浸泡7 d后样品的表面形貌,如图 1所示.

|
图 1 PH13-8Mo在pH3不同Cl-质量分数的Na2SO4+ H2SO4溶液中浸泡7 d后样品的表面形貌 Figure 1 The surface morphology of the PH13-8Mo immersion in pH3 Na2SO4+ H2SO4 solution with different concentrations of Cl- after immersed 7 d:(a)0 Cl-; (b)1% Cl-; (c)3.5% Cl-; (d)7% Cl- |
从图 1可以看出,随着Cl-质量分数的升高,样品表面点蚀的数量和深度明显增加.图 1(a)中可以看出,不添加Cl-时,样品表面光滑平整,基本没有发生腐蚀;少量添加Cl-至1%时,样品表面出现了点蚀,但点蚀坑的数量较少且深度较浅;继续添加Cl-至3.5%时,样品表面点蚀的数量明显增大,而且点蚀坑的深度明显增加;当Cl-的质量分数增加至7%时,相邻的点蚀已经连成片,深度继续增加,样品表面表现出均匀腐蚀的形态.
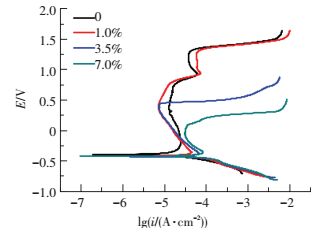
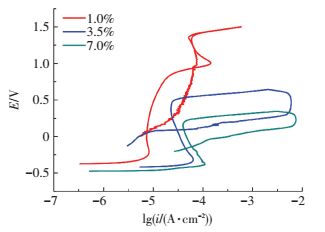
2.1.2 极化曲线和循环极化曲线测试图 2和图 3所示分别为PH13-8Mo在pH为3的不同Cl-质量分数的0.5M Na2SO4+H2SO4溶液中的极化曲线和循环极化曲线.
|
图 2 PH13-8Mo在pH3不同Cl-质量分数的Na2SO4+H2SO4溶液中的极化曲线 Figure 2 The polarization curves of PH13-8Mo in pH3 Na2SO4+H2SO4 solution with different concentrations of Cl- |
|
图 3 PH13-8Mo在pH3不同Cl-质量分数的Na2SO4+H2SO4溶液中的循环极化曲线 Figure 3 The cyclic polarization curves of PH13-8Mo in pH3 Na2SO4+H2SO4 solution with different concentrations of Cl- |
由图 2可以看出,溶液中添加Cl-以及Cl-质量分数的增加,对PH13-8Mo的阴极反应没有影响,阴极极化曲线的形状没有发生变化,这说明Cl-的吸附没有改变阴极反应的类型,仍以析氢为主、伴随吸氧的阴极过程.Cl-的质量分数的增加对钝化区和点蚀电位的影响最大,加入1%的Cl-时,阳极极化曲线出现明显的活化钝化区,然后出现二次钝化区,结合腐蚀形貌分析,此处钝化为点蚀核出现后钝化膜的修复.当Cl-的质量分数高至3.5%时,活化区电流密度增大,钝化区明显缩短,电流密度增大,没有出现二次钝化,这说明Cl-的质量分数升高后需要更多的金属溶解才能形成钝化膜,并且在该Cl-的质量分数下,已经出现点蚀核后的钝化膜无法修复.当Cl-的质量分数继续升高至7%时,活化区电流密度继续增大,钝化现象已经变得不明显,稳定钝化区间由Cl-质量分数为0时的1.0 V缩短至0.1 V,维钝电流密度也显著增加.点蚀电位随着溶液中Cl-质量分数的升高而下降,维钝电流密度随着Cl-质量分数的升高而升高,说明试样随着Cl-质量分数的增大而越容易发生点蚀.从图 3可以看出,点蚀保护电位随着溶液中Cl-质量分数的升高而降低,当Cl-的质量分数由1%增加到7%时,点蚀保护电位由0.935 V减小到-0.143 V.这说明随着溶液中Cl-的质量分数的升高,PH13-8Mo抗点蚀能力下降.
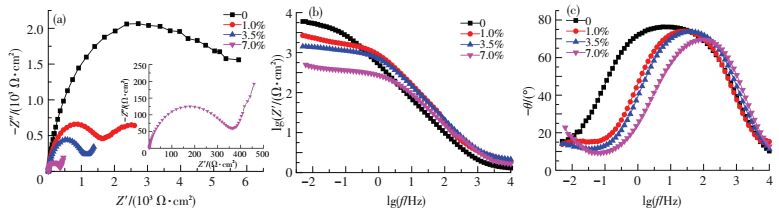
2.1.3 电化学阻抗谱测试图 4所示为Cl-质量分数对PH13-8Mo电化学阻抗的影响曲线.由图 4可以看出:随着溶液中Cl-质量分数的增加,阻抗谱容抗弧的半径明显减小,表明其腐蚀过程的阻力变小,试样的抗腐蚀能力减弱;而且加入Cl-后,Nyquist图的低频端出现了扩散弧.从Bode图上可以看出,高频区范围内相位角接近于0,表明此频率段的阻抗主要为溶液阻抗,而且溶液阻抗值均很小;中频区范围内相位角达到最大值,这是容抗的典型特征;在低频区阻抗值|Z|表示的是腐蚀反应的阻抗,可以看出,随着溶液中Cl-的质量分数的升高,阻抗值|Z|和相位角均减小,而相位角的峰也逐渐变窄.这表明在pH3的酸性溶液中,PH13-8Mo的钝化膜对基体的保护作用随着Cl-质量分数的升高而减弱.
|
图 4 PH13-8Mo在pH3不同Cl-质量分数的Na2SO4+H2SO4溶液中的电化学阻抗谱 Figure 4 The electrochemical impedance spectroscopy of PH13-8Mo in pH3 Na2SO4+H2SO4 solution with different concentrations of Cl- |
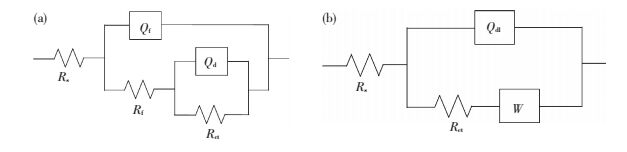
因此,对图 4的交流阻抗图采用如图 5(a)和(b)所示的等效电路进行拟合,结果见表 1.其中,Rs为溶液电阻,Rf为离子穿越钝化膜时的阻抗,Qf为钝化膜的容抗,Rct为电化学转移电阻,Qdl为双电层容抗,W为扩散阻抗.
|
图 5 交流阻抗谱采用的等效电路 Figure 5 The equivalent circuitused for simulation of impedance spectroscopy |
| 表 1 图 4电化学阻抗拟合数据表 Table 1 The fitting data of electrochemical impedance spectroscopy |
电荷转移电阻Rct与Cl-质量分数的关系见图 6.Rct与Cl-的质量分数呈指数关系,如式(1)所示:

|
图 6 电荷转移电阻Rct随Cl-质量分数的变化 Figure 6 The change of the charge transfer resistance Rct with concentration of Cl- |
| ${R_{{\rm{ct}}}} = - 2{\rm{ }}025 + 3{\rm{ }}639{\rm{exp}}( - 0.074{\rm{ }}4{\rm{ }}w({\rm{C}}{{\rm{l}}^ - })).$ | (1) |
不锈钢的耐蚀性主要是由于其中的Cr、Ni等合金元素在其表面形成一层致密的氧化膜,使其表面发生钝化.在钝化膜的生长过程中,氧离子空穴产生于金属/膜界面,消耗于膜/溶液界面,而金属离子空穴产生于膜/溶液界面,消耗于金属/膜界面.氧离子空穴的迁移导致钝化膜的生长,金属离子空穴的迁移导致钝化膜发生溶解.当溶液中存在Cl-时,由于Cl-半径较小,且具有较强的吸附和穿透力,是一种侵蚀性很强的离子,根据点缺陷模型PDM[12],Cl-会被膜/溶液界面处的Cr、Ni等金属离子强烈地吸附,并从金属表面把氧排挤掉,填充到氧离子空位处,这时钝化膜中的O2-被Cl-取代,金属氧化物变成可溶性氯化物,钝化膜开始溶解.与此同时氧离子空位的减小促使钝化膜产生金属离子空位/氧离子空位对,新生成的氧离子空位又可与Cl-在钝化膜/溶液界面反应,产生更多的金属离子空位.因此, Cl-的吸附与金属离子空位的产生为相互催化过程,多余的金属离子空位在金属/膜界面局部堆积,将金属基体与钝化膜隔离,阻止了钝化膜的继续生长.
随着溶液中Cl-质量分数的增加,钝化膜表面金属离子吸附Cl-的数量增加,钝化膜表面发生溶解的区域以及钝化膜内部金属与钝化膜被隔离的区域增大加深,当溶液中Cl-质量分数的增大到某一值时,钝化膜表面开始破裂,并向周围施加张力使钝化膜的破裂速率和面积不断增大,引起点蚀的成核和生长.一旦钝化膜的薄弱处破裂形成点蚀坑,钝化-活化微电池即形成,在点蚀坑底部的金属处于活化态为阳极,在此区域金属发生活性溶解;在金属表面(钝化膜覆盖的表面)以及点蚀坑周围有钝化膜的区域为阴极,阴极反应会消耗阳极溶解过程产生的电子.为了保持电荷平衡,溶解的阳离子一部分从点蚀坑向外流动,而Cl-则通过电泳从金属表面向点蚀坑内移动,结果导致坑内金属离子和Cl-浓缩,在浓的Cl-中,钝化过程更加困难,同时浓的金属离子水解,使点蚀坑内溶液的pH值下降,钝化过程无法进行,使得点蚀向纵深方向发展.
2.2 温度的影响 2.2.1 腐蚀形貌分析为了考察溶液温度对马氏体沉淀硬化不锈钢PH13-8Mo腐蚀行为的影响,对比了样品在不同温度的pH值为3、Cl-质量分数为3.5%的Na2SO4+H2SO4溶液中浸泡7 d后样品的表面形貌,如图 7所示.

|
图 7 PH13-8Mo在pH3、Cl-质量分数为3.5%不同温度的Na2SO4+H2SO4溶液中浸泡7 d后样品的表面形貌 Figure 7 The surface morphology of the PH13-8Mo in pH3 Na2SO4+ H2SO4 solution with 3.5% Cl- at different temperature after immersed 7 d:(a)4 ℃; (b)25 ℃; (c)50 ℃; (d)80 ℃ |
从图 7可知,随着溶液温度的升高,样品表面点蚀的数量和深度明显增加.图 7(a)中可以看出,当溶液温度为4 ℃时,样品表面光滑平整,基本没有发生腐蚀.当溶液温度升高至25 ℃时,样品表面出现了点蚀,但点蚀坑的深度较浅;当溶液温度继续升高至50 ℃时,样品表面已由点蚀发展为全面腐蚀,而且晶粒内部比晶界处腐蚀的更加严重;当溶液温度升高至80 ℃时,全面腐蚀更加严重,腐蚀深度继续增加,样品表面粗糙不平,并且有整块晶粒从样品表面脱落露出相对光滑的晶面.
2.2.2 极化曲线和循环极化曲线测试图 8和图 9分别为PH13-8Mo在不同温度的pH3、Cl-质量分数为3.5%的Na2SO4+H2SO4溶液中的极化曲线和循环极化曲线, 可以看出,随着溶液温度的增加,曲线整体向右下方移动,自腐蚀电位负移,自腐蚀电流密度和维钝电流密度均增加,活性溶解电流峰变大,钝化区间明显缩短,点蚀电位由4 ℃时的0.63 V,25 ℃时的0.48 V,50 ℃时的0.16 V下降至80 ℃时的0 V.从图 9可以看出,随着溶液温度的升高,点蚀保护电位逐渐降低,由4 ℃时的0.162 V降低到80 ℃时的-0.157 V.这些参数的变化表明, 在pH3的酸性溶液中,温度对PH13-8Mo的电化学腐蚀行为影响显著,随着溶液温度的升高,钝化膜的稳定性和保护性减弱,耐腐蚀性能显著降低,腐蚀速率明显增加.
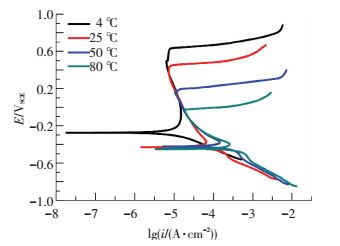
|
图 8 PH13-8Mo在pH3、Cl-质量分数为3.5%的不同温度的Na2SO4+H2SO4溶液中的极化曲线 Figure 8 The polarization curves of PH13-8Mo in pH3 Na2SO4+H2SO4 solution with 3.5% Cl- at different temperature |
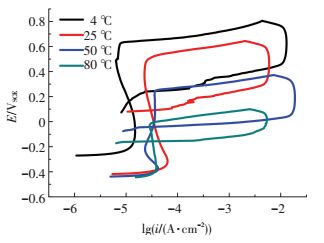
|
图 9 PH13-8Mo在pH3、Cl-质量分数为3.5%的不同温度的Na2SO4+H2SO4溶液中的极化曲线 Figure 9 The cyclic polarization curves of PH13-8Mo in pH3 Na2SO4+H2SO4 solution with 3.5% Cl- at different temperature |
由于温度的升高会加速金属离子的溶解扩散,一般认为, Fe2+或Ni2+是钝化膜中的主要载流子[13-14],溶液温度越高载流子密度越大,钝化膜的稳定性和致密性随之下降.另外,溶液温度越高氢氧化物的脱水反应越剧烈[15],以上两者均使得PH13-8Mo的腐蚀电流密度随着溶液温度的升高而增大.由于溶液温度的升高使得金属氧化物和氢氧化物更容易发生化学和电化学溶解[16],从而使得PH13-8Mo的钝化区间变短.此外,比较不同溶液温度下Cr-H2O,Fe-H2O体系的电位-PH图[17]可以看出,随着溶液温度的升高,Cr2O3→CrO42-、Fe2O3→FeO42-转变的电位下降,也会使得极化曲线的钝化区变窄.
2.2.3 电化学阻抗谱分析图 10所示为PH13-8Mo在不同温度的pH3、Cl-质量分数为3.5%的Na2SO4+H2SO4溶液中的电化学阻抗谱.
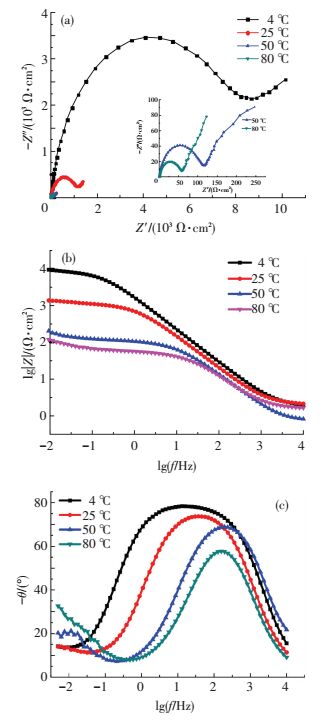
|
图 10 PH13-8Mo在pH3、Cl-质量分数为3.5%的不同温度的Na2SO4+H2SO4溶液中的电化学阻抗谱 Figure 10 The electrochemical impedance spectroscopy of the PH13-8Mo in pH3 Na2SO4+ H2SO4 solution with 3.5% Cl- at different temperature |
由图 10可以看出,在所测量的温度范围内,阻抗谱上均具有一个时间常数,即高频容抗弧和低频扩散弧,且随着溶液温度的增加,低频扩散的特性明显增加.高频容抗弧的出现,说明此时的电极反应主要是溶液及电极表面的电荷转移控制,随着溶液温度的升高,电极表面的法拉第反应加速,致使电极过程的控制步骤由低温时的电荷转移控制变成高温时的扩散控制.因此,采用如图 5(b)等效电路进行拟合,拟合数据见表 2.电荷转移电阻Rct与温度t的关系见图 11.Rct与温度呈指数关系,如式(2)所示.随着温度的升高,Rct呈指数下降:
| 表 2 电化学阻抗拟合数据表 Table 2 The fitting data of electrochemical impedance spectroscopy |
| ${R_{{\rm{ct}}}} = 30.71 + 11724.57{\rm{exp}}\left( { - 0.097{\rm{ }}2t} \right).$ | (2) |
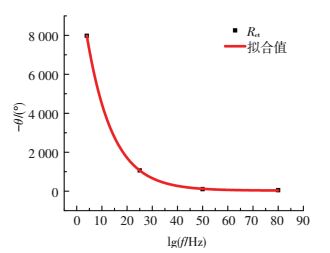
|
图 11 电荷转移电阻Rct随温度的变化 Figure 11 The change of the charge transfer resistance Rct with the temperature |
从物质扩散角度分析,随着系统温度的升高,一方面金属基体晶格内能和晶粒内部金属原子动能增加,使得晶粒的稳定性下降,从而使得金属原子更容易从晶粒内部扩散到表面并逸出;另一方面,逸出的金属离子和溶液中的氧化剂离子OH-、O2-及溶解的O2等扩散速率显著增加,使氧化膜厚度不断增加,金属的腐蚀加剧.从氧化膜结构和形貌角度分析,随着系统温度升高,内层氧化膜中掺杂的Fe2+和Ni2+含量增加导致形成的膜更加不均匀,因此,氧化膜的稳定性、致密性和对基体的保护性都大为降低,必然造成腐蚀电流密度和腐蚀速率增加.
一方面从电化学腐蚀热力学角度分析对于阳极电极反应来说可用Arrhenius公式[18]来表示电极反应速率常数与温度的关系:
| ${\rm{ln}}K = - {E_{\rm{R}}}/RT + B.$ | (3) |
式中:K为阳极反应速度率数;ER为反应活化能;R为摩尔气体常数;T为热力学温度;B为频率因数.
由式(3)可以看出,ER不变时,温度的升高会增大K值,因而阳极反应加速,这对于活化控制来说尤为显著;另一方面,从电化学腐蚀动力学角度分析,随着溶液温度的升高,工作电极表面Cl-的扩散速率增大,电子交换速率越快,Cl-越容易吸附在钝化膜的缺陷处,与钝化膜及金属基体反应,发生点蚀.点蚀的形成加快了基体的溶解速率,进而使得腐蚀电流密度变大,耐腐蚀性能下降.
3 结论1) 酸性NaCl溶液中Cl-质量分数和溶液温度影响了PH13-8Mo沉淀硬化不锈钢的腐蚀形貌.随着Cl-质量分数的增加和溶液温度的升高,PH13-8Mo点蚀的数量和深度明显增加,腐蚀形貌由点蚀演变为全面腐蚀,并且溶液温度对腐蚀的影响更加明显.
2) 电化学极化曲线和循环极化曲线实验测得酸性NaCl溶液中,Cl-质量分数较低时,随着外加电位的增高,试样表面呈现活化/钝化以及过钝化的状态;随着Cl-质量分数的升高,点蚀电位和点蚀保护电位均降低,钝化区间变短,抗点蚀能力下降.当Cl-的质量分数超过某一值时,试样表面的钝化现象消失,试样直接由活化区转变到点蚀区.
3) 电化学阻抗谱实验测得酸性NaCl溶液中,随着溶液温度的升高电极反应的控制过程发生改变,由低温时的电荷转移控制转变为高温时的扩散控制.
| [1] |
吕祥鸿, 赵国仙, 张建兵, 等. 超级13Cr马氏体不锈钢在CO2及H2S/CO2环境中的腐蚀行为[J]. 北京科技大学学报, 2010, 32(2): 207–212.
LV Xianghong, ZHAO Guoxian, ZHANG Jianbing, et al. Corrosion behaviours of super 13Cr martensitic stainless steel under CO2 and H2S/CO2 environment[J]. Journal of University of Science and Technology Beijing, 2010, 32(2): 207–212. |
| [2] | YIN Z F, ZHAO W Z, TIAN W, et al. Pitting behavior on super 13Cr stainless steel in 3.5% NaCl solution in the presence of acetic acid[J]. Journal of Solid State Electrochemistry, 2009, 13(8): 1291–1296. DOI: 10.1007/s10008-008-0675-3 |
| [3] | MONNOT M, NOGUEIRA R P, ROCHE V, et al. Sulfide stress corrosion study of a super martensitic stainless steel in H2S sour environments: metallic sulfides formation and hydrogen embrittlement[J]. Applied Surface Science, 2017, 394: 132–141. DOI: 10.1016/j.apsusc.2016.10.072 |
| [4] | MUNN P, ANDERSSON B. Hydrogen embrittlement of PH13-8Mo steel in simulated real-life tests and slow strain rate tests[J]. Corrosion, 1990, 46(4): 286–295. DOI: 10.5006/1.3585104 |
| [5] |
袁文明, 金建军. 航空用新型高性能结构钢和不锈钢国外标准分析[J]. 航空标准化与质量, 2009(4): 40–43.
YUAN Wenming, JIN Jianjun. Foreign standard analysis of high performance structural steel and stainless steel for aviation[J]. Aeronautic Standardization & Quality, 2009(4): 40–43. |
| [6] |
宋为顺, 赵先存, 马金平. 高强度不锈钢的进展与展望[J]. 重庆特钢, 1993(1): 22–27.
SONG Weishun, ZHAO Xiancun, MA Jinping. Progress and prospace of high strength stainless steels[J]. Chongqing Special Steel, 1993(1): 22–27. |
| [7] | TSAY L W, CHI M Y, CHEN H R, et al. Investigation of hydrogen sulfide stress corrosion cracking of PH 13-8 Mo stainless steel[J]. Materials Science and Engineering A, 2006, 416: 155–160. DOI: 10.1016/j.msea.2005.10.021 |
| [8] | MITTRA J, DEY G K, SEN D, et al. Solution quenched structure of wrought PH 13-8 Mo stainless steel[J]. Scripta Materialia, 2004, 51: 349–353. DOI: 10.1016/j.scriptamat.2004.03.031 |
| [9] | LEITNER H, SCHNITZER R, SCHOBER M, et al. Precipitate modification in PH13-8 Mo type maraging steel[J]. Acta Materialia, 2011, 59: 5012–5022. DOI: 10.1016/j.actamat.2011.04.053 |
| [10] | PING D H, OHNUMA M, HIRAKAWA Y, et al. Microstructural evolution in 13Cr8Ni2.5Mo2Al martensitic precipitation-hardened stainless steel[J]. Materials Science and Engineering A, 2005, 394: 285–295. DOI: 10.1016/j.msea.2004.12.002 |
| [11] | SCHNITZER R, RADIS R, NOHRER M, et al. Reverted austenite in PH13-8Mo maraging steels[J]. Materials Chemistry and Physics, 2010, 122: 138–145. DOI: 10.1016/j.matchemphys.2010.02.058 |
| [12] | FATTAH-ALHOSSEINI A, SOLTANI F, SHIRSALIMI F, et al. The semiconducting properties of passive films formed on AISI 316L and AISI 321 stainless steels: a test of the point defect model (PDM)[J]. Corrosion Science, 2011, 53: 3186–3192. DOI: 10.1016/j.corsci.2011.05.063 |
| [13] | PAOLA A D. Semiconducting properties of passive films on stainless steels[J]. Electrochimica Acta, 1989, 34(2): 203–210. DOI: 10.1016/0013-4686(89)87086-0 |
| [14] | HAKIKI N E, MONTEMOR M F, FERREIRA M G S, et al. Semiconducting properties of thermally grown oxide films on AISI 304 stainless steel[J]. Corrosion Science, 2000, 42: 687–702. DOI: 10.1016/S0010-938X(99)00082-7 |
| [15] | HUANG Junbo, WU Xinqiang, HAN Enhou. Electrochemical properties and growth mechanism of passive films on alloy 690 in high-temperature alkaline environments[J]. Corrosion Science, 2010, 52: 3444–3452. DOI: 10.1016/j.corsci.2010.06.016 |
| [16] | HUANG Junbo, WU Xinqiang, HAN Enhou. Influence of pH on electrochemical properties of passive films formed on alloy 690 in high temperature aqueous environments[J]. Corrosion Science, 2009, 51: 2976–2982. DOI: 10.1016/j.corsci.2009.08.002 |
| [17] | CHEN C M, ARAL K, THEUS G J. Computer-calculated potential-pH diagrams to 300 ℃, EPRI: report NP-3137[R]. Palo Alto, CA: Electric Power Research Institute, 1983. |
| [18] | CHENG Y F, STEWARD F R. Corrosion of carbon steels in high-temperature water studied by electrochemical techniques[J]. Corrosion Science, 2004, 46: 2405–2420. DOI: 10.1016/j.corsci.2004.01.021 |
 2017, Vol. 25
2017, Vol. 25


