2. 中国地质大学(武汉) 环境学院;
3. 中国地质大学(武汉) 材料与化学学院, 武汉 430074
2. School of Environmental Studies, China University of Geosciences, Wuhan 430074, China;
3. Faculty of Materials Science and Chemistry, China University of Geosciences, Wuhan 430074, China
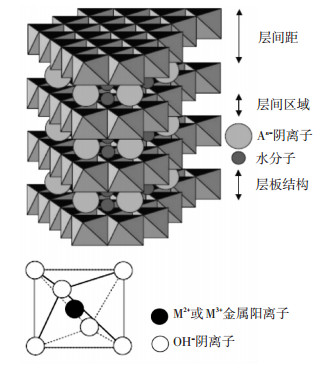
阴离子粘土, 又称为层状双羟基复合金属氧化物(Layered Double Hydroxide, LDH)(结构如图 1所示), 具有相对较弱的层间结合位点, 较大的比表面积, 耐高温、耐辐射, 离子交换容量(2~3 meq/g)可与阴离子交换树脂相媲美, 因而被广泛应用于化学化工、离子交换及吸附等领域[1-5].水氯铁镁石(Mg-Fe-LDH)为具有Mg/Fe结构层的一类特殊阴离子粘土, 由于层板结构中铁的存在, 通过表面络合作用既可以固定溶液中砷、磷、硒、锑、钼、钨等元素的含氧络阴离子[6-11], 又能有效吸附工业废水中的阴离子活性染料[12-14], 因此, 对水环境中上述有害组分有理想的去除效果.此外, Mg/Fe类的阴离子粘土热分解后可形成具有催化活性的金属氧化物固溶体, 在碱催化、氧化还原催化领域发挥重要作用[15-16].
随着综合性多学科的交汇发展, 在高分子材料、医疗制药、水泥添加剂等领域也发现了Mg/Fe类阴离子粘土的强大功效和价值, 因此, 其在新领域的应用也不断受到追捧[17].然而, 实际应用中大颗粒材料因克服自身扩散阻力而丧失了部分吸附性能和催化活性, 以其吸附性能为例, 用比表面积小的微米材料代替纳米材料, 或较少体系吉布斯自由能, 会直接影响水污染修复效果, 若应用过程中直接采用阴离子粘土的纳米悬浮液净化水体, 悬浮液渗透系数低, 分离难度大、造价高, 因此, 寻求获得超微粒的纳米颗粒的方法, 为今后进行渗透墙的应用提供技术支撑, 有助于实现原位处理水环境有害组分.由此笔者开展了合成纳米级阴离子粘土材料的研究, 以期制备颗粒更小、性能更优异的粘土材料, 然而对纳米级水氯铁镁石颗粒的制备和团聚效应控制方面的比较研究还未见报道.
纳米材料粒径小, 表面覆盖原子所占比例高, 通常具备较高的比表面积、较强的表面活性和特殊的物理化学特征, 是其得到广泛应用的物质基础.然而, 这些特征也使得纳米材料不稳定、表面能高, 易于团聚生成次生产物, 导致颗粒粒径增大, 纳米材料的优势难以得到有效开发.通常, 根据纳米颗粒团聚的机理可将团聚现象分为硬团聚和软团聚.软团聚是因粒子间的静电引力和范德华力作用产生的聚合现象, 常通过机械作用或简单的化学作用消除.硬团聚形成机理主要有氢键结合、化学键结合和毛细力结合等[19].研究发现, 硬团聚形成的根源在于羟基基团的氢键, 颗粒间的微量水分子通过氢键作用将纳米粒子两两联结, 另外, 水分蒸发过程中颗粒表面的毛细压力使孔隙收缩, 促使氢键作用进一步强化, 从而加剧硬团聚的生成.液体介质中纳米颗粒间同样发生排斥作用, 主要有粒子表面产生溶剂化膜作用、双电层静电排斥作用和聚合物层间的空间保护作用等[20].一旦引力作用克服排斥作用, 纳米颗粒团聚; 反之, 则发生分散.
绝大多数纳米材料是以悬浮液状态在液相中合成的, 合成过程中未充分反应的盐类等杂质(如氯离子、氢氧根离子), 在颗粒间容易架设“盐桥”, 结合多余的非架桥羟基, 使晶粒生长的速度加快[21].在液相中存放时, 由于布朗运动, 颗粒相互接近, 若颗粒具有足够的能量能克服液体分子运动产生的撞击, 则颗粒间发生团聚效应, 且该团聚效应将引起颗粒尺寸随时间推移而逐渐增大[22].悬浮液干燥时, 随着溶剂相的蒸发, 固相颗粒不断地相互靠近, 在表面张力和毛细力的作用下紧密地聚集在一起.
综上, 团聚效应是纳米悬浮液合成及存放过程中的一个难题, 如何控制羟基基团的联结、干燥时降低颗粒表面张力, 防止纳米颗粒团聚, 获得分散性好的固相粒子, 是充分开发利用纳米材料性能的重要课题.本文在常见纳米材料制备/干燥过程中采用的团聚控制方法的基础上, 设计了控制纳米级水氯铁镁石颗粒团聚的实验方法, 并对控制效果和相关机理进行了深入分析.
1 实验 1.1 纳米级水氯铁镁石悬浮液的制备方法纳米级水氯铁镁石采用快速沉淀-水热法合成.具体步骤为:称取5.075 g六水氯化镁和2.705 g六水氯化铁, 用去离子水配制成100 mL混合盐溶液; 称量3.2 g片状氢氧化钠, 用去离子水配制为400 mL碱溶液.将盐溶液快速注射至碱溶液中, 迅速搅拌均匀后倒入离心管中离心洗涤数次, 直至上层清液电导率小于100 μs/cm.将洗涤后松散的悬浮液分散至400 mL的去离子水中, 采用两种方法对比分散效果—即人工搅拌法和超声分离法.对比晶化时间对晶型的影响, 将两种分散方法制备的悬浮液在80 ℃下分别晶化4和16 h.冷却后的悬浮液在常温下可保存1个月.
1.2 纳米悬浮液干燥方法干燥处理可以得到固态的样品颗粒, 在实际应用时还可降低分离纳米悬浮液成本, 有效阻碍并破坏悬浮液纳米颗粒间形成的液桥.实验时选择鼓风加热干燥、真空干燥法和冷冻干燥法.鼓风加热干燥法将悬浮液置于鼓风干燥箱中, 采用电加热方式进行鼓风循环干燥试验, 通过循环风机吹出热风, 保证箱内温度在55 ℃下加热干燥直至液体蒸发完全.真空干燥则利用真空泵抽出箱内的空气, 使箱内呈真空或低压状态, 设置温度环境55 ℃, 完成样品的干燥处理.冷冻干燥法首先将悬浮液置于-12 ℃的冰箱中冷冻, 使水转变为冰, 后置于冷冻干燥箱中在真空条件下冰转变为蒸气逸出, 升华生成的水蒸气则借冷凝器除去, 最终得到干燥后的固体样品.
1.3 材料表征技术用JEOL JSM-2010型高分辨率透射电子显微镜(TEM), 表征合成悬浮液颗粒的微观形貌和结构特征, 加速电压设为200 kV.实验前将纳米悬浮液在乙醇溶液中超声10 min, 随后取一滴于包覆碳的铜网格上.观测电子衍射场的孔限直径为5~60 μm, TEM图像则通过20 μm高对比度的目标孔径采集.采用Mastersizer 3000型号的激光粒度仪检测悬浮液颗粒的粒径分布, 测试前悬浮液样品需用超声波清洗仪振荡10 min, 测量范围为0.01~3 500 μm.
固体颗粒则采用XRD、SEM和比表面积等测试手段进行表征.X射线粉晶衍射(XRD)可以检测并确定合成固体产物的内部分子结构, 实验时采用X′Pert PRO DY2198型号衍射仪, 功率为40 kV × 30 mA, 选择Cu Kα射线(波长λ=0.154 nm), 步长为0.002°, 每步时间间隔5 s.合成材料颗粒表面形态的检测采用FEI公司生产的装有X射线能谱仪(EDX)的FEI Quanta200型环境扫描电子显微镜(SEM), 可考察样品的外部形貌、粒子大小、团聚情况等, 采用X射线能谱仪对产物元素组分进一步分析.采用Micromeritics ASAP2020仪器表征合成产物比表面积, 将固体产物150 ℃脱气1 h, 选取N2作为吸附气体, 以气体吸附BET原理测定固态物质比表面积, 采用BJH方法对合成产物孔容、孔径等孔结构进行表征.
2 分析与讨论 2.1 合成样品的表征TEM图像可以表征采用快速沉淀法制备的悬浮液的微观结构.如图 2所示, 合成的水氯铁镁石悬浮液TEM图像显示合成产物具备正六边形的完整晶型, 是典型的阴离子粘土结构晶型.

|
图 2 纳米级水氯铁镁石悬浮液的TEM图像 Figure 2 TEM images of Nano-iowaites synthesized:(a) and (b) aging for 4 and 16 h respectively via ultrasonic techniques; (c) and (d) aging for 4 and 16 h respectively via manual mixing method |
由图 2可以看到, 平面上晶体均小于200 nm, 且随晶化时间的增加, 晶体尺寸略有增大.采用人工搅拌分散法得到的纳米水氯铁镁石分散效果并不理想, 图 2(c)的右上角和图 2(d)中可明显看出纳米颗粒的团聚现象.而超声分散法得到的纳米水氯铁镁石相对分散, 晶化4 h的晶型也最完整, 尺寸最小, 如图 2(a)所示, 粒径分析结果显示该样品绝大多数直径在166~675 nm的较窄范围内分布, 颗粒大小均匀.
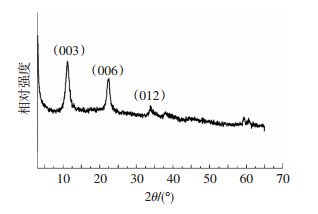
悬浮液干燥后的固体产物水氯铁镁石的XRD谱图如图 3所示, 本实验合成产物的XRD谱中低的衍射角对应更尖锐的特征峰, 高的衍射角对应的衍射峰强度弱、峰型差, 且(003)和(006)晶面显示对称的衍射峰, (012)晶面对应非对称的衍射峰, 符合类水滑石化合物(Hydrotalcite-like compounds)的衍射特点, 水氯铁镁石属三方晶系[23], 具有阴离子粘土典型的层状构造.
|
图 3 合成产物固体XRD谱图 Figure 3 XRD pattern of the synthetic product |
采用快速沉淀法制备的纳米级水氯铁镁石悬浮液, 在制备过程中对合成产物进行适当的分散处理有助于纳米悬浮液的保存.如图 4所示, 静置1周后, 超声分散的纳米悬浮液透光度良好, 无大颗粒团聚, 依旧保持了均匀的分散结果, 而人工搅拌的悬浮液在烧杯底部肉眼可见絮状物质沉淀析出, 颗粒大小不属纳米级.事实上, 在合成初期的TEM图像中就能发现采用人工搅拌法分散的悬浮液中片状颗粒更加聚集(图 2), 尺寸略大, 尽管肉眼无法分辨分散是否完全, 但随着静置时间的增加, 团聚体持续生长, 最终在杯底沉积.

|
图 4 超声分散及人工搅拌法分散悬浮液对比 Figure 4 Effect of ultrasonic techniques(U) and manual mixing method(R):the suspension standing for a week of the aging 4 h (a) and 16 h (b) |
研究发现, 声化学有助于加强颗粒物在悬浮液中的分散, 超声作用是频率在20 kHz至10 MHz间的周期性机械振动.由于超声波的波长远大于颗粒物的尺寸, 超声作用通常会产生强烈的剪切梯度而引发机械破坏, 产生的冲击波和微射流作用于悬浮质, 能击碎颗粒间的软团聚体, 加强颗粒的震动, 同时超声波还具备搅拌作用, 可使合成的悬浮颗粒充分分散[24].若分散时间过长, 超声处理的悬浮液局部温度升高, 热能和机械能增大, 加剧颗粒间的共振运动, 颗粒集合的几率升高, 进而实现了粒子的二次团聚, 因此, 应避免高温超声分散或过长的作用时间, 以最低程度的超声作用来分散悬浮液纳米颗粒, 可延长纳米悬浮液的保存时间.
2.3 干燥过程中团聚现象对比 2.3.1 传统干燥法处理后的团聚现象传统的固体干燥方法包括鼓风干燥法和真空干燥法, 利用蒸发作用使样品脱水干燥, 该方法操作简单、效率高、成本低, 但该干燥方法同时存在副作用, 如样品表面硬化、收缩、再水合能力差等.采用鼓风干燥法和真空干燥法对合成的水氯铁镁石悬浮液进行干燥处理, 纳米颗粒的团聚现象较为严重, 场扫描电镜结果如图 5、图 6所示, 低倍情况下, 可见片状碎屑不均匀堆积, 大小不一; 高倍观察可明显看到纳米级片状颗粒(直径在200 nm左右)聚合成碎块, 交错堆积, 高低起伏, 杂乱无章.此两种干燥方法导致纳米颗粒聚合的主要原因是在悬浮液转变为凝胶或固态颗粒的热处理过程中, 吸附水结构中水分子逐步脱除, 随着水分的蒸发, 水氯铁镁石的孔隙特征和层状结构将引发较强的毛细管行为, 水表面张力作用使颗粒表面毛细管力越来越大, 克服颗粒间静电斥力而越来越紧, 颗粒之间的引力增大, 最后粒子团聚成更大的块体.

|
图 5 纳米级水氯铁镁石悬浮液鼓风干燥后固体颗粒的扫描电镜图像 Figure 5 SEM images of Nano-iowaites after air drying:magnify 2 500 times (a), and 22 000 times(b) |

|
图 6 纳米级水氯铁镁石悬浮液真空干燥后固体颗粒的扫描电镜图像 Figure 6 SEM images of Nano-iowaites after vacuum drying:magnify 2 500 times (a), and 22 000 times(b) |
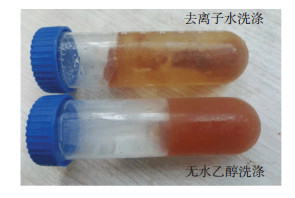
通常, 冷冻干燥技术包括材料的制备、低温下悬浮液冷冻固化和溶剂真空或低压下升华等步骤, 与其他脱水过程相比该技术能最大程度的保留样品的物化性质和结构特征, 尤其适用于样品的储存和长途运输[25].同时, 冷冻干燥技术是控制悬浮液脱水过程中团聚现象产生的有效措施, 充分利用水的物理特性, 通过将水冷冻成冰, 体积膨胀, 使聚集的纳米颗粒能够适当分开, 抑制了团聚体的形成, 且冰的表面张力远远小于液态水, 不利于粒子间团聚.为进一步分散纳米颗粒, 在冷冻干燥前, 在悬浮液中加入无水乙醇代替去离子水洗涤, 含乙醇的纳米悬浮液后置于-12 ℃冰柜中冷却成冰块.如图 7所示, 加入无水乙醇的悬浮液在低温下快速冻结的固体质地更加均匀, 分散较好, 而未加入无水乙醇的悬浮液在快速冻结的过程中冰块中心纳米颗粒呈柱状聚集, 即在冷却过程中纳米颗粒出现了团聚现象.
|
图 7 采用去离子水和无水乙醇洗涤的悬浮液快速固化现象 Figure 7 Expediting setting of the synthetic suspension washed by deionized water and absolute alcohol |
这样, 用有机溶剂充分洗涤悬浮液纳米颗粒, 使颗粒表面吸附的水分被表面张力较小的有机溶剂所取代, 降低羟基基团联结的可能性, 同时减小了使颗粒聚集的毛细力, 使颗粒不再团聚.实验中采用无水乙醇洗去粒子表面的配位水分子, 移除大量的化学及物理吸附水或羟基(—OH), 是避免硬团聚产生的关键步骤.
在场扫描电子显微镜下, 对无水乙醇洗涤的悬浮液进行冷冻干燥后, 固体颗粒表面形态放大2 500倍, 如图 8所示, 固体表面十分平整、细腻, 放大35 000后, 可见纳米颗粒呈蜂窝状结构松散沉积, 较传统干燥法处理后的固体片状结构更薄, 尺寸更小, 且排列均匀, 更接近预期结果.

|
图 8 纳米级水氯铁镁石悬浮液冷冻干燥后固体颗粒的扫描电镜图像 Figure 8 SEM images of Nano-iowaites after freeze drying:magnify 2 500 times (a), and 35 000 times(b) |
比表面积值是表征纳米材料的重要指标, 也是评价吸附剂性能优劣的参考值.理论上, 比表面积越大, 孔径越小, 活性位点分布越密集.采用几种干燥方法处理后的水氯铁镁石比表面积及孔容孔径等孔结构分析如表 1所示.采用冷冻干燥法干燥的固体颗粒比表面积值为124.62 m2/g, 与其他文献中报道的纳米级阴离子粘土最大比表面积值127 m2/g[26]相近.传统的鼓风干燥法和真空干燥法处理的固体颗粒比表面积远远小于其值, 分别为52.47和66.60 m2/g, 与扫描电镜的结果一致, 表明冷冻干燥法处理后的固体颗粒无论是表面形态、颗粒大小还是排列方式均优于传统干燥法, 对纳米颗粒的团聚现象实现了有效控制.
| 表 1 几种干燥法处理的水氯铁镁石比表面积对比 Table 1 Specific surface area of iowaites dried |
1) 超声分散利用超声波的空化作用和微射流的粉碎作用, 较普通的人工搅拌在纳米水氯铁镁石悬浮液的制备中起到了较好的分散效果, 可有效改善悬浮液存放时颗粒团聚的问题.
2) 采用低表面张力的无水乙醇代替去离子水对悬浮液进行洗涤, 避免了在悬浮液快速冷却过程中纳米颗粒形成柱状团聚.
3) 悬浮液干燥时水氯铁镁石层板上—OH基团的氢键是导致硬团聚的关键, 而毛细管作用导致—OH基团的进一步联结, 加剧了硬团聚的形成, 采用冷冻干燥有利于颗粒团聚的控制, 最终达到理想的分散效果.
| [1] | KOILRAJ P, SASAKI K. Fe3O4/MgAl-NO3 layered double hydroxide as a magnetically separable sorbent for the remediation of aqueous phosphate[J]. Journal of Environmental Chemical Engineering, 2016, 4(1): 984–991. DOI: 10.1016/j.jece.2016.01.005 |
| [2] | THEISS F L, AYOKO G A, FROST R L. Iodide removal using LDH technology[J]. Chemical Engineering Journal, 2016, 296: 300–309. DOI: 10.1016/j.cej.2016.02.039 |
| [3] | PRAKRUTHI H R, CHANDRASHEKARA B M, JAI PRAKASH B S, et al. Microwave rehydrated Mg-Al-LDH as base catalyst for the acetalization of glycerol[J]. Catalysis Science & Technology, 2015, 5(7): 3667–3674. |
| [4] | EDENHARTER A, BREUJ. Applying the flame retardant LDH as a Trojan horse for molecular flame retardants[J]. Applied Clay Science, 2015, 114: 603–608. DOI: 10.1016/j.clay.2015.07.013 |
| [5] | CHEN Y, SHUI Z, CHENW, et al. Chloride binding of synthetic Ca-Al-NO3 LDHs in hardened cement paste[J]. Construction and Building Materials, 2015, 93: 1051–1058. DOI: 10.1016/j.conbuildmat.2015.05.047 |
| [6] | GUO Q, CAO Y, ZHUANGY, et al. Effective treatment of arsenic-bearing water by a layered double metal hydroxide:Iowaite[J]. Applied Geochemistry, 2017, 77: 206–212. DOI: 10.1016/j.apgeochem.2016.04.008 |
| [7] | CAO Y, GUO Q, SHU Z, et al. Application of calcined iowaite in arsenic removal from aqueous solution[J]. Applied Clay Science, 2016, 126: 313–321. DOI: 10.1016/j.clay.2016.04.002 |
| [8] | DAS J, SAIRAM PATRA B, BALIARSINGH N, et al. Calcined Mg-Fe-CO(3) LDH as an adsorbent for the removal of selenite[J]. Journal of Colloid Interface Sci, 2007, 316(2): 216–23. DOI: 10.1016/j.jcis.2007.07.082 |
| [9] | PAIKARAY S, HENDRY M J, ESSILFIE-DUGHAN J. Controls on arsenate, molybdate, and selenate uptake by hydrotalcite-like layered double hydroxides[J]. Chemical Geology, 2013, 345: 130–138. DOI: 10.1016/j.chemgeo.2013.02.015 |
| [10] | WAN S, WANG S, LIY, et al. Functionalizing biochar with Mg-Al and Mg-Fe layered double hydroxides for removal of phosphate from aqueous solutions[J]. Journal of Industrial and Engineering Chemistry, 2017, 47: 46–253. DOI: 10.1016/j.jiec.2016.11.031 |
| [11] | ASHEKUZZAMAN S M, JIANG J Q. Strategic phosphate removal/recovery by a re-usable Mg-Fe-Cl layered double hydroxide[J]. Process Safety & Environmental Protection, 2017, 107: 454–462. |
| [12] | AHMED I M, GASSER M S. Adsorption study of anionic reactive dye from aqueous solution to Mg-Fe-CO3 layered double hydroxide (LDH)[J]. Applied Surface Science, 2012, 259(42): 650–656. |
| [13] | BENSELKA-HADJ Abdelkader N, BENTOUAMI A, DERRICHE Z, et al. Synthesis and characterization of Mg-Fe layer double hydroxides and its application on adsorption of orange G from aqueous solution[J]. Chemical Engineering Journal, 2011, 169(1-3): 231–238. DOI: 10.1016/j.cej.2011.03.019 |
| [14] | LI B, ZHANG Y, ZHOU X, et al. Different dye removal mechanisms between monodispersed and uniform hexagonal thin plate-like MgAl-CO32-LDH and its calcined product in efficient removal of Congo red from water[J]. Journal of Alloys and Compounds, 2016, 673: 265–271. DOI: 10.1016/j.jallcom.2016.02.248 |
| [15] | VALENTE J S, HERNANDEZ-CORTEZ J, CANTUM S, et al. Calcined layered double hydroxides Mg-Me-Al (Me:Cu, Fe, Ni, Zn) as bifunctional catalysts[J]. Catalysis Today, 2010, 150(3-4): 340–345. DOI: 10.1016/j.cattod.2009.08.020 |
| [16] | CAO Y, ZHAO Y, JIAO Q. Fe-based catalysts from Mg/Fe layered double hydroxides for preparation of N-doped carbon nanotubes[J]. Materials Chemistry and Physics, 2010, 122(2-3): 612–616. DOI: 10.1016/j.matchemphys.2010.03.055 |
| [17] | ARCO M D, FERNANDEZ A, MARTIN C, et al. Solubility and release of fenbufen intercalated in Mg, Al and Mg, Al, Fe layered double hydroxides (LDH):The effect of Eudragit© S 100 covering[J]. Journal of Solid State Chemistry, 2010, 183(12): 3002–3009. DOI: 10.1016/j.jssc.2010.10.017 |
| [18] | GOH K H, LIM T T, DONGZ. Application of layered double hydroxides for removal of oxyanions:a review[J]. Water Research, 2008, 42(6-7): 1343–1368. DOI: 10.1016/j.watres.2007.10.043 |
| [19] |
唐浩林, 潘牧, 赵修建. 溶胶凝胶法制备α-Al2O3纳米材料团聚控制研究新进展[J]. 材料导报, 2002, 16(9): 44–45.
TANG Haolin, PAN Mu, ZHAO Xiujian. Progress in research on agglomeration control in synthesizing α-Al2O3 nanometer materials by sol-gel technique[J]. Materials Review, 2002, 16(9): 44–45. |
| [20] |
冯拉俊, 刘毅辉, 雷阿利. 纳米颗粒团聚的控制[J]. 微纳电子技术, 2003, 40(7): 536–539.
FENG Lajun, LIU Yihui, LEI Ali. The controlling of nanoparticle agglomerates[J]. Micronanoelectronic Technology, 2003, 40(7): 536–539. |
| [21] |
陈永, 洪玉珍, 曹峰, 等. 纳米材料团聚及其表面包覆[C]//2008全国功能材料科技与产业高层论坛论文集. 天津: [S. n. ], 2008: 642-647. CHEN Yong, HONG Yuzhen, CAO Feng, et al. The aggregation of nanoparticles and its surface coating modification[C]//Proceedings of the 2008 National High Level Forum on Functional Materials Technology and Industry. Tianjin: [S. n. ], 2008: 642-647. |
| [22] |
林灵楠, 彭浩, 丁国良, 等. 表面活性剂对纳米制冷剂颗粒团聚的影响[J]. 工程热物理学报, 2016, 37(9): 1968–1972.
LIN Lingnan, PENG Hao, DING Guoliang, et al. Effect of surfactant on particle agglomeration in refrigerant-based nanofluids[J]. Journal of Engineering Thermophysics, 2016, 37(9): 1968–1972. |
| [23] | CAVANI F, TRIFIRO F, VACCARI A. Hydrotalcite-type anionic clays:preparation, properties and applications[J]. Catalysis Today, 1991, 11(2): 173–301. DOI: 10.1016/0920-5861(91)80068-K |
| [24] |
刘春玲, 严芬英, 赵春英. 超声预处理对纳米SiO2的分散稳定性影响[J]. 电镀与精饰, 2015, 37(8): 32–34.
LIU Chunling, YAN Fenying, ZHAO Chunying. Influence of ultrasonic pretreatment on stability of nano-SiO2 dispersion[J]. Plating and Finshing, 2015, 37(8): 32–34. |
| [25] | LIU X, HIRAJIMA T, NONAKA M, et al. Experimental study on freeze drying of Loy Yang lignite and inhibiting water re-adsorption of dried lignite[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2017, 520: 146–153. |
| [26] | GOH K H, LIM T T, DONG Z. Enhanced arsenic removal by hydrothermally treated nanocrystalline Mg/Al layered double hydroxide with nitrate intercalation[J]. Environmental Science & Technology, 2009, 43(7): 2537–2543. |
 2018, Vol. 26
2018, Vol. 26