2. 玉林师范学院 化学与食品科学学院, 广西 玉林 537000;
3. 广西经正科技开发有限责任公司, 南宁 530007
2. School of Chemistry and Food Science, Yulin Normal University, Yulin 537000, China;
3. Guangxi Jingzheng Science and Technology Development Co.Ltd., Nanning 530007, China
近来, 国际上已有多个研究小组报道[1-4], 在Eu3+, Sm3+共掺杂的荧光粉中, 存在Sm3+离子到Eu3+离子的能量传递效应, 即Sm3+离子将吸收的能量通过发光中心相应的作用机制传递给Eu3+离子, 使Eu3+离子的发光得到增强, 如在Eu3+, Sm3+共掺的SrBi2B2O7:Eu3+, Sm3+[1]、CaGd2(WO4)2:Sm3+, Eu3+[2]、Sr3La(PO4)3:Sm3+, Eu3+[3]和Na3Bi(PO4)2:Eu3+, Tb3+, Dy3+, Sm3+[4]等稀土发光材料的发射光谱中均观察到此种增敏与增强的现象.此外, 在本研究小组合成得到的La0.8Y0.2 PO4:Sm3+, Eu3+荧光粉中[4], 也观察到了Sm3+的增强效应, 且该荧光粉可获得较强的红色发光.通常, 可通过添加敏化剂或添加电荷补偿剂的方法来提高荧光粉的发光强度.处于较高能量激发态的敏化离子通过将其吸收的能量有效地传递给邻近的发光中心, 从而增强发光中心的发光强度.此类能量传递存在3种情况:交换相互作用、多极相互作用和多声子协助能量传递, 前两者需敏化离子的发射光谱与激活离子的激发光谱有所交叠, 且交叠程度越大, 离子间的能量传递效率越高, 后者则是敏化离子与激发离子光谱之间不能满足共振条件时产生的[5].而电荷补偿离子可提高荧光粉的发光强度, 是由于电荷补偿离子进入基质晶格后, 使基质晶格产生畸变, 解除反演对称, 从而提高了稀土离子有效跃迁发射的概率.有文献报道[6], 作为一种电荷补偿离子, Bi3+离子可以有效敏化稀土离子的荧光发光, 故若在La0.8Y0.2 PO4:Eu3+, Sm3+荧光粉中再共掺起敏化作用的Bi3+离子时, 其红色荧光强度将进一步得到提高.
热分解反应过程是制备功能材料过程中一个极为重要的反应过程, 其对功能材料的生成机制、性能等均有重要的影响.但目前鲜有La0.8Y0.2 PO4:Sm3+, Eu3+, Bi3+荧光粉活性前驱体的热分解动力学研究的相关报道, 因此, 本实验运用低热固相法制备La0.8Y0.2 PO4:Bi3+, Sm3+, Eu3+荧光粉的活性前驱体, 并利用非等温等转化率的热分析法研究该前驱体热分解过程的动力学及焙烧样品的荧光性能.
1 实验 1.1 实验仪器和试剂本实验中制备样品所用化学药品均为市售分析纯(AR):(NH4)3PO4·3H2O, La2O3, Y2O3, Eu(NO3)3, Sm(NO3)3, BiCl3.样品晶体结构分析:日本理学公司Rigaku D/max 2500V型粉末X射线衍射仪(Power-XRD); 样品热分解过程分析:德国耐驰公司Netzsch Sta 409 PC/PG型热重分析仪(热重/微分热重分析(TG/DTG)), 样品形貌分:日本日立公司S-3400N型扫描电子显微镜(SEM); 样品荧光性能分析:日本日立公司F-4600型荧光分光光度计(PLE & PL).热分解动力学数据的计算分析由本课题组自编VBA软件实现.
1.2 实验过程首先运用低热固相法制备荧光粉活性前驱体, 而后用高温固相法焙烧活性前驱体得到目标产物.以50 mmol目标产物的合成为例, 以硝酸铕溶液(1 mmol/mL)、硝酸钐溶液(1 mmol/mL)、三氯化铋溶液(1 mmol/mL)、三氧化二镧(La2O3)、三氧化二钇(Y2O3)、三水合磷酸三铵((NH4)3PO4·3H2O)为合成原料, 各元素原子摩尔比为La:Y:P:Bi:Sm:Eu=0.8×(0.958-x):0.2×(0.958-x):1.00:x:0.012:0.030.按上述配比, 用电子天平定量称取三氧化二镧及三氧化二钇置于研钵中, 充分研碎研细并混合均匀, 接着用移液管分别准确地量取硝酸铕、硝酸钐及三氯化铋溶液加入到三氧化二镧及三氧化二钇的混合物中, 固液混合研磨均匀后, 分3次将三水合磷酸三铵粉末加到上述的固液混合物中, 充分混合研磨30 min.研磨结束后, 把混合物转移到蒸发皿, 并在烘箱中于120 ℃下烘干6 h得到前驱体.在马弗炉中于800 ℃下焙烧3 h, 即可将前驱体转化成为目标产物, (La0.8Y0.2 PO4)0.958-x:xBi3+, 0.012Sm3+, 0.030Eu3+(缩写为:LYPO:BSE).
2 结果与讨论 2.1 样品晶体结构分析图 1为LYPO:BSE(x=0, 0.005, 0.01, 0.02, 0.03, 0.04, 0.05)样品的XRD谱图.由图 1(a)可见, 产物的XRD谱图与PDF#84-0600(LaPO4)标准谱图相吻合, 说明已成功合成主晶相为LaPO4的目标荧光粉, 其产物谱图的基线略为毛糙, 主要是少量无定型非晶产物背景峰的干扰所致.该产物衍射峰精修计算后得到的晶格参数如下:a=0.682 781 4(2) nm, b=0.707 533(6) nm, c=0.650 363 1(1) nm; α=90°, β=103.283 72°, γ=90°.该样品晶胞参数与单斜LaPO4的标准谱图(PDF#84-0600, P21/n (14)空间群)的参数相一致:a=0.682 5 nm, b=0.705 7 nm, c=0.648 2 nm; α=90°, β=103.21°, γ=90°.说明LYPO:BSE(x=0.03)的晶体结构和单斜晶系LaPO4的晶体结构相同.图 1(b)是在LYPO:BSE中掺杂不同原子摩尔比Bi3+离子的XRD谱图, 可以看到, 在本实验所掺杂原子摩尔比范围内, 各样品XRD谱峰中没有出现明显的杂相峰, 峰形也没有明显的变化, 进一步说明样品中所掺杂的Eu、Sm及Bi离子已成功进入到基质的晶格中.
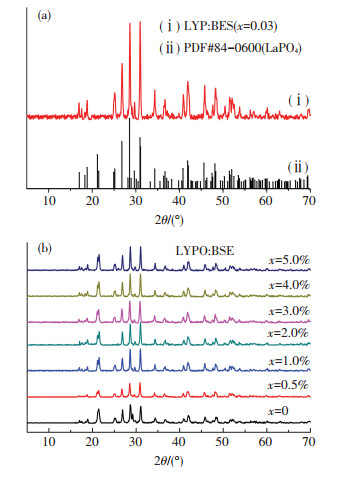
|
图 1 不同浓度样品的XRD谱图 Figure 1 XRD patterns of samples with different concentration |
图 2所示为最佳样品LYPO:BSE (x=0.03)的活性前驱体在4个不同升温速率(6, 9, 12, 15 ℃/min)下得到的TG/DTG曲线.式(1)~(5)用来表示由反应原料合成得LYPO:BSE(x=0.03)样品的化学反应过程.由上述化学反应方程及样品中各元素的摩尔比可以算出由反应原料制备该样品的理论失重率是34.296%.由图 2可见, 对于9 ℃/min的TG曲线, 在400 ℃下, 该最佳样品活性前驱体的热分解过程为一步失重过程, 且完全分解时的终点温度约为362 ℃, 说明当合成温度高于362 ℃时, 完整的LYPO:BSE晶相开始形成.TG曲线所呈现的一步失重过程也说明当合成温度高于362 ℃时, 反应混合物的质量已几乎不发生变化, 所掺杂的Bi3+, Sm3+, Eu3+已成功进入基质晶格, 这与上面XRD分析结果相佐证.通过对TG曲线计算可得该前驱体的实际失重率为17.22%, 但远小于34.296%的理论失重率.这是由于在反应过程中除了生成目标样品外, 还生成了H2O、CO2、NH3、NH4NO3及NH4Cl副样品.这些副样品在烘干前驱体的过程中(120 ℃下烘干3 h), 大部已气化成为气体.所以, 实际失重率比通过理论计算得到的失重率小很多, 但该实际失重率也表明, 前驱体还含有部分结晶水或吸附水, 通过计算确定其分子式为LYPO:BSE·2.55H2O.这一研究结果与文献[7]报道有LaPO4·nH2O的存在构成互证.
| $ \begin{gathered} {\text{L}}{{\text{a}}_{\text{2}}}{{\text{O}}_{\text{3}}}{\text{ + }}\;{\text{2(N}}{{\text{H}}_{\text{4}}}{{\text{)}}_{\text{3}}}{\text{P}}{{\text{O}}_{\text{4}}}\cdot {\text{3}}{{\text{H}}_{\text{2}}}{\text{O}}\;\underline{\underline {120℃}} \hfill \\ \;{\text{2LaP}}{{\text{O}}_{\text{4}}}{\text{ + 6N}}{{\text{H}}_{{\text{3}}}}\left( {\text{g}} \right) \uparrow {\text{ + }}\;{\text{9}}{{\text{H}}_{\text{2}}}{\text{O}}\left( {\text{g}} \right) \uparrow , \hfill \\ \end{gathered} $ | (1) |
| $ \begin{gathered} {{\text{Y}}_{\text{2}}}{{\text{O}}_{\text{3}}}{\text{ + }}\;{\text{2(N}}{{\text{H}}_{\text{4}}}{{\text{)}}_{\text{3}}}{\text{P}}{{\text{O}}_{\text{4}}}\cdot {\text{3}}{{\text{H}}_{\text{2}}}{\text{O}}\;\underline{\underline {120{\text{℃ }}}} \; \hfill \\ {\text{2YP}}{{\text{O}}_{\text{4}}}{\text{ + }}\;{\text{6N}}{{\text{H}}_{\text{3}}}\left( {\text{g}} \right) \uparrow {\text{ + }}\;{\text{9}}{{\text{H}}_{\text{2}}}{\text{O}}\left( {\text{g}} \right)\; \uparrow , \hfill \\ \end{gathered} $ | (2) |
| $ \begin{gathered} {\text{Eu(N}}{{\text{O}}_{\text{3}}}{{\text{)}}_{\text{3}}}\cdot {\text{6}}{{\text{H}}_{\text{2}}}{\text{O + (N}}{{\text{H}}_{\text{4}}}{{\text{)}}_{\text{3}}}{\text{P}}{{\text{O}}_{\text{4}}}\cdot {\text{3}}{{\text{H}}_{\text{2}}}{\text{O}}\;\underline{\underline {120{\text{℃ }}}} \; \hfill \\ {\text{EuP}}{{\text{O}}_{\text{4}}}{\text{ + 3N}}{{\text{H}}_{\text{4}}}{\text{N}}{{\text{O}}_{\text{3}}}\left( {\text{g}} \right){\text{ }} \uparrow + {\text{ 9}}{{\text{H}}_{\text{2}}}{\text{O}}\left( {\text{g}} \right)\; \uparrow \hfill \\ \end{gathered} $ | (3) |
| $ \begin{gathered} {\text{Sm(N}}{{\text{O}}_{\text{3}}}{{\text{)}}_{\text{3}}}\cdot {\text{6}}{{\text{H}}_{\text{2}}}{\text{O + (N}}{{\text{H}}_{\text{4}}}{{\text{)}}_{\text{3}}}{\text{P}}{{\text{O}}_{\text{4}}}\cdot {\text{3}}{{\text{H}}_{\text{2}}}{\text{O }}\underline{\underline {120{\text{℃}}}} \; \hfill \\ {\text{SmP}}{{\text{O}}_{\text{4}}}{\text{ + 3N}}{{\text{H}}_{\text{4}}}{\text{N}}{{\text{O}}_{\text{3}}}\left( {\text{g}} \right){\text{ }} \uparrow + {\text{ 9}}{{\text{H}}_{\text{2}}}{\text{O}}\left( {\text{g}} \right)\; \uparrow , \hfill \\ \end{gathered} $ | (4) |
| $ \begin{gathered} {\text{BiC}}{{\text{l}}_{\text{3}}}{\text{ + (N}}{{\text{H}}_{\text{4}}}{{\text{)}}_{\text{3}}}{\text{P}}{{\text{O}}_{\text{4}}}\cdot {\text{3}}{{\text{H}}_{\text{2}}}{\text{O}}\;\underline{\underline {120{\text{℃}}}} \hfill \\ \;{\text{BiP}}{{\text{O}}_{\text{4}}}{\text{ + 3N}}{{\text{H}}_{\text{4}}}{\text{Cl}}\left( {\text{g}} \right) \uparrow + {\text{3}}{{\text{H}}_{\text{2}}}{\text{O}}\left( {\text{g}} \right) \uparrow . \hfill \\ \end{gathered} $ | (5) |
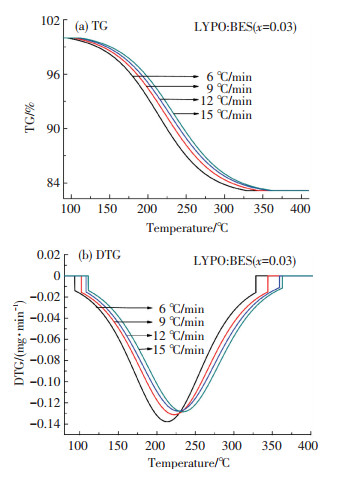
|
图 2 不同升温速率下最佳样品前驱体的TG/DTG曲线 Figure 2 TG/DTG curves for precursors of the optimal sample |
图 3是产物LYPO:BSE (x=0.03)的SEM图.由图 3可见, 因产物已经过高温烧结, 故产物是具有不规整形貌的颗粒.尽管产物的颗粒大小不均匀, 但在尺度上仍属于微米级的颗粒, 且这些粒子已进一步团聚成约3~10 μm疏松颗粒.高温固相法[8]的不足之处是, 高温烧结耗能较高, 且样品的后续研磨操作也会破坏样品颗粒的形貌和发光性能.通常, 水热法[9]或溶剂热法比较容易获得规整形貌的产物, 在这一方面, 高温固相法是无法与这两种方法相比拟的.但尽管这两种方法可以获得形貌规整, 颗粒均匀, 且分散性较好的结晶状产物, 但用来合成发光材料或荧光粉时, 这两种方法所得到的产物在发光强度方面却逊色于高温固相法所得的产物.相对而言, 高温固相法不仅合成工艺简单, 且所得产物的发光强度常比用上述两种方法合成得到的同类产物大得多.因此, 高温固相法仍是发光材料或荧光粉合成研究时首选的合成方法之一.

|
图 3 LYPO:BSE (x=0.03)产物的SEM图 Figure 3 SEM images of LYPO:BSE (x=0.03)samples |
图 4是在室温下LYPO:BSE (x=0, 0.03)两个典型样品的PLE&PL光谱图.图 4显示, 在350~500 nm范围内均有激发峰存在, 392 nm处的激发峰是最强激发峰, 说明LYPO:BSE在近紫外激发白光LED领域中有用做红色荧光粉的潜在应用前景[10].最具特色与亮点的特征是Bi3+离子的掺杂增敏了样品对激发光能的吸收, 使其最强激发峰(392 nm)得到了显著的增宽与增强, 从而使591 nm处的发射峰也得到明显增强, 说明Bi3+离子的掺杂提高了产物的光转化效率.
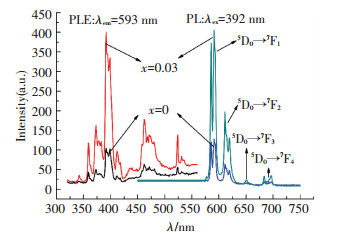
|
图 4 两个典型样品的PLE&PL图 Figure 4 PLE&PL spectra of the two representative samples |
图 4还进一步表明, 在LYPO:BSE (x=0.03)的发射谱带中只有Eu3+的发射峰, 而未呈现Sm3+发射峰.这一结果表明, Sm3+把吸收的能量传递给了Eu3+, 增强了Eu3+的发光强度而其本身并没有发光, 这与本课题组此前报道[4]的现象相一致.Eu3+离子的电子由激发态5D0到基态7FJ (J=1-4)的四重跃迁[11], 在570至690 nm范围内产生4个较强的发射光谱谱峰, 其中, 在593, 617和690 nm处有3个呈现双重分裂的发射峰.
另外, 593 nm处最强发射峰所对应的是5D0→7F1跃迁峰; 617 nm次强峰则对应的是5D0→7F2跃迁峰.依据Judd-Ofelt理论[12-13]可知, Eu3+离子在593 nm处的发射光为橙色光, 属于5D0→7F1的磁偶极跃迁, 该跃迁的强度不受晶体场强度变化的影响, 此时, Eu3+离子占据中心对称性的晶格格位, 且发射光以磁偶极跃迁(5D0→7F1)为主导.Eu3+在617 nm处的发射光为红色光, 属于5D0→7F2的电偶极跃迁.此时, Eu3+离子位于非中心对称性的晶格格位, 且发射光将以电偶极跃迁(5D0→7F2)为主导.该发射强烈依赖于晶格环境, 其强度与基质晶体场大小的变化高度相关.图 4的结果表明在最佳样品中具有中心对称性的晶格格位是Eu3+的主要格位, 因此, 以橙红色的磁偶极发射为主的光谱是样品的主要发光特点.
2.5 Bi3+掺杂浓度对样品PLE及PL的影响Bi3+掺杂浓度对样品PLE及PL强度的影响见图 5.
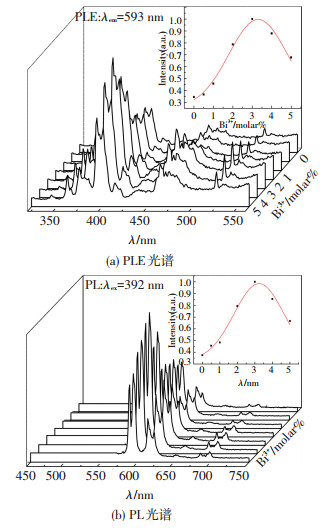
|
图 5 掺杂浓度对样品荧光性质的影响 Figure 5 Fluorescent properties of samples at different doping concentrations:(a) PLE spectra; (b) PL spectra |
由图 5可见, PLE及PL谱峰的强度随Bi3+掺杂原子比变化而发生改变, 谱峰的形状及谱峰的分裂形式没有受到Bi3+掺杂的明显影响.PLE(392 nm)及PL (591 nm)谱峰强度与Bi3+离子原子比的关系为开口向下的抛物线.即随着Bi3+离子原子比的增加, PLE及PL谱峰的强度先增强, 并达到一个最高点, 而后随着Bi3+离子原子比的继续增加, PLE及PL谱峰的强度减弱, 且这条曲线的形状与强度变化趋势相同.
Hussain等人报道[6]Bi3+可以增敏Eu3+的发光, 这与本文中“Bi3+离子对Eu3+的发光具有明显的增强效应”的结论相吻合, 且Bi3+离子的最佳掺杂原子比为x=0.03, 经计算获得最佳掺杂原子比样品的荧光强度是未掺杂样品的2.66倍.另外, 图 5还表明, 在本实验所掺杂Bi3+浓度范围内, 所得样品的发射光谱均是以5D0→7F1磁偶极跃迁为主导发射的谱带.
2.6 最佳样品前驱体的热分解动力学 2.6.1 活化能的计算由非等温动力学理论可知, 固相样品热分解动力学方程为
| $ \beta \frac{\text{d}\alpha }{\text{d}T}=A\text{exp}\left( \frac{-E}{RT} \right)f\left( \alpha \right), $ | (6) |
| $ \alpha =\frac{{{m}_{i}}-{{m}_{\text{t}}}}{{{m}_{i}}-{{m}_{\text{f}}}}. $ | (7) |
式(6)中:T为温度, K; β为升温速率, ℃/min; A为指前因子; E为表观活化能; R为气体常数(R=8.314 J/(mol·K); f(α)为机理函数的微分形式; α为转化率, 可用式(7)计算得到[14-15].式(7)中:mi为测试时产物的质量; mf为测试结束后产物的质量; mt测试过程中产物的瞬时质量.经过一系列的变换, 由式(6)可得到Ozawa-Flynn-Wall(OFW)迭代法(IOFW)方程式(8)[15].式(8)中的H(x)可分别用式(9)和式(10)计算求得.
| $ \text{ln}\frac{\beta }{H\left( x \right)}=-1.051\text{ }6\left( \frac{{{E}_{\alpha }}}{RT} \right)+\text{ln}\frac{0.004\text{ }8A{{E}_{\alpha }}}{g\left( \alpha \right)R}, $ | (8) |
| $ x=\frac{{{E}_{\alpha }}}{RT}, $ | (9) |
| $ H\left( x \right)={{\frac{\text{exp}\left(-x \right)h\left( x \right)/{{x}^{2}}}{0.004\text{ }8\text{exp}\left(-1.051\text{ }6x \right)}}^{[6]}}. $ | (10) |
IOFW法的运算过程在文献[15-19]有详细的介绍, 图 6的曲线是计算所得的结果.图 6结果表明, 当转化率α=0.1~0.9时, 热分解过程活化能平均值及其相对误差分别为:E0 =81.47 kJ/mol, r=9.0%.He等人报道[17], 对于固相材料在0.1 < α < 0.9时的热分解反应过程, 若|r|≤10%, 则Eα的值与α无关, 那么该过程的机理可视为单步热分解反应机理, 进而可以求解得到动力学的活化能、机理函数及指前因子, 即动力学三参数.因此, 图 6的结果表明, 生成样品的热分解反应的机理属于单步反应机理.
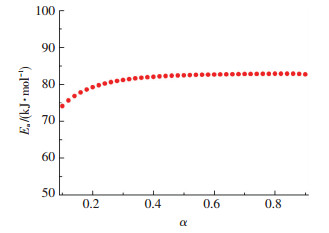
|
图 6 α~Eα曲线 Figure 6 α~Eα curves |
应用与阿伦乌尼参数lnA无关的Masterplots法(方程(11))[18]可以确定最概然机理方程g(α).其中方程(12)[19]用于计算p(x), 方程(13)用于计算x0.5.
| $ \frac{g\left( \alpha \right)}{g\left( 0.5 \right)}=\frac{p\left( x \right)}{p\left( 0.5 \right)}, $ | (11) |
| $ p\left( x \right)=\frac{\text{exp}\left(-x \right)}{x}\cdot \frac{{{x}^{3}}+18{{x}^{2}}+88x+96}{{{x}^{4}}+20{{x}^{3}}+120{{x}^{2}}+240x+120}, $ | (12) |
| $ {{x}_{0.5}}=E/(R{{T}_{0.5}}). $ | (13) |
实验中g(α)/g(0.5)~α(Δα=0.02)数据由方程(11)计算得到, 绘出曲线后与36个机理函数[20]理论曲线(g(α)/ g(0.5)~α曲线)相比较, 经分析与实验曲线匹配得最好的理论曲线所对应之方程即为所要求的机理方程, 图 7所示为比较的方法及结果.
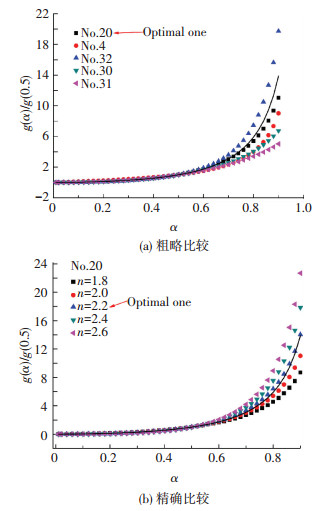
|
图 7 实验曲线和理论曲线比较(β=9 ℃/min) Figure 7 Comparison between experimental result for β=9 ℃/ min (solid line) and modeled results (symbols):(a) rough comparison; (b) precise comparison |
由图 7(a)可见, 在No.20、No.4、No.32、No.30、No.31的5条理论曲线中, No.20号曲线(机理方程为:g(α)=[-ln(1-α)] 2)与实验曲线吻合得最好, 但图 7(a)为粗略比较, 所以实验曲线与No.20号曲线吻合得不理想.因此, 需要进一步进行精确比较.为了便于精确比较, 将No.20号方程转换为:g(α)=[-ln(1-α)]n.通过微调n值, 进而让理论曲线与实验曲线吻合得更为理想.图 7(b)所示的是精确比较的结果.图 7(b)显示, 微调n值后, 该方程的理论曲线与实验曲线达到了比较理想的吻合.吻合得最理想的机理方程为g(α)=[-ln(1-α)]2.2(No.20), 对应于假设自由成核及其随后生长反应机理.
2.6.3 指前因子的计算指前因子A可用峰值温度法来计算,
| $ A=\frac{-\beta {{E}_{0}}}{RT_{\text{max}}^{2}f\prime ({{\alpha }_{\text{max}}})}\text{exp}{{(\frac{{{E}_{0}}}{R{{T}_{\text{max}}}})}^{~\left[21 \right]}}. $ | (14) |
式中:A为指前因子, S-1; R=8.314 J/(mol·K)(理想气体常数); β为升温速率, ℃/min; E0为平均表观活化能, kJ/mol; Tmax为DTG的峰值温度, K; 用方程(15)求得f′(α)max.
| $ \text{ }f\prime {{\left( \alpha \right)}_{\text{max}}}=-1/g{{\left( \alpha \right)}_{\text{max}}}. $ | (15) |
其中, g(α)为热分解过程的最概然机理函数, 下标max表示用给定升温速率的TG曲线获得的DTG曲线的峰值点所对应的参数.计算得到A=6.49×107 min-1.
前驱体热分解动力学研究结果表明, 在364 ℃左右前驱的分解已完成, 该热分解反应过程为单步反应机理的过程, 控制步骤属于假设自由成核及其随后生长反应机理.说明尽管前驱体的组分较多, 但热分解的产物比较均匀, 且已有晶核形成, 这将有助于在后续的焙烧中获得单一物相的固溶体产物, 图 1的XRD结果佐证了这一点.
3 结论用相应的活性前驱体在800 ℃下经高温固相法合成得到了三重共掺的LYPO:0.03Eu3+, 0.012Sm3+, xBi3+荧光粉(缩写为LYPO:BSE).
1) XRD晶相分析结果表明, LYPO:BSE晶体的结构与单斜晶系LaPO4的晶体结构相同, 没有其他的杂质晶相, 说明3种共掺的离子已进入基质的晶格中与基质形成了固溶体.
2) 由实验结果可知, 所得样品激发峰(392 nm)的强度得到显著的提升, 说明其在白光LED的领域中有用作为近紫外激发红色荧光粉的前景与潜质.
3) PLE & PL光谱表征结果说明, 所得样品的发射光谱属于以磁偶极跃迁为主导的光谱.
4) 获得了荧光增敏离子Bi3+离子的最佳掺杂浓度, 在最佳掺杂浓度下获得的样品与未掺杂Bi3+离子的样品相比较, 其发光强度增强了2.66倍.
5) 用非等温等转化率动力学的方法对最佳样品前驱体的热分解过程进行了相关的动力学研究, 获得了动力学三参数.
| [1] | WU L W, BAI Y X, WU L, et al. Sm3+ and Eu3+ codoped SrBi2B2O7:a red-emitting phosphor with improved thermal stability[J]. RSC Adv, 2017, 7(2): 1146–1153. DOI: 10.1039/C6RA26752A |
| [2] | LI G F, WEI Y G, LONG W X, et al. Photoluminescence properties, energy transfer and thermal stability of the novel red-emitting CaGd2(WO4)4:Eu3+, Sm3+ phosphors[J]. Materials Research Bulletin, 2017, 95(9): 86–94. DOI: 10.1016/j.materresbull.2017.05.057 |
| [3] | WANG Z, LOU S, LI P. Single phase tunable warm white-light-emitting Sr3 La(PO4)3:Eu2+, Sm3+ phosphor for white LEDs[J]. Optical Materials Express, 2016, 6(1): 114–124. DOI: 10.1364/OME.6.000114 |
| [4] | ZHU Z Z, FU G S, YANG Y, et al. Tunable luminescence and energy transfer properties in Na3Bi(PO4)2:Eu3+, Tb3+, Dy3+, Sm3+ phosphors with high thermal stability[J]. Luminescence, 2017, 184(4): 96–109. |
| [5] | LU X Q, BI W Y, CHAI W L, et al. Multinuclear NIR luminescent 1, 4-BDC bridged Schiff-base complexes of Nd(Ⅲ)[J]. Polyhedron, 2009, 28(1): 27–32. DOI: 10.1016/j.poly.2008.09.014 |
| [6] | HUSSAIN S K, YU J S. Sol-gel synthesis of Eu3+/Bi3+ ions co-doped BaLa2WO7 phosphors for red-LEDs under NUV excitation and FEDs applications[J]. J Lumin, 2017, 183(1): 39–47. DOI: 10.1016/j.jlumin.2016.11.003 |
| [7] | DIAZ-GUILLEN J A, FUENTES A F, GALLINI S, et al. A rapid method to obtain nanometric particles of rhabdophane LaPO4· nH2O by mechanical milling[J]. J Alloys Compd, 2007, 427(1): 87–93. DOI: 10.1016/j.jallcom.2006.03.011 |
| [8] |
史晓磊. 稀土掺杂磷酸铋发光材料的合成及发光性能研究[D]. 西安: 陕西科技大学, 2016. SHI Xiaolei. Synthesis and luminescence properties of rare earth doped BiPO4 luminescent materials[D]. Xi'an: Shanxi University of Science and Technology, 2016. |
| [9] | LI G H, LI L L, LI M M, et al. Facile synthesis and luminescent properties of LaPO4:Eu3+, Sm3+ nanorods via a designed two-step hydrothermal method[J]. Materials Chemistry&Physics, 2012, 133(1): 263–268. DOI: 10.1016/j.matchemphys.2012.01.020ExportCitation |
| [10] | LONG Q W, XIA Y, HUANG Y H, et al. Na+ induced electric-dipole dominated transition (5D0→7F2) of Eu3+ emission in AMgPO4:Eu3+ (A=Li+, Na+, K+) phosphors[J]. Mater Lett, 2015, 145: 359–362. DOI: 10.1016/j.matlet.2015.01.095 |
| [11] | LONG Q W, GAO Y, HUANG Y H, et al. Dual charge compensation effect by Na+ ions on the luminescence behavior of red phosphor NaMgPO4:Eu3+[J]. Mater Lett, 2015, 160: 436–439. DOI: 10.1016/j.matlet.2015.07.129 |
| [12] | JUDD B R. Optical absorption intensities of rare-earthions[J]. Physics Review, 1962, 127: 750–761. DOI: 10.1103/PhysRev.127.750 |
| [13] | OFELT G S. Intensities of crystal spectra of rare-earthions[J]. Chemical Physics, 1962, 37: 511–519. DOI: 10.1063/1.1701366 |
| [14] | VYAZOVKIN S, BURNHAM A K, CRIADO J M, et al. ICTAC kinetics committee recommendations for performing kinetic computations on thermal analysis data[J]. Thermochim Acta, 2011, 520: 1–19. DOI: 10.1016/j.tca.2014.05.036 |
| [15] | CHEN Z P, CHAI Q, LIAO S, et al. Preparation of LiZnPO4·H2O via a novel modified method and its non-isothermal kinetics and thermodynamics of thermal decomposition[J]. Journal of Thermal Analysis and Calorimetry, 2012, 108(3): 1235–1242. DOI: 10.1007/s10973-011-1799-8 |
| [16] | CHEN Z P, CHAI Q, LIAO S, et al. Application of isoconversional calculation procedure to non-isothermal kinetic study:Ⅲ.Thermal decomposition of ammonium cobalt phosphate hydrate[J]. Thermochimica Acta, 2012(543): 205–210. DOI: 10.1016/j.tca.2012.05.027 |
| [17] | HE Y, LIAO S, CHEN Z P, et al. Application of isoconversional calculation procedure to non-isothermal kinetics study Part Ⅱ.Thermal decomposition of NH4CuPO4·H2O[J]. J Therm Anal Calorim, 2013, 111(1): 313–321. DOI: 10.1007/s10973-012-2306-6 |
| [18] | HUANG Y H, XIA Y, LI Y, et al. Synthesis of a new phosphor (LaPO4:Ce, Li, Mn) and kinetics study for thermal process of its precursor[J]. Adv.Powder Technol, 2015, 26: 861–867. DOI: 10.1016/j.apt.2015.02.013 |
| [19] | XIA Y, HUANG Y H, LI Y, et al. LaPO4:Ce, Tb, Yb phosphor-Synthesis and kinetics study for thermal process of precursor by Vyazovkin, OFW, KAS, Starink and Mastplosts methods[J]. J Therm nal alorim, 2015, 120: 1635–1643. DOI: 10.1007/s10973-015-4548-6 |
| [20] | JIANG H, WANG J, WU S, et al. Pyrolysis kinetics of phenol-formaldehyde resin by non-isothermal thermogravimetry[J]. Carbon, 2010, 48(2): 352–358. DOI: 10.1016/j.carbon.2009.09.036 |
| [21] | HUANG Y H, XIA Y, CHEN Z P, et al. Kinetics study with rigorous nonlinear methods for thermal decomposition of polysaccharide iron complex[J]. Food Biophys, 2014, 9: 277–284. DOI: 10.1007/s11483-014-9351-6 |
 2018, Vol. 26
2018, Vol. 26


