镍作为常见的合金化组分被广泛应用.在电子制造领域的互连材料和镀层大量使用镍及其合金.纯镍具有十分优良的耐高温性能、耐腐蚀性能,良好的焊接和加工性能,镍还具有铁磁性,区别于常规的镍粉,纳米镍粉由于具有比表面积大,表面活性高,催化活性好,良好的导电导磁等物理化学性能而被广泛应用于高性能电池材料、高效催化剂、导电浆料、磁流体、医学、火箭固体燃料推进剂等领域[1-7].同化学气相沉积法[8]、羟基镍分解法[9]、等离子体离子沉积法[10]、电沉积法等[11]纳米镍粉的制备方法相比,液相还原法由于工艺简单、实验成本相对较低、产物粒径与形貌容易控制等优点成为常用的纳米镍粉的制备方法.但是在液相还原法制备纳米镍粉的研究工作中,研究者一般将溶剂种类、分散剂、还原剂,搅拌方式,反应体系温度和PH值等因素作为影响纳米镍粉形貌与粒径的研究重点[12-14],而对于还原剂与Ni2+的摩尔比、加料顺序对实验结果的影响研究很少,因此我们还研究了还原剂与Ni2+的摩尔比以及加料顺序两个变量对反应时间与反应速率的影响.这对于后续研究者开展纳米镍粉制备的工作具有一定的参考价值.
1 试验 1.1 试验试剂和仪器实验所用化学试剂有硫酸镍、无水乙醇、乙二醇、去离子水、氢氧化钠、水合肼以及聚乙烯吡咯烷酮(PVP).主要仪器有恒温水浴锅(DF-101S型,巩义市予华仪器有限责任公司),电动搅拌器(JJ-1型,常州国华电器有限公司)、电子分析天平(FA20048型,上海精密科学仪器有限公司)、真空干燥箱(DHG-9055A型,上海一恒科技有限公司)、高速离心机(TDL-S-A型,ANKE公司),真空泵(RS-2旋片型,上海树立仪器仪表有限公司).
制备的纳米镍粉使用FEI公司的通用型扫描电子显微镜Quanta200,以及荷兰帕纳科多功能粉末X射线衍射仪进行了表征.
1.2 纳米镍粉的制备在三口烧瓶中加入一定量的硫酸镍,并量取一定量的去离子水加入烧瓶用玻璃棒搅拌至分散均匀,再称取一定量的聚乙烯吡咯烷酮(PVP)加入烧瓶中,将烧瓶连接电动搅拌器置于75 ℃的水浴锅中并对烧瓶中的溶液进行搅拌.将预先准备好的水合肼溶液缓慢滴加至三口烧瓶中,之后加入氢氧化钠溶液对PH值进行调节,待溶液颜色变为黑色时再继续反应,以保证反应进行完全,此时的溶液即是含纳米镍粉的溶液.最后将三口烧瓶中的溶液倒入离心管中,在离心机转速为8 000 r/min,离心时间5 min的条件下分别用去离子水、无水乙醇各自离心洗涤3次.在洗涤干净的纳米镍粉中倒入一定量的无水乙醇,然后将其置于真空度为10 Pa,温度为60 ℃的真空干燥箱中充分干燥处理,最终得到纳米级镍粉.
2 结果与讨论本文采用液相还原的实验方法制备纳米镍粉,通过还原剂将可溶性镍盐溶液中的Ni2+还原为镍的晶核,生成镍粉的过程可以看成由3个部分组成:(1)预成核阶段(反应诱导期);(2)成核阶段:Ni2+被还原形成镍晶核;(3)晶核生长阶段:Ni2+被镍晶核表面吸附,进一步被还原,使镍晶核长大.制备的镍粉粒径和形貌与反应过程中的形核和长大密切相关.理论上为了获得粒径小且均匀分布的纳米镍粉需要对形核和长大两个过程加以控制,而影响形核与长大的因素很多,本文着重从NaOH加入量、反应溶剂种类、分散剂、还原剂与Ni2+的摩尔比、加料顺序这五个方面进行了研究.
2.1 氢氧化钠加入量对反应产物的影响氢氧化钠的加入量对反应体系有着很大的影响,它在反应体系中主要有两个方面的作用.由反应方程式:
NiSO4+2NaOH=Ni(OH)2↓+Na2SO4,
N2H4·H2O+2Ni(OH)2=2Ni+N2↑+5H2O.
可知,NaOH一方面作为反应物参加反应体系,另一方面提供水合肼还原Ni2+所需要的碱性环境,因为在酸性介质中N2H4·H2O的还原电位为+0.23 V,在碱性介质中的还原电位为-1.6 V,而Ni2++2e Ni的标准电极电位为-0.23 V,因此水合肼只有在碱性条件下才能将Ni2+还原为镍粉.由此知道氢氧化钠加入量是影响反应体系的一个非常重要的因素,如果加入量过少,会导致碱性环境达不到水合肼还原的条件,从而产生还原不彻底的问题;如果加入量过多,则会导致反应体系生成多余的氢氧化镍沉淀.无论是哪一种,都会对反应产物镍粉的纯度造成不利影响.
通过控制其它量(初始镍盐为0.01 mol,浓度为0.25 mol/L,还原剂与Ni2+摩尔比为20,分散剂含量为主盐质量的10%,水浴温度为75 ℃)不变的情况下,单一改变NaOH(浓度为1 mol/L)的加入量.取3组变量分别为0.015、0.02和0.025 mol,即NaOH与Ni2+的摩尔比分别为0.75: 1、1: 1和1.25: 1,进行对比实验.然后利用X射线衍射仪对产物进行了物相分析以及半定量分析,图 1为NaOH量含量为0.015、0.02和0.025 mol时产物的衍射峰与标准PDF卡片比对图.
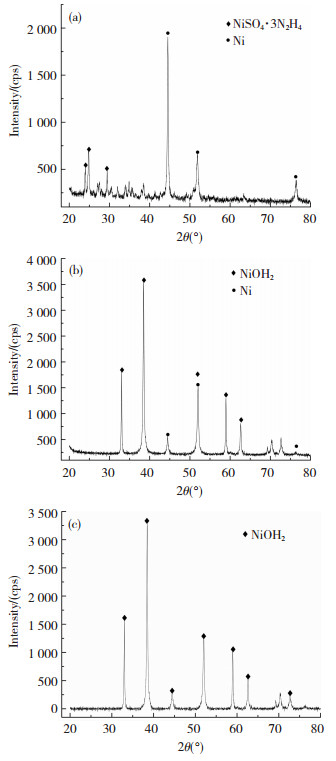
|
图 1 当NaOH含量为(a) 0.015 mol; (b) 0.02 mol; (c) 0.025 mol时产物的XRD谱图 Figure 1 XRD spectra of as-prepared products when the NaOH content was (a) 0.015 mol; (b) 0.02 mol; (c) 0.025 mol |
如图 1(a)所示,当NaOH加入量为0.015 mol时,产物中含有两种物质,NiSO4 · 3N2H4和Ni.其中NiSO4 · 3N2H4是水合肼加入硫酸镍溶液中生成的中间产物,其在溶液中的颜色为粉色,按照化学反应机理可知随后其将与NaOH继续发生反应.由于NaOH加入量不足,导致产物中存在部分NiSO4 · 3N2H4.
如图 1(b)所示,当NaOH加入量为0.02 mol时,产物中也含有两种物质,Ni(OH)2和Ni.并且Ni(OH)2的相对含量为90%,而Ni的相对含量为10%,由此可知NaOH已经过量,推测如果进一步添加NaOH,那么将会全部生成Ni(OH)2沉淀.
如图 1(c)所示,当NaOH加入量为0.025 mol时,可知其产物中只存在一种物质Ni(OH)2,从而证明了上述猜测的正确性.从实验结果可知NaOH加入量过多时会产生浅绿色Ni(OH)2,加入量过少时会产生紫色絮状物NiSO4·3N2H4.
从以上实验结果分析可知,要想获得纯净的镍粉,必须严格控制NaOH的含量,而在本实验条件下当1 mol/L NaOH的加入量在0.015~0.02 mol时才能获得相对纯净的镍粉.
2.2 溶剂种类对反应产物的影响通过控制其他量(还原剂N2H4与Ni2+摩尔比为4: 1,溶液PH值为11,分散剂含量为主盐质量分数的10%,水浴温度为75 ℃)不变的条件下,分别用去离子水、乙醇和乙二醇作为反应溶剂研究了其对纳米镍粉粒径的影响.表 1分别为水、乙醇和乙二醇作为反应溶剂时计算生成镍粉的粒径所需的数据,其中衍射峰角度θ和半高宽B由XRD数据所得.
| 表 1 计算不同反应溶剂下镍粉粒径所需数据 Table 1 Data required for calculating particle size of nickel powders under different reaction solvents |
谢乐公式又名Scherrer公式,是常用的XRD分析晶粒尺寸公式,通过该公式来计算制备的纳米镍粉的尺寸.
| $ D = \frac{{K\lambda }}{{B\cos \theta }}. $ |
上式中K为谢乐常数,它的数值为0.89;D为晶粒垂直于晶面方向的平均厚度;B是积分的半高宽;λ是X射线的波长,其数值等于0.154 056 nm,θ为半衍射角.
由表 1通过计算可知,水作溶剂时反应得到的镍粉在(111)、(200)和(222)3个晶面上的平均粒径分别为28.34、28.49和30.42 nm.乙醇作溶剂时镍粉3个晶面上的平均粒径分别为30.57、20.23和53.50 nm.乙二醇作反应溶剂时得到的镍粉3个晶面上的平均粒径分别为29.14、18.43和53.04 nm.
由上述计算所得的平均粒径大小可知,不同的反应溶剂会对产物镍粉的平均粒径产生影响.其中水作为溶剂时,粒径变化较稳定.乙二醇作为溶剂时,可以得到较小的粒径,从溶剂本身的性质来说,乙二醇具有两个—OH集团,可与镍相互作用,使镍粉表面形成一层薄的保护膜,所以推测乙二醇作为溶剂时可以防止纳米镍粉的长大和团聚,其分散性应该是优于水作为溶剂时的分散性.乙醇和乙二醇作为反应溶剂时得到的镍粉粒径大小相差不大.
2.3 聚乙烯吡咯烷酮(PVP)对反应产物的影响聚乙烯吡咯烷酮(PVP)是常用的分散剂和保护剂.实验过程中通过控制其它量(还原剂与Ni2+摩尔比为4: 1,溶液PH值为11,水浴温度为75 ℃)不变,在反应时不添加PVP,对反应产物镍粉进行了XRD衍射分析,通过分析结果计算了镍粉的平均粒径,并与添加PVP时的情况做了对比,如表 2所示.
| 表 2 水作溶剂不加分散剂时计算粒径所需数据 Table 2 Data required for calculating particle size of nickel powders with water as solvent and without dispersant |
根据谢乐公式,由表 2可知,镍粉3个晶面上的平均粒径分别为71.15、63.17和64.22 nm.对比表 2和表 1,用水作溶剂不加分散剂PVP时,其3个衍射晶面上的平均粒径都大于添加PVP时的平均粒径.
由此可知反应时加入分散剂PVP,可以减少纳米镍粒子团聚,得到较小粒径的产物.这是因为在反应过程中溶液中的PVP吸附在已经还原出来的Ni晶核特定的晶棱晶角上,降低其晶面结合能,减少了晶棱晶角对镍原子的吸附作用,使其生长速度减慢.并且在溶液中形成镍粒子后,PVP的疏水端长链烷基端通过物理作用吸附到镍颗粒的表面,亲水端则扩展到溶液中,从而阻碍了颗粒之间的吸附和团聚,最终得到分散性较好的纳米镍粉.所以理论上推测不加或加入PVP过少,反应将进行得很快,但所得的颗粒团聚会很严重,并且晶粒较粗;而如果PVP加入过多,因为PVP在溶剂中的溶解度是一定的,将会导致部分PVP不溶于溶剂而阻碍反应的进行,使反应不完全.
2.4 还原剂N2H4与主盐Ni2+摩尔比对反应速率的影响还原剂水合肼在碱性条件下,会发生以下反应:
| $ {{\rm{N}}_2}{{\rm{H}}_4} \cdot {{\rm{H}}_2}{\rm{O + 2Ni}}{\left( {{\rm{OH}}} \right)_2} \to 2{\rm{Ni + }}{{\rm{N}}_2} \uparrow + 5{{\rm{H}}_2}{\rm{O}}{\rm{.}} $ | (1) |
当水合肼过量时:
| $ {\rm{N}}{{\rm{i}}^{2 + }} + 3{{\rm{N}}_2}{{\rm{H}}_4} \cdot {{\rm{H}}_2}{\rm{O}} + 3{\rm{O}}{{\rm{H}}^ - } \to {\left[ {{\rm{Ni}}{{\left( {{\rm{N}}{{\rm{H}}_3}} \right)}_6}} \right]^{2 - }} + 6{{\rm{H}}_2}{\rm{O}} $ | (2) |
| $ \begin{array}{l} {{\rm{N}}_2}{{\rm{H}}_4} \cdot {{\rm{H}}_2}{\rm{O}} + 2{\left[ {{\rm{Ni}}{{\left( {{\rm{N}}{{\rm{H}}_3}} \right)}_6}} \right]^{2 - }} + 4{\rm{O}}{{\rm{H}}^ - } \to {{\rm{N}}_2} \uparrow + 2{\rm{Ni}} + 5{{\rm{H}}_2}{\rm{O}}\\ + 12{\rm{N}}{{\rm{H}}_3}. \end{array} $ | (3) |
副反应:
| $ 3{{\rm{N}}_2}{{\rm{H}}_4} \to {{\rm{N}}_2} \uparrow + 4{\rm{N}}{{\rm{H}}_3} \uparrow . $ | (4) |
由式(1)和式(3)可知,这两种反应都会生成Ni粉,还原Ni粉的还原剂与镍主盐的摩尔比为1: 2.但是在实际反应过程中由于副反应的存在所消耗的还原剂会增多.通过控制其它量(Ni2+浓度为0.25 mol/L,溶液PH值为11,水浴温度为75 ℃)不变,在N2H4: Ni2+摩尔比为2: 1、4: 1、8: 1、12: 1、14: 1、18: 1、20: 1的条件下记录了反应所消耗的时间,结果如图 2所示.

|
图 2 不同N2H4:Ni2+摩尔比条件下完成反应所需时间 Figure 2 Reaction time under different N2H4:Ni2+ molar ratios |
由图 2可知,随着还原剂的含量增多,反应完成的时间呈现出先减小后增大的趋势.当还原剂量过少时,反应虽然能进行,但是其消耗的时间很长,随着还原剂含量的增加,反应完成所需的时间缩短,但是随着还原剂的继续加入,反应时间不但没有进一步减少,反而有所增加.推测是还原产物与Ni2+生成了某种配位物附着在镍晶核上面而抑制了晶核的长大,从而使反应完成的时间延长.由实验结果可知,N2H4与Ni2+的摩尔比为4: 1时反应时间最短,图 3为制备的纳米镍粉的透射照片,统计结果显示其平均粒径小于100 nm.

|
图 3 纳米镍粉的TEM图 Figure 3 TEM image of nano-nickel powders |
加料顺序同样也会对实验结果造成一定的影响,为了探讨不同加料顺序对反应速率产生的影响,在还原剂与Ni2+摩尔比为4: 1,溶液PH值为11,水浴温度为75 ℃的情况下,设计了3组不同的加料顺序:(a)硫酸镍溶液中加入氢氧化钠混合,再向混合溶液中加入水合肼;(b)氢氧化钠与水合肼混合,再向混合溶液中加入硫酸镍溶液;(c)硫酸镍溶液与水合肼混合,再向混合溶液中加入氢氧化钠溶液;按照(a)方式加料时,当氢氧化钠溶液与硫酸镍溶液混合时会产生浅蓝色沉淀氢氧化镍,加入水合肼之后,反应所需的诱导时间(溶液颜色有变化时)较(b)长15 min左右,同时其反应所需的时间也是最长的.
按照(b)方式加料时,氢氧化钠与水合肼的混合溶液是澄清的,再向混合溶液中加入硫酸镍溶液时,溶液中会短暂出现紫蓝色的絮状物,继而变黑,由于整个反应体系中只有镍粉的颜色为黑色,从而可以知道变黑的原因是镍粉被还原出来,这种加入方式反应速率很快,制备完成的溶液较为澄清和透明,其还原的机理是镍的络合物和镍离子同时被还原,因此它的还原率也较高,反应时间为45 min左右.
按照(c)方式加料时,会先形成水合肼与镍的紫色络合物,随后加入氢氧化钠溶液后,发生还原反应,生成镍粉,以该方式加料时反应时间介于上述两种方式之间,反应时间为50 min左右.图 4是加料顺序与反应时间之间的关系.
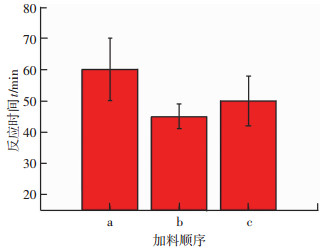
|
图 4 加料顺序与反应时间的关系 Figure 4 Relationship between the feed sequences and reaction time |
通过对加料顺序的研究可知,以氢氧化钠与水合肼混合,再向混合溶液中加入硫酸镍溶液的方式可以得到较快的反应速率.
3 结论本文在水浴加热条件下进行还原反应制备纳米级镍粉.对影响纳米镍粉形貌与粒径的因素进行了分析,结果表明:
1) NaOH的加入量会对产物的纯度造成影响.在本文较优工艺下,1 mol/L的NaOH加入量在0.015~0.02 mol时会获得相对纯净的产物.
2) 溶剂种类和分散剂会影响产物的粒径以及分散情况.水作为溶剂时,反应所得的粒径尺寸较为均匀,乙醇和乙二醇作为溶剂时产物粒径大小很接近,与水相比它们能在一定程度上阻碍镍粉的团聚.反应体系中加入PVP时会降低产物镍粉的团聚现象,获得分散和细小的颗粒.
3) 还原剂与主盐的摩尔比以及加料顺序对反应速率有影响.随着还原剂与主盐摩尔比的增加,反应时间呈现出先减小后增大的趋势,摩尔比为4: 1时,体系有最快的反应时间.同时,氢氧化钠与水合肼混合后,再向混合溶液中加入硫酸镍溶液的加料顺序可以得到较快的反应速率.
| [1] | EL-NAGAR G A, DERR I, FETYAN A, et al. One-pot synthesis of a high performance chitosan-nickel oxyhydroxide nanocomposite for glucose fuel cell and electro-sensing applications[J]. Applied Catalysis B:Environmental, 2017, 204: 185–199. DOI: 10.1016/j.apcatb.2016.11.031 |
| [2] | WANG J, LIU Z, ZHOU Z. Regulation of the catalytic behavior of pullulanases chelated onto nickel (Ⅱ)-modified magnetic nanoparticles[J]. Enzyme and Microbial Technology, 2017, 101: 9–16. DOI: 10.1016/j.enzmictec.2017.02.009 |
| [3] | JIANG Z, XIE J, JIANG D, et al. Modifiers-assisted formation of nickel nanoparticles and their catalytic application to p-nitrophenol reduction[J]. Cryst Eng Comm, 2013, 15(3): 560–569. DOI: 10.1039/C2CE26398J |
| [4] | MARGHESCU C I, DRUMEA A, MIHAILESCU B T.Investigation on current capabilities of Ni-based conductive pastes for PCB repair[C]//Electronics Technology (ISSE), 2015 38th International Spring Seminar on.IEEE, 2015: 324-328.DOI: 10.1109/ISSE.2015.7248015 https://ieeexplore.ieee.org/document/7248015 |
| [5] | USHAKOV M V, OSHTRAKH M I, FELNER I, et al. Magnetic properties of iron oxide-based nanoparticles:Study using M ssbauer spectroscopy with a high velocity resolution and magnetization measurements[J]. Journal of Magnetism and Magnetic Materials, 2017, 431: 46–48. DOI: 10.1016/j.jmmm.2016.09.054 |
| [6] |
王胜难, 崔跃, 袁志山, 等. 医用金属材料离子释放机制、致病机理及防护[J]. 稀有金属材料与工程, 2015, 44(2): 509–513.
WANG Shengnan, CUI Yue, YUAN Zhishan, et al. Metal ions release mechanism from metallic biomaterials and their pathogenic mechanism and protection[J]. Rare Metal Materials and Engineering, 2015, 44(2): 509–513. |
| [7] | REESE D, GROVEN L, SON S, et al.Intermetallic compounds as fuels for composite rocket propellants[C]//47th AIAA/ASME/SAE/ASEE Joint Propulsion Conference&Exhibit.2011: 5865.DOI: 10.2514/6.2011-5865 |
| [8] |
张淑英.化学气相沉积法制备超细镍粉的研究[D].长沙: 中南大学, 2009. ZHANG Shuying.Research on the preparation of ultrafine nickel powder by chemical vapor deposition[D].Changsha: Central South University, 2009.DOI: 10.7666/d.y1536105 http://cdmd.cnki.com.cn/Article/CDMD-10533-2009238548.htm |
| [9] |
屈子梅. 羰基法生产纳米镍粉[J]. 粉末冶金工业, 2003, 13(5): 16–19.
QU Zimei. Production of nanometer nickel powder by carbony lation[J]. Powder Metallurgy Industry, 2003, 13(5): 16–19. DOI: 10.3969/j.issn.1006-6543.2003.05.004 |
| [10] |
蒋渝, 衡俊华, 刘明, 等. 等离子体法制备纳米Ni粉中热泳问题及其影响[J]. 稀有金属材料与工程, 2005, 34(12): 1901–1904.
JIANG Yu, HENG Junhua, LIU Ming, et al. Thermo-natatorial phenomena and influence in preparing nano Ni powder by plasma arc spraying method[J]. Rare Metal Materials and Engineering, 2005, 34(12): 1901–1904. DOI: 10.3321/j.issn:1002-185X.2005.12.014 |
| [11] |
张凯锋, 丁水, 王国峰. 电沉积制备纳米镍的拉伸变形行为[J]. 材料科学与工艺, 2007, 15(1): 35–39.
ZHANG Kaifeng, DING Shui, WANG Guofeng. Tensile behavior of electrodeposited nanocrystalline Ni[J]. Materials Science and Technology, 2007, 15(1): 35–39. DOI: 10.3969/j.issn.1005-0299.2007.01.009 |
| [12] |
李鹏, 官建国, 张清杰, 等. 1, 2丙二醇液相还原法制备纳米镍粉的研究[J]. 材料科学与工艺, 2001, 9(3): 259–262.
LI Peng, GUAN Jianguo, ZHANG Qingjie, et al. Preparation of nanosized nickel powders by reduction in 1, 2-propanediol[J]. Materials Science and Technology, 2001, 9(3): 259–262. DOI: 10.3969/j.issn.1005-0299.2001.03.011 |
| [13] | LI Lei, DU Jinghong, GAN Guoyou, et al. Study on preparation technology of nickel powder with liquid phase reduction method[J]. Rare Metal Materials and Engineering, 2015, 44(1): 36–40. DOI: 10.1016/S1875-5372(15)30008-4 |
| [14] |
李忠平, 俞宏英, 孙冬柏, 等. 制备条件对纳米镍粉电化学性能的影响[J]. 中国有色金属学报, 2006, 16(7): 1288–1294.
LI Zhongping, YU Hongying, SUN Dongbai, et al. Effect of preparation condition on electrochemical property of nano-nickel powders[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(7): 1288–1294. DOI: 10.3321/j.issn:1004-0609.2006.07.025 |
| [15] |
刘银. 一种微反应制备纳米镍粉的研究[J]. 化学工程与装备, 2015(5): 3–6.
LIU Yin. Study on preparation of nanometer nickel powder by micro reaction[J]. Chemical Engineering & Equipment, 2015(5): 3–6. |
| [16] |
王晓春, 张希艳. 材料现代分析与测试技术[M]. 北京: 国防工业出版社, 2009: 82.
WANG Xiaochun, ZHANG Xiyan. Modern material analysis and testing techniques[M]. Beijing: National Defense of Industry Press, 2009: 82. |
| [17] |
覃涛, 叶红齐, 吴超, 等. PVP对液相还原法制备微米级银粉颗粒性能的影响[J]. 中南大学学报(自然科学版), 2013, 44(7): 2675–2680.
QIN Tao, YE Hongqi, WU Chao, et al. Effects of PVP on properties of micro-sized silver powders prepared by liquid phase reduction method[J]. Journal of Central South University (Science and Technology), 2013, 44(7): 2675–2680. |
 2018, Vol. 26
2018, Vol. 26


