铝热剂通常是指铝粉和难溶金属氧化物的混合物,是一种常见的含能材料,能通过发生氧化还原反应释放大量的热[1-2],因此,含能材料的热安定性直接决定其应用前景.热分析是表征含能材料热安定性的重要指标之一,是指在程序控温和一定氛围下测量样品物质的某种物理性质与温度或时间关系的一类技术[3].差示扫描量热法(Differential Scanning Calorimeter, DSC)是近年来热分析技术中应用最广泛的[4], 将该方法与热重分析(Thermogravimetric Analysis, TG)联用是最普遍的热分析联用技术.目前的热力学分析技术主要指等温或者非等温条件下对物质的反应动力学进行研究.活化能是热分析动力学研究中的核心项,可以反映化学反应的难易程度,可对其热安定性进行评估[3-4].
近年来,很多学者开始研究纳米尺度下的铝热剂,也称为超级铝热剂(Superthermite).在纳米铝热剂的制备和性能测试中,最受关注的主要是Fe2O3和CuO金属氧化物[5-9],Hu等[5]利用TG-DSC技术研究了不同形貌和制备工艺下Al/Fe2O3铝热剂的热性能差异,并进一步利用DSC技术研究了它们与炸药之间的相容性;Kim等[6]研究了纳米Al粉包裹CuO纳米线的热性能,对其高热释放的原因进行了分析.Sarangi等[10]计算了在非等温条件下微米级Al/MnO2、Al/Fe2O3和Al/Cr2O3铝热剂的活化能,利用外推法推算了这3种铝热剂的等温活化能.对于Al/MnO2铝热剂,Fisher研究发现,其理论放热量要高于Fe2O3和CuO铝热剂约20%[11].然而,安全性和稳定性通常是制约含能材料应用的主要因素之一,现有文献对金属氧化物MnO2的关注较少,缺乏对该类铝热剂的热行为和热安定性方面的研究.
本文利用超声分散法制备Al/MnO2超级铝热剂,对Al/MnO2超级铝热剂进行X射线衍射分析表征其物相和结构,采用热重-差示扫描同步热分析技术对其进行多重升温速率的热扫描,分别采用微分Kissinger法[12]和积分Ozawa法[13]计算确定超级铝热剂Al/MnO2在氮气气氛下发生铝热反应的动力学参数,对2种计算结果进行分析,进而对其热安定性进行评估.
1 实验 1.1 材料与仪器高锰酸钾(KMnO4),质量分数≥99.5%,级别AR,上海凌峰化学试剂有限公司;盐酸(HCl),质量分数36.0%~38.0%,级别AR,上海凌峰化学试剂有限公司;无水乙醇(C2H6O),质量分数≥99.7%,级别AR,国药集团化学试剂有限公司;纳米铝粉,质量分数99.5%,粒径20~200 nm,Aladdin Industrial Corporation.所有试剂未做进一步处理,直接使用,实验用水为去离子水.
1.2 样品合成与制备称取适量KMnO4溶于去离子水中,用移液枪抽取少量浓盐酸(KMnO4过量).将浓盐酸在常温下加入去离子水稀释10倍后,在磁力搅拌器作用下,将稀释后的盐酸逐滴加入KMnO4的水溶液中;将混合好的反应溶液转移至100 mL的水热反应釜中,在140 ℃条件下反应12 h.反应结束后,待反应釜自然冷却后取出,将溶液倒入废液桶,深棕色沉淀倒入离心管,分别用去离子水和无水乙醇离心清洗数次后,将深棕色产物放置在真空恒温烘箱中60 ℃干燥,得到深棕色MnO2粉末.
根据Yang等对纳米Al粉氧化层厚度的研究[14],同时利用透射电子显微镜(TEM)对纳米Al粉氧化层厚度进行表征,如图 1所示,Al粉表面约有5 nm厚的氧化层,经计算,对于单个100 nm的Al粉球,纯Al质量分数约64.5%.

|
图 1 Al粉的TEM照片 Fig.1 TEM image of Al powder |
根据化学反应方程式,理论上应称取化学计量比为3:7的纳米Al粉和MnO2,考虑到Al粉表面的氧化层,称取纳米Al粉和MnO2的质量比为4.7:7.利用超声清洗机将两者分别分散于乙酸乙酯中,超声分散时间30 min;后将两者混合继续超声分散30 min,倒入蒸发皿中放置在真空恒温烘箱中60 ℃干燥,得到深灰色Al/MnO2铝热剂粉末,如图 2所示.

|
图 2 超级铝热剂样品的合成与制备 Fig.2 Synthesis and preparation of superthermite samples |
物相鉴定分析:德国Bruker公司D8 Advance型X射线衍射仪,将样品置于Cu靶上,扫描范围10°~80°.Al粉氧化层厚度表征:日本电子株式会社JEM-2100F型场发射透射电子显微镜.粒径和形貌分析:日本Hitachi公司S-4800型场发射扫描电子显微镜.样品的热性能分析:德国NETZSCH公司TG-DSC型同步热分析仪,仪器型号STA 449F3.
将超级铝热剂Al/MnO2置于刚玉坩埚中,采用动态氮气气氛,流速为30 mL/min,扫描温度区间为室温~1 000 ℃,升温速率分别为8、10和14 ℃/min,不同升温速率测试的样品质量分别为10.277、9.614和10.951 mg.
2 结果与讨论 2.1 物相与相貌分析将样品进行XRD衍射分析,得到XRD衍射谱图,利用MDI Jade 6.0软件,将测得样品的XRD衍射谱图与标准PDF物相卡片进行对比(JCPDS No.44-0141和JCPDS No.04-0787)见图 3.经比对,样品的衍射谱图的峰位和峰强与标准物相卡片的峰位和峰强均能够一致匹配,且衍射峰比较尖锐,表明样品的结晶度较好,没有明显的杂峰,表明样品的纯度较高,且2种纳米材料在常温下可共存,不发生反应.其中,制备的MnO2对应的空间群为I4/m(87),晶格常数分别为a=0.978 5 nm,c=0.286 3 nm,c/a=0.293,晶型为α型;Al粉对应的空间群为Fm-3m(225),晶格常数分别为a=0.404 9 nm,c=0.404 9 nm,c/a=1.000.采用Scherrer公式计算晶粒大小[15],得出MnO2的粒径约为50 nm,Al粉粒径约为100 nm.

|
图 3 超级铝热剂Al/MnO2的XRD衍射谱图 Fig.3 XRD diffraction pattern of superthermite Al/MnO2 |
图 4是超级铝热剂Al/MnO2的扫描电镜照片,其中球状结构是纳米Al粉,具有一定的团聚现象,制备的MnO2呈短棒状结构,超级铝热剂Al/MnO2混合较均匀,Al粉由于纳米颗粒粒径过小,具有极高的表面能和接触界面,界面间原子相互耦合,团聚现象以现有的技术和工艺难以完全避免[16].

|
图 4 超级铝热剂Al/MnO2在较小放大倍数(a)和较大放大倍数(b)下的SEM照片 Fig.4 SEM images of superthermite Al/MnO2: (a) smaller magnification; (b) larger magnification |
为探究超级铝热剂Al/MnO2的热安定性,对样品进行3组不同升温速率条件下的TG-DSC同步热分析测试,如图 5所示.由图 5可知,3组实验测得的TG-DSC曲线形状相似,实验重复性较好,红色曲线表示TG曲线,黑色曲线表示DSC曲线,DSC曲线的峰向上表示放热,其中各组放热峰A的DSC曲线的详细测量数据列于表 1,表 1详细列出了铝热反应放热峰A的相关参数.
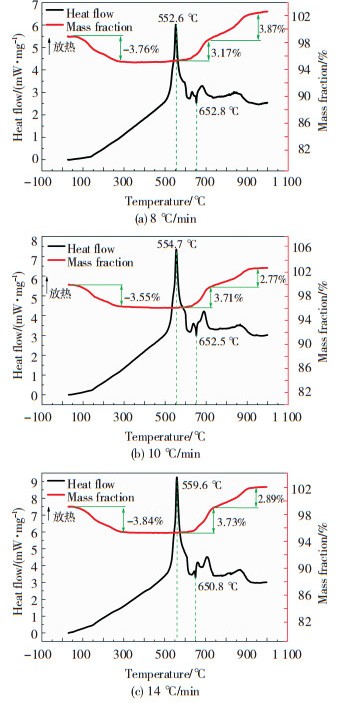
|
图 5 不同升温速率测得的TG-DSC曲线 Fig.5 TG-DSC curves at different heating rates |
| 表 1 不同升温速率的放热峰A详细参数 Table 1 Detailed parameters of exothermic peak A at different heating rates |
观察图 5中的3组红色TG曲线可以发现,在初始阶段从室温升到300 ℃时,均发现约3.7%的热重质量下降信号,而伴随的DSC曲线处于正常状态,没有出现明显的吸热峰或放热峰,经分析,主要是两方面原因导致热重质量下降:1)纳米MnO2的合成制备借助于水溶液,采用水热法合成,而真空烘箱60 ℃干燥只能将制备的MnO2粉末中的游离水分有效去除,但与MnO2形成的结合水无法得到有效去除;而在进行TG-DSC测试时,测试温度从室温升到300 ℃的过程中,由于升至较高温度,结合水逐渐被去除,进而导致热重出现明显下降,出现了明显的TG曲线下降的信号.2)将纳米Al粉与制备的MnO2混合制备超级铝热剂时,由于选用乙酸乙酯作为分散剂,所以剩余的少部分乙酸乙酯可能吸附在样品表面,在进行TG-DSC测试时,随着温度的升高会逐渐挥发出去,因此,也会出现相应的热重下降信号[17-18].
3组DSC曲线中,在540~570 ℃看到1个明显的放热峰,放热量大,且TG曲线没有明显的升降变化,该放热峰的形成是由于此处Al和MnO2之间发生了铝热反应,铝热反应是将MnO2上的氧转移到Al上生成Al2O3,由于只是MnO2和Al之间的反应,根据质量守恒定律,故没有表现出明显的质量信号变化.
从表 1的数据可以看出,Al和MnO2发生的铝热反应起始温度在540 ℃附近,终止温度在560 ℃附近,峰值温度在555 ℃附近,铝热反应的放热量约为930 J/g.随着测试温度的继续升高,DSC曲线出现了1个吸热峰,吸热峰的起始温度在650 ℃附近,终止温度在655 ℃附近,峰值温度在650 ℃附近,TG曲线没有明显的变化,该处是样品中过量未完全反应的Al粉熔化吸热,属于物理过程,吸热量也较小.当温度进一步升高后,3组DSC曲线随后均出现1个或2个小的放热峰,同时伴随有明显的热重增加,TG曲线出现明显的增长,过量未完全反应的Al粉熔化后与吹扫气氮气之间发生化学反应,Al粉被氮化,放出热量并导致质量增加.图 6是3组不同升温速率下TG-DSC测试后收集的产物照片,观察发现,3组反应后产物的颜色、形貌均基本一致,这与样品的粒径匹配和混合均匀程度有关.

|
图 6 TG-DSC测试后收集的产物照片 Fig.6 Products of TG-DSC test after reaction |
铝热剂作为一种含能材料,具有一定的潜在危害,通常需要利用热分析动力学对其热安定性进行评价,以确定在使用和存储过程中的安全性[19].为了理解纳米Al粉和纳米MnO2之间的铝热反应,从而间接地对其稳定性进行评估,选用了2种经典计算方法——Kissinger法和Ozawa法来研究反应活化能.Kissinger法是基于不同的升温速率下,放热峰峰顶处的转化率(α)反应速率最大的假设,即$\frac{{\rm{d}}}{{{\rm{d}}t}}\left({\frac{{{\rm{d}}\alpha }}{{{\rm{d}}t}}} \right) = 0$,求得放热峰峰顶处转化率所对应的活化能的方法,假定反应机理函数为
| $ f(\alpha ) = {(1 - \alpha )^n}. $ | (1) |
结合Arrhenius公式k=Aexp(-E/RT),反应速率dα/dt可以表示为
| $ \frac{{{\rm{d}}\alpha }}{{{\rm{d}}T}} = \frac{A}{\beta }\exp \left( { - \frac{E}{{RT}}} \right){(1 - \alpha )^n}. $ | (2) |
同时, Kissinger认为上式与反应级数n无关,故可得Kissinger法动力学方程
| $ {\mathop{\rm In}\nolimits} \left( {\frac{\beta }{{T_{\rm{p}}^2}}} \right) = {\mathop{\rm In}\nolimits} \left( {\frac{{RA}}{E}} \right) - \frac{E}{R}\frac{1}{{{T_{\rm{p}}}}}. $ | (3) |
式中:β表示升温速率,K/min;Tp表示放热峰峰值温度,K;R表示理想气体常数,J/(mol·K);E表示活化能,J/mol;A表示指前因子,s-1.利用不同升温速率下的DSC曲线峰值温度(Tp),可以利用线性拟合得到拟合直线的斜率,进而求解活化能(E).
Ozawa法是对不定温的非均相反应动力学方程进行分离变量积分后,通过对温度积分求近似解,结合Doyle近似式[12]获得求解方程,得到Ozawa法动力学方程:
| $ \lg (\beta ) = \lg \left( {\frac{{AE}}{{RG(\alpha )}}} \right) - 2.315 - 0.4567\frac{E}{{RT}}. $ | (4) |
式中:β表示升温速率,K/min;T表示温度,K;R表示理想气体常数,J/(mol·K);E表示活化能,J/mol;A表示指前因子,s-1,G(α)表示转化率函数积分.由于不同β下利用DSC曲线放热峰峰值温度对应的转化率近似相等,故可以设G(α)为一个常数,则式(5)可认为是一个线性方程,同样利用线性拟合,利用拟合直线的斜率来求解活化能(E).
根据表 1中放热峰的峰值温度数据,利用Matlab线性回归编程对Kissinger法和Ozawa法分别进行直线拟合,对应的线性方程分别为Y=-51 616x+51.77和Y=-23 138x+28.93,拟合出的直线如图 7所示,其中,Kissinger法拟合出来的相关系数为R2=-0.993 8,Ozawa法拟合出来的相关系数为R2=-0.994 2,拟合相关系数较好.
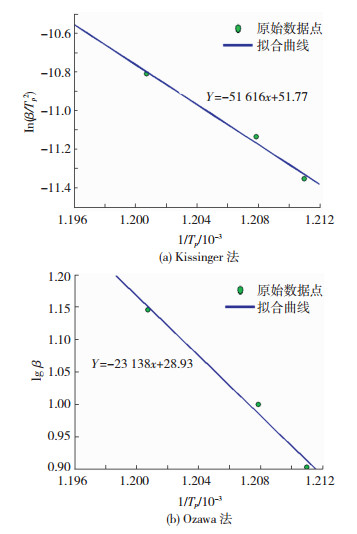
|
图 7 2种动力学方法拟合的直线 Fig.7 Fitting straight lines of two kinetics methods: (a) Kissinger method; (b) Ozawa method |
经计算,采用Kissinger法得到的活化能为E=429.1 kJ/mol,指前因子为In A=62.6 s-1,而采用Ozawa法得到的活化能为E=421.9 kJ/mol.
Kissinger法是假设反应机理函数为(1-α),利用Kissinger法能够快速求取反应活化能(E)和指前因子(A),而Ozawa法则避开了反应机理函数的选择问题,直接求解活化能(E),从实验计算结果来看,两种方法计算出的活化能非常接近,计算结果可信度较高,与活化能真实值差异不大,且活化能数值较大,说明反应的能量壁垒较大,铝热剂的热安定性较好,纳米Al粉表面有一层致密的氧化膜.由于纳米Al粉的粒径非常小,氧化层在Al粉中的占比增大,对Al粉整体性能的影响不可忽视,直接表现在活化能的增高上.此外,由于所使用的Al粉粒径较小,一方面氧化层厚度影响较为显著,对于单个Al球来说,纯Al含量较低; 另一方面,粒径小易团聚,而严重的团聚直接影响点火和自蔓延过程[7],在一定程度上使得铝热反应发生的难度增大,从而影响Al/MnO2复合物的活化能.
3 结论1) XRD结果显示, 制备的MnO2的空间群为I4/m(87),晶型为α型,衍射峰存在宽化现象,根据Scherrer公式计算MnO2的粒径大约为100 nm,与扫描电镜照片观察的结果基本一致,Al/MnO2铝热剂混合较为均匀,Al粉存在一定的团聚现象.
2) 分析3组不同升温速率的TG-DSC测试实验数据的谱图以及收集的产物照片,可以发现,实验具有良好的重复性,经研究分析,可以判定Al和MnO2发生的铝热反应起始温度在540 ℃附近,终止温度在560 ℃附近,峰值温度在555 ℃附近,反应起始温度较高,铝热反应的放热量约为930 J/g.
3) 采用Kissinger法动力学方程计算出来的超级铝热剂Al/MnO2的活化能为E=429.1 kJ/mol,指前因子为In A=62.6 s-1;采用Ozawa法动力学方程计算出来的超级铝热剂Al/MnO2的活化能为E=421.9 kJ/mol.其中,Kissinger法属于热分析曲线动力学分析中的微分法,而Ozawa法属于热分析曲线动力学分析中的积分法,这2种方法计算得到的活化能相近,可信度较高,且活化能较大,样品的稳定性较好.
| [1] |
GUERRERO S E, DREIZIN E L, SHAFIROVICH E. Combustion of thermite mixtures based on mechanically alloyed aluminum-iodine material[J]. Combustion and Flame, 2016, 164: 164-166. |
| [2] |
王晓倩.自组装制备两种铝热剂及其性能研究[D].南京: 南京理工大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10288-1013166117.htm
|
| [3] |
FAIT M, MOUKHINA E, FEIST M, et al. Thermal decomposition of ammonium paratungstate tetrahydrate: new insights by a combined thermal and kinetic analysis[J]. Thermochimica Acta, 2016, 637: 38-50. DOI:10.1016/j.tca.2016.05.009 |
| [4] |
WOLL K, GIBBINS J D, SLUSARSKI K, et al. The utilization of metal/metal oxide core-shell powders to enhance the reactivity of diluted thermite mixtures[J]. Combustion and Flame, 2016, 167: 259-267. DOI:10.1016/j.combustflame.2016.02.006 |
| [5] |
HU X L, LIAO X, XIAO L Q, et al. High-energy pollen-like porous Fe2O3/Al thermie: synthesis and properties[J]. Propellants, Explos, Pyrotech, 2015, 40: 867-872. DOI:10.1002/prep.201500046 |
| [6] |
KIM D K, BAE J H, KANG M K, et al. Analysis on thermite reactions of CuO nanowires and nanopowders coated with Al[J]. Current Applied Physics, 2011, 11: 1067-1070. DOI:10.1016/j.cap.2011.01.043 |
| [7] |
HOSSEINI S G, SHEIKHPOUR A, KESHAVARZ M H. The effect of metal oxide particle size on the thermal behavior and ignition kinetic of Mg-CuO thermite mixture[J]. Thermochimica Acta, 2016, 626: 1-8. DOI:10.1016/j.tca.2016.01.005 |
| [8] |
SHEN L H, LI G P, LUO Y J, et al. Preparation and characterization of Al/B/Fe2O3 nanothermites[J]. Science China Chemistry, 2014, 57(6): 797-802. DOI:10.1007/s11426-013-5050-2 |
| [9] |
王毅.纳米及纳米复合材料在铝热剂中的应用研究[D].南京: 南京理工大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10288-2009197913.htm
|
| [10] |
SARANGI B, RAY H S, DASH R R. Estination of isothermal values of activation energy for aluminothermic reduction[J]. Metallurgical and Materials Transactions B, 1998, 29(10): 1135-1136. |
| [11] |
FISHER S H, GRUBELICH M C. A survey of combustible metals, thermites, and intermetallics for pyrotechnic applications[C]//32nd AIAA/ASME/SAE/ASEE Joint Propulsion Conference and Exhibit. Lake Buena Vista, FL, US: American Institute of Aeronautics and Astronautics, 1996.
|
| [12] |
KISSINGER H E. Reaction kinetics in differential thermal analysis[J]. Analytical Chemistry, 1957, 29(11): 1702-1706. DOI:10.1021/ac60131a045 |
| [13] |
OZAWA T. A new method of analyzing thermogravimetric data[J]. Bulletin of The Chemical Society of Japan, 1965, 38(11): 1881-1886. DOI:10.1246/bcsj.38.1881 |
| [14] |
YANG V, SUNDARAM D. Multi-scale modeling of nano Aluminum particle ignition review[J]. Pennsylvania: Pennsylvania State University, 2010, 17(4): 215-226. |
| [15] |
赵越.不同形貌的二氧化锰纳米材料的制备及研究[D].长春: 吉林大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10183-1016079233.htm
|
| [16] |
SINGHAL A, SKANDAN G, WANG A, et al. On nanoparticle aggregation during vapor phase synthesis[J]. Nanostructure Material, 1999, 11: 545-552. DOI:10.1016/S0965-9773(99)00343-8 |
| [17] |
WILLIAMS R A, SCHOENITZ M, ERMOLINE A, et al. Low-temperature exothermic reactions in fully-dense Al/MoO3 nanocomposite powders[J]. Thermochimica Acta, 2014, 594: 1-10. DOI:10.1016/j.tca.2014.08.026 |
| [18] |
BURNHAM A K. Computational aspects of kinetic analysis. Part D: The ICTAC kinetics project-multi-thermal-history model-fitting methods and their relation to isoconversional methods[J]. Thermochimica Acta, 2000, 355: 165-170. DOI:10.1016/S0040-6031(00)00446-9 |
| [19] |
ESLAMI A, HOSSEINI S G. Improving safety performance of lactose-fueled binary pyrotechnic systems of smoke dyes[J]. Journal of Thermal Analysis and Calorimetry, 2011, 104(2): 671-678. DOI:10.1007/s10973-010-1062-8 |
 2019, Vol. 27
2019, Vol. 27


