2. 湖南省锰锌产品质量监督检验中心,湖南 吉首 416000;
3. 矿物清洁生产与绿色功能材料开发湖南省重点实验室,湖南 吉首 416000
2. Manganese and Zinc Product Quality Supervision and Inspection Center of Hunan Province, Jishou 416000, China;
3. Key Laboratory of Mineral Cleaner Production and Green Functional Materials in Hunan Province, Jishou 416000, China
二氧化钒(以下简称VO2)具有6种不同晶相,分别为A相VO2、B相VO2、C相VO2、M相VO2、T相VO2和R相VO2[1].其中,M相VO2在68 ℃左右具有相变特性,即由单斜结构半导体M相向四方金红石结构金属相R相可逆转变,伴随着相变的发生,其透射率、反射率、光学折射率、磁化率和电阻率也发生突变,使得VO2这种材料被广泛应用于智能窗、抗激光辐射、光电开关和抗静电涂层等领域[2-4].由于M相VO2的微/纳米形貌在红外光下观察其相变过程最直观,所以, 制备微米级M相VO2粉体成为材料科学研究的热点之一.
目前,VO2粉体的制备方法主要有水热法、热分解法、溶胶凝胶法、激光诱导气相沉积法、化学沉积法等[5-11].微波是新材料制备方法中最具特色的方法之一,微波辅热是一种全新的热能技术,除了存在热效应外, 还存在其直接作用于反应分子而引起的特殊的非热效应, 即改变反应历程, 降低反应活化能, 加快反应的速度, 影响反应的选择性, 改善产品的机械性能,甚至还能影响晶粒的发育过程, 控制材料的显微结构[12-13].微波辅热克服了普通的水热法反应温度高、粉料粒度粗且易结块的缺陷,具有快速、高效、受热均匀等特点.
本文以五氧化二钒为原料,甲醇作还原剂,采用微波辅热-甲醇还原法制备二氧化钒粉体, 系统地探讨微波辅热功率、反应填充度、反应温度、反应时间、甲醇用量对制备VO2粉末的影响,选择最佳的制备条件,产物经纯化和热处理后可得到高纯度、具有相变功能的M相VO2粉体.
1 实验 1.1 实验仪器和试剂ETHOS A微波仪(附SK-10HT-FC加热罐), 意大利Milenstone公司;LSK-15-13快速升温式卧式炉,洛阳市九都分析仪器厂;DZF-6021型真空干燥箱,上海中友仪器设备有限公司;D/Max 2550 X-射线衍射仪,日本Rigaku公司;DSC3-差示扫描量热仪,瑞士Mettler-delido公司;Sigma-HD型热场发射扫描电子显微镜,德国蔡司公司.
V2O5,AR,上海山浦化工有限公司;甲醇,AR,国药集团化学试剂有限公司;氮气,高纯,湘西华鑫气体有限公司.
1.2 实验方法 1.2.1 VO2的制备及纯化称取一定量的V2O5,准确移取甲醇于微波辅热罐(SK-10HT-FC)中,加入蒸馏水调节填充度,让粉末充分湿润分散,装好耐压外套,启动微波辅热程序升温反应,反应结束后,冷却,过滤,得到滤饼.反应化学方程式如下:
| $ {\rm{C}}{{\rm{H}}_3}{\rm{OH}} + {{\rm{V}}_2}{{\rm{O}}_5} \to 2{\rm{V}}{{\rm{O}}_2} + {\rm{HCHO}} + {{\rm{H}}_2}{\rm{O}}. $ |
滤饼加入到50 g/L的氢氧化钠溶液中纯化,搅拌0.5 h,静置1 h,过滤,二次滤饼用蒸馏水和乙醇洗涤数次,放入真空干燥箱中80 ℃真空干燥烘干5 h,备用.
1.2.2 热处理将1.2.1小节得到的产物均匀平铺在瓷舟中,推入通氮气的密闭升温式卧式炉中,隔绝空气热处理.热处理条件为:升温速率5 ℃/min, 保持N2流量1 L/min, 温度800 ℃, 时间2 h后随炉体冷却至室温,取出,备用.
1.2.3 测定采用容量法[14]测定钒氧化物VO2、V2O5、V2O3的质量分数;采用D/Max 2550-X射线衍射分析仪对VO2粉体进行物相组成分析,测试条件为:Cu靶,靶电压40 kV,靶电流250 mA,Kα射线,扫描范围12°~70°,步长0.2°,步进扫描,计数时间0.15 s,扫描速度4 (°)/min;采用差示扫描热量仪,在高纯氮气保护下,扫描温度范围为10~180 ℃,升温速率设置为10 K/min,对VO2粉末的相变特性进行分析;采用Sigma-HD型热场发射扫描电子显微镜表征VO2粉末的微观形貌特征.
2 结果与讨论 2.1 微波辅热制备VO2的影响因素 2.1.1 微波辅热功率对各钒氧化物质量分数的影响称取V2O51.0000 g,移取甲醇1.00 mL于微波辅热罐中,用蒸馏水调节填充度为0.7,反应温度180 ℃时保持反应90 min.图 1为微波辅热功率对各钒氧化物质量分数的影响曲线.

|
图 1 微波辅热功率对各钒氧化物质量分数的影响 Fig.1 Effect of microwave heating power on the content of vanadium oxides |
从图 1可以看出,微波功率有利于产物的制备.这是因为在微波辐射下,由于微波具有强偶合热效应,V2O5成为过热分子点,在较低的床层温度下便可启动与甲醇的反应,并伴随放电现象;同时, 随着微波功率的增加,引起V2O5间的电荷传递增强,改变了V2O5的还原氧化势能,从而使V2O5更容易成为较低价态氧化物[15].在微波功率400~1 400 kW时,V2O5与甲醇反应生成的VO2质量分数有上升趋势,但由于部分VO2又会生成较低价态氧化物V2O3,化学反应方程式:2VO2+CH3OH→V2O3+HCHO+H2O,这样VO2的质量分数先增加后略又降低,在微波功率1 000 kW时达到最高点.因此,微波功率选择1 000 kW.
2.1.2 填充度对各钒氧化物质量分数的影响称取V2O51.0000 g,移取甲醇1.00 mL于微波辅热罐中,用蒸馏水调节不同的填充度,微波辅热功率为1 000 kW,反应温度180 ℃时,保持反应90 min.图 2为反应填充度对各钒氧化物含量的影响曲线.由图 2可以看出,反应填充度由0.2逐渐增加到0.7时,VO2和V2O3的质量分数呈上升趋势,直到反应填充度为0.7时,VO2质量分数突然开始下降,此时反应罐内压强已超过了安全压强7 MPa,压强过大造成了溶液泄漏,致使制备VO2质量分数下降.这是因为,在一定温度下罐内压强的高低取决于填充度的大小,随着反应填充度的增高,微波辅热罐中的空间减少,压强升高,水分子的密度增大,水对溶质的溶解能力增大,进而有利于VO2和V2O3的生成,但填充度的增加,也会间接影响反应溶液的过饱和度,进而加快了晶体生长速度,并影响晶体形貌[16].综合考虑,实验的最佳反应填充度选择0.7.
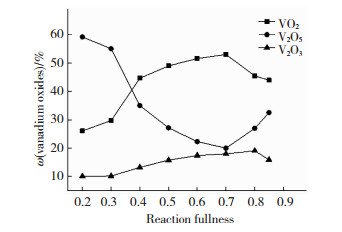
|
图 2 反应填充度对各钒氧化物质量分数的影响 Fig.2 Effect of fullness on the content of vanadium oxides |
称取V2O51.0000 g,移取甲醇1.00 mL于反应釜中,用蒸馏水调节反应填充度为0.7,微波辅热功率为1 000 kW,改变反应温度,保持反应时间90 min.图 3为反应温度对各钒氧化物质量分数的影响曲线.由图 3可以看出,反应温度从180 ℃升高到280 ℃,制备VO2的质量分数总体呈上升趋势.这是因为升高温度有利于降低反应体系中的黏度,有利于五价钒离子在反应过程中的传质和扩散,使得分子碰撞机率增加,分子处于亚稳态,反应物离子的活性增强;同时, 温度升高,溶液剧烈沸腾,固液相界面反应加剧,化学反应速率加快[17].但在250 ℃以后继续升高温度,合成VO2的质量分数略有下降,而V2O3的质量分数却不断增加,这可能多余的甲醇能继续还原VO2为V2O3的缘故.综合考虑,实验的最佳反应温度为250 ℃,化学方程式为:
| $ {\rm{C}}{{\rm{H}}_3}{\rm{OH}} + 2{\rm{V}}{{\rm{O}}_2} \to {{\rm{V}}_2}{{\rm{O}}_3} + {\rm{HCHO}} + {{\rm{H}}_2}{\rm{O}}. $ |

|
图 3 反应温度对各钒氧化物质量分数的影响 Fig.3 Effect of reaction temperature on the content of vanadium oxides |
称取V2O51.0000 g,移取甲醇1.00 mL于反应釜中,用蒸馏水调节反应填充度为0.7,微波辅热功率为1 000 kW,反应温度250 ℃时,保持不同的反应时间.图 4为反应时间对各钒氧化物质量分数的影响曲线.由图 4可以看出,微波辅热能大大加快了反应过程进行的速度,缩短反应达到平衡的时间[17],反应从最初的30~60 min是制备VO2质量分数高峰期,反应时间60 min以后生成VO2质量分数变化不大,但生成V2O3的质量分数略有上升趋势.综合从节约成本考虑,反应时间选择60 min为宜.
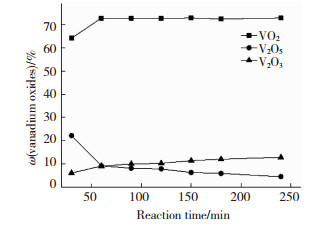
|
图 4 反应时间对各钒氧化物质量分数的影响 Fig.4 Effect of reaction time on the content of vanadium oxides |
称取V2O51.0000 g,移取不同的甲醇体积于反应釜中,用蒸馏水调节反应填充度为0.7,微波辅热功率为1 000 kW,反应温度250 ℃时,保持反应时间为60 min.
由V2O5与甲醇发生化学反应,其反应方程式为:V2O5 +CH3OH → 2VO2 + HCHO +H2O.理论上1 gV2O5的物质的量与0.2 mL甲醇的物质的量接近于1,即V2O5与质量甲醇体积比为5g :1 mL时,恰好反应完全.
图 5为甲醇用量对各价态钒氧化物质量分数的影响曲线.由图 5可以看出,V2O5质量与甲醇体积比为5g :1 mL时,VO2质量分数却在70%左右,推断该方应是一个可逆反应.根据可逆反应可知,增加反应物的浓度,化学平衡向正方向移动,当甲醇用量从0.2 mL增加到1.4 mL时,不断增加反应物甲醇的浓度,V2O5质量分数不断减少,生成VO2质量分数应该是呈上升趋势的;但是当甲醇用量大于在0.6 mL时,VO2质量分数不增加反而呈下降趋势.这是因为反应物V2O5已接近反应完全,但过剩的甲醇又与生成物中的部分VO2被进一步还原生成V2O3.综合考虑,选择甲醇用量为0.6 mL,即V2O5质量与甲醇体积比为5g :3 mL.

|
图 5 甲醇用量对各价态钒氧化物质量分数的影响 Fig.5 Effect of methanol dosage on the content of vanadium oxides |
在微波辅热功率为1 000 kW,填充度为0.7,反应温度为250 ℃时,反应时间为60 min,V2O5质量与甲醇体积比为5g :3 mL的最佳条件下,按照1.2.1小节得到的VO2,再按照1.2.2小节经热处理,得到最终产品并计算产率,结果见表 1.由表 1可知,VO2、V2O5和V2O3的质量分数分别是99.20%、0.25%和0.55%,产率为92.30%.说明微波辅热甲醇还原制备的二氧化钒粉体具有纯度高,含杂质少,制备过程产品转化率高.
| 表 1 VO2粉末中各氧化物的质量分数和产率 Table 1 Content of vanadium oxides and yield in VO2 powder |
对热处理前后的2种VO2粉体分别进行XRD分析,结果见图 6,可知:未经热处理的粉体分别在2θ为14.34°、15.24°、25.22°、29.06°、33.74°、45.02°、49.28°附近出现较强的衍射峰,分别对应于单斜晶系VO2(001)、(200)、(110)、(002)、(311+310)、(601)和(020)晶面的衍射,衍射数据与JCPDS标准卡片PDF No.81-2392相符,说明在微波辅热甲醇还原五氧化二钒得到的产物只是单斜晶系的B相VO2;而热处理后的粉体在2θ为27.06°、27.80°、36.98°、42.08°、55.52°、57.52°、65.10°、69.18°附近出现较强的衍射峰,分别对应于单斜晶系VO2(-111)、(011)、(-202)、(210)、(220)、(022)、(031)、(-231)晶面的衍射,与单斜金红石(P21/c14)的标准谱图PDF 43-1051一致,晶格常数为a=0.575 3 nm,b=0.452 6 nm,c=0.538 3 nm,β=122.58°.这表明B相VO2经800 ℃热处理[18]2 h后,已完全转变成M相的VO2,且峰形清晰、锐利,没有其他杂峰[19].这与化学分析主含量高和杂质含量少是一致的.
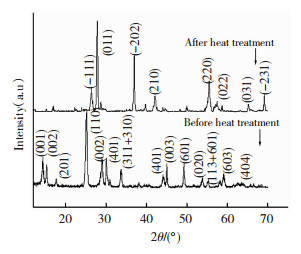
|
图 6 热处理前后VO2的XRD谱图比较 Fig.6 XRD image of VO2 before and after heat treatment |
将热处理前后的粉体按照1.2.3小节所述的条件进行DSC测试,所得结果见图 7.由图 7可知:热处理前的DSC曲线上未出现明显的吸收峰,而热处理后的VO2在68.6 ℃附近出现了吸收峰,结合图 6中XRD谱图,更进一步说明了热处理前的粉体为无相变的B相VO2;而经过800 ℃高温热处理后,B相的VO2已经成功转化为具有相变功能的M相,且该粉体材料的相变点温度为68.6 ℃,与有关文献报道的68 ℃左右相变一致[20].
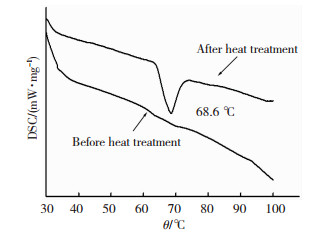
|
图 7 热处理前后VO2的DSC曲线比较 Fig.7 DSC curves of VO2 before and after heat treatment |
为比较微波辅热与水热两种法制备二氧化钒粉体在晶体形貌特征上的差异,对产品进行了扫描电镜分析,结果见图 8.由图 8可观察到:微波辅热法制备的VO2粉体晶体形貌主要呈现较匀称棒状结构,长度为1~2 μm;与水热法[21]制备的VO2粉体相比,具有结晶性良好、尺寸分布匀称的优点.
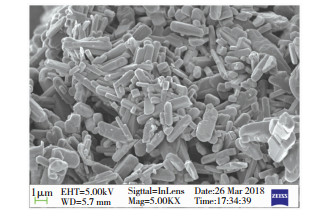
|
图 8 微波辅热法制备VO2粉体SEM照片 Fig.8 SEM image of preparation of VO2 powder by microwave assisted heating |
1) 微波辅热甲醇还原法制备VO2粉体,具有物料加热均匀, 不会出现过热现象,产物主含量高达99.20%,V2O5和V2O3的质量分数均在1%以内,产率为92.30%.与水热法[21]相比,制备时间缩短10 h以上,产率提高近7%.
2) 纯化后的VO2经800 ℃热处理2 h后,粉体形貌主要呈现较匀称棒状结构,长度1~2 μm.与水热法[21]制备的VO2粉体相比,结晶性良好,尺寸分布匀称,且亚稳态B相VO2已转变成具有相变功能的M相VO2,具有68.6 ℃较低的相变点温度.
| [1] |
齐济, 宁桂玲, 刘俊龙, 等. 二氧化钒粉体研究的新进展[J]. 化工进展, 2010, 29(8): 1513-1516. QI Ji, NING Guiling, LIU Junlong, et al. Recent research progress in vanadium dioxide powder[J]. Chemical Industry and Engineering Progress, 2010, 29(8): 1513-1516. DOI:10.16085/j.issn.1000-6613.2010.08.006 |
| [2] |
LI Z Y, CAO D M, ZHOU K C. Review on synthetic technology of vanadium dioxide powder[J]. Rare Metal Materials and Engineering, 2006, 35(2): 316-320. |
| [3] |
GUINNETON F, SAUQUES L, VALMALETTE J C, et al. Optimized infrared switching properties in thermoc-hromic vanadium dioxide thin films: role of deposition process and microstructure[J]. Thin Solid Films, 2004, 446(2): 287-295. DOI:10.1016/j.tsf.2003.09.062 |
| [4] |
GUINNETON R, SAUQUES L, VALMALETTE J C, et al. Role of surface defects and microstructure in infrared optical properties of thermochromic VO2 materials[J]. Journal of Physics and Chemistry of Solids, 2005, 66(1): 63-73. |
| [5] |
REDDY C V S, WALKER E H, WICKER S A, et al. Synthesis of VO2(B) nanorods for Li lattery application[J]. Curr Appl Phys, 2009, 9(6): 1195-1198. DOI:10.1016/j.cap.2009.01.012 |
| [6] |
李寅瑞, 王鲜, 刘卫沪, 等. 水热法一步合成VO2粉末及其微观形貌调控[J]. 材料导报, 2017, 31(专辑29): 263-268. LI Yinrui, WANG Xian, LIU Weihu, et al. One-step hydrothermal synthesis of VO2 powders with micro-morphology control[J]. Materials Review, 2017, 31(Special 29): 263-268. |
| [7] |
DAVID W, BLODGETT, MICHAEL J. Improved vanadium dioxide based infrared spatial light modulator[J]. SPIE, 1994, 2223(5): 63-74. |
| [8] |
杨绍利, 徐楚韶, 陈厚生, 等. 由工业V2O5制取VO2薄膜[J]. 钢铁钒钛, 2002, 23(2): 7-10. YANG Shaoli, XU Chushao, CHEN Housheng, et al. Preparation of VO2 thin films from industrial V2O5[J]. Iron Steel Vanadium Titanium, 2002, 23(2): 7-10. DOI:10.3969/j.issn.1004-7638.2002.02.002 |
| [9] |
SCHLAG H J, SCHERBER W. New sputter process for VO2 thin films and examination with MIS-elements and C-V-measurements[J]. Thin Solid films, 2000, 366(1/2): 28-31. |
| [10] |
PARTLOW D P, GURKOVICH S R, RADFORD K C, et al. Switchable vanadium oxide films by a sol-gel process[J]. Applied Physics, 1991, 70(1): 443-452. DOI:10.1063/1.350272 |
| [11] |
徐灿阳, 庞明杰, 原晨光, 等. 还原五氧化二钒制备二氧化钒粉末[J]. 材料科学与工程学报, 2006, 24(2): 252-254. XU Canyang, PANG Mingjie, YUAN Chenguang, et al. Preparation of VO2 powder by deoxidizing V2O5[J]. Journal of Materials Science & Engineering, 2006, 24(2): 252-254. DOI:10.3969/j.issn.1673-2812.2006.02.022 |
| [12] |
童孟良, 刘绚艳, 何灏彦. 磷酸铁锂的微波合成及改性研究[J]. 电源技术, 2011, 35(9): 1047-1049. TONG Mengliang, LIU Xuanyan, HE Haoyan. Microwave synthesis and modification of lithium iron phosphate[J]. Chinese Journal of Power Sources, 2011, 35(9): 1047-1049. DOI:10.3969/j.issn.1002-087X.2011.09.004 |
| [13] |
万子岸, 高飞, 王辉, 等. 微波加热技术在材料制备中的研究进展[J]. 现代化工, 1995, 29(12): 50-53. WAN Zian, GAO Fei, WANG Hui, et al. Research progress of microwave heating technology in material preparation[J]. Modern Chemical Industry, 1995, 29(4): 231-233. |
| [14] |
徐本平, 易桂华, 钟华, 等. 容量法测定氧化钒中的各种价态钒[J]. 分析化学, 2002(11): 1322-1324. XU Benping, YI Guihua, ZHONG Hua, et al. Volumetric determination of the valence states of vanadium in vanadium oxide[J]. Chinese Journal of Analytical Chemistry, 2002(11): 1322-1324. DOI:10.3321/j.issn:0253-3820.2002.11.011 |
| [15] |
张秀凤, 涂华民. 无机发光材料的微波合成[J]. 河北师范大学学报(自然科学版), 2002(6): 609-613. ZHANG Xiufeng, TU Humin. Microwave synthesis of luminescent materials[J]. Journal of Hebei Normal university(Natural Science Edition), 2002(6): 609-613. DOI:10.3969/j.issn.1000-5854.2002.06.019 |
| [16] |
王艳.强碱液在水热反应中压强与填充度关系的热力学分析[D].南京: 南京工业大学, 2006. WANG Yan. Thermodynamics analysis of the relation-ship between pressure and filling afctor of alkali hydroxide in hydrothermal vessel[D]. Nanjing: University of Technology Nanjing, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10291-2007036020.htm |
| [17] |
易静, 颜文斌, 张晓君, 等. 水热法制备纳米二氧化钒粉末[J]. 精细化工, 2016, 33(4): 361-365. YI Jing, YAN Wenbin, ZHANG Xiaojun, et al. Hydrothermal synthesis of nano vanadium oxide powder[J]. Fine Chemicals, 2016, 33(4): 361-365. |
| [18] |
邓丽.纳米二氧化钒的制备及其形貌对性能的影响[D].南京: 南京理工大学, 2009. DENG Li. The effect of the preparation and morphology of nano-oxide on properties[D]. Nanjing: University of Technology Nanjing, 2009. http://cdmd.cnki.com.cn/article/cdmd-10288-2009196961.htm |
| [19] |
王成迁.二氧化钒纳米线的制备与M相研究[D].哈尔滨: 哈尔滨工业大学, 2013. WANG Chengqian. Preparation of vanadium dioxide nanowire was studied with M phase.[D]. Harbin: Harbin Institute of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10213-1013038323.htm |
| [20] |
山世浩, 王庆国, 曲兆明, 等. 二氧化钒薄膜材料相变临界场强调控方法研究[J]. 材料导报, 2018, 32(6): 870-873. SHAN Shihao, WANG Qingguo, QU Zhaoming, et al. Study on the control method of phase transition critical field strength for two vanadium oxide thin films[J]. Materials Review, 2018, 32(6): 870-873. |
| [21] |
ALIE D, GEDVILAS L, WANG Z W, et al. Dirent synthdsis of thermochromic VO2 through hydrothermal rea[J]. J solid State Chem, 2014, 212(2): 237-241. |
 2019, Vol. 27
2019, Vol. 27


