2. 金属先进凝固成形及装备技术国家地方联合工程实验室,昆明 650093;
3. 云南省钛材应用产品工程技术研究中心,云南 楚雄 651209
2. National-local Joint Engineering Laboratory of Metal Advanced Solidification Forming and Equipment Technology, Kunming 650093, China;
3. Engineering Technology Research Center of Titanium Products and Application of Yunnan Province, Chuxiong 651209, China
近等原子比NiTi合金不仅具有较高的强度、较低的弹性模量、良好的抗腐蚀性和生物相容性,而且具有优异的形状记忆性能和超弹性,在牙科、骨科、介入治疗、心内科、耳鼻喉科以及妇科等医学领域得到广泛应用[1-2].但NiTi合金的弹性模量(约55 GPa)与人骨弹性模量(3 ~ 20 GPa)相比仍相差较大,植入人体后容易在骨组织-植入物界面处产生应力-屏蔽效应,导致材料松动或断裂[3];同时NiTi合金属于生物惰性材料,难以与人体组织之间形成骨性结合,会降低植入体的使用寿命.相关研究表明[4-7],镍钛合金多孔化处理可使其弹性模量显著降低,多孔结构可以促进骨组织向内生长和血管化,生物活性明显提高,容易形成稳定的生物固定[8-11];但多孔化也会导致合金强度显著下降,限制了其应用范围.针对以上问题,本文设计了表面多孔Ti-Ag/NiTi梯度合金,中间为块体合金,表面为多孔合金.通过中间基体NiTi合金保持材料优异的力学性能、耐蚀性能和生物相容性,同时表面多孔Ti-Ag合金可以为材料提供良好的生物活性和抗菌性能,从而改善和提高NiTi合金在临床应用中存在的问题.
张磊等[12]制备了TiAg/Ti径向梯度多孔材料,研究表明,材料界面结合良好,力学性能优异且孔结构有利于成骨细胞生长.放电等离子烧结(Spark Plasma Sintering,SPS)技术具有烧结温度低、升降温速度快(100 ℃/min以上)、烧结时间短、可以产生温度梯度等独特优势[13],不仅可实现梯度合金一次成形,而且可以获得良好界面结合.因此,在前期工作基础上,本文采用SPS技术制备了表面多孔Ti-Ag/NiTi梯度合金,研究了不同Ag含量对梯度合金微观组织、界面结合、表面孔隙特征、力学性能、体外生物活性及抗菌性能的影响及机理.
1 实验实验原料为Ni粉(纯度99.7%,平均粒径30 μm)、Ti粉(纯度99.5%,平均粒径25 μm)和Ag粉(纯度99.99%,平均粒径45 μm)及NH4HCO3造孔剂(纯度AR,粒径<300 μm).NiTi/ Ti-Ag梯度合金制备过程:首先按照55.07: 44.93的质量比称取Ni粉与Ti粉,然后将粉末放入球磨罐中,按球料比3: 1加入不锈钢球,在行星式球磨机上以300 r/min球磨10 h;球磨后粉末经40 ℃烘干获得NiTi混合粉末;在Ti粉中加入质量分数分别为1%、3 %、5 %的Ag粉末,按上述方法球磨烘干得到Ti-Ag混合粉末,再加入质量分数15%的NH4HCO3造孔剂并混合均匀;然后,先将Ti-Ag-NH4HCO3混合粉末填入模具套筒的外层,再将NiTi混合粉末填入模具套筒内层,套筒内层尺寸为5 mm×140 mm、外层尺寸为15 mm×140 mm,在压力试验机上整体压制成型(图 1);最后,将压制成型的坯体装入石墨模具中,在放电等离子烧结设备(SPS-515S,Japan)上进行烧结成形.烧结工艺为:按100 ℃/min的速度升温至所需温度,保温5 min后随炉冷却,系统真空度为2~10 Pa,为了保证表面孔隙率,采用无压烧结,根据前期研究结果[12]选择烧结温度为950 ℃.
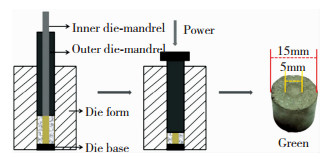
|
图 1 表面多孔Ti-Ag/NiTi梯度合金坯体的制备流程图 Fig.1 Schematic diagram of green bodies fabrication process of surface porous Ti-Ag/NiTi gradient alloy |
采用德国Bruker D8 Advance型X射线衍射仪对烧结成形后的梯度合金试样进行微观结构分析;表面孔隙特征(孔隙率、孔径尺寸)利用日本Nikon ECLIPSE MA200金相显微镜及MCV金相分析软件进行观察检测,每个试样对5张不同视场下照片进行图像计算并取平均值;元素分布检测利用荷兰Philips XL30型扫描电镜(SEM)结合EDS能谱进行;采用阿基米德排水法对基体合金密度进行测试;力学性能测试在日本岛津AG-X万能材料试验机上进行,根据GB/T 7314-2005,将梯度合金整体线切割成Φ15 mm×30 mm的试样,测量其抗压强度,加载速率为1 mm/min;在37 ℃的模拟人体体液(Hanks'溶液)中进行体外生物活性实验,溶液各成分配比为:去离子水1 L、NaCl 8.00 g、CaCl2 0.14 g、KCl 0.40 g、NaHCO3 0.35 g、MgCl2 · H2O 0.1 g、Na2HPO4 · 12H2O 0.12 g、KH2PO4 0.06 g、MgSO4 · 7H2O 0.1 g、葡萄糖1.00 g,实验周期14 d;根据ISO22196-2011,用金黄色葡萄球菌(ATCC6538p)为菌种,采用贴膜法测试样品的抗菌性能,抗菌率计算公式为
| $ R\left( \% \right) = \left( {B - C} \right)/B \times 100. $ | (1) |
式中:R为抗细菌率,%;B为空白对照样品平均回收菌数,cfu/片;C为抗菌塑料样品平均回收菌数,cfu/片.
2 结果与讨论 2.1 表面多孔Ti-Ag/NiTi梯度合金的微观组织和孔隙特征利用XRD分析了表面多孔Ti-Ag/NiTi梯度合金的微观结构.图 2为梯度合金内层及外层的X射线衍射谱图.从图 2(a)可以看出,中间基体组织主要由奥氏体NiTi相(B2)和单斜马氏体NiTi相(B19′)组成,同时还存在少量的次生相Ti2Ni相,无其他杂相;从图 2(b)可观察到表面多孔层的主相为α-Ti,加入的Ag与Ti在烧结过程中发生反应,形成了少量TiAg和Ti2Ag相.
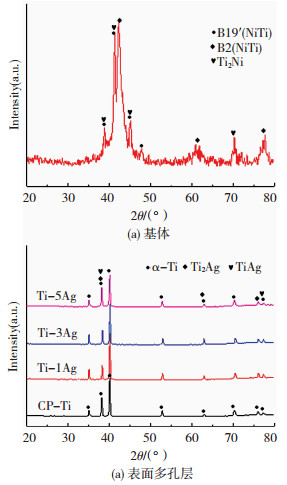
|
图 2 表面多孔Ti-Ag/NiTi梯度合金的X射线衍射谱图 Fig.2 XRD patterns of surface porous Ti-Ag/NiTi gradient alloy: (a) matrix; (b) surface porous layer |
利用金相显微镜观察梯度合金中间基体、表面多孔层及界面的形貌,图 3为不同Ag含量表面多孔Ti-Ag/NiTi梯度合金的光学显微照片.图 3显示:中间基体合金与表面多孔层之间结合紧密,形成良好的冶金结合;表面层孔隙分布均匀,大孔周围分布着较多小微孔且孔之间相互连通.表面多孔层为纯Ti时(图 3(a)),基体和表面多孔层之间结合紧密,几乎没有界面过渡层;Ag含量为1%时(图 3(b)),界面结合无明显变化;当Ag含量为3%和5%时(图 3(c)、(d)),基体和表面多孔层之间开始出现较薄的界面过渡层.

|
图 3 不同Ag含量表面多孔Ti-Ag/NiTi梯度合金的光学显微组织形貌图 Fig.3 Optical microscope photographs of surface porous Ti-Ag /NiTi gradient alloy with different contents of Ag:(a)0;(b)1wt.%; (c)3wt.%; (d)5 wt.% |
利用SEM结合EDS线扫描对界面区域进行了成分分析(图 4).检测结果显示,界面过渡层为较多Ti元素和少量Ni元素,厚度约为30 μm,这主要是由于在烧结温度驱动力下,界面处元素相互扩散,形成了Ti和Ni的化合物;中间基体中主要为Ni和Ti元素,表面多孔层主要为Ti和Ag元素.上述结果表明,过渡层的存在会阻碍中间基体中Ni元素向表面多孔层的扩散,这对材料在使用过程中防止Ni离子的溶出与毒性也是有利的.另外,通过对中间基体合金的致密度检测可知,Ag含量(质量分数)分别为0、1%、3%、5%时,基体致密度分别为(89.8±1.80)%、(89.6±1.79)%、(88.9±1.78)%、(88.4±1.77)%,随着Ag含量增加,基体致密度略有下降,但变化不明显.
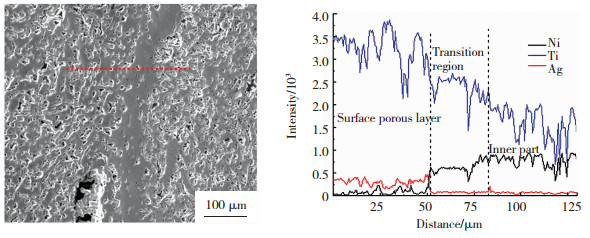
|
图 4 表面多孔Ti-5Ag/NiTi梯度合金的线扫描图 Fig.4 Line scan images of surface porous layer of Ti-5Ag/NiTi gradient alloy |
进一步利用背散射SEM结合EDS能谱分析观察了表面多孔层的组织形貌及成分分布.
图 5为表面多孔Ti-Ag/NiTi梯度合金表面多孔层的SEM形貌,表 1为图 5中不同区域的EDS能谱分析结果.根据图 5和表 1可知,大块灰色区域为α-Ti相,烧结过程中加入的Ag元素固溶进了α-Ti基体并与之反应形成了少量的TiAg和Ti2Ag相,反应生成的Ti2Ag相呈层片状分布在α-Ti相周围,部分反应不完全的Ti-Ag化合物弥散分布在α-Ti相晶界上(图 5(d)),这与Szaraniec[14]和Chen[15]等的研究结果是一致的.Keun-Taek Oh等[16]的研究结果表明,在纯Ti中加入Ag元素可以起到强化作用,反应生成的TiAg和Ti2Ag相具有优异的力学性能、耐蚀性能及良好的生物相容性.

|
图 5 不同Ag含量表面多孔Ti-Ag/NiTi梯度合金表面多孔层的背散射SEM形貌 Fig.5 BSE-SEM micrographs of surface porous layer of Ti-Ag/NiTi gradient alloy with different contents of Ag:(a)1wt.%; (b)3wt.%; (c)5wt.%; (d)Area1 |
| 表 1 梯度合金表面多孔层不同部位的EDS分析结果(原子分数/%) Table 1 EDS analysis of different parts of surface porous layer of gradient alloy(at.%) |
利用MCV金相分析软件对梯度合金表面孔隙特征(孔隙率、孔径尺寸)进行了检测.表 2为计算获得的表面多孔层孔隙率与孔径尺寸的数据.从表 2可以看出,Ag含量(质量分数)为0、1%、3%、5%时,多孔层孔隙率分别为(36.4±1.4)%、(37.3±1.6)%、(36.1±1.4)%、(36.6±1.5)%,平均孔径分别为436、438、442、445 μm,上述结果说明,Ag含量对梯度合金表面多孔层的孔隙率和平均孔径影响很小.根据相关文献报道[17],多孔结构有利于骨组织长入且孔隙率范围在30%~90%、孔径范围在100~500 μm的多孔材料适合骨细胞生长.所制备的表面多孔Ti-Ag/NiTi梯度合金表面孔隙率和孔径范围能够满足上述要求,这对改善合金生物活性是有利的.
| 表 2 表面多孔Ti-Ag/NiTi梯度合金的孔隙率及平均孔径 Table 2 Average pore size and porosity of surface porous Ti-Ag/NiTi gradient alloy |
图 6为不同Ag含量表面多孔Ti-Ag/NiTi梯度合金的室温力学性能,可以看到,Ag含量0、1%、3%、5%时,梯度合金的的抗压强度值分别为431.6、452.4、489.2、553.1 MPa,压缩弹性模量值分别为7.5、7.9、8.5、8.9 GPa.
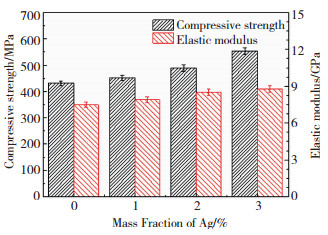
|
图 6 不同Ag含量对表面多孔Ti-Ag/NiTi梯度合金力学性能的影响 Fig.6 Effect of different Ag contents on compressive strength of surface porous Ti-Ag/NiTi gradient alloy |
从图 6可以看出,随着Ag含量的提高,梯度合金的抗压强度呈增大趋势,而压缩弹性模量则呈缓慢增大趋势,但变化不明显.根据前述分析结果,梯度合金中间基体主要为较为致密的NiTi合金,使得材料保持了较高的抗压强度,而表面多孔层中加入的Ag元素与Ti元素发生反应形成了TiAg和Ti2Ag相,起到了合金强化作用,因而梯度合金的抗压强度呈增大趋势;对于压缩弹性模量,由于表面多孔层的存在,使得梯度合金在压缩过程中应力得到大量释放,弹性模量较块体合金显著下降而与多孔合金接近;由于Ag含量对表面多孔层孔隙率和平均孔径影响较小,因而弹性模量变化不明显.综上,所制备的表面多孔Ti-Ag/NiTi梯度合金的抗压强度远高于多孔NiTi合金而与块体合金接近,压缩弹性模量值远低于块体NiTi合金而与多孔合金接近,且与人骨弹性模量(皮质骨3 ~ 20 GPa,松质骨0.05 ~ 0.5 GPa)[18]非常匹配,具有优异的力学相容性.
2.3 表面多孔Ti-Ag/NiTi梯度合金的体外生物活性与抗菌性能图 7为Ag含量(质量分数)3%的表面多孔Ti-Ag/NiTi梯度合金在模拟人体体液Hanks'溶液中浸泡14 d后表面类骨磷灰石的沉积情况,图中可观察到有一定厚度的类骨磷灰石沉积在表面多孔层的孔洞处,且形成了一层均匀连续的涂层.多孔材料有利于营养物质运输和交换,孔内凹陷粗糙处有利于形核生长,因此,类骨磷灰石优先沉积在孔洞处.上述结果表明所制备的梯度合金具有优异的体外生物活性.

|
图 7 表面多孔Ti-Ag/NiTi梯度合金在Hanks′溶液中浸泡14 d的SEM形貌 Fig.7 SEM images of surface porous Ti-Ag/NiTi gradient alloy after soaking in Hanks′ solution for 14 days |
图 8为表面多孔Ti-Ag/NiTi梯度合金培养24 h后的细菌菌落,表 3列出了计算的Ti-Ag合金的抗菌率.从表 3可以看出,表面多孔层未添加Ag元素时,梯度合金可观察到大量细菌菌落且抗菌率仅为6%,表明该梯度合金不具有抗菌性;Ag含量为1%时,梯度合金也可观察到细菌菌落,但数量明显少于未添加Ag元素的梯度合金,其抗菌率为96%(<99%),表明该合金具有了一定的抗菌性;Ag含量为3 %和5%时,合金表面已无细菌菌落,抗菌率均大于99%,该合金抗菌性能稳定且抗菌能力强.上述结果表明,通过在表面多孔层中添加Ag元素使得所制备的梯度合金具有了良好的抗菌性能.
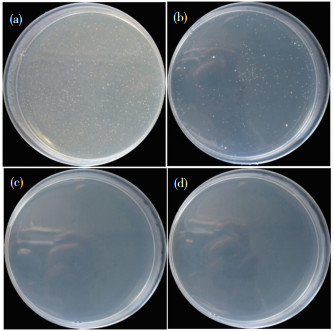
|
图 8 不同Ag含量表面多孔Ti-Ag/NiTi梯度合金细菌菌落 Fig.8 Bacterial colonies on surface porous Ti-Ag/NiTi gradient alloy: (a) 0;(b) 1wt.%; (c) 3wt.%; (d) 5wt.% |
| 表 3 表面多孔Ti-Ag/NiTi梯度合金的抗菌率及抗菌活性值 Table 3 Antibacterial rate and antibacterial activity value of surface porous Ti-Ag/NiTi gradient alloy |
综上所述,由SPS制备的表面多孔Ti-Ag/NiTi梯度合金界面结合良好,表面孔隙率与平均孔径适宜,获得了较高的抗压强度和与人骨相匹配的弹性模量,且具有良好的生物活性和抗菌性,作为人造骨植入材料表现出良好的应用前景.
3 结论1) 利用SPS技术制备的表面多孔Ti-Ag/NiTi梯度合金中间基体主要由奥氏体NiTi相(B2)和单斜马氏体NiTi相(B19′)组成,并同时存在少量次生相Ti2Ni相,表面多孔层主要由α-Ti、TiAg和Ti2Ag相组成,内外层界面形成稳定冶金结合,Ag含量增加对梯度合金表面孔隙率和平均孔径影响不大.
2) 制备的表面多孔Ti-Ag/NiTi梯度合金具有较高的抗压强度和与人骨匹配的低弹性模量.随着Ag含量的提高,抗压强度值呈增大趋势(由431.6 MPa提高到553.1 MPa),而弹性模量值变化不明显(7.5~8.9 GPa).
3) 制备的表面多孔Ti-Ag/NiTi梯度合金不仅具有优异的体外生物活性,而且具有良好的抗菌性能.
| [1] |
GILL P, MUSARAMTHOTA V, MUNROE N, et al. Surface modification of Ni-Ti alloys for stent application after magnetoelectropolishing[J]. Materials Science and Engineering C, 2015, 50: 37-44. DOI:10.1016/j.msec.2015.01.009 |
| [2] |
CHEN Q, THOUAS G A. Metallic implant biomaterials[J]. Materials Science and Engineering R, 2015, 87: 1-57. DOI:10.1016/j.mser.2014.10.001 |
| [3] |
LIU X, WU S, YEUNG W K, et al. Relationship between osseointegration and superelastic biomechanics in porous NiTi scaffolds[J]. Biomaterials, 2011, 32(2): 330-338. DOI:10.1016/j.biomaterials.2010.08.102 |
| [4] |
ABIDI I H, KHALID F A. Sintering and morphology of porous structure in NiTi shape memory alloys for biomedical applications[J]. Advanced Materials Research, 2012, 570: 87-95. DOI:10.4028/www.scientific.net/AMR.570.87 |
| [5] |
刘爱辉, 徐吉林. 医用多孔NiTi合金表面微弧氧化改性研究[J]. 材料科学与工艺, 2015, 23(3): 107-111. LIU Aihui, XU Jilin. Surface modification of biomedical porous NiTi alloy by micro-arc oxidation[J]. Materials Science and Technology, 2015, 23(3): 107-111. DOI:10.11951/j.issn.1005-0299.20150321 |
| [6] |
LI Y H, CHEN N, CUI H T, et al. Fabrication and characterization of porous Ti-10Cu alloy for biomedical application[J]. Journal of Alloys and Compounds, 2017, 723: 967-973. DOI:10.1016/j.jallcom.2017.06.321 |
| [7] |
DUAN B, ZHANG Y, WANG D, et al. Fabrication and properties of porous NiTi alloy by gel-casting with TiH2 powders[J]. Journal of Materials Engineering and Performance, 2017, 4: 1-8. DOI:10.1007/s11665-017-2957-3 |
| [8] |
RHALMI S, ODIN M, ASSAD M, TABRIZIAN M, RIVARD C H, YAHIA L H. Hard, soft tissue and in vitro cell response to porous nickel-titanium: a biocompatibility evaluation[J]. Bio-medical materials and engineering, 1999, 9(3): 151-162. |
| [9] |
LI J, YANG H, WANG H, et al. Low elastic modulus titanium-nickel scaffolds for bone implants[J]. Materials Science and Engineering C, 2014, 34(1): 110-114. DOI:10.1016/j.msec.2013.08.043 |
| [10] |
JIAN Y T, YANG Y, TIAN T, et al. Effect of pore size and porosity on the biomechanical properties and cytocompatibility of porous NiTi alloys[J]. Plos One, 2015, 10(6): 128-138. DOI:10.1371/journal.pone.0149051 |
| [11] |
BASSANI P, PANSERI S, RUFFINI A, et al. Porous NiTi shape memory alloys produced by SHS: microstructure and biocompatibility in comparison with Ti2Ni and TiNi3[J]. Journal of Materials Science: Materials in Medicine, 2014, 25(10): 2277-2287. DOI:10.1007/s10856-014-5253-x |
| [12] |
ZHANG L, TANA J, MENG Z D, et al. Low elastic modulus Ti-Ag/Ti radial gradient porous composite with high strength and large plasticity prepared by spark plasma sintering[J]. Materials Science & Engineering A, 2017, 688: 330-337. DOI:10.1016/j.msea.2017.02.025 |
| [13] |
ZHANG L, HE Z Y, ZHANG Y Q, et al. Rapidly sintering of interconnected porous Ti-HA biocomposite with high strength and enhanced bioactivity[J]. Materials Science and Engineering C, 2016, 67: 104-114. DOI:10.1016/j.msec.2016.05.001 |
| [14] |
SZARANIEC B, GORYCZKA T. Structure and properties of Ti-Ag alloys produced by powder metallurgy[J]. Journal of Alloys and Compounds, 2017, 709: 464-472. DOI:10.1016/j.jallcom.2017.03.155 |
| [15] |
CHEN M, YANG L, ZHANG L, et al. Effect of nano/micro-Ag compound particles on the bio-corrosion, antibacterial properties and cell biocompatibility of Ti-Ag alloys[J]. Materials Science and Engineering C, 2017, 75: 906-917. DOI:10.1016/j.msec.2017.02.142 |
| [16] |
OH K T, SHIM H M, KIM K N. Properties of titanium-silver alloys for dental application[J]. Journal of Biomedical Materials Research. Part B, Applied Biomaterials, 2005, 74(1): 649-658. DOI:10.1002/jbm.b.30259 |
| [17] |
ZHANG L, ZHANG Y Q, JIANG Y H, et al. Superelastic behaviors of biomedical porous NiTi alloy with high porosity and large pore size prepared by spark plasma sintering[J]. Journal of Alloys and Compounds, 2015, 644: 513-522. DOI:10.1016/j.jallcom.2015.05.063 |
| [18] |
HENCH L. Bioceramics[J]. Journal of the American Ceramic Society, 1998, 81(7): 1705-1728. |
 2019, Vol. 27
2019, Vol. 27


