随着工业发展和生活水平的提高,废水的排放量不断增加,种类和结构也日益复杂[1-2].其中很多污染物化学结构稳定,甚至具有致畸,致癌,致突变等毒害作用,即使浓度很低,日积月累,也能够对生物和环境构成极大的威胁[3].在众多水处理方法中,光催化处理难降解有机物的效果十分卓越.传统的芬顿试剂是由H2O2以及Fe2+组成的具有强氧化能力的混合体系,它能够产生·OH,使污染物降解[4].基于此,科学家们也做了很多尝试和改进,开发出很多类芬顿技术,如光芬顿法[5],电芬顿法[6],超声芬顿法[7],微波芬顿法[8]等,同时对催化剂也做了一些探索,Choi[9]等分别用ZnO和Ag/ZnO作为催化剂产生类芬顿反应并降解了亚甲基蓝和罗丹明B,Oliveira[10]等发现氢化的活性炭能够替代Fe2+与H2O2进行类芬顿反应降解有机染料,zhao[11]等用CuOx修饰ZnFe2O4与H2O2进行类芬顿反应降解了金橙Ⅱ.
目前,研究最为广泛的催化材料主要集中在过渡金属和金属氧化物、以金属为主的复合材料及有机金属化合物[12].但金属的使用存在如对环境有害、成本不够低廉、在空气中易被腐蚀、容易产生危险废弃物等诸多弊端[13],而且由于现代工业的快速发展所造成的金属资源过度开发问题使地球上的许多金属资源正在日益减少,因此,不含金属的催化剂特别是碳材料,因其良好的生物相容性、低廉的价格、环境友好、获取容易、性质稳定、可持续再生[14]开始受到人们的关注.石墨烯是由单层碳原子紧密堆积而成的二维蜂窝状平面薄膜[15],是当前发现的唯一一种二维自由态原子晶体,也是目前使用材料中最薄、强度最大、导电和导热性能最好的一种纳米材料,且氧化石墨烯在催化领域也表现出了极其优异的性能[16].
本文采用绿色、安全的改进的Hummers法[17]制备了氧化石墨烯(GO),并利用GO作为催化剂与H2O2复合在可见光下降解有机染料甲基橙(MO),通过改变光照、pH值以及GO的量探究不同条件对GO/H2O2复合试剂降解甲基橙的光催化效果.
1 实验 1.1 主要仪器与试剂实验试剂:鳞片石墨(500目)、硝酸钠、高锰酸钾、H2O2(质量分数30%)、甲基橙、浓硫酸、浓氨水、去离子水,药品纯度均为分析纯.
实验仪器:YP-B2003型电子天平:上海光正医疗仪器有限公司;自制光源(功率200 W,波长380~840 nm);Quanta 650 FEG型扫描电镜:美国FEI公司;Quanta 650 FEG配件EDS能谱仪:美国FEI公司;K-Sens-532型拉曼光谱仪:上海复享光学股份有限公司;722S型可见分光光度计:上海菁华科技仪器有限公司.
1.2 GO及其分散液的制备使用改良的Hummer法[17]制备GO.将2 g鳞片石墨和2 g硝酸钠加入100 mL浓硫酸中,0 ℃搅拌后,缓慢加入12 g高锰酸钾,继续搅拌90 min,再升温至40 ℃继续搅拌2 h,缓慢加入80 mL去离子水和10 mL H2O2(质量分数30%),搅拌10 min后取出.将得到的GO用去离子水洗涤,分离干燥,而后分散于水中,得到质量浓度为4 mg/mL的GO水溶液.
1.3 含难降解有机物废水的降解用于降解的甲基橙质量浓度为20 mg/L,实验均在室温下500 mL容器中进行,用硫酸和氨水调节其pH,并加入0.8 mL H2O2以及0.132 mL GO(4 mg/mL),震荡,使其均匀分布,用功率200 W,波长为380~840 nm的光源照射使其降解.每间隔一定时间取样,用分光光度计测定溶液吸光度.其实验流程图如图 1所示.
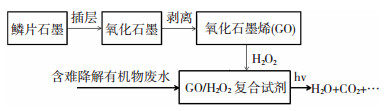
|
图 1 含难降解有机物废水降解实验流程图 Fig.1 Flow schematic of degradation experiment of wastewater containing refractory organic compounds |
配制甲基橙溶液标准溶液,并在甲基橙的最大吸收波长463 nm处测定其吸光度,线性拟合得到甲基橙的质量浓度标准曲线,
| $ C = 12.146\;45\;A + 0.526\;2, $ |
其中,相关系数R2(adj)=0.999 62,证明在上述范围内甲基橙的质量浓度C(mg/ L)与吸光度A具有良好的线性关系,符合Lambert-Beer定律,故降解率可以由(A0-A1)/A0×100%计算,其中,A0为甲基橙溶液初始吸光度值,A1为反应一段时间后甲基橙溶液的吸光度值.
2 结果和讨论 2.1 GO的表征 2.1.1 扫描电子显微镜与电子能谱分析GO的SEM形貌如图 2(a)所示,片层呈现出典型的石墨烯褶皱和卷曲结构,且呈薄纱状,说明层数比较少.EDS能谱分析结果表明,在GO中,C和O的质量比约为1.85: 1,氧化程度较高,表明所得GO有较多的含氧官能团.
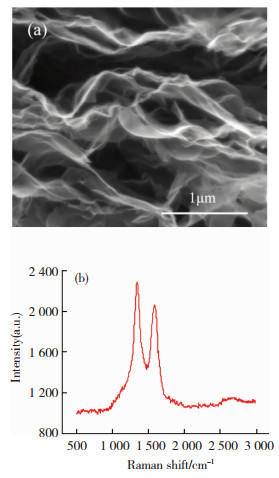
|
图 2 GO的SEM图像(a)与拉曼光谱(b) Fig.2 SEM (a) of GO and Raman spectra (b) of GO |
图 2(b)是石墨烯的拉曼光谱,可以看到在1 350 cm-1附近有D峰,1 580 cm-1附近有G峰,在2 680 cm-1附近有微弱的2D峰.D峰是由石墨烯上的缺陷或边缘无序导致的,G峰是由碳原子sp2电子的平面伸缩振动产生的[18],ID/IG值约为1.11,显示其存在较多的缺陷,具有较高的活性.2D峰很小,说明GO的氧化程度很高[19].
2.2 GO/H2O2复合试剂光催化性能 2.2.1 H2O2和GO降解甲基橙协同关系探究图 3(a)为不同光照和pH值下GO降解甲基橙的效果,可以看出,无论改变溶液的pH值还是改变光照条件,GO对甲基橙的光催化降解能力都十分有限,说明在没有H2O2的条件下,GO的吸附特性可以忽略不计,光催化性能未能很好地体现出来.
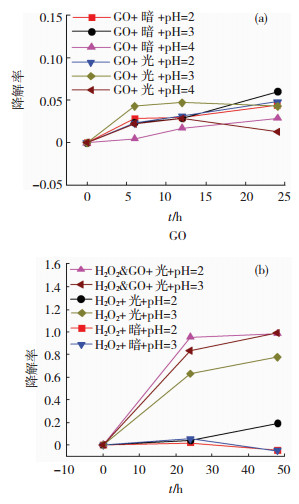
|
图 3 GO(a)及H2O2(b)对MO的降解效果 Fig.3 The degradation rate of MO by using (a) GO, (b) H2O2 |
图 3(b)为不同pH值下光照对H2O2降解MO的影响以及加入GO作为催化剂, 在可见光下降解MO的效果对比,可以看到,光照对于H2O2降解甲基橙有一定的效果.而即使在有光照条件下H2O2降解MO的效果也远不如加入GO作为催化剂的效果,在48 h内,pH分别为2,3时,加入GO作为催化剂,降解率可分别提高79.09%,21.75%及39.49%.
2.2.2 光的照射对甲基橙降解反应效果影响图 4(a)为光反应与暗反应条件下,pH为2,3,4时,甲基橙溶液降解率随时间变化的对比.在暗反应条件下,甲基橙均几乎没有降解,而光照可以大幅度提升GO/H2O2复合试剂的降解率.

|
图 4 不同因素对GO/H2O2复合试剂降解甲基橙的影响 Fig.4 Influencing factors of GO/H2O2 composite reagents degrading MO:(a) light; (b) pH; (c) the amount of GO addition; (d) time |
在仅增加光照的条件下,MO的降解率能够大幅度提升,证明其降解是基于光催化原理.反应中有H2O2参与,结合已往的研究,推测降解机理是自由基理论[20],如图 5所示.当光照在甲基橙溶液中,GO吸收光子的能量激发共轭π键产生电子(e-)-空穴(h+)对[21],电子与空穴迁移到GO表面,在GO表面发生氧化还原反应[22].空穴与H2O2和H2O反应产生羟基自由基,电子则结合氧气生成过氧化物·O2,而·O2并不稳定,会与H2O2和H2O继续发生反应,最终将产生羟基自由基·OH[23],羟基自由基具有强氧化性,可以将MO彻底降解.

|
图 5 GO/H2O2复合试剂对MO的降解原理 Fig.5 Degradation mechanism of MO with GO/H2O2 composite reagents degrade |
图 4(b)为各pH值下MO降解率变化曲线,当溶液pH=2或3时,甲基橙的降解率较大.24 h时,pH=2的甲基橙溶液降解率最高,为94.37%,pH=3的甲基橙溶液降解率为86.67%.48 h时,pH=3的甲基橙溶液降解率最高,可达99.45%,pH=2的甲基橙溶液降解率也能够达到98.43%.反应适宜在较低的pH值下进行,这是因为降解甲基橙的过程主要是由于·OH的参与,而H2O2与电子结合会生成OH-和·OH,因此,pH值的升高会抑制·OH的生成,H2O2还会发生自分解生成H2O和O2,使生成的·OH浓度下降,而且甲基橙在酸性条件下的醌式结构比中性、碱性条件下的偶氮结构更容易降解[24],而pH值过低时,H2O2分解速率较慢,且H+会捕捉·OH生成H2O,阻碍反应的进行,因此,较低的pH值更利于反应的发生.
2.2.4 加入GO的量对甲基橙降解效果影响当加入H2O2的量相同时,在光照条件下,分别加入0、0.066、0.132、0.33 mL的GO,探究GO的加入量与降解效果的关系.如图 4(c)所示,加入GO会促进MO的降解,当GO加入量为0.132 mL(即约1 mg/L)时,降解效果最好,48 h降解率可达92.71%,降解率比不加GO提高了67.4%.当GO质量浓度过低时,反应不够充分.GO质量浓度过高时,质量浓度的增加同样导致溶液的透光率降低,受光面积减小,对光催化产生一定影响[25].
2.2.5 降解时间对甲基橙降解效果的影响降解时间对甲基橙降解效果的影响如图 4(d)所示,甲基橙的降解速率第1个小时最快,随后缓慢上升,降至5 h时,出现平台,随后降解率又继续上升,8 h降解率达到50%以上,16 h的降解率达到93.39%.
3 结论1) GO与H2O2单独使用时效果不显著,将其复合之后,48 h降解率(pH=2)可以提高79.09%,且使用的GO质量浓度较低.
2) pH为2~4时光催化效果最好,降解率最高可达99.45%.同时,光照也可以大幅度提升GO/H2O2复合试剂的降解率.
3) 甲基橙溶液8 h降解率可以达到50%以上,16 h降解率能够达到93.39%.用改良的Hummers法制备的GO成本较低,用量较少,且不产生危险废弃物,在实际污水处理中具有积极的意义.
| [1] |
PHILLIPS P J, SMITH S G, KOLPIN D W, et al. Pharmaceutical formulation facilities as sources of opioids and other pharmaceuticals to wastewater treatment plant effluents[J]. Environmental Science & Technology, 2010, 44(13): 4910-6. DOI:10.1021/es100356f |
| [2] |
RICHARDSON S D. Environmental mass spectrometry: emerging contaminants and current issues 2012[J]. Analytical Chemistry, 2013, 78(12): 747-778. DOI:10.1021/ac800660d |
| [3] |
FEWSON C A, CHARLES A. Biodegradation of xenobiotic and other persistent compounds: the causes of recalcitrance[J]. Trends in Biotechnology, 1988, 6(7): 148-153. DOI:10.1016/0167-7799(88)90084-4 |
| [4] |
SOHRABI M R, KHAVARAN A, SHARIATI S, et al. Removal of carmoisine edible dye by Fenton and photo Fenton processes using Taguchi orthogonal array design[J]. Arabian Journal of Chemistry, 2014, 10(2): S3523-S3531. DOI:10.1016/j.arabjc.2014.02.019 |
| [5] |
AN J, ZHU L, WANG N, et al. Photo-Fenton like degradation of tetrabromobisphenol A with graphene BiFeO3 composite as a catalyst[J]. Chemical Engineering Journal, 2013, 219(3): 225-237. DOI:10.1016/j.cej.2013.01.013 |
| [6] |
BRILLAS E, SIRÉS I, OTURAN M A. Electro-Fenton process and related electrochemical technologies based on Fenton's reaction chemistry[J]. Chemical Reviews, 2009, 109(12): 6570. DOI:10.1021/cr900136g |
| [7] |
SEGURA Y, MARTÍNEZ F, MELERO J A, et al. Enhancement of the advanced Fenton process (Fe0 /H2O2) by ultrasound for the mineralization of phenol[J]. Applied Catalysis B Environmental, 2012, s 113-114(1): 100-106. DOI:10.1016/j.apcatb.2011.11.024 |
| [8] |
YANG Y, WANG P, SHI S J, et al. Microwave enhanced Fenton-like process for the treatment of high concentration pharmaceutical wastewater[J]. Journal of Hazardous Materials, 2009, 168(1): 238-45. DOI:10.1016/j.jhazmat.2009.02.038 |
| [9] |
CHOI Y I, JUNG H J, SHIN W G, et al. Band gap-engineered ZnO and Ag/ZnO by ball-milling method and their photocatalytic and Fenton-like photocatalytic activities[J]. Applied Surface Science, 2015, 356: 615-625. DOI:10.1016/j.apsusc.2015.08.118p |
| [10] |
OLIVEIRA L C A, SILVA C N, YOSHIDA M I, et al. The effect of H2 treatment on the activity of activated carbon for the oxidation of organic contaminants in water and the H2O2 decomposition[J]. Carbon, 2004, 42(11): 2279-2284. DOI:10.1016/j.carbon.2004.05.003 |
| [11] |
ZHAO W, LIANG C, WANG B, et al. Enhanced photocatalytic and Fenton-like performance of CuOx-Decorated ZnFe2O4[J]. Acs Applied Materials & Interfaces, 2017, 9(48): 1-37. DOI:10.1021/acsami.7b14799 |
| [12] |
SU D S, ZHANG J, FRANK B, et al. Metal-free heterogeneous catalysis for sustainable chemistry[J]. Chemsuschem, 2010, 3(2): 169-180. DOI:10.1002/cssc.200900180 |
| [13] |
YU D, NAGELLI E, DU F, et al. Metal-free carbon nanomaterials become more active than metal catalysts and last longer[J]. J Phys Chem Lett, 2010, 1(14): 2165-2173. DOI:10.1021/jz100533t |
| [14] |
NAVALON S, DHAKSHINAMOORTHY A, ALVARO M, et al. Carbocatalysis by graphene-based materials[J]. Chemical Reviews, 2014, 114(12): 6179. DOI:10.1021/cr4007347 |
| [15] |
KS N, D J, F S, et al. Two-dimensional atomic crystals[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(30): 10451. DOI:10.1073/pnas.0502848102 |
| [16] |
PYUN J. Graphene oxide as catalyst: application of carbon materials beyond nanotechnology[J]. Angewandte Chemie International Edition, 2011, 50(1): 46-48. DOI:10.1002/anie.201003897 |
| [17] |
JR W S H, Offeman R E. Preparation of graphitic oxide[J]. Journal of the American Chemical Society, 1958, 80(6): 1339. DOI:10.1021/ja01539a017 |
| [18] |
MALARD L M, PIMENTA M A, DRESSELHAUS G, et al. Raman spectroscopy in graphene[J]. Physics Reports, 2009, 473(5): 51-87. DOI:10.1016/j.physrep.2009.02.003 |
| [19] |
PAREDES J I, VILLARRODIL S, SOLÍSFERNÁNDEZ P, et al. Atomic force and scanning tunneling microscopy imaging of graphene nanosheets derived from graphite oxide[J]. Langmuir the Acs Journal of Surfaces & Colloids, 2009, 25(10): 5957-68. DOI:10.1021/la804216z |
| [20] |
OJHA D P, JOSHI M K, HAN J K. Photo-Fenton degradation of organic pollutants using a zinc oxide decorated iron oxide/reduced graphene oxide nanocomposite[J]. Ceramics International, 2017, 43(1): 1290-1297. DOI:10.1016/j.ceramint.2016.10.079 |
| [21] |
MATSUMOTO Y, KOINUMA M, IDA S, et al. Photoreaction of graphene oxide nanosheets in water[J]. J Phys Chem C, 2011, 115(39): 19280-19286. DOI:10.1021/jp206348s |
| [22] |
HSU H C, SHOWN I, WEI H Y, et al. Graphene oxide as a promising photocatalyst for CO2 to methanol conversion[J]. Nanoscale, 2013, 5(1): 262-8. DOI:10.1039/c2nr31718d |
| [23] |
BORUAH P K, SHARMA B, KARBHAL I, et al. Ammonia-modified graphene sheets decorated with magnetic Fe3O4 nanoparticles for the photocatalytic and photo-Fenton degradation of phenolic compounds under sunlight irradiation[J]. Journal of Hazardous Materials, 2016, 325: 90. DOI:10.1016/j.jhazmat.2016.11.023 |
| [24] |
LI J, MI C, LI J, et al. The removal of MO molecules from aqueous solution by the combination of ultrasound/adsorption/photocatalysis[J]. Ultrasonics Sonochemistry, 2008, 15(6): 949-954. DOI:10.1016/j.ultsonch.2008.03.002 |
| [25] |
刘洋洋, 顾宝珊, 郑艳银, 等. 氧化石墨烯可见光催化能力的影响因素[J]. 材料科学与工艺, 2018, 26(4): 80-87. LIU Yangyang, GU Baoshan, ZHENG Yanyin, et al. Influencing factors of visible light photocatalytic capacity of graphene oxide[J]. Materials Science and Technology, 2018, 26(4): 80-87. DOI:10.11951/j.issn.1005-0299.20170348 |
 2019, Vol. 27
2019, Vol. 27


