铝合金是航空航天领域应用最为广泛的金属材料之一,其中5系、7系铝合金的应用尤为广泛[1].在海洋上空,大气中的氯离子含量较高,将提高铝合金的腐蚀速率,使得点蚀成为其主要的局部腐蚀形式,易造成飞机性能降低,对飞机的安全性能产生威胁.因此,展开铝合金在盐水环境中腐蚀行为的研究至关重要.
国内外许多学者对铝和铝合金在模拟海洋大气环境中的电化学腐蚀行为进行了研究:董超芳等[2]采用电化学交流阻抗测试和扫描Kelvin探针技术, 研究7A04铝合金在初期腐蚀过程中的电化学行为.研究表明:Cl-对铝合金腐蚀有显著的加速作用, 盐雾试验初期表面出现点蚀坑;随盐雾时间增长,点蚀相互连接并扩展,电化学反应阻抗下降.王洪仁等[3]采用动电位极化、循环极化和全浸腐蚀试验方法研究了5083铝合金在静止海水中的腐蚀电化学性能以及活性氯的影响.研究发现,防污活性氯浓度范围(0.2~0.5 mg/L),活性氯对铝合金的阴极和阳极电化学极化以及腐蚀行为没有明显影响,并可提高铝合金的耐点蚀能力,海水的pH值对铝合金的腐蚀具有显著的影响.何建平[4]用电位法、电阻法定量研究铝合金的剥蚀性能,分析认为铝合金受外力作用,有可能裸露出新鲜金属,新鲜金属与其余已钝化的部分之间,存在耦合作用.并根据耦合作用理论,获得了耦合电位、裸露的新鲜金属腐蚀速率的数学表达式.Ahmad和Abdul Alee[5]利用失重法和电化学测试法对高强度Al-Mg-Li合金Weldalite050在阿拉伯海湾大气环境的腐蚀行为进行研究.结果表明:合金最小腐蚀速率为1.82~4.82毫米/年,析出相Al12MgLi,Al-Li,Al12Mg17和Al-Li沉淀物对合金抗腐蚀性能有显著影响.Buzza和Alkire[6]对AA6063铝合金点蚀行为进行分析发现,自然条件下,腐蚀时间对点蚀的稳定性也有显著作用.目前,针对某种铝合金在模拟海水及海洋大气环境下的腐蚀研究较为广泛[7-12],而将两种或多种航空用铝合金作为研究对象,采用多种研究手段,探讨温度对其腐蚀的影响并进行比较方面则鲜有报导.
本文将模拟海洋大气环境,采用微观腐蚀形貌观察、增重法、极化曲线、电化学阻抗谱等技术,对7A04和5A06铝合金在不同温度下的腐蚀行为和机理进行研究,以期为航空用铝合金的腐蚀检测和保护提供参考.
1 实验实验材料为7A04铝合金和5A06铝合金,其化学成分见表 1.
| 表 1 7A04和5A06铝合金的化学成分(质量分数/%) Table 1 Chemical composition of 7A04 and 5A06 aluminum alloy (wt.%) |
试样规格为:直径20 mm,厚度10 mm的圆柱块,平行试验数量为5件.实验前先对试样进行打磨,P-2T金相试样抛光机进行抛光,用50 g/L氢氧化钠溶液将氧化膜去除,3%硝酸溶液中出光,出光后放入蒸馏水使表面液体去除.冷风吹干,称量质量,精确到0.1 mg.
将处理好的试样放入盛有3.5%氯化钠溶液的烧杯中进行腐蚀实验.此实验采用单因素控制变量的方法,在其他因素相同的情况下,利用水浴加热方式,改变温度条件,使试样分别在20、30、40、60和80 ℃的环境下进行腐蚀.腐蚀时间均为5 h.
腐蚀实验完成后,将试样取出,放入干燥箱中保持60 ℃恒温干燥30 min,使试样表面完全干燥.干燥后将试样放在电子秤上称重,记录数据.使用Axio Scope A1蔡司显微镜(成贯仪器(上海)有限公司)观察试样的腐蚀情况,采用HATACHI S-3400N钨丝扫描电子显微镜(苏州佐藤精密仪器有限公司)观察试样典型的点腐蚀坑,并利用Proimaging软件对腐蚀坑尺寸进行测量.
利用电化学测试方法对铝合金在不同温度下的腐蚀行为和机理进行研究.电化学测试使用Princeton Parstat 2273电化学工作站.测试采用三电极体系,分别由工作电极(不同温度腐蚀后的铝合金电极)、参比电极(饱和甘汞电极)、辅助电极(铂丝电极)构成.测试溶液均为室温下3.5%NaCl溶液.其中,动电位极化测试扫描速率为0.166 mV/s,电化学阻抗测试扫描频率范围为10 kHz~10 mHz.
2 结果与讨论 2.1 铝合金腐蚀微观形貌利用蔡司显微镜对7A04和5A06铝合金的腐蚀表面形貌进行观察,结果如图 1所示.
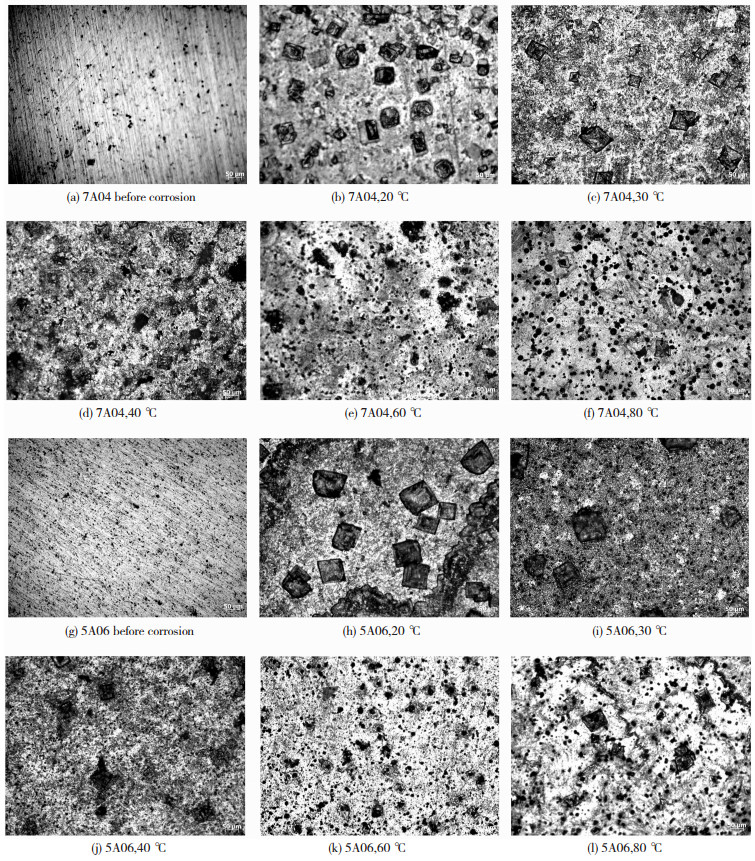
|
图 1 7A04和5A06铝合金腐蚀表面形貌 Fig.1 Corrosion surface morphology of 7A04 and 5A06 aluminum alloy |
由图 1可知,两种铝合金在不同温度下腐蚀5 h后,表面出现很多细小的点坑,说明两种铝合金在腐蚀初期以点腐蚀为主.图 1(a)~(f)和(g)~(l)分别为7A04和5A06铝合金随温度变化的腐蚀表面形貌,可以看到,随着温度的增加,7A04和5A06铝合金表面点蚀坑均逐渐变大.放大倍数相同的情况下,腐蚀坑的数量和密集程度均随着温度的增加而增大.
氧化膜的形成过程与溶解过程是同时存在的,同时产生非常多的气孔,致使膜的表面状态为稀疏多孔[13].由于NaCl溶液中Cl-浓度较高,而Cl-是一种穿透性很强的离子,可以进入铝合金表面较为脆弱的氧化膜中或氧化膜缺失处,导致无氧化膜保护暴露的金属发生阳极反应,金属溶解生成Al3+;在部分区域,Cl-会积聚成核,导致该区域阳极溶解加速.随着溶液温度的升高,Cl-在铝合金表面的扩散速度加大,并将会以更快的速度破坏铝合金表面的氧化膜,使金属表面更易溶解,形成点蚀坑.正是由于这一原因,腐蚀坑数目和密集程度才会随着温度的升高而增大.
图 2中(a)~(d)均为利用蔡司显微镜放大得到的腐蚀形貌图.将图 2(a)和(b)作为一组,图 2(c)和(d)作为一组进行比较,可以看出在其他条件相同的情况下,5A06铝合金比7A04铝合金的点腐蚀坑面积更大,即腐蚀程度更大.7A04铝合金为铝镁合金,5A06为铝锌合金,而合金元素在氯化钠溶液中会形成一个个微小的原电池,从而加快反应速率.在氯化钠溶液中,铝和锌内部电位差要高于铝和镁内部电位差,因此,在相同条件下,5A06铝合金的腐蚀程度要高于7A04铝合金.
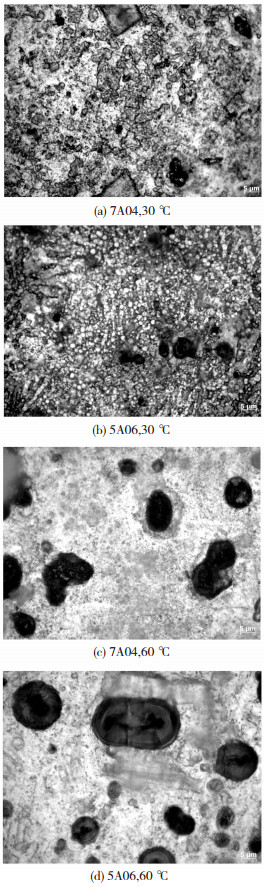
|
图 2 7A04铝合金的腐蚀表面形貌 Fig.2 Corrosion surface morphologies of 7A04 aluminum alloy |
表 2和表 3为两种材料腐蚀5 h的腐蚀前后质量及腐蚀速率.
| 表 2 5A06铝合金腐蚀前后质量及腐蚀速率 Table 2 Mass and corrosion rate of 5A06 aluminum alloy before and after corrosion |
| 表 3 7A04铝合金腐蚀前后质量及腐蚀速率 Table 3 Mass and corrosion rate of 7A04 aluminum alloy before and after corrosion |
从表 3可以看出,不同温度下腐蚀5 h,两种铝合金的腐蚀速率均很小,仍处于腐蚀的萌生阶段,但腐蚀速率均随温度的升高而呈增大趋势.
2.3 铝合金稳态极化曲线测试对两种铝合金在不同温度条件下的极化曲线进行了测试,结果如图 3所示.
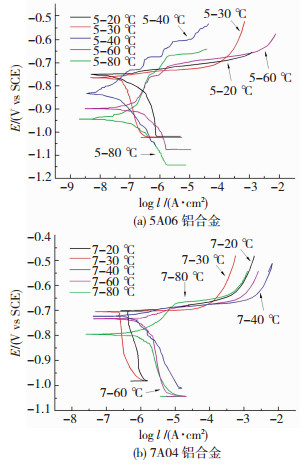
|
图 3 不同温度下5A06和7A04铝合金的极化曲线 Fig.3 Polarization curve of 5A06 and 7A04 aluminum alloy at different temperatures |
由图 3(a)可知,5A06铝合金试样在不同温度下的极化曲线趋势大致相同,说明在5种条件下进行的电化学测试中,金属试样的腐蚀过程基本相同.
根据塔菲尔区分析并结合相应的计算,可以找到每条曲线对应的自腐蚀电位(Ecorr),腐蚀电流密度(Icorr)和年腐蚀深度,如表 4和表 5所示.
| 表 4 5A06铝合金极化曲线数值 Table 4 Numerical value of polarization curve of 5A06 aluminum alloy |
| 表 5 7A04铝合金极化曲线数值 Table 5 Numerical value of polarization curve of 7A04 aluminum alloy |
利用表 4中的参数对比分析,可以更准确的看出5种试样的自腐蚀电位随着腐蚀温度的升高而向负方向移动,即自腐蚀电位的大小排序为E5-80 ℃<E5-60 ℃<E5-40 ℃<E5-30 ℃<E5-20 ℃.说明腐蚀温度越高,试样更易发生腐蚀.基于此,可以认为腐蚀温度越高,试样表面点蚀坑越密集,单位表面积点蚀坑数量越多,这将导致试样表面氧化膜破坏更加严重,暴露出的金属基体也更多,因此,腐蚀温度越高,5A06铝合金越容易受到腐蚀.
利用测试得到的腐蚀电流密度对数,可以计算出对应的腐蚀电流密度,并利用相应公式计算出5个试样的年腐蚀深度.由表 4可知,在实验温度范围内,腐蚀电流密度按照由小大的顺序依次为I5-80 ℃<I5-60 ℃<I5-40 ℃<I5-30 ℃<I5-20 ℃.年腐蚀深度大小排序与腐蚀电流密度相同,即腐蚀速率排序与腐蚀电流密度相同.说明在本实验条件下,腐蚀温度越低,电化学测试中试样的腐蚀速率越大.这是由于腐蚀温度越低,试样表面生成的点蚀坑越少,暴露出的金属基体面积也相应越小,单位面积产生的电流就越大,因此,腐蚀温度低的试样在电化学测试中的腐蚀速度更快.以上结论均与微观形貌观察得到的结论相符.
通过对图 3(b)观察分析可知,7A04铝合金在电化学测试中腐蚀难易程度和腐蚀速率随腐蚀温度的关系变化与5A06铝合金一致.分别选取腐蚀温度60和80 ℃,对两种铝合金极化曲线进行比较,分析其腐蚀行为,结果如图 4所示.
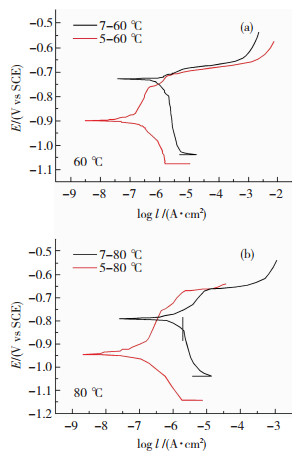
|
图 4 7A04与5A06铝合金极化曲线 Fig.4 Polarization curve of 7A04 and 5A06 aluminum alloy |
根据塔菲尔区分析并结合相应的计算,可以找到每条曲线对应的自腐蚀电位(Ecorr),腐蚀电流密度(Icorr)和年腐蚀深度,如表 6和表 7所示.
| 表 6 腐蚀温度60 ℃时7A04与5A06铝合金的极化曲线数值 Table 6 Numerical number of polarization curve of 7A04 and 5A06 aluminum alloy at 60 ℃ |
| 表 7 腐蚀温度80 ℃时7A04与5A06铝合金的极化曲线数值 Table 7 Numerical number of polarization curve of 7A04 and 5A06 aluminum alloy at 80 ℃ |
由表 6和表 7结果可以看出,自腐蚀电位E7A04>E5A06,腐蚀电流密度I7A04>I5A06.由于在前期腐蚀中,5A06铝合金比7A04的腐蚀程度更大,表面氧化膜受到了更严重的破坏,因而露出的金属基体更多,更易发生腐蚀;同时腐蚀后5A06铝合金露出的金属基体面积更大,电化学测试中单位面积流过的电流则更小,因此,腐蚀电流密度、年腐蚀深度及腐蚀速率更小.这些结论与微观形貌观察所得到的结论相符.
2.4 铝合金电化学阻抗测试对5A06铝合金和7A04铝合金试样在不同温度下进行电化学阻抗测试,结果如图 5所示.
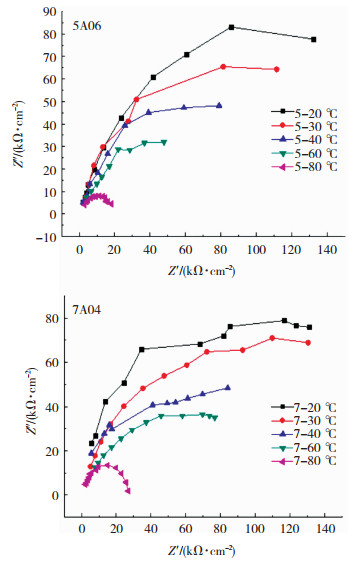
|
图 5 5A06铝合金和7A04铝合金电化学阻抗测试Nyquist谱图 Fig.5 Nyquist plots of electrochemical impedance spectroscopy |
由图 5可知,5A06铝合金在不同温度下的Nyquist图均只出现了一个容抗弧,容抗弧的半径会随着腐蚀温度的升高而减小,半径由大到小排序为:R5-20 ℃>R5-30 ℃>R5-40 ℃>R5-60 ℃>R5-80 ℃.这对应着铝合金腐蚀过程中电极表面与溶液形成的双电层反应过程.由于金属溶解失去电子,其表面会带有正电性,这将会吸附溶液中带负电的离子排列在金属表面,因而金属-电解质的两相界面就会形成双电层.由此分析得出,不同温度的前期腐蚀所得到的5A06铝合金试样抗腐蚀能力为5-20 ℃>5-30 ℃>5-40 ℃>5-60 ℃>5-80 ℃.这与田继强[14]关于钨铝合金腐蚀行为的研究结果相一致.
同理,5A06铝合金在不同温度下的Nyquist图均出现了一个容抗弧,由大到小排序为R7-20 ℃>R7-30 ℃>R7-40 ℃>R7-60 ℃>R7-80 ℃,故7A04铝合金在不同温度下的前期腐蚀后所得试样表面抗腐蚀能力大小为7-20 ℃>7-30 ℃>7-40 ℃>7-60 ℃>7-80 ℃.这与极化曲线测试中所得到的结论相一致.
3 结论1) 考察温度对5A06和7A04两种铝合金在3.5%NaCl环境中的影响,其腐蚀程度均随腐蚀温度的升高而加大,即80 ℃>60 ℃>40 ℃>30 ℃>20 ℃,因此,环境温度的升高会促进这两种铝合金腐蚀程度的加深.
2) 在腐蚀温度为30和60 ℃条件下,5A06铝合金的腐蚀程度相比于7A04铝合金更大.
3) 对于同一种铝合金,在3.5%NaCl溶液中的腐蚀速率会随着腐蚀温度的升高的增大.
4) 在实验条件范围内,同种铝合金的自腐蚀电位排序为E5-80 ℃>E5-60 ℃>E5-40 ℃>E5-30 ℃>E5-20 ℃,腐蚀电流密度的排序为I5-80 ℃>I5-60 ℃>I5-40 ℃>I5-30 ℃>I5-20 ℃.在同一腐蚀温度下,两种铝合金相比较,5A06铝合金比7A04铝合金更容易发生腐蚀,但腐蚀速率比7A04铝合金慢.
5) 通过电化学方法中的电化学阻抗测试可得5A06铝合金和7A04铝合金极化电阻均随腐蚀温度的升高而减小,即R5-20 ℃>R5-30 ℃>R5-40 ℃>R5-60 ℃>R5-80 ℃和R7-20 ℃>R7-30 ℃>R7-40 ℃>R7-60 ℃>R7-80 ℃.同样证明,腐蚀温度越高,试样表面氧化膜破坏程度更大,电化学测试中铝合金表面越容易受到腐蚀.
| [1] |
李念奎. 铝在船舶上的应用[J]. 轻合金加工技术, 1993, 21(8): 1-7. LI Niankui. Application of aluminum in shipbuilding[J]. Light Alloy Fabrication Technology, 1993, 21(8): 1-7. |
| [2] |
董超芳, 安英辉, 李晓刚, 等. 7A04铝合金在海洋大气环境中初期腐蚀的电化学特性[J]. 中国有色金属学报, 2009, 19(2): 346-352. DONG Chaofang, AN Yinghui, LI Xiaogang, et al. Electrochemical performance of initial corrosion of 7A04 aluminium alloy in marine atmosphere[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(2): 346-352. DOI:10.3321/j.issn:1004-0609.2009.02.024 |
| [3] |
王洪仁, 吴建华, 王均涛, 等. 5083铝合金在海水中的腐蚀电化学行为及活性氯影响研究[J]. 电化学, 2003, 9(1): 60-65. WANG Hongren, WU Jianhua, WANG Juntao, et al. Study on the corrosion& electrochemical properties of alloy AA5083 and the effect of active chlorine in seawater[J]. Electrochemistry, 2003, 9(1): 60-65. DOI:10.3969/j.issn.1006-3471.2003.01.011 |
| [4] |
何建平.环境与力学因素协同作用下的航空铝合金性能研究[D].南京: 南京航空航天大学, 2002. HE Jianping. The investigation on the properties of aeronautic aluminum alloys under synergistic action of environmental and mechanical factors[D]. Nanjing: Nanjing University of Aeronautics & Astronautics, 2002. http://cdmd.cnki.com.cn/article/cdmd-10287-2002000666.htm |
| [5] |
AHMAD Z, ABDUL ALEEM B J. Evaluation of corrosion behavior of Al-Mg-Li alloys in seawater[J]. Journal of Materials Engineering and Performance, 1996, 5(2): 235-240. DOI:10.1007/BF02650893 |
| [6] |
BUZZA D W, ALKIRE R C. Growth of corrosion pits on pure aluminum in 1M NaCl[J]. Journal of the Electrochemical Society, 1995, 142(4): 1104-1111. DOI:10.1149/1.2044137 |
| [7] |
MORRIS A W. Corrosion control test method for avionic component[J]. Materials Science Forum, 1981, 78(4): 18-25. |
| [8] |
AGARWALA V S. A Continuous corrosively monitoring device for naval environments[J]. Materials Science Forum, 1980, 56(6): 25-36. |
| [9] |
KETEHAM S J. Accelerated laboratory corrosion test for materials and finishes used in naval aircraft[J]. Materials Science Forum, 1991, 78(2): 23-25. |
| [10] |
HONG H P. Application of the stochastic process to pitting corrosion[J]. Corrosion, 1999, 55(1): 10-16. DOI:10.5006/1.3283958 |
| [11] |
PENG G S, CHEN K H, FANG H C, et al. The Effect of recrystallization on corrosion and electrochemical behavior of 7150Al alloy[J]. Materials and Corrosion, 2011, 62(1). DOI:10.1002/maco.200905490 |
| [12] |
Kim Seong-Jong, Ko Jae-Yong. Electrochemical properties of Al and Al alloys relevant to corrosion protection in seawater environments[J]. Korean Journal of Chemical Engineering, 2006, 23(5): 847-853. DOI:10.1007/BF02705939 |
| [13] |
肖纪美, 曹楚南. 材料腐蚀学原理[M]. 北京: 化学工业出版社, 2008. XIAO Jimei, CAO Chunan. Principles of electrochemistry of corrosion[M]. Beijing: Chemical Industry Press, 2008. |
| [14] |
田继强.钨铝合金在NaCl溶液中的电化学腐蚀行为研究[D].青岛: 中国海洋大学, 2013. TIAN Jiqiang. The electrochemical corrosion behavior of tungsten aluminum (W-Al) alloy in NaCl solution[D]. Qingdao: Ocean University of China, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10423-1013367704.htm |
 2019, Vol. 27
2019, Vol. 27


