CuO是一种间接带隙半导体,其禁带宽度在1.4 ~1.8 eV [1],由于其能带窄且具有良好的光导和光化学性质,在太阳能电池、气体传感器、超级电容器、有机污染物净化等领域具有广泛应用[2-3]。同时,由于铜氧化物兼具多种价态、无毒且廉价的巨大优势,其作为电化学催化剂的研究日益增多[4]。有研究表明,在电化学水分解反应的过程中,CuO中的Cu(Ⅱ)在O2析出过程中会转化为Cu(Ⅲ),是加速-OOH*中间体形成的活性位点,进而影响-OOH*去质子化生成O2[5-6]。借助各类合成手段,得到的CuO微米球、Cu/(Cu(OH)2-CuO)核壳纳米管阵列,均具有较好的电化学催化活性,其中树枝状纳米CuO的起始电位达到290 mV,显示了CuO作为电化学催化剂具有极佳的发展前景[7-9]。
目前,利用水热、溶胶-凝胶、气相氧化、微乳液等手段,已实现了多种形貌的铜基纳米材料的制备与性质调控[10-13]。基于二维层状材料在电化学催化领域的优异表现,CuO的二维层状化成为重要的研究目标。然而,关于稳定的二维层状CuO的制备尚未有相关报道,其合成仍存在挑战。
溶液法可以在深入理解铜基材料生长机理的基础上进行其特定形貌的精准合成[14-16]。例如,利用CuO不同晶面吸附甲酰胺的能力不同,溶液中的Cu2 +离子在溶液中的附着具有各向异性,得到椭圆形CuO单晶[17];结合自组装过程和奥斯瓦尔德熟化过程,得到CuO微米空心球以及高度有序的CuO纳米盘阵列[18-20]。因此,如果在溶液中选择合适的表面活性剂,利用Cu(OH)2中间体的层状特点,有望实现CuO的二维限域生长。
本文选择具有特殊结构的四丁基氢氧化铵作为表面活性剂并为反应提供碱性环境,实现了在室温常压的温和条件下CuO纳米片层的制备,探索了不同合成原料比例下,产物的电化学催化活性,得到了最适宜的投料比。在此基础上,进一步通过煅烧得到晶化更好的CuO纳米粒子,增强了其电化学催化活性。
1 实验 1.1 CuO薄层的制备50 mL烧杯中,称取氯化亚铜(CuCl)0.01,0.02,0.05与0.10 g作为铜源,量取溶质质量分数为10%的10 mL的四丁基氢氧化铵(TBAOH)溶液,混合,常温搅拌6 h,反应液由浅绿变为黑色。反应方程式为
4Cu+ + O2 + 4OH- = 2H2O + 4CuO.
收集产物悬浊液,8000 r/min离心5 min,得到黑色沉淀,在60 ℃的鼓风干燥箱中烘干12 h。本文所讨论的全部产物均是在10 mL TBAOH溶液中得到。
将得到的黑色粉末转移至马弗炉中煅烧退火:室温升至200 ℃,5 ℃/min,煅烧2 h,自然冷却到室温。
1.2 材料的表征本实验样品的表征所使用的仪器及其型号如下:X射线粉末衍射仪(XRD),Rigaku D/MAX2550,Cu Kα(λ = 0.154 178 nm)用来表征样品的晶体结构,测试电压50 kV,测试电流200 mA,角度范围20°~80°,步长0.02°;扫描电子显微镜(SEM),FEI Helios NanoLab 600i,测试电压15 kV;透射电子显微镜(TEM),FEI Tecnai G2 S-Twin F20,测试电压200 kV,用于样品的形貌表征;X射线光电子能谱仪(XPS),Thermo Fisher Scientific ESCALAB 250Xi,Al Kα,用于样品表面的元素价态表征。
电化学测试:上海辰华仪器有限公司CHI-802D。室温三电极测试系统,1 mol/L KOH溶液,样品为工作电极、Ag/AgCl为参比电极、Pt电极为对电极。过程如下:准确量取产物20 mg,超声分散在2 mL去离子水与异丙醇(体积比为1: 1)的混合溶液中,加入40 μL的萘酚溶液,超声混合分散,量取20 μL的悬浊液(少量多次)滴在玻碳电极上,扫描范围-0.8 ~0.8 V,扫描速度0.25 V/s。
2 结果与讨论铜离子在碱性溶液中会首先与氢氧根反应生成Cu(OH)2,这一过程中包括多步无机聚合反应[21],再进一步生成CuO,具体反应步骤如下。
| $ \begin{array}{l} {\rm{C}}{{\rm{u}}^{2{\rm{ }} + }} + 2{\rm{O}}{{\rm{H}}^ - } \to {\rm{Cu}}{\left( {{\rm{OH}}} \right)_2}, \\ {\rm{Cu}}{\left( {{\rm{OH}}} \right)^2} \to {\rm{CuO }} + {\rm{ }}{{\rm{H}}_{\rm{2}}}{\rm{O}}. \end{array} $ |
CuO层状结构的形成机理是以Cu(OH)2为中间体,在溶液中Cu2 +沿[100]方向生长,OH-和Cu2 +的dz2轨道相连,形成二维Cu(OH)2层,层间通过氢键连接,当体系的pH值较高或是反应时间较长时,Cu(OH)2中间体进一步脱水,形成CuO三维晶体[22]。
图 1为不同反应物比例下产物的XRD谱图,底端黑色竖线为CuO标准pdf卡片、从下至上CuCl的投料量依次增大。由图 1可以看到,当CuCl的量为0.01 g时,产物只有CuO(PDF no.44- 0706)的衍射峰出现,说明此时TBAOH形成的碱性环境足以将全部Cu2 +沉淀为CuO;然而,随着CuCl量的增加,TBAOH的量不足,出现Cu(OH)2杂质与CuO产物共存的现象。

|
图 1 不同反应物比例得到的产物XRD谱图 Fig.1 XRD patterns of CuO nanosheets with different CuCl/TBAOH ratios |
图 2为不同反应物比例得到的产物形貌照片,可以清晰地观察到,4种产物均为厚度在纳米级的薄层材料,形貌均一无明显差别。当CuCl的投料量最少时,得到的纳米片层最疏松,随CuCl的投料量增大,得到的CuO片层堆积的逐渐致密。

|
图 2 不同反应物比例得到的产物SEM图 Fig.2 SEM images of CuO nanosheets with different CuCl/TBAOH ratios |
图 3为不同反应物比例得到的产物TEM照片,观察发现,结果与SEM的观察结果一致,4种产物均为二维纳米级薄层材料,厚度均一。同样的,当CuCl的投料量最少时,得到的纳米片层最疏松,随CuCl的投料量增大,得到的CuO片层堆积的逐渐致密。

|
图 3 不同反应物比例得到的产物TEM图 Fig.3 TEM images of CuO nanosheets with different CuCl/TBAOH ratios |
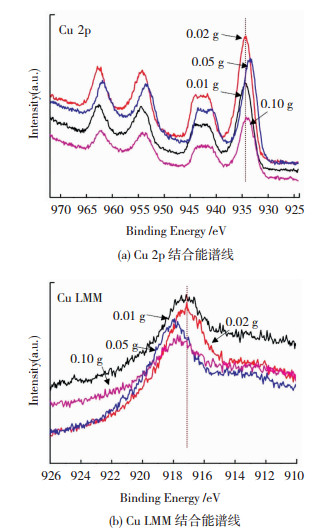
图 4为不同反应物比例得到的产物的XPS谱图。Cu 2p结合能是判断二价铜的主要依据,图 4(a)中由左至右,从高结合能到低结合能的4个特征峰分别为卫星峰1、Cu 2p1/2、卫星峰2与Cu 2p3/2,结合图 4(b)给出的Cu LMM谱图,与图 4(a)结果一致,说明4种产物均含有大量的Cu2+离子。图 4显示随CuCl的投料量增大,Cu 2p3/2的峰位略向高结合能方向移动,而Cu LMM的峰位则略向低结合能方向移动,与Cu 2p3/2的移动方向相反,说明产物中存在少量未与TBAOH反应掉的Cu+离子,可能残留在样品表面。4组Cu 2p3/2与Cu 2p1/2的两峰间距均接近20 eV,卫星峰的峰间距基本接近9 eV,均与典型CuO峰间距近似,说明产物为CuO[23-24]。
|
图 4 不同反应物比例得到的产物XPS谱线 Fig.4 XPS profiles of CuO nanosheets with different CuCl/TBAOH ratios |
对不同投料比得到的产物进行线性扫描伏安(LSV)曲线测试,测试结果如图 5所示,可以看到,CuCl的量为0.01 g时,产物的起始电位最低,这可能是由于0.01 g铜源得到的产物中纳米片层堆积最疏松,比表面积最大,暴露出更多的活性位点。如图 5所示,当CuCl的投料量为0.05 g时,产物的起始电位最高,随后进一步增大CuCl的量,起始电位略有减小,可能是在电化学反应过程中产物表面残留的低价Cu+影响了反应中的电子传导过程。

|
图 5 不同反应物比例得到的产物LSV曲线 Fig.5 LSV curves of CuO nanosheets with different CuCl/TBAOH ratios |
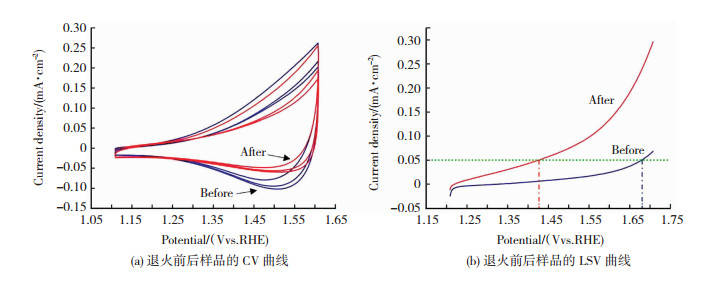
为了提高产物的结晶性,探索结晶性对产物电化学催化性能的影响,将0.01 g CuCl反应后得到的产物在200 ℃下煅烧退火2 h。图 6给出了退火后样品的循环伏安(CV)曲线和线性扫描伏安(LSV)曲线。如图 6(a)所示,煅烧前后,材料电极的氧化还原峰电流变化不大,分别在1.53 V处与1.57 V处(红线),其循环伏安曲线包围的面积明显变小,说明其电容特性变好。另外,如图 6(b)所示,电流密度相同时,煅烧后的起始电位(红线)显著降低,析氧反应更容易发生,析氧反应速率更快,电催化活性更高,以上均说明提高产物的结晶性能够增强电化学催化性能。
|
图 6 煅烧前、后CuO纳米片层的电化学催化活性 Fig.6 CV and LSV curves of CuO nanosheets before and after calcification |
1) 采用TBAOH这一特殊结构的模板剂,温和快速地制备了CuO纳米片层。
2) 探索了不同Cu+/TBAOH投料比对产物价态的影响,发现随着Cu+/TBAOH投料比减小,Cu离子的结合能向低价态移动,低价态有利于CuO的电化学催化活性。
3) 通过煅烧提高产物的结晶性,能够进一步增强其电化学活性。
| [1] |
KOFFYBERG F P, BENKO F A. A photoelectrochemical determination of the position of the conduction and valence band edges of p-type CuO[J]. Journal of Applied Physics, 1982, 53(2): 1173-1177. DOI:10.1063/1.330567 |
| [2] |
MARUYAMA T. Copper oxide thin films prepared by chemical vapor deposition from copper dipivaloylmethanate[J]. Solar Energy Materials and Solar Cells, 1998, 56(1): 85-92. |
| [3] |
GAO X P, BAO J L, PAN G L, et al. Preparation and electrochemical performance of polycrystalline and single crystalline CuO nanorods as anode materials for Li ion battery[J]. The Journal of Physical Chemistry B, 2004, 108(18): 5547-5551. DOI:10.1021/jp037075k |
| [4] |
HUAN T N, ROUSSE G, ZANNA S, et al. A dendritic nanostructured copper oxide electrocatalyst for the oxygen evolution reaction[J]. Angewandte Chemie International Edition, 2017, 56(17): 4792-4796. DOI:10.1002/anie.201700388 |
| [5] |
DENG Y, HANDOKO A D, DU Y, et al. In situ Raman spectroscopy of copper and copper oxide surfaces during electrochemical oxygen evolution reaction: Identification of CuⅢ oxides as catalytically active species[J]. ACS Catalysis, 2016, 6(4): 2473-2481. DOI:10.1021/acscatal.6b00205 |
| [6] |
HANDOKO A D, DENG S, DENG Y, et al. Enhanced activity of H2O2-treated copper(Ⅱ) oxide nanostructures for the electrochemical evolution of oxygen[J]. Catalysis Science & Technology, 2016, 6: 269-274. DOI:10.1039/C5CY00861A |
| [7] |
DU X, HUANG J, DING Y. The mechanism change by switching the reactants from water to hydroxyl ions for electrocatalytic water oxidation: A case study of copper oxide microspheres[J]. Dalton Transactions, 2017, 46(22): 7327-7331. DOI:10.1039/C7DT01230F |
| [8] |
CHENG N, XUE Y, LIU Q, et al. Cu/(Cu(OH)2-CuO) core/shell nanorods array: in-situ growth and application as an efficient 3D oxygen evolution anode[J]. Electrochimica Acta, 2015, 163: 102-106. DOI:10.1016/j.electacta.2015.02.099 |
| [9] |
HUAN T N, ROUSSE G, ZANNA S, et al. A dendritic nanostructured copper oxide electrocatalyst for the oxygen evolution reaction[J]. Angewandte Chemie, 2017, 129(17): 4870-4874. DOI:10.1002/ange.201700388 |
| [10] |
ZHANG X, WANG G, LIU X, et al. Copper dendrites: Synthesis, mechanism discussion, and application in determination of L-tyrosine[J]. Crystal Growth and Design, 2008, 8(4): 1430-1434. |
| [11] |
CAO M H, HU C W, WANG Y H, et al. A controllable synthetic route to Cu, Cu2O, and CuO nanotubes and nanorods[J]. Chemical Communications, 2003, 15: 1884-1885. DOI:10.1039/B304505F |
| [12] |
ARMELAO L, BARRECA D, BERTAPELLE M, et al. A sol-gel approach to nanophasic copper oxide thin films[J]. Thin Solid Films, 2003, 442: 48-52. DOI:10.1016/S0040-6090(03)00940-4 |
| [13] |
ZHANG H, ZHANG X, LI H, et al. Hierarchical growth of Cu2O double tower-tip-like nanostructures in water/oil microemulsion[J]. Crystal Growth Design, 2007, 7(4): 820-824. DOI:10.1021/cg0607351 |
| [14] |
QIU S, DONG J, CHEN G. Preparation of Cu nanoparticles from water-in-oil microemulsions[J]. Journal of Colloid and Interface Science, 1999, 216(2): 230-234. DOI:10.1006/jcis.1999.6296 |
| [15] |
VÁZQUEZ-VÁZQUEZ C, BAÑOBRE-LÓPEZ M, MITRA A, et al. Synthesis of small atomic copper clusters in microemulsions[J]. Langmuir, 2009, 25(14): 8208-8216. DOI:10.1021/la900100w |
| [16] |
HAN D, YANG H, ZHU C, et al. Controlled synthesis of CuO nanoparticles using TritonX-100-based water-in-oil reverse micelles[J]. Powder Technology, 2008, 185(3): 286-290. DOI:10.1016/j.powtec.2007.10.018 |
| [17] |
ZHANG Z, SUN H, SHAO X, et al. Three-dimensionally oriented aggregation of a few hundred nanoparticles into monocrystalline architectures[J]. Advanced Materials, 2005, 17(1): 42-47. |
| [18] |
QIN Y, ZHANG F, CHEN Y, et al. Hierarchically porous CuO hollow spheres fabricated via a one-pot template-free method for high-performance gas sensors[J]. The Journal of Physical Chemistry C, 2012, 116(22): 11994-12000. DOI:10.1021/jp212029n |
| [19] |
GUAN X, LI L, LI G, et al. Hierarchical CuO hollow microspheres: controlled synthesis for enhanced lithium storage performance[J]. Journal of Alloys and Compounds, 2011, 509(7): 3367-3374. DOI:10.1016/j.jallcom.2010.12.067 |
| [20] |
ZOU G, LI H, ZHANG D, et al. Well-aligned arrays of CuO nanoplatelets[J]. The Journal of Physical Chemistry B, 2006, 110(4): 1632-1637. |
| [21] |
LISIECKI I, PILENI M P. Synthesis of copper metallic clusters using reverse micelles as microreactors[J]. Journal of the American Chemical Society, 1993, 115(10): 3887-3896. DOI:10.1021/ja00063a006 |
| [22] |
ZHANG W, WEN X, YANG S. Controlled reactions on a copper surface: synthesis and characterization of nanostructured copper compound films[J]. Inorganic Chemistry, 2003, 42(16): 5005-5014. DOI:10.1021/ic0344214 |
| [23] |
KULKARNI P, MAHAMUNI S, CHANDRACHOOD M, et al. Photoelectron spectroscopic studies on a silicon interface with Bi2Sr2CaCu2BO8+δ high Tc superconductor[J]. Journal of Applied Physics, 1990, 67(7): 3438-3442. DOI:10.1063/1.345330 |
| [24] |
GHIJSEN J, TJENG L H, VAN ELP J, et al. Electronic structure of Cu2O and CuO[J]. Physical Review B, 1988, 38(16): 11322. DOI:10.1103/PhysRevB.38.11322 |
 2020, Vol. 28
2020, Vol. 28


