2. 上海交通大学 材料科学与工程学院,上海 200240;
3. 上海交通大学 氢科学中心,上海 200240
2. School of Materials Science and Engineering, Shanghai Jiao Tong University, Shanghai 200240, China;
3. Center of Hydrogen Science, Shanghai Jiao Tong University, Shanghai 200240, China
氢能的有效开发和应用主要需要解决氢气的绿色制取、高密度储运和高效转化3个科学问题[1-2]。其中,氢气储存,特别是高性能储氢材料的开发是实现氢能实际应用的瓶颈。理想储氢材料应具有高储氢密度、良好的吸放氢特性和循环稳定性[3-4]。针对上述要求,美国能源部提出的研究目标是储氢质量密度突破6wt. %,放氢温度低于150 ℃,且循环寿命超过1 000次。众多轻质高容量储氢材料中,MgH2具有高储氢容量(7.6wt. %的质量储氢密度、110 kg/m3的体积储氢密度)、来源丰富(地球镁含量约2.5wt. %)以及成本低廉等优点,被认为是最具发展前途的储氢材料之一[5-7]。但是,MgH2放氢反应焓变较高(74.7 kJ/mol),放氢温度高(>300 ℃),MgH2/Mg体系吸放氢反应涉及不同气-固反应能垒,包括氢的解离、氢的扩散和成核长大等过程,反应能垒高达218 kJ/mol,因此吸放氢动力学较慢[8]。过高的吸放氢温度和较差的动力学性能严重限制了MgH2/Mg体系在实际中的应用。
目前,国内外众多专家学者在提升MgH2/Mg储氢体系的性能上做出了大量有意义的工作[9-13]。降低吸放氢温度和改善动力学特性的方法主要包括组织纳米晶化,添加催化剂,掺杂常温可吸附氢的金属或碳材料等。其中,催化剂的引入可以改变MgH2/Mg的电子结构,降低镁基材料的稳定性;镁基材料的纳米化,可缩短扩散通道,更有利于氢原子的传输,从而显著改善镁基储氢材料的吸放氢性能。Yu和Liang等[14-18]系统研究了纳米镁基复合过渡金属材料体系的吸放氢性能。研究表明,纳米化和催化可协同改善镁基材料的储氢性能。其中,纳米Mg-Ni-CrCl3复合物,200 ℃时50 s吸氢6.2wt. %,320 ℃、0.1 MPa氢压下800 s可放氢6wt. %以上。近来, 研究者们发现从纳米尺度对镁基储氢材料进行设计,制备纳米MgH2/Mg与催化组分核壳结构更有助于改善材料的综合储氢性能。核壳结构会提供大量的Mg与活性组分的接触界面和活性位点,提升氢的传输速率。同时,核壳结构界面处的原子会存在相互作用,改变原子的电子结构,从而改善材料的热力学和动力学性能。此外,核壳结构可以兼作保护剂,防止纳米镁基储氢材料的氧化。本文针对国内外纳米镁基核壳结构储氢体系研究现状,对其最新研究和进展进行了总结论述,重点总结了核壳结构镁基储氢材料制备技术及储氢性能,并指出其今后研究的重点和方向。
1 核壳纳米镁基储氢材料制备方法 1.1 高能球磨法高能球磨法是目前制备核壳纳米镁基储氢材料最常用的方法之一[19-20]。该技术通过机械力的作用在MgH2/Mg表面包覆金属或碳材料。高能球磨法操作简单,同时球磨可引入位错、层错等缺陷位点,加快氢的扩散和传输。并且,高能球磨法合成的核壳结构会形成更多的活性相/界面,从而显著提升镁基储氢材料的吸放氢动力学性能。但是,由高能球磨法制备的纳米镁基核壳结构材料厚度、粒度不均匀,吸放氢温度宽,不利于吸放氢性能调控,阻碍了其实际应用。
1.2 等离子体法等离子体法是利用镁的低熔点与过渡金属及其化合物形成核壳结构纳米镁基储氢材料的制备手段[21-23]。当电弧将金属气化时,镁的低熔点会导致其先成核,而其他具有高熔点的过渡金属及其化合物会形成壳层,厚度通常为几纳米到20纳米之间。等离子体法适用于将镁基材料与不同金属基化合物形成核壳结构,且操作可控性强,便于规模化生产。但是,等离子法制备的镁基材料粒径仍较大(1~20 μm),需对技术方案和参数作进一步优化,调控镁基材料粒径。
1.3 化学镀法化学镀法是直接利用Mg的强还原性,将电负性较高的过渡金属从金属盐中还原出来,原位包覆在Mg基储氢材料表面,从而形成核壳结构[24-26]。该方法原位生成Mg与过渡金属的核壳结构,更利于Mg与过渡金属相互作用,形成不稳定界面便于氢扩散,但由于产生了副产物,后处理较繁琐。
1.4 纳米限域法纳米限域法是通过将镁盐限域到多孔支撑模板材料中,再将其进行氢化,得到氢化镁为核,模板材料为壳的核壳结构材料[27-28]。利用模板材料的孔结构,可有效调控材料的尺寸,实现材料尺寸的纳米化。支撑材料主要包括碳材料、金属框架材料和高分子材料等。限域法制备的MgH2颗粒尺寸较小,通常为1~5 nm。但限域法在较高的氢气压(>3.5 MPa H2)和较高的温度(>150 ℃)下才能进行反应,因此成本较高且条件苛刻。目前纳米化Mg基材料的合成方法并不适用于实际生产,还需要进一步的探究。
表 1对比了不同制备方法得到的核壳结构纳米镁基储氢材料的储氢量、放氢焓、活化能和经济性, 可以发现,等离子体法操作简单,可控性强,是目前最适宜的制备纳米镁基储氢材料产业化方法。但等离子体法制备的Mg颗粒粒径较大且不均匀,尚需优化工艺参数进一步改善储氢性能。
| 表 1 核壳纳米镁基储氢材料制备方法对比 Table 1 Comparison of synthesis approaches for core-shell nanostructured Mg-based hydrogen storage materials |
过渡金属因其独特的空d/f电子结构会与H相互作用,降低H2的分解能垒和Mg—H键的稳定性。因此,众多研究者以过渡金属(TM)为壳层制备了核壳结构Mg@过渡金属,并系统探究其储氢性能及吸放氢反应机理。
Cui等[24]通过高能球磨联合化学镀技术将Mg与TMClx(TM: Ti, Nb, V, Co, Mo和Ni)反应生成了以Mg为核、TM为壳的复合材料。透射电镜分析显示TM壳的厚度低于10 nm。核壳结构Mg-TM材料的储氢性能明显优于传统球磨制备的Mg和催化剂复合材料,这主要是由于核心颗粒表面的Mg可与壳层的过渡金属充分接触,加快H的扩散和传输速率。Mg-TM(TM: Ti, Nb, V, Co, Mo和Ni)材料的储氢性能测试表明放氢快慢顺序如下:Mg-Ti, Mg-Nb,Mg-Ni,Mg-V,Mg-Co和Mg-Mo。其中,Mg-Ti样品在275 ℃下5 min可吸收5.5wt. %的氢气,在相同温度下10 min可放出6.35wt. %氢气。研究表明电负性越低的金属对镁基储氢材料的催化活性越高。Mg-TM材料的储氢机理示意图和DSC放氢曲线如图 1所示。
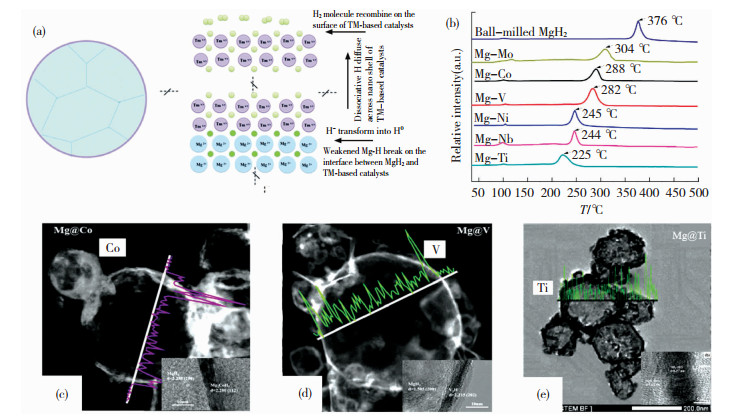
|
图 1 图 1 Mg-TM(TM: Ti, Nb, V, Co, Mo or Ni)材料[24]的(a)核壳结构储氢机理示意图;(b)DSC曲线;(c)Mg@Co[29], (d)Mg@V[29]和(e)Mg@Ti[26]的TEM图和EDS线分析图 Fig.1 (a) Hydrogen storage mechanism and (b) DSC curves of core-shell structure of Mg-TM (TM: Ti, Nb, V, Co, Mo or Ni) materials[24]; TEM and EDS of (c) Mg@Co[29], (d) Mg@V[29], and (e) Mg@Ti[26] |
Zou等[25-26,29]也通过等离子体法联合化学镀法制备Mg与过渡金属制备核壳结构的Mg@TM (TM = Ni、Co、V和Ti)。HRTEM和EDS联合表征到Mg的表面会形成TM壳层,如图 1(c)~(e)所示。在Mg@TM中,Mg@Ni具有最快吸氢速率,在250 ℃下5 min可吸收4.4wt. %的氢气。由XRD分析Mg@TM吸放氢机理如下。
| $ {\rm{Mg}} + {\rm{Ni}} + {{\rm{H}}_2} \to {\rm{M}}{{\rm{g}}_2}{\rm{Ni}} + {{\rm{H}}_2} \to {\rm{M}}{{\rm{g}}_2}{\rm{Ni}}{{\rm{H}}_4} \to {\rm{M}}{{\rm{g}}_2}{\rm{Ni}} + {{\rm{H}}_{\rm{2}}}, $ | (1) |
| $ \begin{array}{l} 3{\rm{Mg}} + {\rm{Co}} + 7/{\rm{2}}{{\rm{H}}_2} \to {\rm{Mg}}{{\rm{H}}_2} + {\rm{M}}{{\rm{g}}_2}{\rm{Co}}{{\rm{H}}_5} \to {\rm{Mg}} + \\ {\rm{M}}{{\rm{g}}_{\rm{2}}}{\rm{Co}} + 7/2{{\rm{H}}_2}, \end{array} $ | (2) |
| $ {\rm{Mg}} + 2{\rm{V}} + 3/2{{\rm{H}}_2} \to {\rm{Mg}}{{\rm{H}}_2} + {{\rm{V}}_2}{\rm{H}} \to {\rm{Mg}} + 2{\rm{V}} + 3/2{{\rm{H}}_2}, $ | (3) |
| $ {\rm{Ti}} + {{\rm{H}}_2} \to {\rm{Ti}}{{\rm{H}}_2}. $ | (4) |
此外,Lu等[26,29]尝试利用过渡金属与Mg六方颗粒形成核壳结构的三元复合体系(Mg@Co@V和Mg@Ti@Ni),研究表明三元镁基储氢材料相较于二元储氢材料具有较低的吸氢反应焓变和活化能,但由于催化剂的添加量过高,会降低材料的总体储氢量。
贵金属对镁基储氢材料也显示出较高的催化活性。Lu等[21]利用等离子体联合固相法制备了核壳结构Mg@Pt材料。利用高分辨透射电镜原位探究其放氢过程中的结构变化,结果表明在放氢过程中Mg3Pt会变为Pt。理论计算研究表明, H存在Mg3Pt晶格间隙时形成能降低,可稳定Mg3Pt相,其作为“氢泵”加快Mg/MgH2的吸放氢速率。Mg3Pt的晶体结构和缺陷形成势垒如图 2所示。
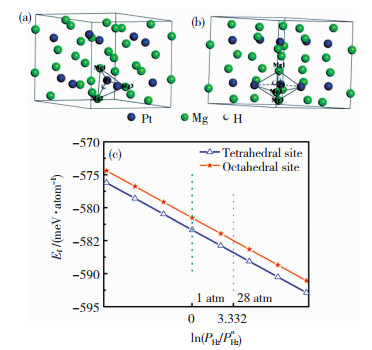
|
图 2 H在Mg3Pt的(a)四面体间隙,(b)八面体间隙的晶体结构和(c)H在不同间隙位置处Mg3Pt的形成能[21] Fig.2 H atom in (a) tetrahedral sites and (b) octahedral sites of Mg3Pt; (c) defect formation energy of Mg3Pt with H atom at different sites[21] |
Zou等首先利用等离子体法制备了尺寸为50~600 nm的纳米单晶六方Mg颗粒,并利用原位钝化技术使其表面包裹一层10~20 nm的MgO壳,保护内部Mg不受氧化[22]。该材料在350和400 ℃的吸氢平台压分别为0.505和1.36 MPa H2,放氢平台压分别为0.368和1.04 MPa H2。经过van′t Hoff方程和Johnson-Mehl-Avrami模型拟合可以得到核壳结构Mg-MgO的吸氢的焓变和活化能分别为-73.2 kJ/mol H2和55.9 kJ/mol H2。
为了提高纳米Mg的吸放氢热力学和动力学性能,Zou等采用稀土金属氧化物作为保护剂和催化剂,制备了一系列纳米核壳结构Mg@ER2O3(ER2O3 = Ce2O3、La2O3、Er2O3、Gd2O3、Nd2O3)[22,30-31]。ER2O3的厚度大约为几纳米到20纳米之间。在Mg@ER2O3复合材料中,Mg@La2O3具有最佳的储氢性能,其储氢量为6.635wt. %,且在250 ℃下15 min内即可吸收4.81wt. %的氢气,吸氢活化能降低到41.98 kJ/mol H2。Mg@La2O3在200 ℃下2 h内的吸氢总量为5.98wt. %,而纯Mg颗粒在相同条件下仅吸收1.8wt. %的氢气,Mg@La2O3的TEM图、SAED图和PCI图如图 3(a)~(c)所示。分析表明, 稀土金属氧化物可作为H扩散通道,从而显著提升Mg颗粒的吸放氢动力学性能。
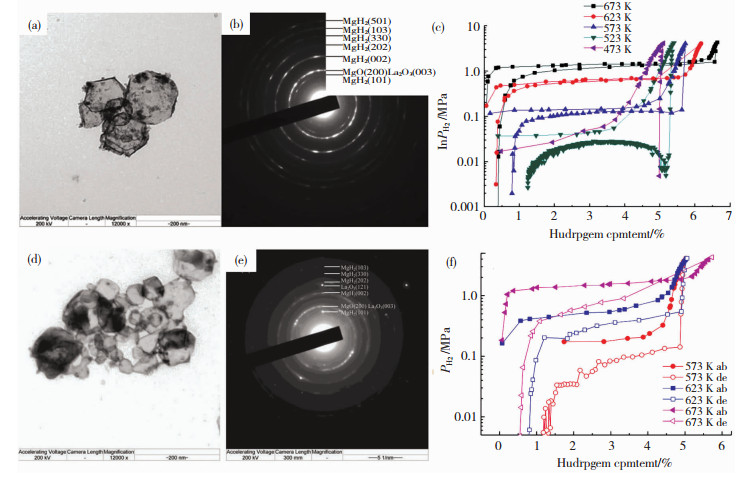
|
图 3 不同材料(a)~(c)Mg@La2O3[22]和(d)~(f)Mg@Ti@La的TEM图、SAED图和PCI图[32] Fig.3 TEM, SAED, and PCI of different materials: (a)~(c) Mg@La2O3[22]; (d)~(f) Mg@Ti@La[32] |
Zou等也尝试构建了三元核壳镁基复合金属氧化物纳米材料。基于稀土金属La具有最优的催化效果,利用过渡金属合成了Mg-TM-La(TM = Ti, Fe, Ni)三元体系[32]。实验结果表明, Mg-TM-La体系的储氢性能优于二元Mg-TM或Mg-La体系。其中,Mg-Ti-La复合材料的的TEM图、SAED图和PCI图如图 3(d)~(f)所示,该体系的吸氢反应焓变可降低到-68.7 kJ/mol H2。XRD分析结果显示, Mg-Ti-La复合材料在吸放氢后均无Ti的相关物相出现,说明Ti进入了Mg的晶格,从而影响了MgH2/Mg的稳定性,降低了吸放氢反应焓变。而Mg-Ni-La复合材料具有最优的吸氢动力学性能,其在200 ℃下50 s内可吸收3.8wt. %的氢气,且在超低吸氢温度(30 ℃)也可吸收1.5wt. %的氢气。XRD分析结果显示, Mg-Ni-La复合材料吸氢后出现了Mg2NiH4,因此加快了其动力学性能。
2.3 Mg@碳与Mg基材料形成核壳结构的除金属材料及氧化物外,密度更低、质量更轻、价格更低的碳材料也引起了人们的广泛关注。如,Jeon等[27]利用可通过氢气、阻绝氧气和水分子的PMMA,对Mg进行纳米限域制备了Mg-PMMA核壳结构复合材料,研究了该材料的吸放氢性能。该材料的合成过程和储氢性能如图 4(a)~(c)所示。微观结构分析表明Mg颗粒的平均直径为5 nm。该材料在200 ℃下可实现可逆循环,且具有较快的吸氢反应速率,在30 min内可吸收4wt. %的氢气。同时,PMMA可以有效阻止Mg/MgH2的氧化和团聚,保持该储氢材料的性能稳定性。Jia等[28]利用经过特殊处理的CMK3通过氢化二丁基镁来制备得到MgH2@CMK3核壳结构的镁基复合材料。利用CMK3的多孔结构,MgH2的颗粒尺寸降低到1~2 nm,吸氢反应焓变降低到-55.4 kJ/mol H2,但MgH2的负载率仅为37.5%,储氢量较低。
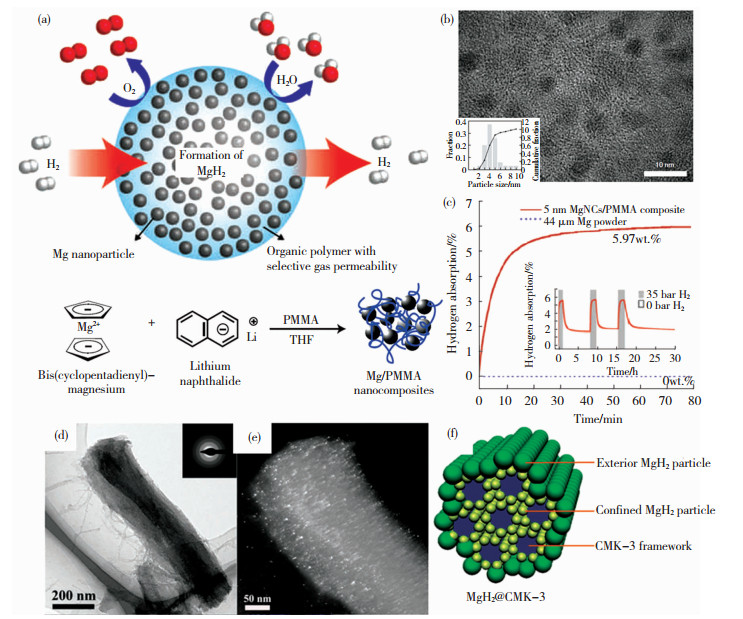
|
图 4 核壳结构Mg-PMMA的(a)合成示意图,(b)TEM图和(c)储氢性能[27];MgH2@CMK3的TEM(d)明场像、(e)暗场像和(f)结构示意图[28] Fig.4 (a) Schematic diagram of synthesis process, (b) TEM image, and (c) hydrogen storage performance of core-shell structured Mg-PMMA[27]; (d) TEM bright field image, (e) TEM dark field image, and (f) schematic structure of MgH2@CMK3[28] |
Liu等[19]研究发现在镁基与金属复合材料中加入碳材料有利于形成以MgH2为核心的核壳结构。该研究团队将Co/Pd均匀负载在“竹节状”碳纳米管(Co/Pd@B-CNTs)。研究发现碳纳米管在高能球磨下会破碎覆盖在MgH2颗粒表面形成薄碳层,如图 5所示。
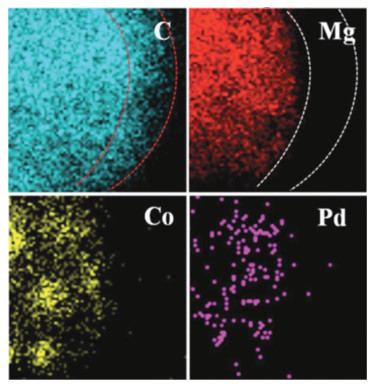
|
图 5 MgH2-Co/Pd@B-CNTs复合材料的元素分布图[19] Fig.5 Element distribution of MgH2-Co/Pd@B-CNTs composite material[19] |
研究表明, 碳壳会抑制颗粒的团聚,从而提升材料的动力学性能。MgH2-Co/Pd@B-CNTs复合材料在250 ℃下10 s内可吸收6.68wt. %的氢气,且在低温下也具有很快的吸氢速率。Lotoskyy等[20]的研究也发现通过高能球磨法在Mg-Ti体系中添加石墨后,石墨均匀的覆盖到MgH2表面。添加石墨的镁基储氢材料具有较优的稳定性,甚至在100周后吸放氢速率和储氢量依然没有衰减。Zhang等[33]通过球磨的方式在Mg颗粒中加入Ni负载石墨烯。研究表明,石墨烯可以作为促进剂使Ni颗粒更均匀的分布在Mg的表面,从而提升体系的储氢性能。Mg@Ni8Gn2在100 ℃下100 s内即可吸收6.28wt. %的氢气,在250 ℃下30 min内释放5.73wt. %氢气,且活化能可降低到71.8 kJ/mol H2。该团队进一步通过气相沉积法制备MgO@Mg2NiH4@石墨烯镁基储氢材料,可将放氢活化能降低31.2 kJ/mol H2[34]。而Xia等[35]将尺寸约为5.4 nm的MgH2颗粒纳米限域于Ni/石墨烯(Ni/G)。该材料的总储氢量为5.6wt. %,并可在200 ℃下循环100周,具备优越的可逆循环性。该材料在150 ℃下10 min内即可吸收5.4wt. %氢气,焓变降低到62.1 kJ/mol H2。
Chen等[36]通过气相沉积法构建了以碳材料为壳的平均尺寸为32 nm的Mg-V-C储氢体系。该材料的碳壳厚度为1 nm,因此,该材料的储氢量较高,可保持5.2wt. %的储氢量。并且,在镁基储氢材料吸放氢过程中,会出现VH2/V2H相转变,显著提升材料的吸放氢动力学性能,吸放氢的活化能分别降低到41和67 kJ/mol H2。Mg-V-C储氢体系吸放氢反应机理如式(5)~(7)和图 6所示。
吸氢过程中:
| $ {\rm{Mg}} + {\rm{V}} + {{\rm{H}}_2} \to {\rm{Mg}}{{\rm{H}}_2} + {\rm{V}}{{\rm{H}}_2}\left(低于 {353{\rm{K}}} \right), $ | (5) |
| $ {\rm{Mg}} + 4{\rm{V}} + 2{{\rm{H}}_2} \to {\rm{Mg}}{{\rm{H}}_2} + 2{{\rm{V}}_2}{\rm{H }}\left( {353{\rm{K}} - 673{\rm{K}}} \right). $ | (6) |
放氢过程中:
| $ {\rm{Mg}}{{\rm{H}}_2} + 2{{\rm{V}}_2}{\rm{H}} \to {\rm{Mg}} + {\rm{V}} + {{\rm{H}}_2}\left( {673{\rm{K}}} \right). $ | (7) |

|
图 6 Mg-V-C储氢体系的吸/放氢过程示意图[36] Fig.6 (a) Schematic diagram of hydrogen absorption process at 80 ℃ and (b) hydrogen absorption and desorption process at 400 ℃ for Mg-V-C hydrogen storage materials[36] |
Mao等利用等离子法制备了核壳结构的Mg-MFx(M = Ni、V、La和Ce),并对复合材料的粒径分布、相组成、微观结构和氢吸附性能进行了研究[37]。粒径分析表明, 金属基氟化物MFx的添加可以显著降低Mg颗粒的尺寸,将其从1~20 μm降低到100~200 nm,明显利于提升Mg基材料的动力学性能。PCT测试结果显示,等离子法加入MFx可以改善镁的储氢性能。其中Mg-NiF2复合材料在相对较低的温度下表现出最佳的吸氢动力学性能。在100 ℃下2 h内的总吸氢量可达到3.26wt. %。HRTEM和XRD分析结构表明, 吸氢速率的明显改善主要是由于在制备过程中会原位形成Mg2Ni和MgF2。而Mg-VF3具有最低的放氢温度,微观结构分析这主要是由于VO2会在Mg颗粒表面生成,从而抑制了颗粒的团聚,使放氢温度降低。
表 2综合对比了核壳结构储氢材料的吸放氢性能,可以看出,纳米Mg@Ni/石墨烯复合储氢体系具有最优的性能。这主要是由于纳米Ni负载在石墨烯时,有利于活性相Mg2Ni的弥散生成,对Mg的吸放氢动力学性能起到了显著的催化作用,在100 ℃的较低温度下100 s内即可吸收6.28wt. %的氢气[33]。而Xia等[35]通过纳米限域法制备的MgH2@Ni/石墨烯材料吸/放氢活化能分别降低到22.7和64.7 kJ/mol H2,储氢综合性能得到极大的改善。
| 表 2 核壳结构镁基储氢材料的吸放氢性能[19-29,31-37] Table 2 Hydrogen absorption and desorption properties of core-shell structured Mg-based hydrogen storage materials[19-29,31-37] |
MgH2/Mg体系凭借其高储氢量、丰富储量及价格较低成为目前最具发展潜力的储氢材料之一。但是,MgH2/Mg体系高吸放氢温度、慢吸放氢速率会影响其实际应用。近年来,核壳结构镁基储氢材料的发展为提升镁基吸放氢热力学和动力学性能提供了新的解决途径。
核壳结构纳米镁基储氢材料的制备方法主要包括高能球磨法、等离子体法、化学镀法和纳米限域法。其中,高能球磨法、等离子体法为物理手段,化学镀法和纳米限域法为化学法。这些方法可从纳米尺度进行设计,来调控纳米镁基储氢材料的核壳结构,从而显著降低吸放氢温度,提升动力学性能。特别是等离子体法操作简单,可控性强,是目前最适宜产业化的核壳结构镁基储氢材料。但等离子体法和化学镀法制备的Mg颗粒粒径较大且不均匀,纳米限域法所需模板材料较多,降低体系的总储氢量。因此,针对核壳结构纳米镁基储氢材料的不同制备方法,寻找最优工艺参数及技术参数以改善整体的热力学动力学性能及循环稳定性,并在各个制备方法中进行平衡联合,是优化提升镁基储氢体系的整体性能值得研究的课题方向。
核壳结构纳米镁基储氢材料主要为Mg/MgH2表面包裹过渡金属、金属化合物或碳材料组成。这些材料兼做保护剂和催化剂,显著提升镁基储氢材料的性能。尤其是金属@碳复合材料能显著提升镁基储氢材料的热/动力学性能和循环稳定性,更适用于实际应用。针对核壳结构镁基储氢材料体系,研发新型多功能纳米材料,调控Mg/MgH2尺寸及壳层厚度,将纳米镁基材料的尺寸效应及壳层材料的催化效应有机高效结合起来,高效提升其热力学动力学性能,是该领域未来的研究方向。
| [1] |
SCHLAPBACH L, ZUTTEL A. Hydrogen-storage materials for mobile applications[J]. Nature, 2001, 414: 353-358. DOI:10.1038/35104634 |
| [2] |
SCHNEEMANN A, WHITE J L, KANG S, et al. Nanostructured metal hydrides for hydrogen storage[J]. Chemical Reviews, 2018, 118: 10775-10839. DOI:10.1021/acs.chemrev.8b00313 |
| [3] |
BARDHAN R, RUMINSKI A M, BRAND A, et al. Magnesium nanocrystal-polymer composites: A new platform for designer hydrogen storage materials[J]. Energy & Environmental Science, 2011, 4: 4882-4895. DOI:10.1039/C1EE02258J |
| [4] |
KENDALL K. Hydrogen and fuel cells in city transport[J]. International Journal of Energy Research, 2016, 40: 30-35. DOI:10.1002/er.3290 |
| [5] |
ZHANG Q, HUANG Y, MA T, et al. Facile synthesis of small MgH2 nanoparticles confined in different carbon materials for hydrogen storage[J]. Journal of Alloys and Compounds, 2020, 825: 153953. DOI:10.1016/j.jallcom.2020.153953 |
| [6] |
ZHANG M, XIAO X, WANG X, et al. Excellent catalysis of TiO2 nanosheets with high-surface-energy {001} facets on the hydrogen storage properties of MgH2[J]. Nanoscale, 2019, 11(15): 7465-7473. DOI:10.1039/C8NR10275A |
| [7] |
ZHANG L, CAI Z, YAO Z, et al. A striking catalytic effect of facile synthesized ZrMn2 nanoparticles on the de/rehydrogenation properties of MgH2[J]. Journal of Materials Chemistry A, 2019, 7(10): 5626-5634. DOI:10.1039/C9TA00120D |
| [8] |
POZZO M, ALFE D. Hydrogen dissociation on the Mg (0001) surface from quantum Monte Carlo calculations[J]. Physics, 2008, 78: 245313. DOI:10.1103/physrevb.78.245313 |
| [9] |
ZHOU C, BOWMAN R C, FANG Z Z, et al. Amorphous TiCu-based additives for improving hydrogen storage properties of magnesium hydride[J]. ACS Applied Materials and Interface, 2019, 11(42): 38868-38879. DOI:10.1021/acsami.9b16076 |
| [10] |
LIU M, ZHAO S, XIAO X, et al. Novel 1D carbon nanotubes uniformly wrapped nanoscale MgH2 for efficient hydrogen storage cycling performances with extreme high gravimetric and volumetric capacities[J]. Nano Energy, 2019, 61: 540-549. DOI:10.1016/j.nanoen.2019.04.094 |
| [11] |
CHEN H, LIU P, LI J, et al. MgH2/CuxO hydrogen storage composite with defect-rich surfaces for carbon dioxide hydrogenation[J]. ACS Applied Materials and Interface, 2019, 11(34): 31009-31017. DOI:10.1021/acsami.9b11285 |
| [12] |
LAN Z, SUN Z, DING Y, et al. Catalytic action of Y2O3@graphene nanocomposites on the hydrogen-storage properties of Mg-Al alloys[J]. Journal of Materials Chemistry A, 2017, 5(29): 15200-15207. DOI:10.1039/C7TA03879H |
| [13] |
SHINDE S S, KIM D H, YU J Y, et al. Self-assembled air-stable magnesium hydride embedded in 3-D activated carbon for reversible hydrogen storage[J]. Nanoscale, 2017, 9(21): 7094-7103. DOI:10.1039/C7NR01699A |
| [14] |
YU Z X, LIU Z Y, WANG E. Hydrogen storage properties of nanocomposite Mg-Ni-Cu-CrCl3 prepared by mechanical alloying[J]. Materials Science and Engineering A, 2002, 335(1): 43-48. DOI:10.1016/S0921-5093(01)01902-5 |
| [15] |
YU Z X, LIU Z Y, WANG E. Hydrogen storage properties of the Mg-Ni-CrCl3 nanocomposite[J]. Journal of Alloys and Compounds, 2002, 333(1): 207-214. DOI:10.1016/s0925-8388(01)01723-6 |
| [16] |
LIANG G, HUOT J, BOILY S, et al. Hydrogen storage properties of the mechanically milled MgH2-V nanocomposite[J]. Journal of Alloys and Compounds, 1999, 291(1): 295-299. DOI:10.1016/s0925-8388(99)00268-6 |
| [17] |
LIANG G, HUOT J, BOILY S, et al. Hydrogen storage in mechanically milled Mg-LaNi5 and MgH2-LaNi5 composites[J]. Journal of Alloys and Compounds, 2000, 297(1): 261-265. DOI:10.1016/S0925-8388(99)00592-7 |
| [18] |
LIANG G, HUOT J, BOILY S, et al. Hydrogen storage properties of nanocrystalline Mg1.9Ti0.1Ni made by mechanical alloying[J]. Journal of Alloys and Compounds, 1999, 282(1): 286-290. DOI:10.1016/S0925-8388(98)00853-6 |
| [19] |
LIU M, XIAO X, ZHAO S, et al. Facile synthesis of Co/Pd supported by few-walled carbon nanotubes as an efficient bidirectional catalyst for improving the low temperature hydrogen storage properties of magnesium hydride[J]. Journal of Materials Chemistry A, 2019, 7(10): 5277-5287. DOI:10.1039/C8TA12431K |
| [20] |
LOTOSKYY M, DENYS R, YARTYS V A, et al. An outstanding effect of graphite in nano-MgH2-TiH2 on hydrogen storage performance[J]. Journal of Materials Chemistry A, 2018, 6(23): 10740-10754. DOI:10.1039/C8TA02969E |
| [21] |
LU C, MA Y, LI F, et al. Visualization of fast "hydrogen pump" in core-shell nanostructured Mg@Pt through hydrogen-stabilized Mg3Pt[J]. Journal of Materials Chemistry A, 2019, 7: 14629-14637. DOI:10.1039/C9TA03038G |
| [22] |
ZOU J, ZENG X, YING Y, et al. Preparation and hydrogen sorption properties of a nano-structured Mg based Mg-La-O composite[J]. International Journal of Hydrogen Energy, 2012, 37(17): 13067-13073. DOI:10.1016/j.ijhydene.2012.04.136 |
| [23] |
ZOU J X, PÉREZ-BROKATE C F, ARRUFFAT R, et al. Nanostructured bulk Mg+MgO composite synthesized through arc plasma evaporation and high pressure torsion for H-storage application[J]. Materials Science and Engineering B, 2014, 183: 1-5. DOI:10.1016/j.mseb.2013.11.025 |
| [24] |
CUI J, LIU J W, WANG H, et al. Mg-TM (TM: Ti, Nb, V, Co, Mo or Ni) core-shell like nanostructures: synthesis, hydrogen storage performance and catalytic mechanism[J]. Journal of Materials Chemistry A, 2014, 2(25): 9645-9655. DOI:10.1039/c4ta00221k |
| [25] |
ZOU J, LONG S, CHEN X, et al. Preparation and hydrogen sorption properties of a Ni decorated Mg based Mg@Ni nano-composite[J]. International Journal of Hydrogen Energy, 2015, 40(4): 1820-1828. DOI:10.1016/j.ijhydene.2014.11.113 |
| [26] |
LU C, ZOU J, SHI X, et al. Synthesis and hydrogen storage properties of core-shell structured binary Mg@Ti and ternary Mg@Ti@Ni composites[J]. International Journal of Hydrogen Energy, 2017, 42(4): 2239-2247. DOI:10.1016/j.ijhydene.2016.10.088 |
| [27] |
JEON K J, MOON H R, RUMINSKI A M, et al. Air-stable magnesium nanocomposites provide rapid and high-capacity hydrogen storage without using heavy-metal catalysts[J]. Nature Materials, 2011, 10(4): 286-290. DOI:10.1038/nmat2978 |
| [28] |
JIA Y, SUN C, CHENG L, et al. Destabilization of Mg-H bonding through nano-interfacial confinement by unsaturated carbon for hydrogen desorption from MgH2[J]. Physical Chemistry Chemical Physics, 2013, 15(16): 5814-5820. DOI:10.1039/c3cp50515d |
| [29] |
LU C, ZOU J, ZENG X, et al. Hydrogen storage properties of core-shell structured Mg@TM (TM = Co, V) composites[J]. International Journal of Hydrogen Energy, 2017, 42(22): 15246-15255. DOI:10.1016/j.ijhydene.2017.04.063 |
| [30] |
LONG S, ZOU J, LIU Y, et al. Hydrogen storage properties of a Mg-Ce oxide nano-composite prepared through arc plasma method[J]. Journal of Alloys and Compounds, 2013, 580: S167-S170. DOI:10.1016/j.jallcom.2013.02.063 |
| [31] |
ZOU J, ZENG X, YING Y, et al. Study on the hydrogen storage properties of core-shell structured Mg-RE (RE = Nd, Gd, Er) nano-composites synthesized through arc plasma method[J]. International Journal of Hydrogen Energy, 2013, 38(5): 2337-2346. DOI:10.1016/j.ijhydene.2012.11.145 |
| [32] |
ZOU J, GUO H, ZENG X, et al. Hydrogen storage properties of Mg-TM-La (TM = Ti, Fe, Ni) ternary composite powders prepared through arc plasma method[J]. International Journal of Hydrogen Energy, 2013, 38(21): 8852-8862. DOI:10.1016/j.ijhydene.2013.05.007 |
| [33] |
ZHANG J, ZHU Y, ZANG X, et al. Nickel-decorated graphene nanoplates for enhanced H2 sorption properties of magnesium hydride at moderate temperatures[J]. Journal of Materials Chemistry A, 2016, 4(7): 2560-2570. DOI:10.1039/C5TA09848C |
| [34] |
ZHANG J, ZHU Y, LIN H, et al. Metal hydride nanoparticles with ultrahigh structural stability and hydrogen storage activity derived from microencapsulated nanoconfinement[J]. Advanced Materials, 2017, 29(24): 1700760. DOI:10.1002/adma.201700760 |
| [35] |
XIA G, TAN Y, CHEN X, et al. Monodisperse magnesium hydride nanoparticles uniformly self-assembled on graphene[J]. Advanced Materials, 2015, 27(39): 5981-5988. DOI:10.1002/adma.201502005 |
| [36] |
CHEN M, HU M, XIE X, et al. High loading nanoconfinement of V-decorated Mg with 1 nm carbon shells: hydrogen storage properties and catalytic mechanism[J]. Nanoscale, 2019, 11(20): 10045-10055. DOI:10.1039/C8NR09909J |
| [37] |
MAO J, ZOU J, LU C, et al. Hydrogen storage and hydrolysis properties of core-shell structured Mg-MFx (M = V, Ni, La and Ce) nano-composites prepared by arc plasma method[J]. Journal of Power Sources, 2017, 366: 131-142. DOI:10.1016/j.jpowsour.2017.09.015 |
 2020, Vol. 28
2020, Vol. 28


