2. 纤维材料改性国家重点实验室(东华大学), 上海 201620
2. State Key Laboratory for Modification of Chemical Fibers and Polymer Materials (Donghua University), Shanghai 201620, China
龋齿是人类口腔中最常见的慢性疾病之一,主要源于日常饮食摄入的细菌性发酵物质产生的酸性副产物对牙齿硬组织的腐蚀,其病理形成过程复杂且漫长[1]。全球疾病负担报告表明,全球每年因永久性龋齿引发急性后遗症的发病率超过2亿例[2], 受其影响的人数超过世界人口的10%[3]。若龋病进一步发展产生龋洞会引起病患极大的疼痛和不适,若扩散至牙髓,还会引起感染,并诱发败血症和牙齿脱落[4], 严重影响患者的生活质量。充填修复法是临床治疗龋病最常用和最有效的方法,主要是通过使用修复材料对龋坏组织进行充填、固化和抛光等操作,最终达到对牙齿缺损部位的修复。银汞合金作为早期使用的龋洞充填材料距今已有150多年的历史[5], 该材料耐磨且价格便宜,但因其美观性欠佳以及金属汞对人体产生危害等缺点逐渐被淘汰[6]。自20世纪60年代起,复合树脂凭借优异的美观性和生物相容性等优点,逐渐取代银汞合金,成为牙体缺损治疗的重要材料[7]。然而,继发龋是导致复合树脂修复失败的主要原因之一[8], 抑制继发龋的发生对阻止龋病发展和延长修复体寿命具有重要意义。
近年的大量研究表明,复合树脂与牙体组织边缘存在的缝隙中易积存食物残渣,从而滋生细菌,进而产生继发龋。因此,使用抗菌型复合树脂进行龋病治疗可在一定程度上降低继发龋的发生,并延长复合树脂的使用寿命。目前,主要通过添加具有抗菌功能的无机填料或者有机单体以制备抗菌牙科复合树脂[9]。本文重点聚焦于近年报道的抗菌型无机粒子以及具有抗菌性能的有机单体在牙科复合树脂中的应用。基于对牙科复合树脂表面细菌生物膜形成机理的阐释,本文比较了不同抗菌剂的抗菌机理及优缺点,并针对各自存在的缺陷综述了国内外科研工作者提出的解决方案和最新研究进展,最后总结了抗菌牙科复合树脂的研究现状,并对未来牙科复合树脂用抗菌剂的发展方向进行了展望。
1 牙科复合树脂 1.1 复合树脂的组成牙科复合树脂主要由有机基质和无机填料构成,经外界刺激(光、热等) 作用下交联形成网络结构。其中,有机基质包括有机单体和引发剂等,其含量大约占复合树脂的20 wt.%~80 wt.%, 主要作用是粘附复合树脂的各组成部分,并在引发剂作用下赋予树脂可塑性和固化成型性[10]。常用的有机单体主要为丙烯酸酯类,如双酚A甲基丙烯酸缩水甘油酯(Bisphenol A diglycidylether methacrylate, Bis-GMA)、氨基甲酸酯双甲基丙烯酸缩水甘油酯(Urethane dimethacrylate, UDMA)和双甲基丙烯酸三乙二醇酯(Tetra-ethyleneglycol dimethacrylate, TEGDMA), 其结构式如图 1所示。此外,无机填料作为分散相和增强相主要影响复合树脂的力学性能,包括弯曲强度[11]、杨氏模量[11]、硬度[12]等,以及聚合收缩率[13]和X射线阻射性[14]等。常用的无机填料包括二氧化硅、羟基磷灰石、二氧化钛和氧化铝等,部分填料的形貌如图 2所示[15-18]。
|
图 1 牙科复合树脂常用有机单体的结构式 Fig.1 Structural formula of commonly used organic monomers in dental resin composites |

|
图 2 牙科复合树脂中无机填料的SEM图像 Fig.2 SEM microspheres of inorganic fillers for dental resin composites: (a) SiO2 microspheres[15](Copyright 2012, Elsevier B.V.); (b) urchin-like serried hydroxyapatite[16] (Copyright 2019, WILEY-VCH Verlag Gmb H & Co.KGa A, Weinheim) |
临床研究表明,银汞合金的使用寿命大约为13 y, 平均修复失败率为1.6%;而复合树脂的使用寿命仅为7年,平均修复失败率为2.9%。由此可见,复合树脂的使用寿命较短、修复失败率较高[19-22], 这主要由修复体断裂和继发龋两大因素所致[8]。近年来,随着混合填充技术和增强-增韧填料的发展,复合树脂的强度、模量和耐磨性得到显著提高,有效地减少了修复体断裂导致的修复失败[23], 但继发龋仍是龋病治疗中导致复合树脂修复失败的主要原因和最大挑战[24]。继发龋的发生主要有以下两个原因。1) 丙烯酸酯基复合树脂在光固化过程中产生的聚合收缩。在自由基聚合反应时,单体分子间会形成共价键,导致单体单元间距离减小,同时伴随着自由体积减小[25], 进而导致修复树脂与牙本质之间或复合树脂与混合层之间形成间隙,为口腔中细菌和食物残渣等提供滋养空间。2) 复合树脂不具备抗菌性能或抗菌性能欠佳。上述两个因素最终引起继发龋,并导致修复体结构丧失和功能退化[26]。经由复合树脂修复治疗的继发龋病例的发病率在20%~44%, 且需要反复治疗[8, 27]。
近期的一项德尔菲法调查对未来20年口腔修复治疗进行了分析和预测,并明确指出“预防继发龋”是未来口腔修复治疗中最重要的项目[28]。继发龋产生的主要因素是牙齿与修复体间的微渗漏所引起的细菌生物膜在修复体表面的沉积[27, 29]。Svanberg等人[30]通过个体间/个体内临床实验分别比较了银汞合金、复合树脂和玻璃离子水门汀修复体边缘的菌斑中S.mutans的水平,研究表明,细菌生物膜在复合树脂材料上的沉积量明显高于其他修复材料。这种现象源于复合树脂中单体转化不完全。该研究还表明,复合树脂中残留并渗出的未反应单体,即双甲基丙烯酸乙二醇酯(Ethyleneglycol dimethacrylate, EGDMA)和TEGDMA可能会促进致龋细菌的生长,如变形链球菌(Streptococcus mutans, S.mutans)、乳酸杆菌(Lactobacillus)和内氏放线菌(Actinomyces naeslundii, A.naeslundii), 并会增强远缘链球菌(Streptococcus sobrinus, S.sobrinus) 的葡萄糖基转移酶活性,从而增加细菌生物膜在复合树脂表面沉积的可能性[31-32]。同时,细菌生物膜的存在增加了修复体表面的粗糙度,将继续吸引生物膜的附着,形成恶性循环,进一步感染邻近的软组织和硬组织,包括牙釉质、牙本质和牙龈[29], 引发其他口腔疾病。
因此,抗菌型复合树脂的研发对抑制继发龋、提高复合树脂使用寿命具有重要意义。目前主要通过使用抗菌剂赋予牙科复合树脂抗菌性能[9]。抗菌剂是一类能够杀死致病微生物的化合物[33], 用于牙科复合树脂的抗菌剂可分为抗菌型无机粒子和抗菌型有机单体。近年来,关于抗菌型无机粒子的研究主要包括银系抗菌剂、金属氧化物系抗菌剂和氟化物系抗菌剂等;关于抗菌型有机单体的研究主要包括氯己定、三氯生和季铵盐类化合物,其中季铵盐类化合物因其特殊的“接触型抑制”抗菌机理受到了尤为广泛的关注,这类抗菌剂在没有抗菌成分释放的条件下依然能够产生持久的抗菌作用,避免了抗菌剂溶出对复合材料力学性能产生的负面影响。表 1汇总了上述抗菌剂应用于牙科复合树脂的实例,同时将抗菌剂进行归类,并对其抗菌测试方法和结果进行了梳理,表中所示例子将在后文详述。表 1结果表明,在合理选择抗菌剂的条件下,经由复合树脂修复的继发龋发病率有望大幅度降低。
| 表 1 抗菌型牙科复合树脂中抗菌剂类型、组成及抗菌性能 Table 1 Type and composition of antibacterial agents and the antibacterial activity of dental resin composites |
通过向牙科复合树脂中添加抗菌型无机粒子或对无机填料进行抗菌功能改性是制备抗菌牙科复合树脂的一类方法。相较于有机抗菌剂易迁移、热稳定性差等缺点,无机抗菌剂因其具有良好的生物相容性、快速杀菌性和广谱抗菌性能等优点,在牙科复合树脂中得到了广泛的应用。
2.1 银系抗菌剂银系抗菌剂是指银离子由吸附或离子交换等方式固定到无机载体上所得的物质,其抗菌性能与自身价态关联紧密,高价态的银离子比低价态的银离子具有更强的抗菌能力,即Ag3+ > Ag2+ > Ag+ > Ag0[65, 66]。目前,用于牙科复合树脂中的银系抗菌剂主要为一价银离子(Ag+)和银单质(Ag0), 尚未见高价态银离子的研究报道。
2.1.1 Ag+在具有抗菌效果的重金属离子中,Ag+抗菌活性最高,并且对人体组织的毒性较低[67], 因此成为最常用的一类无机抗菌剂。Ag+的抗菌机理主要有两种:1) Ag+能与细菌酶中含硫、氮或氧的官能团形成络合物,导致细菌细胞壁不稳定以及新陈代谢紊乱,产生杀菌作用[68]; 2) Ag+与细菌DNA相互作用,使其失去复制能力,阻止细胞繁殖,起到抑菌作用[69]。Zhu等人[34]利用酸化改性的介孔材料吸附Ag+得到载银介孔材料,并将其用作抗菌型无机填料制备牙科复合树脂。研究表明,所制得的树脂材料对变形链球菌、金黄色葡萄球菌(S.aureus) 和大肠杆菌(E.coli) 的抗菌率均在90%以上。但是,该类复合树脂通常表现出离子释放快、抗菌活性短暂等缺点,无法提供稳定且长期的抗菌性能[70], 限制了基于释放机理的Ag+抗菌剂在牙科复合树脂领域的应用。
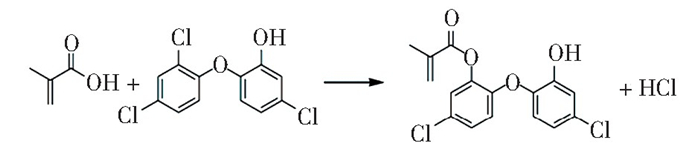
除上述两种抗菌机理外,近年来出现了银离子接触抗菌机理的报道,具体以磺胺嘧啶银为例说明。磺胺嘧啶是一种广泛用于烧伤创面的抗菌药物,Srivastava等人[35]将磺胺嘧啶银通过共价键接到钡硼硅酸盐玻璃粉表面(图 3), 获得了具有高效持久抗菌效果的牙科复合树脂,这得益于银与磺胺嘧啶之间形成的稳定化学结构。结果表明,分别用5wt.%和10wt.% 的经磺胺嘧啶银改性的玻璃粉代替未改性玻璃粉,所制得复合树脂在直接接触式抗菌试验(接触时间30 min)中,使S.mutans的数目降低了3~4个对数单位,且该填料用于Bis-GMA/TEGDMA基树脂中可持续至少8周以上的抗菌活性。因此,磺胺嘧啶银修饰无机填料有望成为临床应用中的新型长效抗菌剂。
|
图 3 磺胺嘧啶银改性钡硼硅酸盐玻璃粉的合成路线[35] Fig.3 Reaction scheme for the modified glass powder[35](Copyright 2017, Elsevier B.V.) |
相较于Ag+抗菌剂,目前银单质作为抗菌剂的应用更为广泛,尽管银单质抗菌活性低于银离子,但银单质可以储存并经过氧化反应释放大量的银离子。因此,用银单质填充的聚合物材料可以起到长效抗菌作用。根据式(1)可知,银单质与水和溶解在水中的氧气接触时会释放少量Ag+[71]。
| ${{\rm{O}}_{2({\rm{aq}})}} + 4{{\rm{H}}_3}{{\rm{O}}^ + } + 4{\rm{A}}{{\rm{g}}_{({\rm{s}})}} \to 4{\rm{Ag}}_{{\rm{(aq)}}}^ + + 6{{\rm{H}}_2}{\rm{O}}$ | (1) |
根据该反应方程式可知,单质银经氧化反应形成Ag+, 因此,Ag+释放的浓度和速率可以由银单质的比表面积,即粒径来控制[71]。相较于传统的银粉,纳米银粒子(silver nanoparticles, Ag NPs)是一种粒径为1~100 nm的银单质粒子,比表面积高,被视为一种广谱且高效的抗菌剂,其可能的抗菌机理有以下3种(图 4): 1) 与细胞膜、膜蛋白、DNA碱基结合,导致正常功能的破坏(蓝色虚线); 2) 释放银离子,影响膜、DNA、蛋白(红色虚线); 3) 产生活性氧(ROS) 也可能影响DNA、细胞膜、膜蛋白(黑色虚线) [72]。需要注意的是,将Ag NPs引入牙科复合树脂需考虑纳米粒子的分散性问题,避免Ag NPs因团聚而丧失抗菌性能。

|
图 4 银纳米材料抗菌活性的潜在机制[72] Fig.4 Potential mechanisms of silver nanomaterials'antibacterial activity[72] |
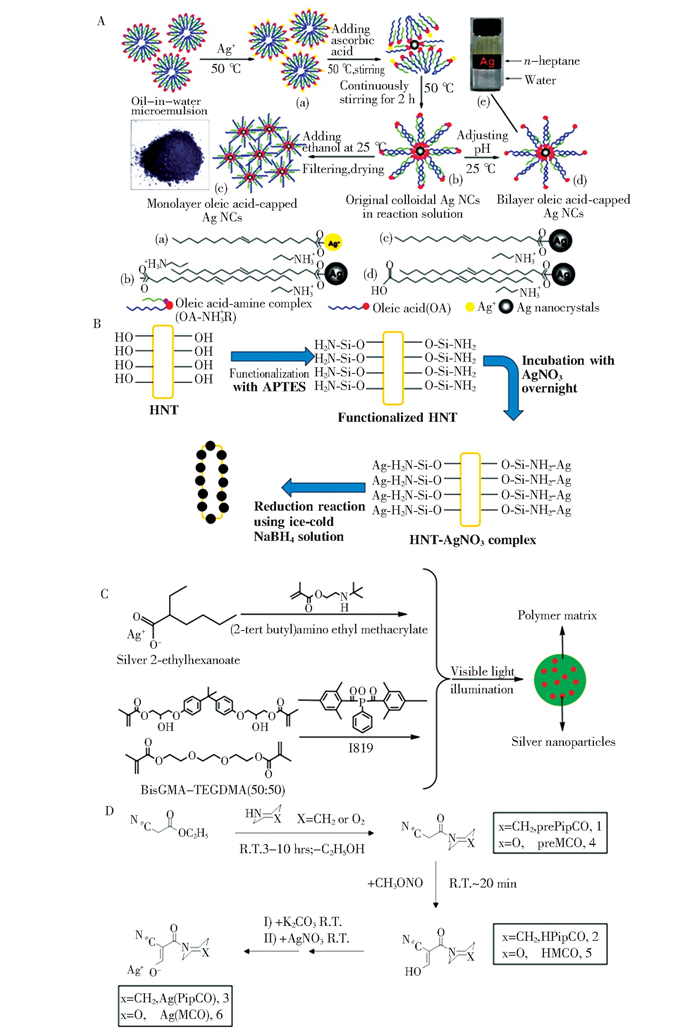
因此,Liu和Shi等人[36, 73]对Ag NPs表面进行了有机功能化改性,将油酸和烷基胺组成的单层表面活性剂包覆于Ag NPs表面,得到易于分散在有机介质,即有机可溶Ag纳米晶(Nanocrystals, NCs), 制备流程如图 5(a)所示,进而研究了添加Ag NCs对牙科复合树脂力学性能和抗菌性能的影响。研究结果表明,Ag NCs具有较高的比表面积,并在有机溶剂(如正庚烷、环己烷和甲苯) 中分散性良好,且含1×10-4 wt.%Ag NCs的复合树脂对S.aureus、Lactobacillus和E.coli的抗菌率分别达到64.6%、66.5%和69.1%[36]。因此,对Ag NPs进行表面处理,可以有效提高其在有机基体中的分散性以及避免纳米粒子的团聚问题,但该研究中Ag NPs仅通过机械混合的方式与复合树脂中的无机填料共混,两者之间缺少化学吸附,不易得到均质的未固化树脂材料。此外,直接将Ag NPs掺入在复合树脂中易导致纳米颗粒的快速浸出,降低树脂的抗菌潜力。
|
图 5 向复合树脂中引入Ag NPs的方法: (a) Ag NPs的有机功能化: 在水溶液中形成有机可溶Ag NCs封端油酸的机理示意图[73]; (b) HNTs和Ag NPs反应的示意图[39]; (c)在二甲基丙烯酸酯聚合物中原位制备银纳米粒子[41]; (d)氰基肟及其银配合物的合成路线[42] Fig.5 Methods of introducing Ag NPs into resin composites: (a) organic functionalization of Ag NPs: scheme of the proposed mechanism describing formation of organic-soluble Ag NCs capped oleic acid in aqueous solution[73](Copyright 2011, Chinese Materials Research Society and Elsevier B.V.); (b) schematic illustration of the Halloysite nanotubes and Ag NPs reaction[39]; (c) in situ preparation of silver nanoparticles in dimethacrylate polymers[41](Copyright 2011, John Wiley and Sons); (d) synthetic route to cyanoximes and their Ag-complexes[42] |
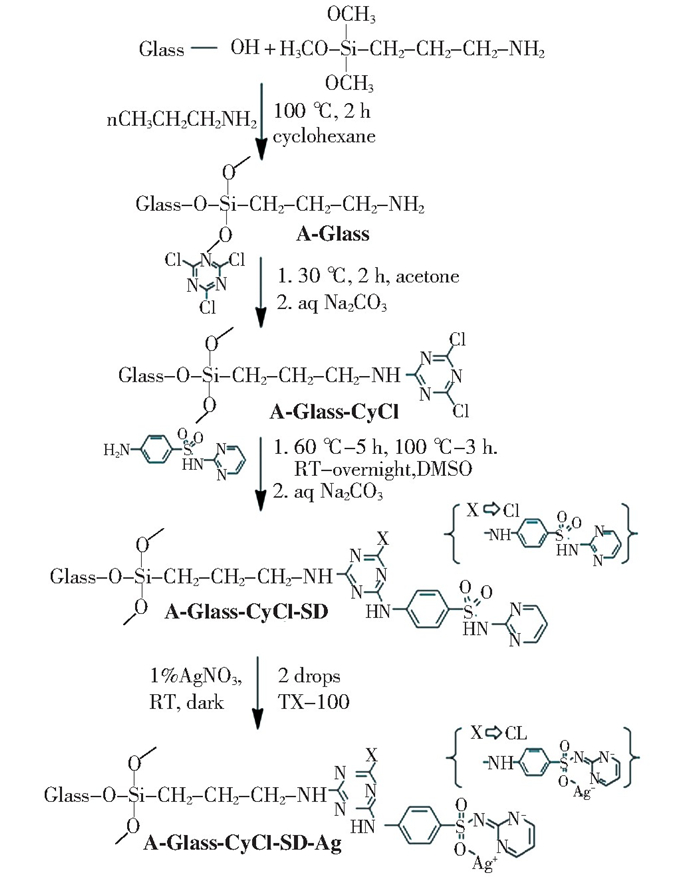
为了解决上述问题,微粒载体法引起科研工作者的广泛关注。该方法可将Ag NPs通过化学键/静电吸附作用负载于无机填料上,进而通过载银无机填料向牙科复合树脂中引入抗菌成分。为了在无机填料上提供吸附Ag NPs的位点,可利用硅烷偶联剂对无机填料表面进行氨基化改性,其中,3-氨基丙基三乙氧基硅烷((3-aminopropyl) trimethoxysilane, APTES)是最常见的氨基化试剂[74-76]。由于银原子有一个空轨道,氮原子有一对孤对电子,因此,-NH2基团可以与银原子形成配位键,使Ag NPs与无机填料之间形成化学键合,得到载银无机填料,且该配位键的形成可有效避免Ag NPs的快速浸出。He等人[37]将以纳米SiO2球为载体制备得到的载银SiO2抗菌剂用于牙科粘结剂,其对大肠杆菌的抗菌率最高可达98%。Pei等人[38]将以介孔SiO2为载体制得的载银介孔SiO2抗菌剂用于牙科粘结剂,其对S.mutans的抗菌活性可达99%。Barot等人[39]以埃洛石纳米管(Halloysite nanotubes, HNTs)作为载体制备载银HNTs抗菌剂(图 5(b)), 实验表明,使用HNTs为载体可保证抗菌剂的持续释放,随着时间的推移,抗菌活性持续增加,并充分减少了抗菌剂对口腔粘膜细胞的不利影响。
除了使用APTES对无机填料进行接枝改性以外,聚多巴胺(Polydopamine, PDA)也受到研究者的关注。Ai等人[40]使用P DA对羟基磷灰石(Hydroxyapatite, HA)纳米线进行表面包覆,利用还原反应制备了载银HA纳米线(HA-PDA-Ag)。当AgNO3质量浓度为1.0 g/L时,所制备的HA-PDA-Ag-1.0可与树脂基体均匀混合,同时实现了Ag NPs在树脂基体中的均匀分布。此外,8 wt.% HA-PDA-Ag-1.0填充复合树脂对S.mutans具有高抗菌活性,即在活/死细胞染色实验中基本看不到绿色活S.mutans。但Ai等人[77]同时也指出,微粒载体法制备的复合树脂最好采用热固化而不是光固化,这是由于Ag NPs的加入导致复合树脂颜色加深呈棕色,影响了光的传输,继而降低树脂双键转化率、增加了未固化单体含量,因此降低了该类复合树脂的生物相容性。
上述Ag NPs添加影响复合树脂光学性能这一问题,可利用原位合成法解决,其实质是使树脂基体的光引发自由基聚合反应与Ag+的光还原反应同时发生,从而解决化学还原造成的弊端。在该反应过程中,Ag+被光激发使电子从溶剂分子迁移到Ag+生成Ag0, Ag0聚集生成Ag NPs [78]。Cheng等人[41]采用该方法将2-乙基己酸银(2-(tert-butylamino)ethyl methacrylate, TBAEMA)分散至Bis-GMA/TEDGMA树脂基体中,使Ag NPs经可见光光照原位合成过程形成于聚合物中(图 5(c))。与空白样相比,含有一定质量分数(0.03wt.%~0.37wt.%) TBAEMA的复合树脂的细菌覆盖总表面积比例表现出明显下降(p≤0.05)。该方法不仅使Ag NPs均匀分散在树脂基体中,同时对单体转化率几乎不产生影响。Riddles等人[42]合成了两种含Ag+的氰基配合物(图 5(d)), 并将二者分别加入到Bis-GMA/ TEDGMA/UDMA基体中进行Ag NPs的原位合成,制得的抗菌复合树脂光照2~3 min后颜色无明显变化,且Ag+氰基配合物添加量达1wt.% 时,能够完全抑制S.mutans和S.aureus的生长。除了上述在树脂基体中分散有机银盐原位还原得到Ag NPs的策略之外,还可将无机银盐作为填料加入到树脂基体中,同样能够通过光还原反应得到Ag NPs。Natale等人[43]利用磷酸银具有的光催化特性,制备了磷酸钙/磷酸银片状填料颗粒,进一步通过原位合成法得到兼具再矿化和抗菌性能的牙科复合树脂。实验结果表明,与纯有机基体相比,填充CaP/Ag颗粒的复合树脂上的活菌落数量减少了3个对数单位。由此可见,原位合成法的优点:1) Ag NPs的添加不影响复合树脂的光透过率;2) Ag NPs在树脂基体中分散良好,但缺点是银离子的还原反应可能会消耗一部分的引发剂,甚至终止高分子链的链增长反应,因此,使用该方法制备含银抗菌牙科树脂时可适当增加树脂基体中光引发剂的含量。
2.2 金属氧化物系抗菌剂 2.2.1 氧化锌氧化锌(ZnO)对革兰氏阳性和革兰氏阴性细菌均表现出抗菌活性,且与Ag NPs相比,ZnO NPs更接近人类牙齿的本色,因此,更适合作为填充材料赋予牙科复合树脂抗菌性能,然而ZnO NPs的抗菌机制尚无定论。目前,ZnO NPs的抗菌机理主要有4个方面(图 6)[79-80]∶1) 生成的ROS可杀灭细菌;2) 释放的Zn2+会附着在细胞膜上,引起细胞壁的机械损伤;3) ZnO与细菌的相互作用会破坏细胞表面电荷的平衡,杀死细菌;4) 纳米粒子的细胞内化可诱导细菌死亡。然而,Jiang等人[81]发现,虽然在ZnO NPs悬浮液中检测到一定浓度的Zn2+和H2O2, 但Zn2+和H2O2的浓度不足以产生抑菌作用。另外,实验中自由基捕捉剂的加入抑制了ZnO对E.coli的杀菌作用,表明ROS的生成对ZnO NPs的抗菌性能起着重要作用,由此他们猜测ZnO NPs的抗菌性能可能来自羟基自由基(HO·)。因此,ZnO NPs作为抗菌剂的确切抗菌机理目前仍存在争议,还有待进一步论证。
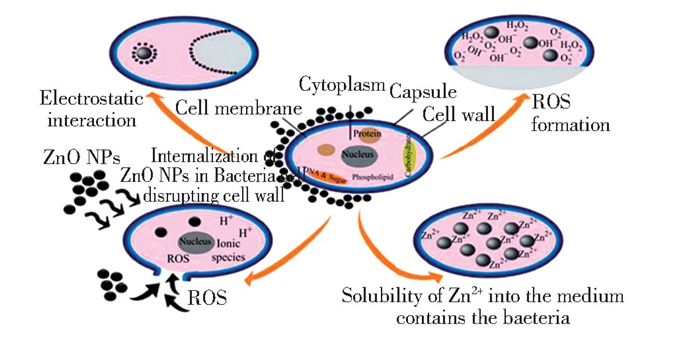
|
图 6 ZnO NPs抗菌活性的不同机制[79] Fig.6 Different possible mechanisms of ZnO NPs antibacterial activity[79](Copyright 2015, Springer Nature) |
文献表明[44], ZnO的形貌对复合树脂的抗菌性能产生一定的影响。Dias等人制备了六方微棒状ZnO填料,将其以含量(质量分数)0.2%、0.5%和1.0%分别加入至商品化树脂FiltekTM Z350XT(3M Brazil) 中,发现三者的菌落形成单位(colony forming unit, CFU)相较于未添加ZnO的树脂均表现出明显的降低(p < 0.05)。Collares等人[45]合成了针状ZnO NPs, 填充20wt.%该填料的复合树脂表现出显著的抗菌性能,其CFU值较纯有机基体降低了9.8%。
但是,单独加入ZnO NPs的复合树脂不能满足口腔服役所需的力学性能[82]。为了实现树脂兼具优异的抗菌性能和力学性能,ZnO复合填料增强树脂的设计理念被陆续提出和研究。Chen等人[46]合成了具有独特核-壳介孔结构的ZnO@m-SiO2, 并将其用作牙科复合树脂的功能填料(图 7(a))。该填料结构中的介孔SiO2(m-SiO2)层有利于填料与树脂基体间形成微机械互锁效应,提高复合树脂的力学性能。同时,ZnO能够通过m-SiO2中的孔结构释放Zn2+, 通过CFU计数抗菌测试得到,添加Z7S63(ZnO@m-SiO2: 硅烷化改性SiO2=7∶63, wt./wt., 总填料填充量70wt.%)的复合树脂可获得高达99.9%的抗菌率,明显优于不含ZnO@m-SiO2填料的对照组(图 7(b)和图 7(c))。Wang等将纤维素纳米晶(Cellulose nanocrystal, CNC) 作为载体[47], 利用其对聚合物基质优异的增强性能[83], 进一步利用混酸改性法、冻干技术以及真空干燥工艺,制备了CNC/ZnO纳米复合材料,并将其引入牙科复合树脂中。相比于纯有机基体,2wt.% CNC/ZnO填充复合树脂的CFU值下降了78%, 且力学性能中的压缩强度由(344.3±10.7)MPa增加到(371.0±6.6)MPa。Liu等人[48]制备了ZnO介晶,该填料粗糙的表面和孔隙有利于树脂单体的渗入,固化后可在填料与树脂基体间形成机械互锁结构。相较于商业ZnO微球/SiO2微球填充的复合树脂,ZnO介晶/SiO2微球填充的复合树脂的弯曲模量提高了23.2%, 相较于SiO2微球填充的复合树脂,ZnO介晶/SiO2微球填充的复合树脂对S.mutans的抗菌率从92.3%提高至99.9%。Shen等人[49]通过调整ZnO形貌和表面接枝方法,在赋予树脂一定力学强度的同时,兼顾了ZnO的长效抗菌性能。研究人员将表面包覆碳碳双键的杂化SiO2颗粒/四针状ZnO晶须作为无机填料引入UDMA/Bis-GMA/TEGDMA基树脂中,对应20wt.%填料量制备的复合树脂的抑菌率高达98.1%, 且在37 ℃蒸馏水保存20 d后,树脂样品的抑菌率依然可达93.7%, 弥补了四针状ZnO晶须填充复合树脂的短暂抗菌性(上述抗菌试验中抗菌率由95.8%降低到83.4%)[49, 82]。因此,ZnO复合填料的出现可同时赋予复合树脂优异的抗菌性能和力学性能。
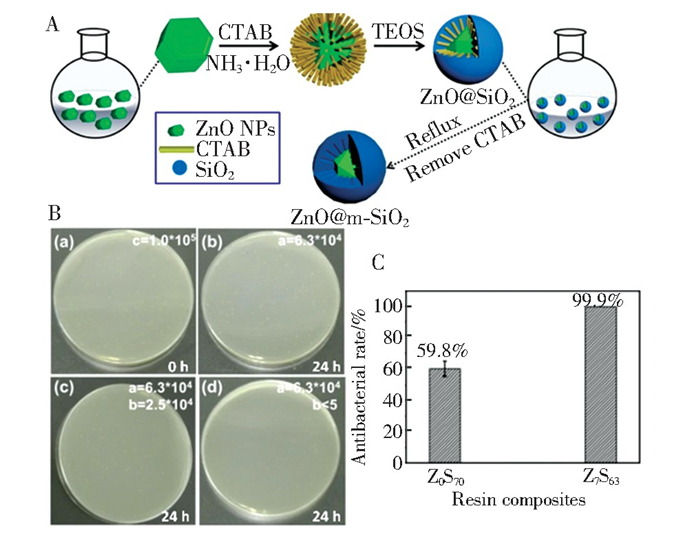
|
图 7 A: 合成ZnO@m-SiO2粒子的示意图.B: 复合树脂经不同培养时间后表面S.mutans菌落数的数码照片.(a)空白无菌板,0 h; (b)空白无菌板,24 h; (c) Z0S70, 24 h; (d) Z7S63, 24 h; C: Z0S70(0wt.%ZnO@m-SiO2+70wt.%SiO2NPs)和Z7S63(0wt.%ZnO@m-SiO2+63wt.%SiO2NPs)对S.mutans的抗菌率[46] Fig.7 A: Schematic illustration of the synthesis of ZnO@m-SiO2 particles.B: Digital photographs of the number of Streptococcus mutans on the surface of two dental composites after being incubated for different time: (a) blank sterile plate, 0 h; (b) blank sterile plate, 24 h; (c) Z0S70, 24 h; (d) Z7S63, 24 h.C: Antibacterial rate of Z0S70 and Z7S63 to Streptococcus mutans[46](Copyright 2018, The Academy of Dental Materials and Elsevier Inc.) |
基于ZnO NPs可能存在的抗菌机理,近年来还提出了一系列增强ZnO抗菌性能的策略,包括使用其他抗菌剂对ZnO进行包覆/负载/修饰,以及调整ZnO NPs的粒径、形貌和浓度等方法[84]。目前出现了将Ag修饰的ZnO NPs作为抗菌填料用于牙科复合树脂的报道[50]。该抗菌增强机理是:1) 通过光催化反应在ZnO NPs表面产生ROS, 但光激发的e-和h+可以在它们产生的同时发生再结合,从而减少ROS的产生,而Ag对ZnO NPs的修饰能提高光生e--h+对的分离效率,降低这种再结合效应[85]; 2) ZnO/Ag NPs中的Ag NPs能起到对O2化学吸附位点的作用,通过化学吸附的O2与光生电子反应形成ROS[85]; 3) ZnO/Ag NPs在口腔弱碱性环境下(pH = 7.4)表现出弱的正电性,与带负电的细菌膜形成静电吸引,通过与细胞壁物理接触增强细胞膜的透过性,表现出对革兰氏阴性菌和革兰氏阳性菌增强协同的抗菌活性[86]。另外,通过改变ZnO/Ag NPs复合填料的形貌也可影响复合树脂的抗菌性能。Dias等人分别通过聚合前驱体法和共沉淀法合成了ZnO/Ag NPs纳米球和ZnO/Ag NPs纳米片[50], 并分别将它们作为抗菌填料引入牙科树脂中。由7 d培养后S.mutans生物膜的CFU值可知,ZnO/Ag NPs纳米球填充复合树脂的抑菌效果优于ZnO/Ag NPs纳米片掺杂的复合树脂。这是因为ZnO/AgNPs纳米球的表面积(42.26 m2/g)几乎是ZnO/Ag NPs纳米片(16.80 m2/g)的3倍,而ROS的生成是在纳米颗粒表面。因此,除了ZnO/Ag NPs的形貌之外,纳米颗粒的表面积也是影响抗菌活性的参数之一。
对含ZnO NPs抗菌牙科复合树脂而言,由于ZnO NPs折光指数(2.008~2.029)高于有机单体Bis-GMA (1.540)、TEGDMA (1.461)以及常用配比单体Bis-GMA/TEGDMA = 50/50(wt./wt.) (1.500) 的折光指数,所以会影响复合树脂的固化深度和力学性能。因此,如何兼顾该类复合树脂的理化性能和抗菌性能是未来重要的研究方向。此外,目前ZnO的抗菌机制尚无定论,仍需进一步研究,而对机制的了解可以促进该类牙科复合树脂在生物医用领域更广泛的应用。
2.2.2 二氧化钛二氧化钛(TiO2) 通常作为牙科粘结剂用抗菌剂[87-89], 近年来陆续出现将其用于复合树脂的研究报道[51, 90-91]。TiO2的抗菌机理主要依靠自身光催化特性,是光与光催化剂表面在适当波长和光能下相互作用的结果[73]: 如果满足这种电子需求(以锐钛矿为例,即385 nm和3.220 4 eV), 那么存在于价带的基态电子将被激发到导带进入激发态中,在价带中留下带正电的电子空穴。由此产生的导带自由电子(eCB-)和价带中留下带正电的电子空穴(hVB+)可以复合(式(2)), 以热或光的形式释放多余的能量;如果不发生复合,则新产生的eCB-和hVB+迁移到光催化剂表面,参与多种氧化还原反应,这些反应将产生ROS(式(3)和式(4))。由此产生过氧化氢(H2O2) 或过氧化氢自由基(·OOH), 如式(5)~(8)所示。TiO2受光照射产生的ROS会优先通过脂质过氧化过程攻击微生物膜上的多不饱和磷脂。这个过程引起连锁反应,促进蛋白质和电子介质的变性,使微生物膜被完全破坏,进而导致细胞质泄漏和细胞死亡。
| ${\rm{Ti}}{{\rm{O}}_2} + {\rm{hv}} \to {\rm{e}}_{{\rm{CB}}}^ - + {\rm{h}}_{{\rm{VB}}}^ + $ | (2) |
| ${{\rm{H}}_{\rm{2}}}{\rm{O + h}}_{{\rm{VB}}}^{\rm{ + }} \to \cdot {\rm{OH + }}{{\rm{H}}^{\rm{ + }}}$ | (3) |
| ${\rm{O}}{{\rm{H}}^ - }{\rm{ + h}}_{{\rm{VB}}}^{\rm{ + }} \to \cdot {\rm{OH}}$ | (4) |
| $2{\rm{O}}_2^ - + 2{{\rm{H}}^{\rm{ + }}} \to {{\rm{H}}_{\rm{2}}}{{\rm{O}}_2} + {{\rm{O}}_2}$ | (5) |
| $\cdot {\rm{OH}} + \cdot {\rm{OH}} \to {{\rm{H}}_{\rm{2}}}{{\rm{O}}_2}$ | (6) |
| ${\rm{O}}_2^ - + {{\rm{H}}_{\rm{2}}}{{\rm{O}}_2} \to \cdot {\rm{OH}} + {\rm{O}}{{\rm{H}}^ - } + {{\rm{O}}_2}$ | (7) |
| ${\rm{O}}_2^ - + {{\rm{H}}^ + } \to \cdot {\rm{OOH}}$ | (8) |
Dias等人通过微波水热法制得TiO2 NPs, 将其加入到复合树脂FiltekTM Z350XT (3M Brazil) 中。结果表明,仅2wt.% 的TiO2 NPs就使复合树脂表面S.mutans的生长明显减少[51]。然而,由上述机理可知TiO2的禁带较宽,只有在吸收紫外光时才真正具有杀菌作用,但紫外光只占太阳光谱的很小一部分(< 5%), 这意味着在可见光条件下,TiO2的杀菌效果欠佳,这也是以TiO2为抗菌剂的牙科复合树脂报道偏少的主要原因。
基于上述问题,为使TiO2的光吸收范围转移至可见光范围,可通过向TiO2中掺杂氮、氟、铜、银等多种原子的方法形成一类新型的可见光活性材料[92-94]。Chambers等制备了银掺杂TiO2(Ag-TiO2), Ag+对TiO2的改性使带隙能降低,可见光即可激活材料的光催化活性。将Ag-TiO2粉末引入牙科树脂后,虽然因暴露在可见光下的Ag-TiO2表面积有限,材料的光催化性能下降(表现为光照下自由基释放显著减少), 但复合树脂仍表现出对S.mutans完全的接触杀菌效果[52]。Zane等人指出,金属掺杂的TiO2光催化材料可重复性差,该课题组用乙基甲胺作为氮源改性TiO2得到氮掺杂TiO2(N-TiO2), N-TiO2在蓝光照射1 h后对E.coli具有明显的杀菌效果(图 8), 且对人体牙龈上皮细胞危害性小,该材料有望成为具有光激活抗菌性能的新型牙科树脂[53]。TiO2作为牙科复合树脂用抗菌剂的最大局限在于其光催化性能与光照材料的表面积直接相关。而在临床应用时,被修复的龋齿并非时刻暴露于可见光下,因此会降低该类复合树脂中TiO2的光催化效果。但考虑到TiO2不仅能通过产生的ROS提高光引发聚合的单体转化率,也可改性树脂亲水性和力学性能以及其潜在的抗菌能力[50, 87-88], 因此,含TiO2的抗菌牙科复合树脂仍具备一定的研究价值。
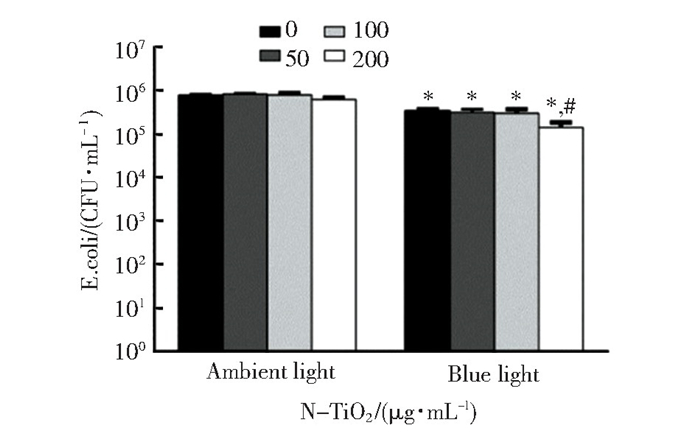
|
图 8 暴露于1.25N-TiO2颗粒(1.25为N元素的相对添加量)和1 h环境光或蓝光后E.coli的CFU值[53] Fig.8 Colony counts of Escherichia coli after exposure to 1.25 N-TiO2 particles (1.25 is the relative amount of nitrogen added) and 1 hour of either ambient room light or blue light[53] (Copyright 2016, Dove Medical Press Limited) |
氟化物在牙科领域中具有重要意义,通常氟元素能够以离子形式释放以防止牙釉质脱矿,并有助于牙釉质的再矿化,它作为一种防龋剂已广泛添加于饮用水、漱口水及牙膏中[95]。除此之外,氟元素本身也具有抗菌性,其抗菌机理较为复杂(图 9)[96-97]: 1) 氟化物会影响许多代谢酶,其中烯醇化酶对氟化物特别敏感,抑制该种酶的活性可有效抑制糖摄取和糖酵解;2) 氟化物能够抑制糖原合成和过氧化物酶活性;3) 氟化物可以抑制链球菌的质子移位膜ATP酶(H+-ATPase), 并通过抑制质子从酶催化的细胞向外转移,提高细胞的质子通透性,降低细胞ATP水平;4) 在低pH值下,F-与H+结合形成的HF可穿透细菌膜;5) 氟化物能降低微生物对生物膜的粘附性,增加对酸性环境的敏感性,从而对细菌细胞的代谢和粘附产生不利影响。已有报道的氟化锶(SrF2)、三氟化镱(YbF3)或浸出式玻璃填料等含氟填料体系均具有抗菌作用[98-100], 这些含氟填料是通过唾液扩散到复合树脂中的交换反应和颗粒中氟化物的释放来实现抗菌效果的。
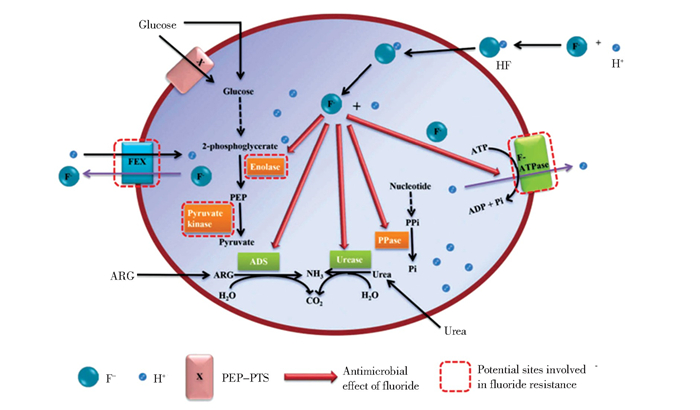
|
图 9 氟化物的抗菌机理及参与氟抗菌机制的潜在位点[97] Fig.9 Mechanisms for the antimicrobial effects of fluoride and potential sites involved in the mechanisms of fluoride resistance[97](Copyright 2017, Taylor & Francis Group) |
Kulshrestha等人用共沉淀法合成了氟化钙纳米颗粒(CaF2NPs), 共聚焦激光扫描显微镜(Confocal laser scanning microscopy, CLSM) 图像表明,CaF2NPs的存在使S.mutans高度分散,且生物膜结构明显消失,但仍保持细菌活性。因此,CaF2NPs的抗菌性能源于对细菌生物膜形成的抑制作用,而非对细菌活性的抑制[54]。这是由于在CaF2NPs存在下,胞外多糖(Exopolysaccharide, EPS) 的产生显著减少,导致S.mutans生物膜形成能力降低,而EPS对生物膜的形成、维持和扩散至关重要,是影响S.mutans生物膜毒性的关键因素之一[101]。另外,CaF2NPs可以作为F-的贮存器,F-的释放不仅有助于抑制S.mutans生物膜的形成,而且可以促进再矿化,减少龋病的发生[102]。Hesaraki等人将抗菌剂SrF2NPs、辅助填料氧化钇稳定氧化锆(Yttria-stabilized zirconia, YSZ)与辅助抗菌剂ε-多聚赖氨酸(ε-poly-lysin, ε-PL) 一同加入Bis-GMA/TEDGMA/UDMA树脂基体[55], 结果发现,SrF2与ε-PL之间发生协同作用,其对应的复合树脂表现出优于单独添加SrF2的抗菌效果。该树脂与Xu等人报道的含CaF2纳米粒子复合树脂[103]相比,F-累计释放量由0.50~1.13 μg/(cm2·day1)提高到1.49~1.58 μg/(cm2·day1)。
上述引入至复合树脂材料中的可溶性氟盐,会在初始服役期内呈现爆发式释放,随着时间的推移,当氟盐抗菌剂完全耗尽时,往往会在复合树脂中留下微孔,导致材料机械性能的下降[56]。为了克服这一缺陷,Tammaro等人采用NaF/HNO3水溶液将F-以硝酸盐的形式嵌入至层状双氢氧化物(Layered double hydroxide, LDH), 制备了氟化层状双氢氧化物(LDH-F), 将其作为无机填料与Bis-GMA/TEGDMA基体混合后得到牙科复合树脂[104]。氟的释放速率随着时间的推移相对稳定,不存在初始毒性爆发效应,因此,LDH-F成为一种氟离子释放可调、可控的材料。这得益于LDH的层状形貌,随着LDH-F在树脂中添加量的增加,其会形成类晶团聚体,使F-不易在树脂中被反离子接触、分离和扩散,因此,F-与LDH的结合使其释放速率变慢。外推结果显示,LDH-F中F-的释放最多可持续1 y, 且日平均释放浓度在ppm级别,实现了F-抗菌剂在复合树脂中的长效释放。
综上可知,含氟牙科复合树脂在氟的释放特性上存在明显差异。F-的释放机制与它们的基质、固定机制、氟化物含量以及修复体的形成机制和环境条件有关。因此,控制初期爆发式释放和维持长期有效释放依然是未来含氟牙科材料研究的重点,寻找可作为F-缓释贮存器的载体材料将成为未来的研究热点。
3 抗菌有机单体通过添加抗菌有机单体或将抗菌基团引入有机单体是制备抗菌牙科复合树脂的另一类方法。有机抗菌剂按照抗菌机理可分为释放型和接触型两大类,其中,释放型抗菌剂主要包括氯己定,接触型抗菌剂主要包括三氯生和季铵盐类化合物。
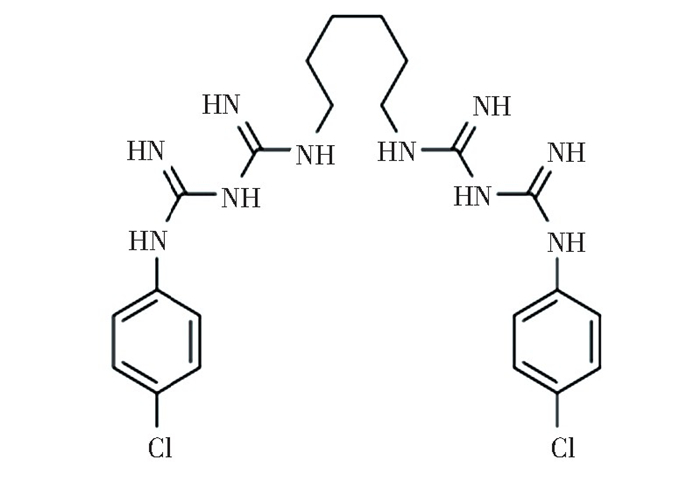
3.1 氯己定氯己定(Chlorhexidine, CHX), 化学名称为双氯苯双胍己烷(图 10), 被广泛用作牙科释放型抗菌剂,其抗菌机理为CHX分子与细胞表面带负电荷的基团发生反应,导致细胞质成分的不可逆损失、膜损伤和酶抑制[105]。
|
图 10 氯己定的结构式 Fig.10 Structural formula of chlorhexidine |
通过添加CHX衍生物赋予复合树脂抗菌性能已被大量报道,其中包括醋酸氯己定、二醋酸氯己定、葡萄糖酸氯己定和盐酸氯己定等[106]。虽然CHX衍生物可以抑制复合树脂周围的细菌生长,但其释放量在两周内即可达到总添加量的50%, 无法实现长期抗菌[107]。因此,实现CHX衍生物在树脂基体中的缓释成为研究关注的焦点。Cattell课题组建立了新型CHX颗粒在牙科复合树脂中的释放动力学模型,深入研究了CHX控释的方法。该团队首先对CHX微球进行了超声处理,结果表明,CHX微球表现出响应性和较低含量的释放行为,说明通过超声处理的CHX实现了可控释放[108]。随后,该团队通过冻干法将Fe3O4掺入CHX微球,通过外加磁场来改变CHX的释放动力学,用于牙科复合树脂可实现磁导向和药物响应特性[57]。Cidreira等人依托载体的层状形貌实现了对CHX释放行为的有效控制,研究人员制备了负载CHX的蒙脱石颗粒,并将其用于Bis-GMA/TEGDMA基牙科树脂的抗菌剂。研究发现CHX与蒙脱石层状结构的化学键接可有效减少CHX早期的爆发性释放行为,其复合树脂中CHX的释放质量浓度保持在0.002~0.010 mg/mL (仅占总CHX含量的0.0002%~0.001%), 呈恒定的释放曲线[58]。
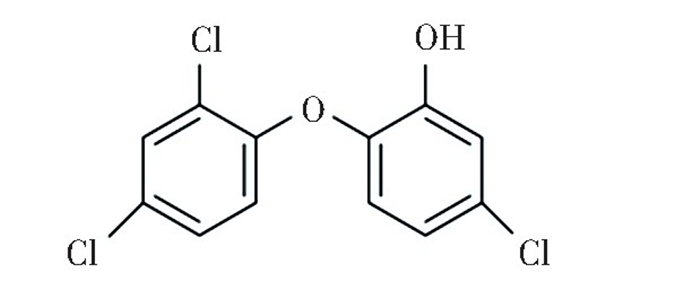
3.2 三氯生三氯生,化学名称为2, 4, 4′-三氯-2′-羟基二苯醚(图 11), 是一种对多种微生物有效的常用抗菌剂。目前已将三氯生应用至牙膏和漱口液中,旨在控制牙菌斑积聚[109]。三氯生主要通过抑制细菌烯醇酰基载体蛋白还原酶和作为细胞膜基础的Ⅱ型脂肪酸合酶产生抗菌效果[110]。该类抗菌剂常态为白色晶状粉末,在添加入复合树脂后可能导致材料因抗菌剂的浸出而发生降解,使复合树脂的机械性能下降[111]。
|
图 11 三氯生的结构式 Fig.11 Structural formula of triclosan |
为避免三氯生的浸出,De Paula课题组合成了甲基丙烯酸三氯生(Triclosan methacrylate, TM) 抗菌有机单体(图 12), 使其参与树脂基体共聚反应[59]。所研制的复合树脂在不牺牲力学性能的条件下,大大减少了S.mutans的粘附,抑制了细菌生物膜的形成。此外,与空白组相比,添加TM的复合树脂将生物膜积累量由8.91(±0.29) log10 CFU减少到7.22(±0.15) log10 CFU; 树脂与TM复合后,细菌生物膜主要由死微生物组成(42.42%), 明显高于对照组(19.08%)。他们推测这种新单体的抗菌性能得益于氯元素与复合树脂固化后被永久固定在聚合物网络中,当S.mutans与抗菌单体接触时,细菌细胞外基质的合成被阻碍;另一种可能的抗菌机理是甲基丙烯酸三氯生能够改变细菌细胞膜的通透性或破坏表面电荷平衡,导致胞浆渗漏,最终使细菌死亡。
针对TM的抗菌机理,该课题组的De Souza Araújo等人研究了添加TM的复合树脂对S.mutans生物膜的影响。结果表明,TM的存在能对S.mutans在分子和细胞水平上造成有害影响,使这些微生物的毒力降低,因此,显著降低了复合树脂表面菌斑的生长[112]。Teplova等人进一步研究发现,线粒体是三氯生毒性作用的靶点,易对许多哺乳动物细胞产生毒性,因此,该类单体在牙科复合树脂中添加量需要被严格控制[110]。综上可知,如何兼顾抗菌效果、单体转化率以及细胞毒性将是三氯生作为抗菌剂引入牙科复合树脂不可忽视的议题。
3.3 季铵化合物季铵盐类化合物(Quaternary ammonium compounds, QACs) 对细菌、真菌和病毒具有广谱的抗菌特性。季铵盐的抗菌机理主要分为3个步骤(图 13)[113]: 1) 带负电荷的细菌与带正电荷的QACs接触,产生渗透压;2) QACs通过细胞壁扩散并与细胞质膜结合;3) 细胞膜破坏,胞质成分释放,细胞死亡。该抗菌机理利用了细菌和QACs之间的静电吸附作用,被称为“接触型抑制”[114]。
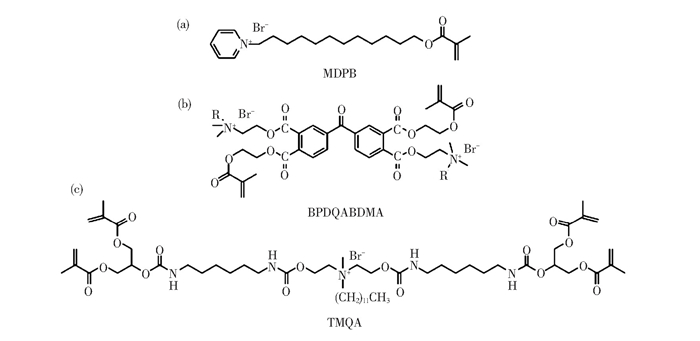
由于吸水率高,含可溶性抗菌剂(如CHX)的树脂洗脱后会形成多孔结构,故通常只有短期抗菌效果且力学性能差,同时,其与树脂基体没有化学键接,因此,随着时间的推移会逐渐渗出,可能危害人体健康[115]。与此相比,甲基丙烯酸酯季铵单体(Quaternary ammonium methacrylate, QAM)具有一个或多个甲基丙烯酸酯官能团,该单体中的双键可与树脂基体发生自由基共聚反应,进而将季铵盐类物质固定在牙科复合树脂中,使其具有不可逆且持久的抗菌活性[116]。其中,甲基丙烯酰氧十二烷基嗅吡啶(Methacryloyloxy-dodecyl pyridinium bromide, MDPB)是最早被用作牙科材料抗菌剂中的单甲基丙烯酸酯基季铵单体(图 14(a))[60], 它是一种可参与聚合反应的抗菌剂。含有MDPB的复合树脂经固化操作后,其分子中的抗菌成分即被固定,0.2wt.% MDPB样品可明显抑制细菌(S.mutans)生长,90 d后仍表现出抗菌效果。
|
图 14 (a) 甲基丙烯酰氧十二烷基嗅吡啶(MDPB)的结构式[60], (b)溴化双甲基丙烯酸酯基季铵盐(BPDQABDMA)的结构式[61], (c)四甲基丙烯酸酯基季铵单体(TMQA)的结构式[64] Fig.14 The structures of (a) MDPB[60], (b) BPDQABDMA[61], and (c) TMQA[64] |
但是,单甲基丙烯酸酯类季铵单体只能进行线性聚合,高浓度单体的加入会显著影响聚合物整体网络结构和性能[117]。与此相比,双甲基丙烯酸酯基季铵单体可用作交联剂,因此,近年来研究人员围绕该单体的结构设计和合成开展了相关研究工作。Weng等人合成了溴化双甲基丙烯酸酯基季铵盐(BPDQABDMA), 其结构如图 14(b)所示。该单体具有的长链烷基结构使其抗菌性能得到显著提高,但同时也极大地降低了单体转化率和力学性能[61]。实验结果显示,随着BPDQABDMA含量从10wt.%增加到70wt.%, 复合树脂的抗压强度从300 MPa下降到78 MPa, S.mutans存活率从78%降低至16%。因此,需要通过调控该溴化季铵盐的含量,平衡复合树脂的抗菌活性与机械强度。Li等人合成了1, 3-双(甲基丙烯酰氧基)丙基-羰基-己基溴化吡啶(1, 3-bis(methacryloyloxy)propyl-carbonyl-hexylpyridinium bromide, QANMA), 当向Bis-GMA/ TEGDMA基树脂中引入10wt.%以上的QANMA单体时,方能在活/死细胞染色实验中观察到复合树脂对S.mutans明显的抗菌性。虽然该单体的加入降低了复合树脂的力学性能,但其弯曲强度依然满足ISO标准[62]。Melo等人将合成的双(2-甲基丙烯酰氧乙基)二甲基溴化铵(bis(2-methacryloyloxyethyl)dimethyl-ammonium bromide, QADM) 用于牙科复合树脂,并进行了人体体内实验以研究其对细菌生物膜形成的抑制效果[63]。在受试者体内对S.mutans生物膜培养7~14 d后发现,含10wt.% QADM单体的复合树脂在7 d内表现出明显的抑菌效果(较空白样CFU值下降了43%), 但7~14 d的测试结果没有显著性差异(p > 0.05), 即抗菌效果欠佳。因此,合成新型抗菌双甲基丙烯酸酯基季铵单体时,除了考虑其抗菌性能,还需兼顾单体转化率、力学性能和长效抗菌性能等。
鉴于双甲基丙烯酸酯基季铵盐类单体的加入对提高树脂力学性能的作用依然有限,Wang等人进一步合成了四甲基丙烯酸酯基季铵单体(Tetrafunctional methacrylate-based polymerizable quaternary ammonium monomer, TMQA), 其结构如图 14(c)所示,旨在通过增加甲基丙烯酸酯基基团的数目以提高交联度,提高复合树脂的力学性能[64]。TMQA的最低抑菌浓度(MIC)为7.81 μg/mL, 最低杀菌浓度(MBC) 为31.3 μg/mL, 与常用抗菌剂CHX和单甲基丙烯酸酯基季铵单体(2-methacryloxylethyl dodecyl methyl ammonium bromide, MAE-DB)的抗菌活性维持在同一数量级。但由于TMQA的分子量较高,树脂基体的粘度随着TMQA加入量的增加而增大,聚合过程中单体的流动性受到影响。因此,如果树脂基体中TMQA的浓度过高,超过树脂聚合物网络的可聚合能力,反而可能对树脂的结构和性能产生不利影响。综上可知,TMQA在含量控制得当的情况下,仍有望成为一种牙科复合树脂用新型有机单体类抗菌剂。
4 展望由于口腔细菌生物膜可在树脂基复合材料上沉积和生长,因此,在牙科复合树脂中加入抗菌剂可有效降低龋齿修复失败率,具有重要的临床研究意义和应用价值。相较于常见的银系抗菌剂和氟系抗菌剂,QACs作为最为典型的非释放型抗菌剂,在提高牙科复合树脂抗菌性能的研发中起着关键作用。近期研究表明,通过有机-无机杂化技术和无机填料表面改性方法可将QACs类有机单体成功接枝于无机填料表面,且所制得的有机-无机杂化填料的抗菌活性远高于QAM, 从而为牙科复合树脂用抗菌剂的设计和应用开拓了新的思路。此外,在抗菌型有机单体的选择方面,天然生物分子及其衍生物的化学结构也得到了科研工作者的广泛关注,为抗菌型牙科复合树脂的研发提供了更多选择。
此外,由于多数抗菌剂在满足抗菌性能的同时,无法避免地对复合树脂的单体转化率、力学性能、生物相容性或美观性产生负面的影响。因此,在新型抑菌剂的开发和应用中,不应以降低牙科复合树脂材料的物理-机械性能为代价,否则也将导致修复失败。同时,为了满足材料在口腔中的长期服役,抗菌活性的长期有效性也是后续研究工作中必须考量的重要指标之一。因此,抗菌牙科复合树脂的结构和组成仍需进一步进行探索和研究,以期满足材料的长期临床应用。
| [1] |
SELWITZ R H, ISMAIL A I, PITTS N B. Dental caries[J]. The Lancet, 2007, 369(9555): 51-59. DOI:10.1016/S0140-6736(07)60031-2 |
| [2] |
Global Burden of Disease Study C. Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990-2013: A systematic analysis for the global burden of disease study 2013[J]. The Lancet, 2015, 386(9995): 743-800. DOI:10.1016/S0140-6736(15)60692-4 |
| [3] |
DISEASE G B D, INJURY I, PREVALENCE C. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: A systematic analysis for the global burden of disease study 2015[J]. The Lancet, 2016, 388(10053): 1545-1602. DOI:10.1016/S0140-6736(16)31678-6 |
| [4] |
PERES M A, MACPHERSON L M D, WEYANT R J, et al. Oral diseases: A global public health challenge[J]. The Lancet, 2019, 394(10194): 249-260. DOI:10.1016/S0140-6736(19)31146-8 |
| [5] |
LYNCH C D, WILSON N H. Managing the phase-down of amalgam: Part I. Educational and training issues[J]. British Dental Journal, 2013, 215(3): 109-113. DOI:10.1038/sj.bdj.2013.737 |
| [6] |
UMESI D, OREMOSU O, MAKANJUOLA J. Amalgam phase down: Baseline data preceding implementation in nigeria: Data preceding amalgam phase down in nigeria[J]. International Dental Journal, 2020, 70: 161-166. DOI:10.1111/idj.12536 |
| [7] |
KHALAF M E, ALOMARI Q D, OMAR R. Factors relating to usage patterns of amalgam and resin composite for posterior restorations——a prospective analysis[J]. Journal of Dentistry, 2014, 42(7): 785-792. DOI:10.1016/j.jdent.2014.04.010 |
| [8] |
DELIGEORGI V, MJÖR I, WILSON N. An overview of and replacement reasons for the of restorations placement[J]. Primary Dental Care: Journal of the Faculty of General Dental Practitioners(UK), 2001, 8: 5-11. |
| [9] |
BEYTH N, FARAH S, DOMB A J, et al. Antibacterial dental resin composites[J]. Reactive & Functional Polymers, 2014, 75: 81-88. |
| [10] |
陈治清, 张彩霞, 郑增葵, 等. 口腔材料学[M]. 北京: 人民卫生出版社, 1995: 60-61. CHEN Zhiqing, ZHANG Caixia, ZHEN Zengkui, et al. Dental Materials[M]. Beijing: People′s Medical Publishing House, 1995: 60-61. |
| [11] |
王瑞莉, 朱美芳. 三级硅基填料的构筑及其对牙科复合树脂性能的影响[J]. 材料科学与工艺, 2020, 28(3): 24-30. WANG Ruili, ZHU Meifang. Construction of trimodal silica-based filler and its effects on properties of dental resin composites[J]. Materials Science and Technology, 2020, 28(3): 24-30. DOI:10.11951/j.issn.1005-0299.20200093 |
| [12] |
BRAEM M, FINGER W, VANDOREN V E, et al. Mechanical-properties and filler fraction of dental composites[J]. Dental Materials, 1989, 5(5): 346-349. DOI:10.1016/0109-5641(89)90128-0 |
| [13] |
MUNKSGAARD E C, HANSEN E K, KATO H. Wall-to-wall polymerization contraction of composite resins versus filler content[J]. Scandinavian Journal of Dental Research, 1987, 95(6): 526-531. |
| [14] |
DUKIC W, DELIJA B, DEROSSI D, et al. Radiopacity of composite dental materials using a digital X-ray system[J]. Dental Materials Journal, 2012, 31(1): 47-53. DOI:10.4012/dmj.2011-119 |
| [15] |
MIAO Xiaoli, LI Yaogang, ZHANG Qinghong, et al. Low shrinkage light curable dental nanocomposites using SiO2 microspheres as fillers[J]. Materials Science & Engineering C-Materials for Biological Applications, 2012, 32(7): 2115-2121. |
| [16] |
QIAN Li, WANG Ruili, LI Wei, et al. The synthesis of urchin-like serried hydroxyapatite(USHA)and its reinforcing effect for dental resin composites[J]. Macromolecular Materials and Engineering, 2019, 304(5): 1800738. DOI:10.1002/mame.201800738 |
| [17] |
YOSHIDA K, TANAGAWA M, ATSUTA M. Effects of filler composition and surface treatment on the characteristics of opaque resin composites[J]. Journal of Biomedical Materials Research, 2001, 58(5): 525-530. DOI:10.1002/jbm.1050 |
| [18] |
THORAT S, DIASPRO A, SALERNO M. Effect of alumina reinforcing fillers in bisgma-based resin composites for dental applications[J]. Advanced Materials Letters, 2013, 4: 15-21. DOI:10.5185/amlett.2013.icnano.283 |
| [19] |
ROUMANAS E D. The frequency of replacement of dental restorations may vary based on a number of variables, including type of material, size of the restoration, and caries risk of the patient[J]. Journal of Evidence Based Dental Practice, 2010, 10(1): 23-24. DOI:10.1016/j.jebdp.2009.11.009 |
| [20] |
RHO Y J, NAMGUNG C, JIN B H, et al. Longevity of direct restorations in stress-bearing posterior cavities: A retrospective study[J]. Operative Dentistry, 2013, 38(6): 572-582. DOI:10.2341/12-432-C |
| [21] |
KOPPERUD S E, TVEIT A B, GAARDEN T, et al. Longevity of posterior dental restorations and reasons for failure[J]. European Journal of Oral Sciences, 2012, 120(6): 539-548. DOI:10.1111/eos.12004 |
| [22] |
WANG Weiguo, SUN Xiang, HUANG Li, et al. Structure-property relationships in hybrid dental nanocomposite resins containing monofunctional and multifunctional polyhedral oligomeric silsesquioxanes[J]. International Journal of Nanomedicine, 2014, 9: 841-852. |
| [23] |
FERRACANE J L. Resin composite——state of the art[J]. Dental Materials, 2011, 27(1): 29-38. DOI:10.1016/j.dental.2010.10.020 |
| [24] |
NEDELJKOVIC I, DE MUNCK J, VANLOY A, et al. Secondary caries: Prevalence, characteristics, and approach[J]. Clinical Oral Investigations, 2020, 24(2): 683-691. DOI:10.1007/s00784-019-02894-0 |
| [25] |
BRAGA R R, BALLESTER R Y, FERRACANE J L. Factors involved in the development of polymerization shrinkage stress in resin-composites: A systematic review[J]. Dental Materials, 2005, 21(10): 962-970. DOI:10.1016/j.dental.2005.04.018 |
| [26] |
BRAGA R R, FERRACANE J L. Alternatives in polymerization contraction stress management[J]. Critical Reviews in Oral Biology & Medicine, 2004, 15(3): 176-184. |
| [27] |
JOKSTAD A. Secondary caries and microleakage[J]. Dental Materials, 2016, 32(1): 11-25. DOI:10.1016/j.dental.2015.09.006 |
| [28] |
SEEMANN R, FLURY S, PFEFFERKORN F, et al. Restorative dentistry and restorative materials over the next 20 years: A delphi survey[J]. Dental Materials, 2014, 30(4): 442-448. DOI:10.1016/j.dental.2014.01.013 |
| [29] |
BUSSCHER H J, RINASTITI M, SISWOMIHARDJO W, et al. Biofilm formation on dental restorative and implant materials[J]. Journal of Dental Research, 2010, 89(7): 657-665. DOI:10.1177/0022034510368644 |
| [30] |
SVANBERG M, MJOR I A, ORSTAVIK D. Mutans streptococci in plaque from margins of amalgam, composite, and glass-ionomer restorations[J]. Journal of Dental Research, 1990, 69(3): 861-864. DOI:10.1177/00220345900690030601 |
| [31] |
HANSEL C, LEYHAUSEN G, MAI U E M, et al. Effects of various resin composite(co)monomers and extracts on two caries-associated micro-organisms in vitro[J]. Journal of Dental Research, 1998, 77(1): 60-67. DOI:10.1177/00220345980770010601 |
| [32] |
KAWAI K, TSUCHITANI Y. Effects of resin composite components on glucosyltransferase of cariogenic bacterium[J]. Journal of Biomedical Materials Research, 2000, 51(1): 123-127. DOI:10.1002/(SICI)1097-4636(200007)51:1<123::AID-JBM16>3.0.CO;2-7 |
| [33] |
KENAWY E R. Biologically active polymers. IV. Synthesis and antimicrobial activity of polymers containing 8-hydroxyquinoline moiety[J]. Journal of Applied Polymer Science, 2001, 82(6): 1364-1374. DOI:10.1002/app.1973 |
| [34] |
朱美芳, 王瑞莉, 陈红艳, 等. 一种介孔材料基牙科抗菌复合树脂及其制备方法: CN109620739A[P]. 2019-04-16. ZHU Meifang, WANG Ruili, CHEN Hongyan, et al. A kind of mesoporous material-based dental antibacterial compound resin and preparation method: CN109620739A[P]. 2019-04-16. |
| [35] |
SRIVASTAVA R, SUN Y. Silver sulfadiazine immobilized glass as antimicrobial fillers for dental restorative materials[J]. Materials Science & Engineering C-Materials for Biological Applications, 2017, 75: 524-534. |
| [36] |
LIU Fengwei, WANG Ruili, SHI Yuyuan, et al. Novel Ag nanocrystals based dental resin composites with enhanced mechanical and antibacterial properties[J]. Progress in Natural Science: Materials International, 2013, 23(6): 573-578. DOI:10.1016/j.pnsc.2013.11.011 |
| [37] |
何丹农, 张彬, 周涓, 等. 一种基于纳米银的双重固化齿科抗菌粘结剂的制备方法: CN104546508A[P]. 2015-04-29. HE Dannong, ZHANG Bin, ZHOU Juan, et al. Method for preparing nano-silver-based dual-curing dental antibacterial adhesive: CN104546508A[P]. 2015-04-29. |
| [38] |
裴欢欢. 自酸蚀粘结剂的成分调控及抗菌性能[D]. 上海: 东华大学, 2018. PEI Huanhuan. Composition adjusting and antibacterial properties of self-etching adhesives[D]. Shanghai: Donghua University, 2018. |
| [39] |
BAROT T, RAWTANI D, KULKARNI P. Physicochemical and biological assessment of silver nanoparticles immobilized halloysite nanotubes-based resin composite for dental applications[J]. Heliyon, 2020, 6(3): e03601. DOI:10.1016/j.heliyon.2020.e03601 |
| [40] |
AI Miao, DU Zhiyun, ZHU Siqi, et al. Composite resin reinforced with silver nanoparticles-laden hydroxyapatite nanowires for dental application[J]. Dental Materials, 2017, 33(1): 12-22. DOI:10.1016/j.dental.2016.09.038 |
| [41] |
CHENG Yajun, ZEIGER D N, HOWARTER J A, et al. In situ formation of silver nanoparticles in photocrosslinking polymers[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2011, 97B(1): 124-131. DOI:10.1002/jbm.b.31793 |
| [42] |
RIDDLES C N, WHITED M, LOTLIKAR S R, et al. Synthesis and characterization of two cyanoxime ligands, their precursors, and light insensitive antimicrobial silver(I)cyanoximates[J]. Inorganica Chimica Acta, 2014, 412: 94-103. DOI:10.1016/j.ica.2013.12.006 |
| [43] |
NATALE L C, ALANIA Y, RODRIGUES M C, et al. Synthesis and characterization of silver phosphate/calcium phosphate mixed particles capable of silver nanoparticle formation by photoreduction[J]. Materials Science & Engineering C-Materials for Biological Applications, 2017, 76: 464-471. |
| [44] |
DIAS H B, BASSO BERNARDI M I, DOS SANTOS RAMOS M A, et al. Zinc oxide 3D microstructures as an antimicrobial filler content for composite resins[J]. Microscopy Research and Technique, 2017, 80(6): 634-643. DOI:10.1002/jemt.22840 |
| [45] |
COLLARES F M, GARCIA I M, KLEIN M, et al. Exploring needle-like zinc oxide nanostructures for improving dental resin sealers: Design and evaluation of antibacterial, physical and chemical properties[J]. Polymers, 2020, 12(4): 789-803. DOI:10.3390/polym12040789 |
| [46] |
CHEN Hongyan, WANG Ruili, ZHANG Jiadong, et al. Synthesis of core-shell structured ZnO@m---SiO2 with excellent reinforcing effect and antimicrobial activity for dental resin composites[J]. Dental Materials, 2018, 34(12): 1846-1855. DOI:10.1016/j.dental.2018.10.002 |
| [47] |
WANG Yazi, HUA Hongfei, LI Wei, et al. Strong antibacterial dental resin composites containing cellulose nanocrystal/zinc oxide nanohybrids[J]. Journal of Dentistry, 2019, 80: 23-29. DOI:10.1016/j.jdent.2018.11.002 |
| [48] |
刘玉玲, 王瑞莉, 李楠, 等. ZnO介晶填料的制备及其齿科复合树脂的性能[J]. 无机材料学报, 2019, 34(10): 1077-1084. LIU Yuling, WANG Ruili, LI Nan, et al. Preparation of zinc oxide mesocrystal filler and its properties as dental composite resin[J]. Journal of Inorganic Materials, 2019, 34(10): 1077-1084. |
| [49] |
SHEN Meng, LIANG Guozheng, GU Aijuan, et al. Development of high performance dental resin composites with outstanding antibacterial activity, high mechanical properties and low polymerization shrinkage based on SiO2 hybridized tetrapod-like zinc oxide whisker with C=C bonds[J]. RSC Advances, 2016, 6: 56353-56364. DOI:10.1039/C6RA13498J |
| [50] |
DIAS H B, BERNARDI M I B, MARANGONI V S, et al. Synthesis, characterization and application of Ag doped ZnO nanoparticles, in a composite resin[J]. Materials Science & Engineering C-Materials for Biological Applications, 2019, 96: 391-401. |
| [51] |
DIAS H B, BASSO BERNARDI M I, BAUAB T M, et al. Titanium dioxide and modified titanium dioxide by silver nanoparticles as an anti biofilm filler content for composite resins[J]. Dental Materials, 2019, 35(2): E36-E46. DOI:10.1016/j.dental.2018.11.002 |
| [52] |
CHAMBERS C, STEWART S B, SU B, et al. Silver doped titanium dioxide nanoparticles as antimicrobial additives to dental polymers[J]. Dental Materials, 2017, 33(3): e115-e123. DOI:10.1016/j.dental.2016.11.008 |
| [53] |
ZANE A, ZUO R, VILLAMENA F A, et al. Biocompatibility and antibacterial activity of nitrogen-doped titanium dioxide nanoparticles for use in dental resin formulations[J]. International Journal of Nanomedicine, 2016, 11: 6459-6470. DOI:10.2147/IJN.S117584 |
| [54] |
KULSHRESTHA S, KHAN S, HASAN S, et al. Calcium fluoride nanoparticles induced suppression of streptococcus mutans biofilm: An in vitro and in vivo approach[J]. Applied Microbiology and Biotechnology, 2016, 100(4): 1901-1914. DOI:10.1007/s00253-015-7154-4 |
| [55] |
HESARAKI S, KARIMI M, NEZAFATI N. The synergistic effects of SrF2 nanoparticles, YSZ nanoparticles, and poly-ε-L-lysin on physicomechanical, ion release, and antibacterial-cellular behavior of the flowable dental composites[J]. Materials Science & Engineering C, Materials for Biological Applications, 2020, 109: 110592-110592. |
| [56] |
TAMMARO L, DI SALLE A, CALARCO A, et al. Multifunctional bioactive resin for dental restorative materials[J]. Polymers, 2020, 12(2): 332-349. DOI:10.3390/polym12020332 |
| [57] |
LUO Dong, SHAHID S, HASAN S M, et al. Controlled release of chlorhexidine from a HEMA-UDMA resin using a magnetic field[J]. Dental Materials, 2018, 34(5): 764-775. DOI:10.1016/j.dental.2018.02.001 |
| [58] |
CIDREIRA BOARO L C, CAMPOS L M, COSTA VARCA G H, et al. Antibacterial resin-based composite containing chlorhexidine for dental[J]. Dental Materials, 2019, 35(6): 909-918. DOI:10.1016/j.dental.2019.03.004 |
| [59] |
DE PAULA A B, TAPARELLI J R, BRUSCHI ALONSO R C, et al. Synthesis and application of triclosan methacrylate monomer in resin composites[J]. Clinical Oral Investigations, 2019, 23(2): 965-974. DOI:10.1007/s00784-018-2521-z |
| [60] |
IMAZATO S, TORII M, TSUCHITANI Y, et al. Incorporation of bacterial inhibitor into resin composite[J]. Journal of Dental Research, 1994, 73(8): 1437-1443. DOI:10.1177/00220345940730080701 |
| [61] |
WENG Yiming, GUO Xia, CHONG V, et al. Synthesis and evaluation of a novel antibacterial dental resin composite with quaternary ammonium salts[J]. Journal of Biomedical Science and Engineering, 2011, 443021: 147-157. |
| [62] |
LI Shuangli, YU Xiaolin, LIU Fang, et al. Synthesis of antibacterial dimethacrylate derived from niacin and its application in preparing antibacterial dental resin system[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2020, 102: 103521. DOI:10.1016/j.jmbbm.2019.103521 |
| [63] |
MELO M A S, WEIR M D, PASSOS V F, et al. Human in situ study of the effect of bis(2-methacryloyloxyethyl)dimethylammonium bromide immobilized in dental composite on controlling mature cariogenic biofilm[J]. International Journal of Molecular Sciences, 2018, 19(11): 3443-3456. DOI:10.3390/ijms19113443 |
| [64] |
WANG Weiguo, WU Fan, ZHANG Guoqing, et al. Preparation of a highly crosslinked biosafe dental nanocomposite resin with a tetrafunctional methacrylate quaternary ammonium salt monomer[J]. RSC Advances, 2019, 9(71): 41616-41627. DOI:10.1039/C9RA09173D |
| [65] |
刘朗, 丰俊东, 沈应中, 等. 高价银配合物的制备、表征及抗菌性能研究[J]. 化学通报, 2017, 80(4): 378-384. LIU Lang, FENG Jundong, SHEN Yingzhong, et al. Preparations, characterizations and antibacterial activities of high-valence silver complexes[J]. Chemistry Bulletin, 2017, 80(4): 378-384. |
| [66] |
墙蔷, 倪红卫, 幸伟, 等. 银的抗菌作用机理[J]. 武汉科技大学学报(自然科学版), 2007(2): 121-124. QIANG Qiang, NI Hongwei, XING Wei, et al. Antibacterial mechanism of silver[J]. Journal of Wuhan University of Science and Technology(Natural Science Edition), 2007(2): 121-124. DOI:10.3969/j.issn.1674-3644.2007.02.003 |
| [67] |
DAMM C. Silver ion release from polymethyl methacrylate silver nanocomposites[J]. Polymers & Polymer Composites, 2005, 13(7): 649-656. |
| [68] |
SONDI I, SALOPEK-SONDI B. Silver nanoparticles as antimicrobial agent: A case study on E. coli as a model for gram-negative bacteria[J]. Journal of Colloid and Interface Science, 2004, 275(1): 177-182. DOI:10.1016/j.jcis.2004.02.012 |
| [69] |
FENG Q L, WU J, CHEN G Q, et al. A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus[J]. Journal of Biomedical Materials Research, 2000, 52(4): 662-668. DOI:10.1002/1097-4636(20001215)52:4<662::AID-JBM10>3.0.CO;2-3 |
| [70] |
HOSKINS J S, KARANFIL T, SERKIZ S M. Removal and sequestration of iodide using silver-impregnated activated carbon[J]. Environmental Science & Technology, 2002, 36(4): 784-789. |
| [71] |
DAMM C, MUENSTED H, ROESCH A. Long-term antimicrobial polyamide 6/silver-nanocomposites[J]. Journal of Materials Science, 2007, 42(15): 6067-6073. DOI:10.1007/s10853-006-1158-5 |
| [72] |
TANG Shaoheng, ZHENG Jie. Antibacterial activity of silver nanoparticles: Structural effects[J]. Advanced Healthcare Materials, 2018, 7(13): 1701503. DOI:10.1002/adhm.201701503 |
| [73] |
SHI Yuyuan, SUN Bin, ZHOU Zhe, et al. Size-controlled and large-scale synthesis of organic-soluble Ag nanocrystals in water and their formation mechanism[J]. Progress in Natural Science: Materials International, 2011, 21(6): 447-454. DOI:10.1016/S1002-0071(12)60081-1 |
| [74] |
LV Yaohui, LIU Hong, WANG Zhen, et al. Silver nanoparticle-decorated porous ceramic composite for water treatment[J]. Journal of Membrane Science, 2009, 331(1): 50-56. |
| [75] |
DANG VIET Q, SARAWADE P B, HILONGA A, et al. Facile route for preparation of silver nanoparticle-coated precipitated silica[J]. Applied Surface Science, 2011, 257(9): 4250-4256. DOI:10.1016/j.apsusc.2010.12.031 |
| [76] |
TAGLIETTI A, ARCIOLA C R, D'AGOSTINO A, et al. Antibiofilm activity of a monolayer of silver nanoparticles anchored to an amino-silanized glass surface[J]. Biomaterials, 2014, 35(6): 1779-1788. DOI:10.1016/j.biomaterials.2013.11.047 |
| [77] |
DURNER J, STOJANOVIC M, URCAN E, et al. Influence of silver nano-particles on monomer elution from light-cured composites[J]. Dental Materials, 2011, 27(7): 631-636. DOI:10.1016/j.dental.2011.03.003 |
| [78] |
SAKAMOTO M, FUJISTUKA M, MAJIMA T. Light as a construction tool of metal nanoparticles: Synthesis and mechanism[J]. Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2009, 10(1): 33-56. DOI:10.1016/j.jphotochemrev.2008.11.002 |
| [79] |
SIRELKHATIM A, MAHMUD S, SEENI A, et al. Review on zinc oxide nanoparticles: Antibacterial activity and toxicity mechanism[J]. Nano-Micro Letters, 2015, 7(3): 219-242. DOI:10.1007/s40820-015-0040-x |
| [80] |
DJURIŠIĈ A B, LEUNG Y H, NG A M C, et al. Toxicity of metal oxide nanoparticles: Mechanisms, characterization, and avoiding experimental artefacts[J]. Small, 2015, 11(1): 26-44. DOI:10.1002/smll.201303947 |
| [81] |
JIANG Yunlong, ZHANG Lingling, WEN Dongsheng, et al. Role of physical and chemical interactions in the antibacterial behavior of ZnO nanoparticles against e. Coli[J]. Materials Science & Engineering C-Materials for Biological Applications, 2016, 69: 1361-1366. |
| [82] |
TAVASSOLI HOJATI S, ALAGHEMAND H, HAMZE F, et al. Antibacterial, physical and mechanical properties of flowable resin composites containing zinc oxide nanoparticles[J]. Dental Materials, 2013, 29(5): 495-505. DOI:10.1016/j.dental.2013.03.011 |
| [83] |
SILVA R M, PEREIRA F V, MOTA F A P, et al. Dental glass ionomer cement reinforced by cellulose microfibers and cellulose nanocrystals[J]. Materials Science and Engineering: C, 2016, 58: 389-395. DOI:10.1016/j.msec.2015.08.041 |
| [84] |
QI Kezhen, CHENG Bei, YU Jiaguo, et al. Review on the improvement of the photocatalytic and antibacterial activities of ZnO[J]. Journal of Alloys and Compounds, 2017, 727: 792-820. DOI:10.1016/j.jallcom.2017.08.142 |
| [85] |
XIE Wei, LI Yuanzhi, SUN Wei, et al. Surface modification of ZnO with Ag improves its photocatalytic efficiency and photostability[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2010, 216(2): 149-155. |
| [86] |
GHOSH S, GOUDAR V S, PADMALEKHA K G, et al. ZnO/Ag nanohybrid: Synthesis, characterization, synergistic antibacterial activity and its mechanism[J]. RSC Advances, 2012, 2(3): 930-940. DOI:10.1039/C1RA00815C |
| [87] |
FLOREZ F L E, HIERS R D, LARSON P, et al. Antibacterial dental adhesive resins containing nitrogen-doped titanium dioxide nanoparticles[J]. Materials Science & Engineering C-Materials for Biological Applications, 2018, 93: 931-943. |
| [88] |
SUN Jirun, PETERSEN E J, WATSON S S, et al. Biophysical characterization of functionalized titania nanoparticles and their application in dental adhesives[J]. Acta Biomaterialia, 2017, 53: 585-597. DOI:10.1016/j.actbio.2017.01.084 |
| [89] |
SODAGAR A, AKHOUNDI M S A, BAHADOR A, et al. Effect of TiO2 nanoparticles incorporation on antibacterial properties and shear bond strength of dental composite used in orthodontics[J]. Dental Press Journal of Orthodontics, 2017, 22(5): 67-74. DOI:10.1590/2177-6709.22.5.067-074.oar |
| [90] |
SUN Jirun, WATSON S S, ALLSOPP D A, et al. Tuning photo-catalytic activities of TiO2 nanoparticles using dimethacrylate resins[J]. Dental Materials, 2016, 32(3): 363-372. DOI:10.1016/j.dental.2015.11.021 |
| [91] |
RAORANE D V, CHAUGHULE R S, PEDNEKAR S R, et al. Experimental synthesis of size-controlled TiO2 nanofillers and their possible use as composites in restorative dentistry[J]. The Saudi Dental Journal, 2019, 31(2): 194-203. DOI:10.1016/j.sdentj.2019.01.008 |
| [92] |
CHOI J, PARK H, HOFFMANN M R. Effects of single metal-ion doping on the visible-light photoreactivity of TiO2[J]. Journal of Physical Chemistry C, 2010, 114(2): 783-792. DOI:10.1021/jp908088x |
| [93] |
YU J C, YU Jiaguo, HO Wingkei, et al. Effects of F-doping on the photocatalytic activity and microstructures of nanocrystalline TiO2 powders[J]. Chemistry of Materials, 2002, 14(9): 3808-3816. DOI:10.1021/cm020027c |
| [94] |
ASAHI R, MORIKAWA T, OHWAKI T, et al. Visible-light photocatalysis in nitrogen-doped titanium oxides[J]. Science, 2001, 293(5528): 269-271. DOI:10.1126/science.1061051 |
| [95] |
ESHED M, LELLOUCHE J, BANIN E, et al. MgF2 nanoparticle-coated teeth inhibit streptococcus mutans biofilm formation on a tooth model[J]. Journal of Materials Chemistry B, 2013, 1(32): 3985-3991. DOI:10.1039/c3tb20598c |
| [96] |
SUTTON S V W, BENDER G R, MARQUIS R E. Fluoride inhibition of proton-translocating ATPases of oral bacteria[J]. Infection and Immunity, 1987, 55(11): 2597-2603. DOI:10.1128/IAI.55.11.2597-2603.1987 |
| [97] |
LIAO Ying, BRANDT B, LI Jiyao, et al. Fluoride resistance in streptococcus mutans: A mini review[J]. Journal of Oral Microbiology, 2017, 9: 1344509. DOI:10.1080/20002297.2017.1344509 |
| [98] |
SOBUE S, SUZUKI T, YAMAGA R, et al. Caries preventive effects of SrF2-cement filled in the proximal portion of acrylic space maintainer[J]. The Journal of Osaka University Dental School, 1974, 14: 37-60. |
| [99] |
WIEGAND A, BUCHALLA W, ATTIN T. Review on fluoride-releasing restorative materials-fluoride release and uptake characteristics, antibacterial activity and influence on caries formation[J]. Dental Materials, 2007, 23(3): 343-362. DOI:10.1016/j.dental.2006.01.022 |
| [100] |
CARRENO N L V, OLIVEIRA T C S, PIVA E, et al. YbF3/SiO2 fillers as radiopacifiers in a dental adhesive resin[J]. Nano-Micro Letters, 2012, 4(3): 189-196. DOI:10.1007/BF03353713 |
| [101] |
FLEMMING H C, WINGENDER J. The biofilm matrix[J]. Nature Reviews Microbiology, 2010, 8(9): 623-633. DOI:10.1038/nrmicro2415 |
| [102] |
SUN Limin, CHOW L C. Preparation and properties of nano-sized calcium fluoride for dental applications[J]. Dental Materials, 2008, 24(1): 111-116. DOI:10.1016/j.dental.2007.03.003 |
| [103] |
XU H H K, MOREAU J L, SUN L, et al. Novel CaF2 nanocomposite with high strength and fluoride ion release[J]. Journal of Dental Research, 2010, 89(7): 739-745. DOI:10.1177/0022034510364490 |
| [104] |
TAMMARO L, VITTORIA V, CALARCO A, et al. Effect of layered double hydroxide intercalated with fluoride ions on the physical, biological and release properties of a dental composite resin[J]. Journal of Dentistry, 2014, 42(1): 60-67. DOI:10.1016/j.jdent.2013.10.019 |
| [105] |
SHEN Ya, STOJICIC S, HAAPASALO M. Antimicrobial efficacy of chlorhexidine against bacteria in biofilms at different stages of development[J]. Journal of Endodontics, 2011, 37(5): 657-661. DOI:10.1016/j.joen.2011.02.007 |
| [106] |
FARRUGIA C, CAMILLERI J. Antimicrobial properties of conventional restorative filling materials and advances in antimicrobial properties of composite resins and glass ionomer cements——a literature review[J]. Dental Materials, 2015, 31(4): e89-e99. DOI:10.1016/j.dental.2014.12.005 |
| [107] |
LEUNG D, SPRATT D A, PRATTEN J, et al. Chlorhexidine-releasing methacrylate dental composite materials[J]. Biomaterials, 2005, 26(34): 7145-7153. DOI:10.1016/j.biomaterials.2005.05.014 |
| [108] |
LUO Dong, SHAHID S, SUKHORUKOV G B, et al. Synthesis of novel chlorhexidine spheres with controlled release from a UDMA-HEMA resin using ultrasound[J]. Dental Materials, 2017, 33(6): 713-722. DOI:10.1016/j.dental.2017.04.003 |
| [109] |
YAZDANKHAH S P, SCHEIE A A, HϕIBY E A, et al. Triclosan and antimicrobial resistance in bacteria: An overview[J]. Microbial Drug Resistance, 2006, 12(2): 83-90. DOI:10.1089/mdr.2006.12.83 |
| [110] |
TEPLOVA V V, BELOSLUDTSEV K N, KRUGLOV A G. Mechanism of triclosan toxicity: Mitochondrial dysfunction including complex II inhibition, superoxide release and uncoupling of oxidative phosphorylation[J]. Toxicology Letters, 2017, 275: 108-117. DOI:10.1016/j.toxlet.2017.05.004 |
| [111] |
RATHKE A, STAUDE R, MUCHE R, et al. Antibacterial activity of a triclosan-containing resin composite matrix against three common oral bacteria[J]. Journal of Materials Science: Materials in Medicine, 2010, 21(11): 2971-2977. DOI:10.1007/s10856-010-4126-1 |
| [112] |
DE SOUZA ARAǗJO I J, DE PAULA A B, BRUSCHI ALONSO R C, et al. A novel triclosan methacrylate-based composite reduces the virulence of streptococcus mutans biofilm[J]. Plos One, 2018, 13(4): e0195244-e0195244. DOI:10.1371/journal.pone.0195244 |
| [113] |
COCCO A R, DE OLIVEIRA DA ROSA W L, DA SILVA A F, et al. A systematic review about antibacterial monomers used in dental adhesive systems: Current status and further prospects[J]. Dental Materials, 2015, 31(11): 1345-1362. DOI:10.1016/j.dental.2015.08.155 |
| [114] |
CHENG Lei, WEIR M D, ZHANG Ke, et al. Dental primer and adhesive containing a new antibacterial quaternary ammonium monomer dimethylaminododecyl methacrylate[J]. Journal of Dentistry, 2013, 41(4): 345-355. DOI:10.1016/j.jdent.2013.01.004 |
| [115] |
MAKVANDI P, JAMALEDIN R, JABBARI M, et al. Antibacterial quaternary ammonium compounds in dental materials: A systematic review[J]. Dental Materials, 2018, 34(6): 851-867. DOI:10.1016/j.dental.2018.03.014 |
| [116] |
ZHOU Xinxuan, HUANG Xiaoyu, LI Mingyun, et al. Development and status of resin composite as dental restorative materials[J]. Journal of Applied Polymer Science, 2019, 136(44): 48180. DOI:10.1002/app.48180 |
| [117] |
BELKHIR K, LACROIX M, JAMSHIDIAN M, et al. Evaluation of antibacterial activity of branched quaternary ammonium grafted green polymers[J]. Food Packaging and Shelf Life, 2017, 12: 28-41. DOI:10.1016/j.fpsl.2017.02.005 |
 2021, Vol. 29
2021, Vol. 29