2. 中国地质大学(武汉) 环境学院,武汉 430074
2. School of Environmental Studies, China University of Geosciences(Wuhan), Wuhan 430074, China
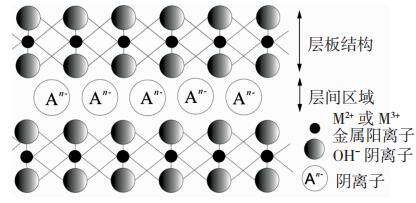
层状双氢氧化物,也称层状双羟基复合金属氧化物(Layered Double Hydroxide, LDH),是天然存在同时可通过廉价化学试剂实验室合成的新型材料[1]。LDHs的单元结构为金属-(氢)氧八面体,如图 1所示,片层内部带正电荷的金属阳离子通过吸附片层外部的阴离子以平衡片层整体的电中性。层状双氢氧化物的化学通式为[M1-x2+Mx3+(OH)2(An-)x/n]·mH2O[2-3],其中M2+、M3+分别表示片层上2、3价金属阳离子;An-表示层间吸附的阴离子,m、x、上标n分别表示水分子数、金属元素的摩尔比和层间阴离子所带电荷数,已知当x取0.2~0.33时,所得产物纯净[1, 4-5]。这种特殊的结构决定了层状双氢氧化物具有较大的比表面积、离子交换容量大、良好的热稳定性和记忆效应等特点,因此在吸附、催化[6-8]、离子交换[9]、医学、光学[10]和食品[11]等领域得到广泛应用。前期研究结果表明片层由Fe3+取代Mg2+的Mg/Fe型层状双氢氧化物不仅可以有效吸附废水中As、W、Mo、Pb等重金属元素和F-、PO43-、有机染料等阴离子[12-17],还在建筑材料加固、催化、阻燃和脱色等应用领域中表现出色[18-20],因此研究Mg/Fe型层状双氢氧化物合成方法的优化及插层离子的选择对该材料的发展和应用都具有重要意义。
|
图 1 层状双氢氧化物结构示意图 Fig.1 Schematic diagram of layered double hydroxide structure |
常用的层状双氢氧化物合成方法中,共沉淀法制备的合成产物晶化程度较低,颗粒尺寸不易控制,且合成过程中产生大量碱性污水[21-23];离子交换法基于已有的层状双氢氧化物与溶液中目标离子发生离子交换,形成一种新的层状双氢氧化物,该方法受限于层间原有离子的可交换性和溶液中离子的可插入性[24];焙烧复原法则利用层状双氢氧化物的“记忆效应”,在适当的温度下焙烧后层状结构崩塌,层间阴离子释放,再次置于其他阴离子溶液中能够生成新的层状双氢氧化物,该方法对温度和实验条件提出了较高的要求,增加了能量的消耗[25-29]。上述方法合成的层状双氢氧化物层间阴离子主要为Cl-、NO3-、CO32-等,在实际吸附应用中因离子交换作用导致层间阴离子大量释放至处理好的溶液中,焙烧处理也不能完全去除层间的阴离子组分,潜在的二次污染问题不容忽视。
而机械化学合成法通过研磨球在研磨罐中使颗粒发生剧烈碰撞,提高反应物活性,诱发化学反应发生,最终合成目标层状双氢氧化物。该方法大量减少了溶剂的使用,还可减少有毒气体和废液等的排放,因此在合成LDH材料方面有明显的优势[30-32]。Ay、Iwasaki和Fahami等人[30, 33-34]采用氢氧化镁和铝盐或氢氧化铝合成了Mg/Al型的层状双氢氧化物,Qu等人[35]也曾报道使用机械化学法合成Li/Al型层状双氢氧化物,但鲜少报道制备Mg/Fe型层状双氢氧化物的研究成果。一方面铁(氢)氧化物结构稳定,Mg2+和Fe3+的半径相差较大,普通的机械撞击和研磨很难改变其化学结构和表面形态,Fe3+不易进入Mg2+行列中,从而加大了Mg/Fe型层状双氢氧化物机械化学法的合成难度;另一方面铁盐材料虽然具有较高的化学活性,但合成系统中不可避免的引入了其他阴离子。基于此,本文采用改进的机械化学合成法制备层间为羟基插层的Mg/Fe型层状双氢氧化物(Mg-Fe-OH-LDH),优化反应物前驱,不引入二次污染的阴离子,在一定的条件下机械研磨,并将混合物置于适宜温度下晶化。探究研磨强度、研磨时间和晶化条件对合成产物晶体结构的影响,阐述合成Mg/Fe型层状双氢氧化物材料的关键步骤;对合成产物进行XRD、SEM、FT-IR及比表面积分析,探究Mg/Fe型层状双氢氧化物的结构、形貌和结晶纯度等,对实用新型材料的开发、环境保护和能源利用等方面具有重要的现实意义。
1 实验 1.1 机械化学合成方法本文设计了4种实验方案,具体如表 1所示。过程如下:方案A中前驱物分别取10.8 g和6.96 g于尼龙罐中,加入球径约为0.9 cm的玛瑙球作研磨介质(玛瑙球与反应物质量比为80 ∶1),室温下研磨24 h后取出混合物,加去离子水约500 mL于1 L烧杯中,在80 ℃下晶化4 h后取出。将悬浮液洗涤2~3次,至上层清液的电导率低于200 μs/cm,在45 ℃下干燥后得到固体产物待测;方案B中前驱物质量分别为11.3 g和24.7 g,制取工艺与方案A相同;方案C中前驱物质量分别为5.81 g和6.56 g,研磨和晶化分别做了24 h和48 h两组平行实验,其余制取工艺与方案A相同;方案D中球粉比为40 ∶1,研磨设备为行星球磨机,研磨时间为1.5 h, 晶化时间分别做了4、16、24和48 h 4组对照试验,前驱物与制取工艺与方案C相同。
| 表 1 实验方案 Table 1 Experimental scheme |
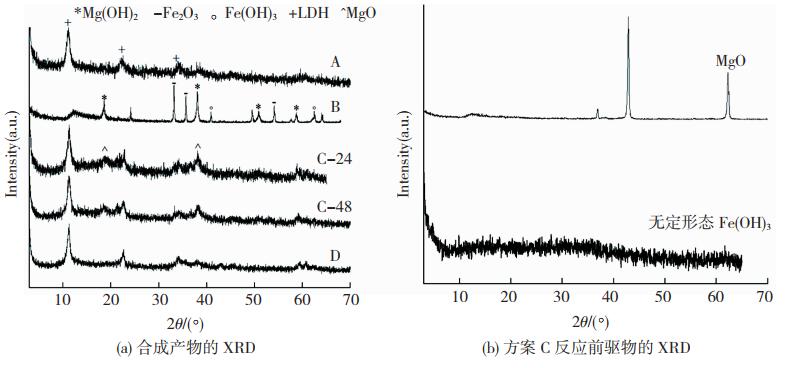
方案C中因铁源(结晶良好的Fe(OH)3)结构稳定,普通的机械研磨很难破坏其化学结构,导致反应发生不彻底,选用了无定形态的Fe(OH)3,制备方法如下:称取FeCl3·6H2O 13.5 g和NaOH 6.3 g分别加去离子水溶解后,将铁盐溶液缓慢溶解于匀速搅拌的NaOH溶液中,悬浮液离心、洗涤、干燥后得到的反应前驱物中的铁源,XRD结果显示该反应前驱物为无定型态的Fe(OH)3(图 2(b))。
|
图 2 不同实验条件下合成产物的XRD图谱 Fig.2 XRD patterns of synthesized products under different experimental conditions: (a)XRD patterns of synthesized products; (b) XRD patterns of reaction precursors in scheme C |
利用微波消解法分析合成产物的成分:将一定量的固体完全溶解于浓HNO3溶液中,采用美国Thermo Scientific公司生产的iCAP RQ型电感耦合等离子体质谱仪(ICP-MS)检测溶液中Mg和Fe的含量,计算合成产物的化学结构式;采用荷兰PANalytical公司生产的X’Pert PRO DY2198型X射线衍射仪(XRD)分析产物的矿物组成及晶体结构,选择CuKα射线(波长λ=0.154 nm),测试步长为0.002°,每步间隔时间约为5 s,测试前待测样品需研磨后过200目筛网,并将过筛后的粉末均匀铺平于测样模具中,放入衍射仪内进行检测;采用荷兰FEI公司生产的装有X衍射线能谱仪的FEI Quanta200型环境扫描电子显微镜(SEM-EDX)考察样品外部的形貌、大小、团聚现象和晶体颗粒的排列等,采用X射线能谱仪进一步分析产物元素;采用德国Bruker公司生产的VERTEX-70型红外光谱仪测定傅里叶红外光谱(FT-IR)谱图,表征合成产物官能团的振动波长,测试前需将KBr(100~200 mg)与固体样品(1~2 mg)在玛瑙研钵中研磨成微米级的细粉,采用专用的压片设备,压制成直径13 mm、厚度约1 mm的透明薄片;采用美国Micromeritics公司生产的Micromeritics ASAP2020仪器测定比表面积:将固体产物150 ℃脱气6 h,N2做吸附气体,以气体吸附BET原理(Brunauer、Emmett和Teller)测定固态物质的比表面积,利用BET方法对合成物的孔径、孔容等孔结构进行表征;采用天津喀纳斯光学分析仪器有限公司生产的721型可见分光光度计测定刚果红的质量浓度:将已知浓度的刚果红溶液置于比色皿中,在特征波长为488 nm处测定溶液的吸光度,根据配置的溶液浓度与吸光度绘制吸光度-质量浓度标准曲线,测定样品中刚果红的质量浓度。
1.3 吸附实验方法 1.3.1 磷酸根吸附实验称取0.219 5 g KH2PO4,用去离子水配制成质量浓度为200 mg/L(以磷计)的贮备液,使用时按比例稀释成相应含磷量的标准溶液(10、50、100和200 mg/L),分别加入0.1 g Mg-Fe-OH-LDH,在室温(20±2)℃条件下恒温震荡24 h,然后过滤并取滤液,采用离子色谱检测磷酸根的浓度。
1.3.2 刚果红吸附实验配置质量浓度为200 mg/L的刚果红储备液(称取0.05 g刚果红溶解于去离子水中,并定容于250 mL的容量瓶中),实验时按照比例稀释成相应含量(25、50、100和200 mg/L),分别加入0.1 g的Mg-Fe-OH-LDH,在室温(20±2)℃条件下恒温震荡24 h,取出混合液进行离心分离,测定上清液中刚果红的含量。
根据下式计算出不同条件下Mg-Fe-OH-LDH对磷酸根及刚果红的吸附容量。
| $q = ({C_0} - C)V/m $ | (1) |
式中:q为吸附量,mg/g;C0为初始浓度,mg/L;C为平衡浓度,mg/L;V为反应溶液体积,L;m为吸附剂投加量,g。
2 分析与讨论 2.1 合成产物的XRD结果分析 2.1.1 不同反应前驱物对合成产物的影响图 2(a)为表 1中4种实验方案合成的产物XRD图谱。方案A产物的XRD图谱中(图 2(a)中A曲线)出现了层状双氢氧化物的特征衍射峰,表明产物为Cl-插层的Mg/Fe型层状双氢氧化物(Mg-Fe-Cl-LDH)[4];为合成以—OH羟基插层的Mg/Fe型层状双氢氧化物(Mg-Fe-OH-LDH),方案B将前驱物中铁源替换为Fe2O3,其余条件不变,产物中仅有少量Fe(OH)3生成,主要成分仍为反应前驱物的混合物(图 2(a)中B曲线),表明两者未能发生化学改变,未生成层状双氢氧化物,说明该实验的反应前驱物不具备合成条件;方案C的反应前驱物为结晶良好的MgO和无定形态的Fe(OH)3(图 2(b)),在球粉比及研磨设备不变的条件下,分别研磨了24 h(图 2(a)中C-24曲线)和48 h(图 2(a)中C-48曲线)。由XRD图谱可观察出合成产物具备层状双氢氧化物特征衍射峰,但产物中残留少量的Mg(OH)2,说明该实验方案的铁源和镁源可合成目标产物Mg-Fe-OH-LDH;方案D同样选用MgO和无定形态的Fe(OH)3,为优化产物纯净度研磨设备更改为行星球磨机,在晶化时间达到48 h后前驱物全部参与反应,产物具备层状双氢氧化物特征衍射峰(图 2(a)中D曲线),基线整体稳定、无杂峰。由于反映前驱物为结晶良好的MgO和无定形态的Fe(OH)3,MgO不含水,Fe(OH)3经干燥至重量不变后参与反应,说明该反应未引入液态水;另外,氢氧化铁微波消解后计算各元素配比得出不含结晶水,因此在合成过程中水含量的影响极小可忽略不计。本文的Mg/Fe型层状双氢氧化物是在大气中制备的,前驱物中Mg元素和Fe元素均为自身稳定价态(Mg2+和Fe3+),制备过程中也未添加氧化还原剂,所以合成产物中Mg元素和Fe元素以Mg2+和Fe3+的形态存在;且反应未引入其他阴离子组分,表明产物为—OH插层的Mg/Fe型层状双氢氧化物(Mg-Fe-OH-LDH),经微波消解后,检测主要元素组分的含量,结果如表 2所示,合成产物的Mg/Fe比为2.96,与理论比值3相近,依据电荷平衡和质量守恒原则计算产物的化学结构式为Mg2.96Fe(OH)8.94·0.942H2O。
| 表 2 方案D中合成产物的化学组成 Table 2 Chemical composition of synthesized product in scheme D |
表 3利用Jade5.0软件分析得到合成样品XRD图谱中(003)晶面对应衍射峰的层间距、半高宽、衍射角等参数,样品A(Mg-Fe-Cl-LDH)与样品D(Mg-Fe-OH-LDH)对应的层间距d(003)取值分别为0.793和0.779 nm,半高宽β(003)分别为0.682°和0.556°,衍射角θ(003)分别为5.553°和5.703°,据Sherrer公式可以计算晶体在c轴方向上的晶粒大小。结果显示以羟基插层的样品D(Mg-Fe-OH-LDH)晶胞在c轴上的大小为14.4 nm,氯离子插层的样品A(Mg-Fe-Cl-LDH) 晶胞大小为11.7 nm。两者晶胞参数相差无几,具有相似的晶体结构和良好的塑性和韧性,而羟基插层的样品D相对于氯离子插层的样品A在实际应用中因不会引入二次污染的阴离子而更加环保。
| 表 3 利用Sherrer公式计算晶粒大小 Table 3 Grain size calculated by Sherrer formula |
图 2(a)的中曲线C-24和C-48分别对应方案C中利用罐磨机研磨24、48 h后合成产物的XRD图谱,罐磨机的转速不到100 r/min,提供的机械能有限,经比对,产物同时具有层状双氢氧化物和Mg(OH)2的特征峰,但研磨时间增加后产物的图谱相对平滑,杂峰减少,且Mg(OH)2特征峰稍有降低,表明在该研磨条件下延长研磨时间仅有限地减少杂质的生成;方案D采用高能行星球磨机,转速可达400 r/min,研磨仅持续1.5 h,晶化48 h后产物XRD图谱基线平稳,且全部为层状双氢氧化物的特征峰,表明选取能量更高的行星球磨机,增加颗粒间的碰撞强度,即使在较短的研磨时间下也可使前驱物充分混合,加速合成反应的发生,并且获得纯净、单一的层状双氢氧化物矿物。
值得注意的是,方案D中利用高能球磨机机械研磨的产物中始终没有出现Mg(OH)2的特征衍射峰(图 2),而在方案C利用能量较低的罐磨机合成的产物中会残留较多的Mg(OH)2。这是因为Mg(OH)2是Fe(OH)3和MgO在合成LDH过程中产生的中间产物[36],在较短的研磨时间下,罐磨机不能提供混合物所需的反应激活能,铁离子不易越过能垒扩散进入片层间,阴离子的扩散速率也较低,难以满足直接合成LDH的反应条件,在过渡阶段首先生成了Mg(OH)2,这一点也充分说明了高能机械研磨在制备高活性材料中的重要作用。
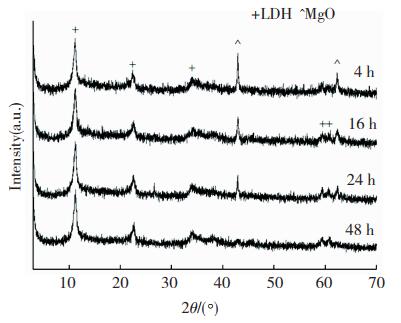
2.1.3 晶化时间对合成产物的影响为了得到合成产物的最优实验条件,实验考察了晶化时间的长短对产物结晶形态的影响。据水热法知适宜的温度可加速晶粒分解和分子扩散,故将研磨后的混合物溶解于超纯水中在80 ℃下晶化。图 3显示方案D条件下不同的晶化时间(4、16、24和48 h)合成产物的XRD谱图。晶化4、16和24 h时,图谱中都同时存在目标产物层状双氢氧化物和前驱物MgO的特征衍射峰。但随着晶化时间的增长,层状双氢氧化物的衍射峰越来越尖锐,相反MgO的衍射峰逐渐降低,这种趋势直到晶化时间达到48 h后发生改变,表现为MgO衍射峰完全消失。前驱物在反应前按镁铁比例确定了MgO和无定形态的Fe(OH)3的用量,反应48 h后混合物组分稳定,MgO完全参与反应且合成产物为纯净的层状双氢氧化物,可确定前驱物全部转化为目标产物。
|
图 3 方案D条件下不同晶化时间合成样品的XRD谱图 Fig.3 XRD patterns of synthesized products in scheme D with different crystallization times |
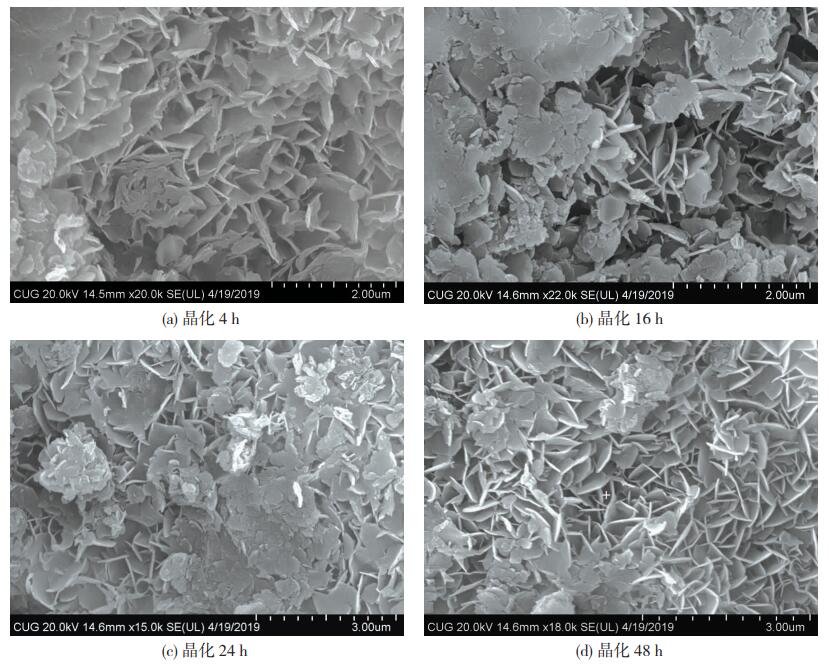
合成产物的SEM照片也可说明晶化时间对产物表面形态的影响。如图 4所示,合成产物晶化4 h后,大部分为团聚现象,形状、大小、厚度不规则的碎片不规则堆积;晶化时间的延长后,团聚现象无明显改善,但相互连接堆叠的薄片边缘开始固定形状化;随晶化时间的增长晶形发育规整,直至晶化48 h团聚现象显著降低,结晶薄片厚度均匀,排列紧密且孔隙发达。与XRD结果一致,延长晶化时间,合成产物结晶程度高,晶化48 h能够得到晶型完整的Mg/Fe型层状双氢氧化物,作为吸附载体具有良好的稳定性和高效性。
|
图 4 方案D条件下不同晶化时间合成产物的SEM图像 Fig.4 SEM images of synthesized products in scheme D with different crystallization times: (a)crystallization for 4 h; (b)crystallization for 16 h; (c)crystallization for 24 h; (d)crystallization for 48 h |
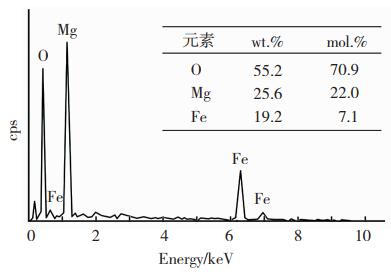
对方案D条件下晶化48 h的产物进行能谱分析,判断产物的组成成分。如图 5所示(选区位置为图 4(d)中的“+”处),合成产物的主要化学元素为O、Mg、Fe,质量百分比分别为55.2%、25.6%和19.2%,Mg/Fe摩尔比为3.10,与微波消解结果相近,非常接近摩尔比3;此外O/Fe摩尔比9.99,也较为接近理论值9。结合薄片状、排列规整的表面晶型,说明此时的合成产物为Mg/Fe型层状双氢氧化物,层间也未见可能造成二次污染的阴离子组分,确定层间的插层离子为羟基,合成物应为Mg-Fe-OH-LDH。
|
图 5 合成产物的能谱分析结果 Fig.5 Energy spectrum analysis results of synthesized products |
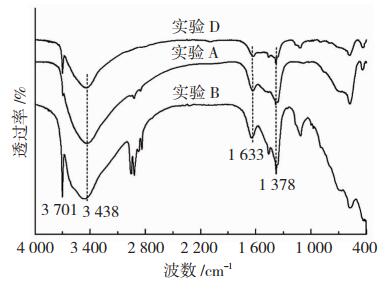
傅里叶红外光谱的测试可以验证合成产物的表面官能团。如图 6所示,方案A、B和D合成产物位于3 701 cm-1处的尖而窄的吸收峰和3 438 cm-1处的较宽的羟基带,可以归结为在片层间的—OH基团和类水镁石的—OH基团的弹性振动;而在1 633 cm-1处的弱水带,是由于片层间的水分子的羟基结构形变引起的;在575和432~440 cm-1处的吸收峰对应的是Fe—O—H和Mg—O—H的弯曲;位于1 378 cm-1处的吸收峰显示的是由于吸收了空气中CO2引起的振动。此外,方案B合成样品在400~1 000 cm-1处显示的吸收峰是铁氧化物的特征吸收峰;方案A合成样品中在664 cm-1处显示的吸收峰推断为Cl-的振动特征[4]。方案D的合成样品在664 cm-1处并无吸收峰,也未显示代表其他阴离子振动特征的吸收峰,且将样品D通过微波消解后采用ICP-MS检测样品中成分含量,结果表明,合成产物中仅含Mg、Fe、O和H 4种元素,不含Cl元素,进一步证明方案D利用无定型态Fe(OH)3和MgO前驱物合成的Mg/Fe型层状双氢氧化物中层间主要阴离子确实为羟基基团。
|
图 6 方案A、B、D合成产物的FT-IR谱图 Fig.6 FT-IR spectra of products synthesized in schemes A, B and D |
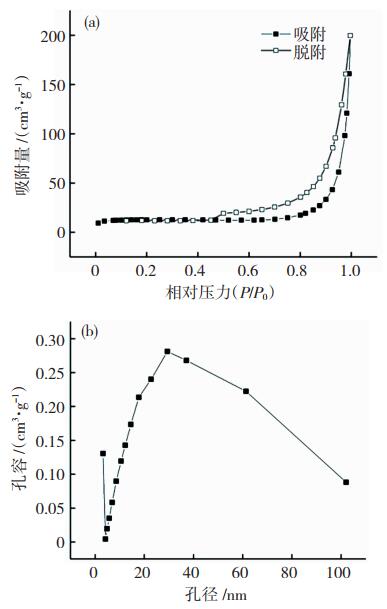
通过BET分析,由图 7(a)可以看出氮气吸附-脱附曲线属于Ⅲ型多分子吸附理论,图 7(b)孔径分布图中平均孔径为14.193 92 nm,最可几孔径在29.408 7 nm处,对应于累计孔容增加最快的部分;材料的微孔孔容为0.017 cm3/g,比表面积为42.8 m2/g,对于较易团聚的铁基层状双氢氧化物来说,该比表面积和孔隙参数在吸附材料的应用上是具有一定优势的,能有效提高材料的应用价值。作为重金属元素或有机污染物的吸附剂时,可增大接触面积,在单位体积吸附更多的污染物;在化工领域,有利于其他负载材料的充填;作为催化剂,也可一定程度地提高材料的利用率。
|
图 7 Mg-Fe-OH-LDH的吸附等温曲线(a)及孔径分布(b) Fig.7 Pore diameter distribution (a) and adsorption isotherm (b)of Mg-Fe-OH-LDH |
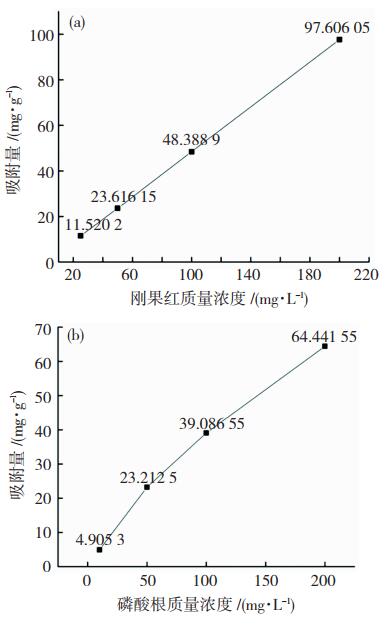
图 8给出了在25 ℃条件下,羟基插层Mg/Fe型层状双氢氧化物对磷酸根及刚果红的吸附曲线。结果表明合成物LDH对硝酸根及刚果红均有显著吸附效果,计算结果显示LDH对硝酸根和刚果红的单分子层最大吸附量分别达到了64.44、97.61 mg/g,可有效去除生活污水及工业染料废水中的硝酸盐和有毒有害染料,降低其对环境和人体健康的危害。同时,制备该层状双氢氧化物的前驱物价廉易得,合成方法操作简便,这使得制备过程中节省了大量人力物资等的消耗;且产物层间的羟基和水分子对环境均无明显污染,在工业生活等领域也可广泛应用。
|
图 8 刚果红(a)和磷酸根(b)吸附量曲线图 Fig.8 Adsorption capacity curve of congo red (a) and phosphate (b) |
1) 采用简单高效的机械化学合成法,以MgO和无定形态的Fe(OH)3作为反应前驱物,在研磨1.5 h、晶化48 h后成功制备出羟基插层的Mg/Fe型层状双氢氧化物,产物纯净单一,晶体颗粒形状规整、排列有序、孔隙发达。
2) 傅里叶红外光谱验证了层间仅含羟基和水分子,无二次污染阴离子;通过产物微波消解确定了Mg-Fe-OH-LDH的化学结构式为Mg2.96Fe(OH)8.94·0.942H2O。
3) 层状双氢氧化物的比表面积为42.8 m2/g,孔径14.2 nm,孔隙体积0.017 cm2/g,不仅可作为优异的吸附材料,又因插层阴离子的无污染性可在更多领域内实现应用。
4) 在25 ℃条件下,Mg-Fe-OH-LDH对磷酸根和刚果红的单分子层最大吸附量分别达到了64.44、97.61 mg/g,可有效去除生活污水及工业染料废水中的硝酸盐和有毒有害染料,降低其对环境和人体健康的危害。
| [1] |
XU Z P, BRATERMANPS. Synthesis, structure and morphology of organic layered double hydroxide (LDH) hybrids: comparison between aliphatic anions and their oxygenated analogs[J]. Applied Clay Science, 2010, 48(1-2): 235-242. DOI:10.1016/j.clay.2009.11.009 |
| [2] |
刘红, 陆天虹, 李淑萍, 等. 类水滑石化合物制备方法研究综述[J]. 南京师大学报(自然科学版), 2009, 32(2): 82-86. LIU Hong, LU Tianhong, LI Shuping, et al. Investigation survey of preparation methods for hydrotalcite-like compounds[J]. Journal of Nanjing Normal University(natural science edition), 2009, 32(2): 82-86. |
| [3] |
LI Qianwen, WANG Donghui, QIU Jiajun, et al. Regulating the local pH level of titanium via Mg-Fe layered double hydroxides films for enhanced osteogenesis[J]. Biomaterials Science, 2018, 6(5): 1227-1237. DOI:10.1039/C8BM00100F |
| [4] |
CAVANI F, TRIFIRO F, VACCARI A. Hydrotalcite-type anionic clays: preparation, properties and applications[J]. Catalysis Today, 1991, 11(2): 173-301. DOI:10.1002/chin.199212317 |
| [5] |
GIL A, ARRIETA E, VICENTE M A, et al. Synthesis and CO2 adsorption properties of hydrotalcite-like compounds prepared from aluminum saline slag wastes[J]. Chemical Engineering Journal, 2018, 334: 1341-1350. DOI:10.1016/j.cej.2017.11.100 |
| [6] |
SELS B F, DE VOS D E, JACOBS P A. Jacobs. Hydrotalcite-like anionic clays in catalytic organic reactions[J]. Catalysis Reviews, 2001, 43(4): 443-488. DOI:10.1081/CR-120001809 |
| [7] |
CORMA A, PALOMARES A E, REY F, et al. Simultaneous Catalytic removal of SOxand NOxwith hydrotalcite-derived mixed oxides containing copper, and their possibilities to be used in FCC units[J]. Journal of Catalysis, 1997, 170(1): 140-149. DOI:10.1006/jcat.1997.1750 |
| [8] |
KATHLEEN A C, ATHANASIOS K, STEVEN L S. Layered double hydroxides (LDHs)[J]. Solid State Ionics, 1988, 26(2): 77-86. DOI:10.1016/0167-2738(88)90018-5 |
| [9] |
KHAN A I, O'HARE D. Intercalation chemistry of layered double hydroxides: recent developments and applications[J]. Journal of Materials Chemistry, 2002, 12(11): 3191-3198. DOI:10.1039/b204076j |
| [10] |
LI F, DUAN X. Applications of layered double hydroxides[M]. Layered double hydroxides. Springer, Berlin, Heidelberg, 2006: 193-223. DOI: 10.1007/430_007
|
| [11] |
CAGRI A, USTUNOL Z, RYSER E T. Antimicrobial edible films and coatings[J]. Journal of Food Protection, 2004, 67(4): 833-848. DOI:10.1016/j.socec.2008.08.006 |
| [12] |
GUO Qinghai, CAO Yaowu, YIN Z, et al. Enhanced removal of arsenic from water by synthetic nanocrystalline iowaite[J]. Scientific Reports, 2017, 7(1): 17546. DOI:10.1038/s41598-017-17903-z |
| [13] |
KANG D, YU X, TONG S, et al. Performance and mechanism of Mg/Fe layered double hydroxides for fluoride and arsenate removal from aqueous solution[J]. Chemical Engineering Journal, 2013, 228: 731-740. DOI:10.1016/j.cej.2013.05.041 |
| [14] |
CAO Y, GUO Q, SHU Z, et al. Tungstate removal from aqueous solution by nanocrystalline iowaite: An iron-bearing layered double hydroxide[J]. Environmental Pollution, 2019, 247: 118-127. DOI:10.1016/j.envpol.2019.01.021 |
| [15] |
HUDCOVÁB, VÁTKOVÁ M, OUÁEDNÍĈEK P, et al. Stability and stabilizing efficiency of Mg-Fe layered double hydroxides and mixed oxides in aqueous solutions and soils with elevated As (V), Pb (II) and Zn (II) contents[J]. Science of the Total Environment, 2019, 648: 1511-1519. DOI:10.1016/j.scitotenv.2018.08.277 |
| [16] |
GUO Q, CAO Y, ZHUANG Y, et al. Effective treatment of arsenic-bearing water by a layered double metal hydroxide: Iowaite[J]. Applied Geochemistry, 2017, 77: 206-212. DOI:10.1016/j.apgeochem.2016.04.008 |
| [17] |
LUO L, GUO Q, CAO Y. Uptake of aqueous tungsten and molybdenum by a nitrate intercalated, pyroaurite-like anion exchangeable clay[J]. Applied Clay Science, 2019, 180: 105179. DOI:10.1016/j.clay.2019.105179 |
| [18] |
HEREDIA A C, DE LA FUENTE GARCÍA-SOTO M M, NARROS SIERRA A, et al. Boron removal from aqueous solutions by synthetic MgAlFe mixed oxides[J]. Industrial & Engineering Chemistry Research, 2019, 58(23): 9931-9939. DOI:10.1021/acs.iecr.9b02259 |
| [19] |
XUE L, GAO B, WAN Y, et al. High efficiency and selectivity of MgFe-LDH modified wheat-straw biochar in the removal of nitrate from aqueous solutions[J]. Journal of the Taiwan Institute of Chemical Engineers, 2016, 63: 312-317. DOI:10.1016/j.jtice.2016.03.021 |
| [20] |
MA Y, WANG Y, XIE D, et al. Hierarchical MgFe-layered double hydroxide microsphere/graphene composite for simultaneous electrochemical determination of trace Pb (II) and Cd (II)[J]. Chemical Engineering Journal, 2018, 347: 953-962. DOI:10.1016/j.cej.2018.04.172 |
| [21] |
NOGUEIRA T, BOTAN R, WYPYCH F, et al. Synthesis and characterization of LDHs/PMMA nanocomposites: Effect of two different intercalated anions on the mechanical and thermal properties[J]. Journal of Applied Polymer Science, 2012, 124(3): 1764-1770. DOI:10.1002/app.35213 |
| [22] |
REICHLE W T. Synthesis of anionic clay minerals (mixed metal hydroxides, hydrotalcite)[J]. Solid State Ionics, 1986, 22(1): 135-141. DOI:10.1016/0167-2738(86)90067-6 |
| [23] |
王岚, 陈慧琴, 詹正坤. MgFe水滑石类化合物的制备与表征[J]. 合成化学, 2002, 10(6): 531-533. WANG Lan, CHEN Huiqin, ZHAN Zhengkun. Preparation and characterization of magnesium-iron hydrotalcite-like compounds[J]. Chinese Journal of Synthetic Chemistry, 2002, 10(6): 531-533. DOI:10.3969/j.issn.1005-1511.2002.06.018 |
| [24] |
GOH K H, LIM T T, DONG Z L. Application of layered double hydroxides for removal of oxyanions: a review[J]. Water Research, 2008, 42(6-7): 1343-1368. DOI:10.1016/j.watres.2007.10.043 |
| [25] |
LIANG H, MENG F, CABÁN-ACEVEDO M, et al. Hydrothermal continuous flow synthesis and exfoliation of NiCo layered double hydroxide nanosheets for enhanced oxygen evolution catalysis[J]. Nano letters, 2015, 15(2): 1421-1427. DOI:10.1021/nl504872s |
| [26] |
WANG Q, O′HARE D. Recent advances in the synthesis and application of layered double hydroxide (LDH) nanosheets[J]. Chemical Reviews, 2012, 112(7): 4124-4155. |
| [27] |
曹耀武, 罗黎, 郭清海, 等. 纳米级水氯铁镁石的制备及颗粒团聚控制[J]. 材料科学与工艺, 2018, 26(2): 27-33. CAO Yaowu, LUO Li, GUO Qinghai, et al. Synthesis and agglomeration control of nanocrystalline iowaite[J]. Materials Science and Technology, 2018, 26(2): 27-33. DOI:10.11951/j.issn.1005-0299.20170178 |
| [28] |
EXTREMERA R, PAVLOVIC I, PÉREZ M R, et al. Removal of acid orange 10 by calcined Mg/Al layered double hydroxides from water and recovery of the adsorbed dye[J]. Chemical engineering journal, 2012, 213: 392-400. DOI:10.1016/j.cej.2012.10.042 |
| [29] |
PAREDES S P, FETTER G, BOSCH P, et al. Sol-gel synthesis of hydrotalcite-like compounds[J]. Journal of Materials Science, 2006, 41(11): 3377-3382. DOI:10.1007/s10853-005-5347-4 |
| [30] |
FAHAMI A, BEALL G W. Structural and morphological characterization of Mg0.8Al0.2(OH)2Cl0.2 hydrotalcite produced by mechanochemistry method[J]. Journal of Solid State Chemistry, 2016, 233: 422-427. DOI:10.1016/j.jssc.2015.11.006 |
| [31] |
BALÁŽP. Mechanochemistry in minerals engineering[M]. Mechanochemistry in Nanoscience and Minerals Engineering, Springer, Berlin, Heidelberg, 2008: 257-296. DOI: 10.1007/978-3-540-74855-7_5
|
| [32] |
任鸿儒, 高金涛, 王哲, 等. 热处理中电沉积Ni-Fe合金箔粘结过程与抑制方法[J]. 材料科学与工艺, 2017, 25(1): 23-29. REN Hongru, GAO Jintao, WANG Zhe, et al. Research on the sticking process during annealing and the suppression method of electrodeposited Ni-Fe alloy foil[J]. Materials Science and Technology, 2017, 25(1): 23-29. DOI:10.11951/j.issn.1005-0299.20160350 |
| [33] |
AY A N, ZVMREOGLU-KARAN B, MAFRA L. A Simple mechanochemical route to layered double hydroxides: synthesis of hydrotalcitelike Mg-Al-NO3-LDH by manual grinding in a mortar[J]. Zeitschrift Für Anorganische and Allgemeine Chemie, 2009, 635(9-10): 1470-1475. DOI:10.1002/zaac.200801287 |
| [34] |
IWASAKI T, SHIMIZU K, NAKAMURA H, et al. Novel mechanochemical process for facile and rapid synthesis of a Co-Fe layered double hydroxide[J]. Materials Letters, 2012, 68: 406-408. DOI:10.1016/j.matlet.2011.11.007 |
| [35] |
QU J, LI X, LEI Z, et al. Mechano-hydrothermal synthesis of tetraborate pillared Li-Al layered double hydroxides[J]. Journal of the American Ceramic Society, 2016, 99(4): 1151-1154. DOI:10.1111/jace.14196 |
| [36] |
李淑萍, 齐凤林. 机械化学法合成镁铝层状双氢氧化物研究[C]//中国化学会第十三届胶体与界面化学会议论文摘要集, 2011: 272-3. LI Shuping, QI Fenglin, . Study on synthesis of MG-Al layered double hydroxides by mechanistic method[C]//Abstract of papers presented at the 13th Colloidal and interfacial Chemistry Conference of the Chinese Chemical Society, 2011: 272-3. |
 2021, Vol. 29
2021, Vol. 29


