癌症已成为当今社会人类生命健康的重大威胁之一。临床上广泛使用的癌症治疗方式主要包括外科手术治疗、放射治疗和化学治疗等。这些治疗方法虽然成功地减少了癌症死亡率,但仍面临着缺乏特异性、疗效有限、毒副作用较大等诸多问题[1]。光热治疗(Photothermal Therapy,PTT)是近年飞速发展的一种微创肿瘤治疗技术,它利用光吸收材料在光照下将光能转化为热能,产生局部高热量,从而直接导致癌细胞因受热而损伤、凋亡和消融[2-3]。多种具有杰出的近红外吸收能力的材料已被开发研究并用于光热治疗,包括Au纳米材料、CuS纳米粒、钯纳米片、碳纳米材料等[4-8]。CuS纳米粒子作为一种新型的无机半导体光吸收剂,它在近红外区域有强烈的吸收,最大吸收峰在900~1 000 nm,而且吸收峰不会随着粒子大小和形状的改变而发生改变,具有良好的光热稳定性,且制备方法简单、成本低[6, 9-11]。
为了实现最佳疗效,光热治疗前还需完成肿瘤的定位、肿瘤大小的确定,还需确保光吸收材料在病灶部位足够的富集浓度,并对治疗过程实行监测。因此,光热治疗需要通过其他影像方法的指引和辅助来确保治疗过程能顺利进行,并期望能及时获取反馈信息,以便采取下一步治疗方案。这种将诊断和治疗结合为一体的肿瘤治疗方法称为诊疗一体化(Theranostics)[12-14]。磁共振成像(Magnetic Resonance Imaging,MRI)是利用生物体内的不同组织或器官在强磁场的作用下产生磁共振信号,经过图象重建而成像的一种技术[15],能为肿瘤治疗提供有价值的解剖学信息和体内分布信息,可有效指导和监测肿瘤的光热治疗过程[16-17]。MRI是分子成像手段中一个最有力的和非侵入性的诊断技术,基于质子与组织周围分子的相互作用,能为肿瘤治疗提供有价值的解剖学信息和体内生物分布信息[18-19]。Mn3O4是一种具有良好顺磁性的造影剂,价格低廉且制备成本低[20-23]。可将其制成尺寸合适的纳米粒,并在表面修饰功能基团,使之成为具有诊断、成像、治疗等多种功能的复合纳米粒。这不仅可以增强其对癌细胞的靶向能力,还能降低Mn离子作为金属元素而产生的细胞毒性。因此本研究采用具有良好生物相容性的聚合物纳米药物载体,共包载Mn3O4顺磁性MRI造影剂和具有较强近红外光吸收能力的CuS纳米粒,构建集磁共振成像与光热治疗为一体的多功能核壳纳米粒,实现肿瘤的诊疗一体化。
1 材料与方法 1.1 材料与实验仪器所使用材料如下:聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)(济南岱罡生物科技有限公司,特性粘度:0.54 dL/g,LA ∶GA=50 ∶50,分子量:63 kDa);油胺(上海晶纯生化科技股份有限公司);乙酰丙酮锰(C15H21MnO6) (北京百灵威科技有限公司);一水乙酸铜(Cu(CH3COO)2·H2O)、Na2S·9H2O、NaOH(上海国药集团);牛血清白蛋白BSA(沃凯生物医药公司)。所使用实验仪器如下:真空干燥机(Martinchrist);超声波细胞粉碎仪(宁波新芝生物科技股份有限公司,JY92-II);紫外-可见-近红外分光光度计(日本岛津精密仪器公司,UV-2600);激光粒度仪(美国马尔文,Nano-ZS90)近红外激光器(785 nm、980 nm,长春飞秒科技有限公司);透射电镜(美国FEI公司,Tecnai G220)。
1.2 方法 1.2.1 油胺稳定的Mn3O4纳米粒的制备采用高温热解法制备[24]:①精密称取11.97 g油胺,0.45 g乙酰丙酮锰C15H21MnO6,超声分散混合均匀后共置于干燥洁净的100 mL三颈瓶中,放入干燥洁净的磁力搅拌子,连接冷凝管,通入氮气,直至反应仪器中原有的空气完全排除;②在氮气保护下,用加热套加热至162 ℃,磁力搅拌反应11 h,冷却至室温后,12 000 r/min高速离心15 min得到棕色沉淀;③取沉淀物,用4~5 mL乙醇超声与涡旋分散后,3 500 r/min离心洗涤3次,得到Mn3O4纳米粒,分散于6 mL的正己烷中。
1.2.2 CuS白蛋白纳米粒的制备采用白蛋白模板法制备[9, 25]:①溶液配制:20.0 mM的乙酸铜(Cu(CH3COO)2)溶液;35.0 mg/mL牛血清白蛋白(BSA)溶液;100.0 mM Na2S溶液;2.0 M氢氧化钠溶液。②取BSA溶液20.0 mL置于50 mL的离心管中,加入4.0 mL Cu(CH3COO)2溶液,在磁力搅拌器上剧烈搅拌1 min,溶液混合均匀后,边搅拌边加入2.0 M的NaOH溶液,将反应体系的pH调至12;③剧烈搅拌5 min后,加入配好的Na2S溶液3.5 mL,反应体系变为黄褐色;④将反应液转移到55 ℃水浴锅中搅拌反应4 h。得到CuS白蛋白纳米粒,用去离子水持续透析24 h,制成CuS白蛋白纳米粒的水分散液待用。
1.2.3 核壳纳米粒的制备① 取80.0 μL上述制备的含Mn3O4纳米粒的正己烷分散液置于通风橱,完全挥发正己烷(CH3(CH2)4CH3);②用分析天平称取5.0 mg的PLGA溶解于0.2 mL的二氯甲烷(CH2Cl2)中,得到25.0 mg/mL的PLGA/CH2Cl2溶液,并以此溶解Mn3O4纳米粒;③将此混合液加入到4.0 mL的含CuS白蛋白纳米粒的水分散液中,用超声波细胞粉碎仪对混合液进行探针超声乳化(功率400 W,超声时间2 s,间隔时间2 s,90次);④将此乳浊液转移到小玻璃瓶内,放入干燥洁净的磁力搅拌子,置于通风橱中,在磁力搅拌器上持续搅拌挥发6 h,直至CH2Cl2完全挥发;⑤对制备的水分散液进行离心洗涤,即得到核壳纳米粒(Mn3O4/PLGA@CuS)。
PLGA是经美国FDA认证的药用辅料,它是一种无毒且可以被人体降解的功能性有机高分子化合物,具有良好的生物相容性,因此可以被广泛应用于纳米材料、药物载体、生物医学等领域和制药行业。本研究采用PLGA作为载体,通过超声乳化-溶剂挥发法,共包载油溶性的Mn3O4纳米粒以及水溶性的CuS白蛋白纳米粒,其制备过程如图 1。

|
图 1 核壳纳米粒的制备示意图 Fig.1 Scheme of the preparation process of core-shell nanoparticles |
通过透射电镜、粒径分布仪、紫外-可见-近红外分光光度计对于核壳纳米粒的形态、粒径、吸收光谱进行表征;采用医用磁共振成像仪对制备的核壳纳米粒进行MRI造影能力的表征,通过医用磁共振成像仪测定其纵向弛豫时间T1加权的磁共振增强图像,并计算其纵向弛豫率r1;采用785、980 nm激光器测定不同浓度核壳纳米粒的光热诱导升温曲线。
2 结果与讨论 2.1 核壳纳米粒的理化性质透射电镜结果可见,通过高温热解法制备的Mn3O4纳米粒大多呈现出球形或接近球形的结构,平均粒径大约为(10 ± 2.1) nm,粒径均一且分散性较好(图 2(a))。从图 2(b)可以看到,通过蛋白模板法制备的CuS白蛋白纳米粒呈现球形或类球形的结构,且经统计计算其粒径大约为(12 ± 0.9) nm,粒径较为均一。采用乳化-溶剂挥发法制备得到的核壳纳米粒在电镜图中可观察到球形或类球形的核壳结构,粒径在100~200 nm,证明核壳纳米粒的成功制备(图 2(c))。

|
图 2 透射电镜表征 Fig.2 TEM images: (a) Mn3O4 nanoparticles; (b) CuS albumin nanoparticles; (c) core-shell nanoparticles |
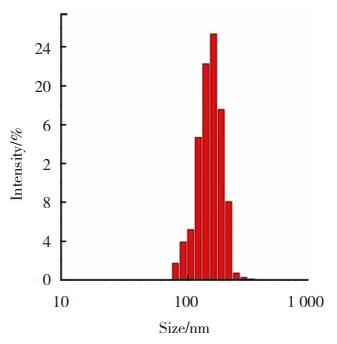
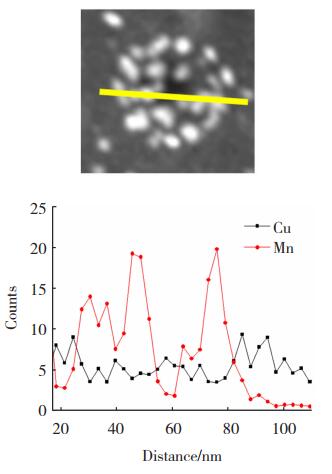
动态光散射结果显示,核壳纳米粒的粒径呈正态分布,平均粒径为160 nm,多分散系数PDI为0.272(图 3)。较小且分布较为均一的尺寸可使纳米粒更易于通过EPR效应渗透到达肿瘤组织,实现较高的局部浓度,有助于肿瘤高效诊断和治疗。核壳纳米粒的线扫描元素分析结果显示,核壳纳米粒含Cu、Mn两种元素,且Cu在外侧含量较高,Mn在内部含量较高(图 4)。该结果证明我们成功制备出以CuS纳米粒为外壳,内核为聚合物与氧化锰纳米粒的核壳纳米粒(Mn3O4/PLGA@CuS)。
|
图 3 核壳纳米粒的粒径分布 Fig.3 DLS size distribution of core-shell nanoparticles |
|
图 4 核壳纳米粒的线扫描元素分析结果 Fig.4 Line scanning element analysis of core-shell nanoparticles |
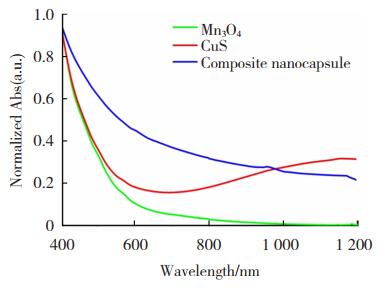
Mn3O4纳米粒、CuS白蛋白纳米粒和制备得到的核壳纳米粒的吸收光谱如图 5所示。Mn3O4纳米粒在400~1 200 nm的范围内无明显的特征吸收峰,而CuS白蛋白纳米粒在近红外区的700~1 200 nm范围内出现较为明显的吸收峰,可通过近红外光照射实现较强的光热效应。核壳纳米粒在400~1 200 nm的范围内均有较强吸收且呈递减趋势,同时在近红外区(700~1 200 nm)出现类似CuS纳米粒的较强的吸收,提示其对近红外光有明显的吸收作用,具有较强的光热效应。
|
图 5 Mn3O4纳米粒、CuS白蛋白纳米粒和核壳纳米粒的吸收光谱 Fig.5 Absorbance spectra of Mn3O4 nanoparticles, CuS albumin nanoparticles and core-shell nanoparticles |
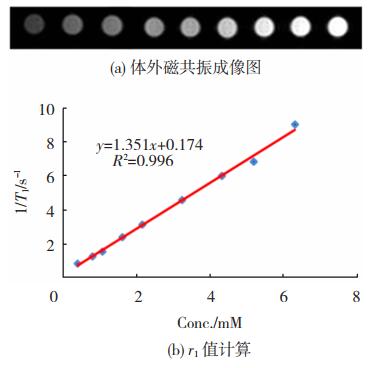
图 6(a)是不同Mn浓度的核壳纳米粒水分散液在磁共振成像仪中得到的T1加权的MRI造影成像图, 可以看出,随着纳米粒水分散液中Mn浓度的升高(从左到右),其对应的信号值逐渐增强(亮度变亮),表明该纳米粒的磁共振造影性能具有Mn浓度依赖性。纵向弛豫时间的倒数(1/T1) 与浓度间的关系作图,采用线性拟合得到该核壳纳米粒的r1值为1.351 mM-1·s-1,表明其具备良好的磁共振造影能力(图 6(b))。
|
图 6 核壳纳米粒的体外磁共振成像图及r1值 Fig.6 (a) In vitro magnetic resonance imaging and (b) r1 calculation of core-shell nanoparticles |
本研究采用蛋白模板法进行CuS白蛋白纳米粒的制备。白蛋白上具有多个金属结合位点,可通过氨基末端或者半胱氨酸残基有效结合金属离子,形成白蛋白-金属离子复合物[26]。结合的金属离子可通过还原反应或沉淀反应成核结晶,通过调节反应条件,控制纳米结晶在白蛋白空腔中的生长,形成内部为无机纳米材料、表面为白蛋白的核壳型纳米粒[3, 9, 16, 25 27-29]。该方法具有生物相容性好、粒径可控、工艺简单等特点,可通过生物矿化作用实现无机纳米粒的可控合成,具有良好的生物应用前景。
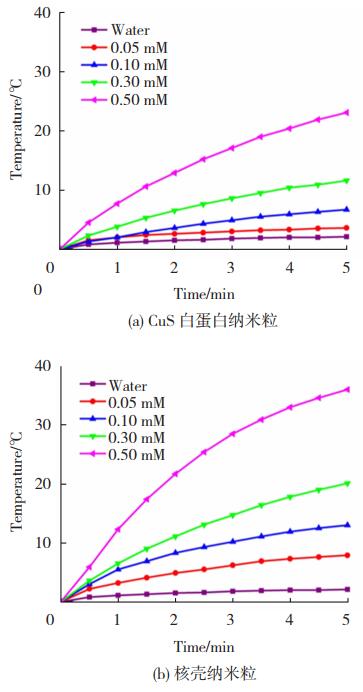
我们分别考察了CuS白蛋白纳米粒和核壳纳米粒在785 nm和980 nm激光照射下的光热升温效应(图 7、图 8)。
|
图 7 785 nm激光照射下纳米粒的光热升温效应 Fig.7 Temperature elevation by photothermal effect of (a) CuS albumin nanoparticles and (b) core-shell nanoparticles upon 785 nm laser irradiation |

|
图 8 980 nm激光照射下纳米粒的光热升温效应 Fig.8 Temperature elevation by photothermal effect of (a) CuS albumin nanoparticles and (b) core-shell nanoparticles at 980 nm laser irradiation |
如图 7(a)、(b)可见,在785 nm激光照射下,去离子水几乎不升温,而不同Cu浓度(0.05、0.10、0.20和0.50 mM)的核壳纳米粒在5 min时分别升高了7.9、13.0、20.1和36.0 ℃,随着浓度的增大升温效果增强,显示其浓度依赖的光热升温效果,并且浓度相同情况下,核壳纳米粒比CuS纳米粒的光热升温效应更为显著。而在980 nm激光照射下,核壳纳米粒与CuS相比并未表现出明显提升,但仍可说明核壳纳米粒不会影响所负载的CuS纳米粒的光热效果(图 8(a)、(b))。虽然核壳纳米粒温度提升最高可达到50.9 ℃,但由于水在980 nm处具有较强吸收,可在该波长激光照射下升温约28 ℃。因此,785 nm波长的激光由于较好的避开了水的吸收,具有较好的选择性和低毒副作用,将更有潜力应用于肿瘤光热治疗。
3 结论癌症已成为现今社会严重威胁人类生命健康的疾病之一,并且发病率呈逐年升高的趋势,研究并构建诊断治疗一体化纳米药物,对实现肿瘤高效诊治具有重要意义。
本文通过高温热解法制备Mn3O4纳米粒,同时采用蛋白模板法制备CuS白蛋白纳米粒,最后以可降解性高分子PLGA作为载体,通过超声乳化的方法,制成共包裹Mn3O4和CuS纳米粒的核壳纳米粒。该纳米粒具有如下特征:
1) 核壳纳米粒具有球形或类球形结构,平均粒径为160 nm,分散较为均一且稳定性较好,在近红外区有较强吸收;
2) 体外磁共振成像研究表明该核壳纳米粒保留了Mn3O4纳米粒的MRI造影剂功能;
3) 同时,体外光热效应研究表明该纳米粒具有较强的光热治疗能力,可用于肿瘤的诊疗一体化,在磁共振造影成像的引导下,实现肿瘤的光热消融治疗。
| [1] |
CHEN H, GU Z, AN H, et al. Precise nanomedicine for intelligent therapy of cancer[J]. Science China Chemistry, 2018, 61(12): 1503-1552. DOI:10.1007/s11426-018-9397-5 |
| [2] |
CHEN W R, ADAMS R L, HIGGINS A K, et al. Photothermal effects on murine mammary tumors using indocyanine green and an 808 nm diode laser: an in vivo efficacy study[J]. Cancer Letters, 1996, 98(2): 169-173. DOI:10.1016/s0304-3835(06)80028-5 |
| [3] |
YANG T, TANG Y, LIU L, et al. Size-dependent Ag2S nanodots for second near-infrared fluorescence/photoacoustics imaging and simultaneous photothermal therapy[J]. ACS Nano, 2017, 11(2): 1848-1857. DOI:10.1021/acsnano.6b07866.s001 |
| [4] |
HUANG X H, EL-SAYED I H, QIAN W, et al. Cancer cell imaging and photothermal therapy in the near-infrared region by using gold nanorods[J]. Journal of the American Chemical Society, 2006, 128(6): 2115-2120. DOI:10.1021/ja057254a |
| [5] |
HUANG X, JAIN P K, EL-SAYED I H, et al. Plasmonic photothermal therapy (PPTT) using gold nanoparticles[J]. Lasers in Medical Science, 2007, 23(3): 217. DOI:10.1007/s10103-007-0470-x |
| [6] |
HESSEL C M, PATTANI V P, RASCH M, et al. Copper selenide nanocrystals for photothermal therapy[J]. Nano Letters, 2011, 11(6): 2560-2566. DOI:10.1021/nl201400z |
| [7] |
ZHANG W, GUO Z, HUANG D, et al. Synergistic effect of chemo-photothermal therapy using PEGylated graphene oxide[J]. Biomaterials, 2011, 32(33): 8555-8561. DOI:10.1016/j.biomaterials.2011.07.071 |
| [8] |
LIU J, ZHENG X, YAN L, et al. Bismuth sulfide nanorods as a precision nanomedicine for in vivo multimodal imaging-guided photothermal therapy of tumor[J]. ACS Nano, 2015, 9(1): 696-707. DOI:10.1021/nn506137n |
| [9] |
YANG T, WANG Y, KE H, et al. Protein-nanoreactor-assisted synthesis of semiconductor nanocrystals for efficient cancer theranostics[J]. Advanced Materials, 2016, 28(28): 5923-5930. DOI:10.1002/adma.201506119 |
| [10] |
LIU X, LI B, FU F, et al. Facile synthesis of biocompatible cysteine-coated CuS nanoparticles with high photothermal conversion efficiency for cancer therapy[J]. Dalton Trans, 2014, 43(30): 11709-11715. DOI:10.1039/c4dt00424h |
| [11] |
TIAN Q, JIANG F, ZOU R, et al. Hydrophilic Cu9S5 nanocrystals: a photothermal agent with a 25.7% heat conversion efficiency for photothermal ablation of cancer cells in vivo[J]. ACS Nano, 2011, 5(12): 9761-9771. DOI:10.1021/nn203293t |
| [12] |
KELKAR S S, REINEKE T M. Theranostics: combining imaging and therapy[J]. Bioconjugate Chemistry, 2011, 22(10): 1879-1903. DOI:10.1021/bc200151q |
| [13] |
LIM E-K, KIM T, PAIK S, et al. Nanomaterials for theranostics: recent advances and future challenges[J]. Chemical Reviews, 2015, 115(1): 327-394. DOI:10.1021/cr300213b |
| [14] |
MELANCON M P, ZHOU M, LI C. Cancer theranostics with near-infrared light-activatable multimodal nanoparticles[J]. Accounts of Chemical Research, 2011, 44(10): 947-956. DOI:10.1021/ar200022e |
| [15] |
ZHAO Y, PENG J, LI J J, et al. Tumor-targeted and clearable human protein-based MRI nanoprobes[J]. Nano Letters, 2017, 17(7): 4096-4100. DOI:10.1021/acs.nanolett.7b00828 |
| [16] |
LV X, WANG X, LI T, et al. Rationally designed monodisperse Gd2O3/Bi2S3 hybrid nanodots for efficient cancer theranostics[J]. Small, 2018, 14(49): 1802904. DOI:10.1002/smll.201802904 |
| [17] |
WANG Y, YANG T, KE H, et al. Smart albumin-biomineralized nanocomposites for multimodal imaging and photothermal tumor ablation[J]. Advanced Materials, 2015, 27(26): 3874-3882. DOI:10.1002/adma.201500229 |
| [18] |
RAYMOND K N, PIERRE V C. Next generation, high relaxivity gadolinium MRI agents[J]. Bioconjugate Chemistry, 2005, 16(1): 3-8. DOI:10.1021/bc049817y |
| [19] |
CHO E C, GLAUS C, CHEN J, et al. Inorganic nanoparticle-based contrast agents for molecular imaging[J]. Trends in molecular medicine, 2010, 16(12): 561-573. DOI:10.1016/j.molmed.2010.09.004 |
| [20] |
BRANNON-PEPPAS L, BLANCHETTE J O. Nanoparticle and targeted systems for cancer therapy[J]. Adv Drug Deliv Rev, 2004, 56(11): 1649-1659. DOI:10.1016/j.addr.2004.02.014 |
| [21] |
PARK K, LEE S, KANG E, et al. New generation of multifunctional nanoparticles for cancer imaging and therapy[J]. Advanced Functional Materials, 2009, 19(10): 1553-1566. DOI:10.1002/adfm.200801655 |
| [22] |
NA H B, LEE J H, AN K, et al. Development of a T1 ontrast agent for magnetic resonance imaging using MnO nanoparticles[J]. Angewandte Chemie International Edition, 2007, 46(28): 5397-5401. DOI:10.1002/anie.200604775 |
| [23] |
SHIN J, ANISUR R M, KO M K, et al. Hollow manganese oxide nanoparticles as multifunctional agents for magnetic resonance imaging and drug delivery[J]. Angewandte Chemie International Edition, 2009, 48(2): 321-324. DOI:10.1002/ange.200802323 |
| [24] |
YANG H, ZHUANG Y, HU H, et al. Silica-coated manganese oxide nanoparticles as a platform for targeted magnetic resonance and fluorescence Imaging of cancer cells[J]. Advanced Functional Materials, 2010, 20(11): 1733-1741. DOI:10.1002/adfm.200902445 |
| [25] |
WEN R, LV X Y, YANG T, et al. Albumin nanoreactor-templated synthesis of Gd2O3/CuS hybrid nanodots for cancer theranostics[J]. Science China-Materials, 2017, 60(6): 554-562. DOI:10.1007/s40843-017-9056-1 |
| [26] |
XIE J, ZHENG Y, YING J Y. Protein-directed synthesis of highly fluorescent gold nanoclusters[J]. Journal of the American Chemical Society, 2009, 131(3): 888-889. DOI:10.1021/ja806804u |
| [27] |
ZHOU L, YANG T, WANG J, et al. Size-tunable Gd2O3@albumin nanoparticles conjugating chlorin e6 for magnetic resonance imaging-guided photo-induced therapy[J]. Theranostics, 2017, 7(3): 764-774. DOI:10.7150/thno.15757 |
| [28] |
YANG T, KE H T, WANG Q L, et al. Bifunctional tellurium nanodots for photo-induced synergistic cancer therapy[J]. ACS Nano, 2017, 11(10): 10012-10024. DOI:10.1021/acsnano.7b04230 |
| [29] |
ZHANG J, HAO G Y, YAO C F, et al. Albumin-mediated biomineralization of paramagnetic NIR Ag2S QDs for tiny tumor bimodal targeted imaging in vivo[J]. Acs Applied Materials & Interfaces, 2016, 8(26): 16612-16621. DOI:10.1021/acsami.6b04738 |
 2021, Vol. 29
2021, Vol. 29


