2002年,Hench教授等[1]在Science杂志上发表观点文章,指出第1代生物材料目标是获得合适的物质性能组合以般配替代组织,并在宿主中毒性反应最小;第2代生物材料的特点是可被人体吸收或具有生物活性;第3代生物材料则兼具可被人体吸收特性和生物活性,一旦植入人体可协助组织自愈合。据此,传统医用金属材料(不锈钢、钴基合金、钛合金)被归结为第1代生物材料。进入21世纪,医用金属材料家族迎来了新的成员,即被认为是第3代生物材料的可降解金属。与传统医用金属材料相比,可降解金属因其独特的体液降解特性而避免了长期在体存留,更符合组织再生的需求。同时,可降解金属在降解过程中呈现与传统医用金属的生物惰性完全不同的生物活性,从而带来原位的离子释放等有益的生物学效应,甚至在某种意义上被认为是在整个全降解周期内呈现出药物持续释放(是否可控另说)的化学与生物学作用。
在学术界,可降解金属经历了2001年出现初期被业界的质疑,到2012年世界生物材料大会上被首次设为分会场(标志着国际生物材料界对其的接纳,随后在2016和2020年连续3届被设为分会场),再到2018年国际生物材料科学与工程联合会组织的生物材料定义共识会上,对可降解金属定义的投票表决通过,以及2020年“可降解金属”被作为章节写入美国的《生物材料科学》第4版教科书[2]。在产业界,在过去的20年间可降解金属相关医疗器械产品研发也经历了器械产品的原型设计、体外生物学评价、动物体内生物学评价、临床研究直至产品获批上市。从监管科学角度,可降解金属作为一种新型医用金属材料,目前已经得国内外监管部门的普遍认同,例如ISO TS 20721标准给出了可降解金属植入物的一般性评价准则[3],ASTM F3268标准给出了可降解金属体外降解行为的测试方法[4],我国国家药监局医疗器械技术评审中心正式颁布《可降解镁金属骨科植入物注册审查指导原则(2022年第4号)》[5],这将加快可降解镁金属在骨科植入领域的产品注册上市,同时对其他可降解金属用于骨科提供了指导性原则。
值得一提的是,在可降解金属及其器械研发历史中,中国科学家和企业界都做出了较为重要的贡献,包括在基础研究领域发展出具有中国自主知识产权的专利镁合金、铁基合金、锌合金及其表面降解调控方法,以及在产品研发方面获得CE认证的可降解纯镁骨钉产品、铁基可吸收血管支架产品,以及在国际上首次将可降解锌合金颌面修复骨板和骨钉植入人体等重要进展。
本文将结合作者多年从事可降解金属的基础研究、应用基础研究中取得的一些相关研究结果和产品研发相关问题的思考,分别介绍可降解金属的定义、生物降解性与生物相容性双判据及分类,然后再分门别类地介绍镁基可降解金属、铁基可降解金属和锌基可降解金属的研究现状、尚未解决的科学技术问题和未来的产品研发机遇与挑战。
1 可降解金属的定义、判据、分类和设计 1.1 可降解金属的定义迄今关于可降解金属的定义有4个版本,第1个版本是2014年本文作者与顾雪楠、Frank Witte共同给出的[6]:可降解金属(Biodegradable Metals),是指能够在体内逐渐被体液腐蚀降解的一类医用金属,其所释放的腐蚀产物给机体带来恰当的宿主反应,当协助机体完成组织修复使命之后将全部被体液溶解,不残留任何植入物。第2个版本是美国ASTM F3160-16标准中给出的可吸收金属材料(Absorbable Metallic Materials)[7]:一个最初明显的外来材料或物质,或者直接或者通过预定的降解,能穿过细胞/组织,或被细胞/组织所新陈代谢/同化。第3个版本是2018年Frank Witte在经与Diego Mantovani、Mark Staiger和本文作者邮件沟通后,在成都召开的国际生物材料科学与工程学会联合会主办的生物材料定义共识会上,提交给专家委员会投票表决通过的定义:可降解金属是指一种金属、合金或金属基复合材料,目的是在体内降解[8]。第4个版本是2019年本文作者在先进功能材料杂志上提出的[9],可降解金属是指能够在体内逐渐被体液腐蚀降解的一类医用金属,它们所释放的腐蚀产物,或者直接或者通过预定的降解,能穿过细胞/组织,或被细胞/组织所新陈代谢/同化,给机体带来恰当的宿主反应,当协助机体完成组织修复使命之后将全部被体液溶解,不残留任何植入物。第4个版本是将第1个版本和第2个版本有机的结合在一起,目的是便于统一后更方便使用。未来随着人们对可降解金属的更深入理解也会有新的版本的定义出现,这与生物材料本身的定义,在不同时期不同人会提出自己的见解是类似的。
1.2 元素周期表中的元素作为可降解金属的双判据众所周知,元素周期表上60%以上的元素都是金属属性,其中哪些元素适合作为可降解金属的备选元素而被使用,使用量应如何控制,均需要有一个科学的判据。2019年本文作者[9]提出了生物降解性和生物相容性双判据,认为只有满足100%生物降解性和100%生物相容性的元素才能够入选。
1.2.1 生物降解性判据关于生物降解性判据,本文作者提出一些参数来反映金属元素与水发生化学反应的活性和难易程度,包括化学元素活泼性(Reactivity)、标准电极电位(Standard Electrode Potential)、P-B比(Pilling-Bedworth Ratio)和布拜图(Pourbaix Diagram)[9]。
1) 化学元素的活泼性,是指元素与其他物质反应的难易程度。越容易与别的物质反应,元素越活泼。越难与其他物质反应,元素越不活泼,也就越稳定。金属的活动性是反映金属在水溶液中形成水合离子倾向的大小,即反映金属在水溶液中起氧化反应的难易,它是以金属的标准电极电位为依据的。锂是活动性最强的金属元素。通常,标准电极电位是以标准氢原子作为参比电极,即将氢的标准电极电位值定为0,与氢标准电极比较,电位较高的为正,电位较低者为负。
2) P-B比是金属与氧结合在金属表面生成的氧化物膜中的每个金属离子体积与金属中的每个金属原子体积之比。P-B比在1~2范围的金属,其表面氧化物膜中产生一定程度的压应力,膜比较致密,金属抗氧化性强。P-B比小于1或大于2时,氧化物膜中产生张应力或过大的压应力,容易造成膜破裂,金属抗氧化性低。
3) 布拜图,又称为电位-pH图,是以电位(平衡电极电位,相对于标准氢电极)为纵坐标,以pH为横坐标的电化学平衡图,其展示的是反应的平衡电极电位与pH的关系。依据布拜图可直接判断在给定条件下(给定电位和pH)反应进行的可能性,并且明确地示出在某一电位和pH条件下体系的稳定物态或平衡物态。此外,根据布拜图可以从热力学方面很方便地判断在一定电位和pH条件下,金属材料发生腐蚀的可能性。
1.2.2 生物相容性判据关于生物相容性判据,本文作者将分别从材料的细胞毒性、组织安全性以及人体/临床安全性3个不同的层级评定,提出一些参数来反映金属元素的生物相容性和生物安全性[9],如图 1所示。

|
图 1 各种金属离子的半数抑制浓度IC50、半数致死量LD50和饮食推荐日摄入量RDI数据汇总 Fig.1 Summary of data of half-maximal inhibitory concentration (IC50), median lethal dosage (LD50), and recommended daily intake (RDI) for various metal ions (?表示该元素没有饮食推荐日摄入量RDI数据) ("?" represents that there is no RDI data for this element) |
已有大量研究化学物质外源因素(化学、物理、生物因素)对生物体的毒性反应、严重程度、发生频率和毒性作用机制,对于金属元素包括在整体、器官、细胞和亚细胞水平上的金属毒理学数据。细胞层面上我们采用“半数抑制浓度IC50”这个参数,即材料的浸提液能将细胞生长抑制50%所需的浓度,或者说细胞存活率为50%的浓度值。在MTT法中,就是以对照组吸光度OD值减少一半所需的药物浓度为IC50。对一群个体,有“半数致死量LD50”这个参数,是指“能杀死一半试验个体之有害物质、有毒物质或游离辐射的剂量”。LD50通常采用有毒物质的质量和试验生物体重之比表达,如“毫克/千克体重”。尽管毒性不一定与体重成正比,但该表达方式仍有助于比较不同物质的相对毒性,以及同一物质在不同大小动物之间的毒性剂量的比较。
1.2.2.2 生物化学角度从生物化学角度看,通常人体是由50多种元素所组成。根据元素在人体内的含量不同,可分为宏量元素(体内含量占体重0.01%以上的元素)和微量元素(体内含量介于体重0.01%~0.005%的元素)两大类[11]。宏量元素在体内所占的比例较大,有机体需要量较多,是构成有机体的必备元素。标准健康成年人的元素组成为氧65%、碳18%、氢10%、氮3%、钙1.5%、磷1%、钾0.35%、硫0.25%、钠0.15%、氯0.15%、镁0.05%等,这些宏量元素约占体重的99.9%。人体必需的微量元素是指缺乏该元素将引起机体生理功能及结构异常、发生各种病变和疾病的微量元素。必需微量元素的标准包括5个方面:1)这种元素存在于一切健康机体的所有组织之中;2)在组织中的浓度相当恒定;3)缺乏该元素时,能够在不同组织中产生相似的结构、生理功能异常;4)补充该元素能够防止此类异常变化;5)补充该元素可使失常的功能及结构恢复正常。人体必需的微量元素共8种,包括碘、锌、硒、铜、钼、铬、钴、铁。按照生物学活性,人体非必需的微量元素可分为惰性微量元素与毒性微量元素,常见的惰性非必需微量元素包括铝、铷、锗等, 其对人体是否具有特殊生理功能,尚不清楚, 毒性非必需微量元素主要是指铍、镉、汞、铅、砷、铊等。血元素检查是指利用专业仪器,对人体血液中的各种元素进行检测,常见的金属离子在血清中正常浓度值:血清镁:0.8~1.2 mmol/L;血清钾:3.5~5.5 mmol/L;血清钠:135~145 mmol/L;血清钙:2.2~2.7 mmol/L;血清铁:10.7~27 mmol/L。
1.2.2.3 营养学关于通过食物每天摄取的金属元素的量人体每天都需要通过食物摄取有益于身体的微量元素,包括锌、铁、铜、锰、锶、碘、钴、铬、硒等[11]。尽管人体对于微量元素的需求量很低,但其作用却非常大。如:“锰”能够刺激免疫器官的细胞增值,显著提高巨噬细胞的生存率。“锌”则是直接参与免疫功能的重要生命相关元素,由于锌具有免疫功能,因此在白血球中锌的含量比红血球高25倍。“锶”、“铬”可预防高血压,防治糖尿病、高血脂胆石。中国营养学会根据营养调查资料和中国膳食特点,以中国推荐膳食营养素供给量(RDA)为基础,参照国外膳食营养素参考摄入量相关文件,2000年修订现行的中国居民膳食营养素参考摄入量表,涉及如下4个营养水平指标:平均需要量(EAR)、推荐摄入量(RNI)、适宜摄入量(AI)、可耐受最高摄入量(UL)。例举如下。1)镁的适宜摄入量AI:30 mg(0~0.5岁);70 mg(0.5~1岁);100 mg(1~4岁);150 mg(4~7岁);250 mg(7~11岁);350 mg(11~50+岁);如果是孕妇(早期、中期和晚期),镁的AI增加到400 mg。2)铁的AI:0.3 mg(0~0.5岁);10 mg(0.5~1岁);12 mg(1~11岁);有趣的是大于11岁后,对于铁的AI,男性和女性有变化:男性为16 mg(11~14岁);20 mg(14~18岁);15 mg(18~50岁);女性为18 mg(11~14岁);25 mg(14~18岁);20 mg(18~50岁),不论男性还是女性,当年龄大于50岁后,铁的AI变为15 mg。如果是孕妇,早期、中期和晚期铁的AI分别为15、25和35 mg。乳母铁的AI为25 mg。3)对于锌的推荐摄入量RNI:1.5 mg(0~0.5岁);8 mg(0.5~1岁);9 mg(1~4岁);12 mg(4~7岁);13.5 mg(7~11岁);但大于11岁后对锌的AI,男性和女性有变化:男性为18 mg(11~14岁);19 mg(14~18岁);15 mg(18~50岁);女性为15 mg(11~14岁);15.5 mg(14~18岁);11.5 mg(18~50岁),不论男性还是女性,当年龄大于50岁后,锌的AI变为11.5 mg。如果是孕妇,早期、中期和晚期锌的AI分别为11.5、16.5和16.5 mg。乳母锌的AI为21.5 mg。4)铜的适宜摄入量AI:0.4 mg(0~0.5岁);0.6 mg(0.5~1岁);0.8 mg(1~4岁);1 mg(4~7岁);1.2 mg(7~11岁);1.8 mg(11~14岁);2 mg(14~50+岁)。5)锰的适宜摄入量AI:未制定参考值(0~18岁),3.5 mg(18~50+岁)。
1.2.2.4 药典学关于金属杂质元素的每日暴露量要求随着《美国药典》USP新通则 < 232 >和USP < 233 >、人用药品注册技术要求国际协调会ICH Q3D元素杂质指南、《中国药典》元素杂质限度和测定指导原则等法规的实施,金属元素杂质研究也作为关系到药品的国内外注册申报、原料药等进出口贸易的直接相关材料,日益受到药企重视。ICH Q3D是用于控制药品中元素杂质的质量指南,规定了24种金属杂质元素的每日暴露量(PDE)。由于不同金属杂质发挥毒性的部位不同,因此不同给药途径的PDE不同,根据原料药的制剂类型及其制剂最大日摄入量,通常基于下式计算原料药中该元素杂质的安全限度。
安全限度=PDE(μg/d)/ 最大日剂量(μg/d)
控制阈值(μg/g)=安全限度×30%
如果制剂中所有来源的该元素杂质总水平始终小于PDE的30%,则说明目前控制方法有效,不需要对该元素进行额外的控制。例举如下,其中的PDE单位均为μg/d。Co的PDE:口服制剂为5;注射剂为0.5;吸入制剂为0.3。V的PDE:口服制剂为10;注射剂为1;吸入制剂为0.1。Ni的PDE:口服制剂为10;注射剂为1;吸入制剂为0.1。Ag的PDE:口服制剂为15;注射剂为1;吸入制剂为0.7。Li的PDE:口服制剂为55;注射剂为25;吸入制剂为2.5。Ba的PDE:口服制剂为140;注射剂为70;吸入制剂为30。Mo的PDE:口服制剂为300;注射剂为150;吸入制剂为1。Cu的PDE:口服制剂为300;注射剂为30;吸入制剂为3。Sn的PDE:口服制剂为600;注射剂为60;吸入制剂为6。Cr的PDE:口服制剂为1 100;注射剂为110;吸入制剂为0.3。
1.3 可降解金属的分类2014年本文作者与合作者给出可降解金属的分类为[6]:1)纯金属;2)合金;3)金属基复合材料。2019年本文作者与合作者将可降解金属的分类进一步细分为[9]:1)可降解纯金属;2)可降解晶态合金;3)可降解大块非晶合金;4)可降解高熵合金;5)可降解金属基复合材料。
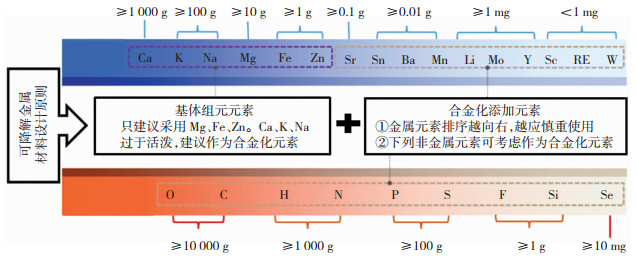
1.4 可降解金属的基体元素与合金化元素选择基于可降解金属的生物降解性和生物相容性双重判据,我研究团队对元素周期表中的元素是否适合作为生物医学领域使用的可降解金属进行了筛选[9]。首先根据生物降解性判据,排除了Ti、Zr、Tc、Re、Ru、Os、Rh、Ir、Pt、Pd、Cu、Ag、Au、Ge、Sb和Bi;其次根据生物相容性判据,排除了Be、Al、Hf、V、Nb、Ta、Cr、Co、Ni、Ga、Cd、In、Tl和Pb,最终获得了我们认为可以作为可降解金属的候选元素,按照其在人体中总含量由高到低的顺序依次为Ca、K、Na、Mg、Fe、Zn、Rb、Sr、Sn、Ba、Mn、Li、Cs、Mo、Y、Sc、RE和W。图 2是上述元素在人体中的总含量及其合金化建议。由图 2可知,在人体中存在的总量在克数量级以上的包括Ca、K、Na、Mg、Fe、Zn,共6种。然而,其中的单质Ca、K和Na是非常活泼的,在空气中无法以金属态稳定存在(在自然界中多以离子状态或化合物形式存在),因此,不适合作为基体组元元素,但可以将其作为合金化元素添加。而其中的Mg、Fe和Zn则可以在空气中稳定存在,并且已经开发出大量的工程用合金,因此,我研究团队认为Mg、Fe和Zn是最适宜作为可降解金属基体的3个元素。按照可作为可降解金属的候选元素的排序,紧跟在Zn后面的元素是Rb和Sr,其在人体中的含量高于100 mg, 再次就是元素Sn、Ba、Mn,其在人体中的总含量均高于10 mg。虽然这些元素在人体中的总含量较低,但其作为可降解金属的合金化元素是可能的。以一个骨螺钉为例,假设其质量为1 g左右,以镁作为主元素并在其使用的材料中加入Rb、Sr、Sn、Ba、Mn这些元素中的某个元素作为合金化元素,如果在骨钉所用材料中,其加入量为0.1wt. %,则意味通过植入物该类元素被引入到人体的量已接近该元素在人体中总含量值的1/10,需要警惕;但如果是将元素Li、Cs、Mo、Y中的某个元素作为合金化元素加入到使用的材料中,则它们在人体中的总量大于1 mg但小于10 mg,如果在骨钉所用材料中其加入量为0.1wt. %,则意味着通过植入物该类元素被引入到人体的量已接近该元素在人体中的总含量值,需要十分警惕;如果在使用的材料中加入的是元素Sc、RE和W中的某个元素作为合金化元素,则它们在人体中的总量小于1 mg,如果在骨钉所用材料中其加入量为0.1wt. %,则意味着通过植入物该类元素被引入到人体的量已接近该元素在人体中的总含量值的数倍到数十倍,其生物安全性令人堪忧,应尽量不采用。综上分析可知,对于图 2列出的数十种元素,从左向右元素在人体内的含量越低,在进行元素选择时应该更为慎重,在使用时可添加到可降解金属中的含量应减少。然而我们也看到,人体中存在的非金属元素含量从高到低,包括O、C、H、N、P、S、F、Si、Se等。有些元素可以作为合金化元素直接加入到Fe中,如C、N、P、Si等,也可通过表面处理(离子注入、渗入等)方式加入可降解金属中,如C、N、P、S和F可分别通过碳化、氮化、磷化、硫化和氟化处理引入可降解金属表面。
|
图 2 可降解金属材料设计原则 Fig.2 Material design principle for biodegradable metals and alloys |
可降解金属材料与器械的设计则需要考虑各种性能,包括力学、物理、化学和生物学特性,并且针对不同的应用背景,性能需求是不一样的。如作为骨植入物或心血管支架,可考虑生物降解性能、生物相容性能和力学性能三性合一的材料设计思想[12];当基于可降解金属用于暂态电子学的薄膜器械设计[13],可考虑生物降解性能、生物相容性能和电学性能三性合一的材料设计思想,此时力学性能就不是考虑的必选项。因此,在回答元素周期表中哪些元素可以被认为适合作为可降解金属的备选元素而被使用这一科学问题时,我们仅提出了生物降解性和生物相容性双判据,而不是包含力学性能的三判据。
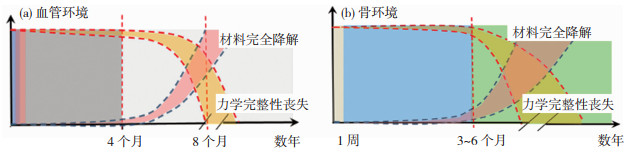
1.5 可降解金属的降解过程与组织修复过程的生物适配性血管受损后,通常会经历以下3个相互重叠的修复阶段(图 3(a))[6]。1)炎症阶段:血液和可溶性血清纤连蛋白凝固并形成细胞外基质的过程,标志着炎症阶段的开始。在血管修复的早期阶段,炎症细胞和一些活性因子能够和纤连蛋白上的特定位点相结合。同时,血小板在伤口表面聚集并被激活。活化的血小板释放出促进局部血管收缩和血栓形成的物质。同时释放出能够激活受损组织附近的间充质细胞的生长因子;2)肉芽阶段:肉芽阶段的开始伴随着局部组织细胞向伤口部位迁移。上皮细胞或内皮细胞主要从伤口边缘迁移,而成纤维细胞或平滑肌细胞则从邻近组织迁移。这两种类型的细胞在这个阶段都会增殖,上皮细胞或内皮细胞会覆盖伤口表面,而成纤维细胞或平滑肌细胞则会合成和分泌细胞外基质成分,特别是透明质酸和蛋白多糖;3)血管重塑阶段:细胞外基质沉积和重塑将会持续数月。当损伤血管表面已被细胞覆盖,迁移到损伤区域的间充质细胞就会减缓其增殖并开始产生大量蛋白多糖来取代纤连蛋白作为主要的细胞外基质成分。由于血管的重塑阶段通常在90~120天内结束,所以对于可降解金属血管支架而言,在血管完成其重塑阶段并恢复正常生理功能之后即可完全降解。因此,在前4个月内,可降解金属血管支架需要提供足够的径向支撑力帮助血管修复,而后再逐渐降解并最终完全消失。
|
图 3 血管修复过程中可降解金属血管支架的降解行为与力学完整性(a)和可降解金属在骨修复期间降解行为和力学完整性(b)的变化示意图 Fig.3 Schematic diagram of variation of mechanical intergrity and degradation behavior of vascular stents made of biodegradable metals during blood vessel tissue repair procedure (a) and schemtatic diagram of variation of mechanical intergrity and degradation behavior of bone implants made of biodegradable metals during bone tissue repair procedure (b) |
骨折修复过程通常包括3个阶段(图 3(b))[6]。1)炎症阶段,骨折位置形成血肿并伴随典型的炎症反应(1~7天)。2)修复阶段:在骨折后的前2~3周,软愈伤组织形成,创伤处逐渐固定;新生成的软愈伤组织可以抵抗压缩,其力学性能和纤维组织类似;随后,软愈伤组织从外围开始向骨折中心矿化,形成具备足够强度和刚度抵抗低冲击力活动的硬愈伤组织(根据骨折部位和类型,通常持续3~6个月)。3)重塑阶段:编织骨逐渐被皮质骨替代,髓腔修复(通常持续几年)。因此,可降解金属骨植入物在骨折修复期间的降解速度,需要满足至少提供3~6个月的有效力学支撑的要求。
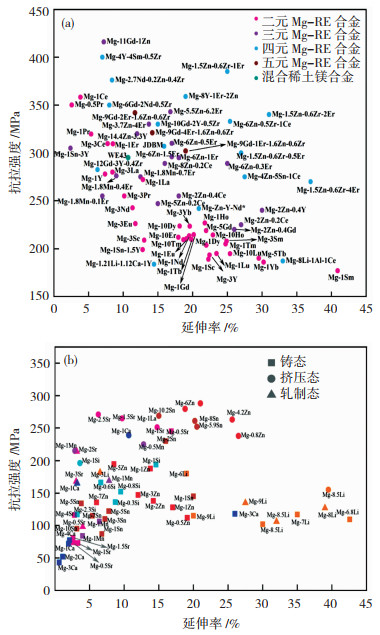
2 可降解金属的研究现状 2.1 镁基可降解金属的研究现状镁及其合金是迄今最具代表性的可降解金属材料,也是研究和应用最深入的材料体系。镁是人体必需的宏量元素,它与生命的维持、身体健康有着密切的关系,其本身是高度生物相容的。镁在体液环境中易腐蚀,非常适合作为暂时性的植入器械。回顾可降解镁合金研发历史,一方面,Mg-RE稀土镁合金具有良好的强韧性和抗腐蚀能力被考虑作为医用可降解金属,其中最具代表性的是WE43(W代表稀土Y,E代表混合稀土)镁合金,根据不同的热处理和塑性变形工艺,其屈服强度和抗拉强度可分别大于240和350 MPa,同时拥有较好的韧性(延伸率>10%),如图 4(a)所示[14]。目前欧盟两个获得CE认证的可降解镁合金产品(MAGNEZIX®骨科螺钉和Magmaris血管支架),其材料配方都是基于WE43稀土镁合金成分上发展出来的专利合金。另一方面,近年来含有人体必需元素的医用镁合金体系得到了迅速的发展,包括Mg-Ca、Mg-Zn、Mg-Li、Mg -Mn、Mg-Si、Mg-Sr等二元合金以及在二元合金体系基础上发展出的Mg-Zn-Ca、Mg-Li-Ca、Mg-Sr -Zn、Mg-Ca-Sr、Mg-Ca-Si等三元合金和Mg-Ca-Sr-Zn等四元合金。这些新型医用镁合金材料的抗拉强度基本都在300 MPa以下,延伸率在20%以下,如图 4(b)所示[15]。另外,部分合金元素的加入可赋予镁合金良好的塑性变形能力,如铸态Mg-6.8Li合金的延伸率可达42.58%,远高于铸态纯镁的延伸率(4.8%)。对于这些合金体系,元素的生物相容性可以得到一定的保证,但合金的综合力学性能和耐腐蚀性能方面仍逊色于含有稀土元素的Mg-RE合金。
|
图 4 含稀土元素的镁合金(a)与含营养元素的二元镁合金(b)的力学性能汇总[14-15] Fig.4 Summary of mechanical property data for (a) Mg alloys containing rare earth elements and (b) binary Mg alloys with nutrient elements as alloying elements[14-15] |
关于医用镁合金的合金化设计,按照合金化元素在镁基体中固溶度不同可以分为两类:在镁中有固溶度的元素和在镁中没有固溶度的元素。前者包括Ca、Zn、Si、Mn、Zr、Bi、Ba、Al、Sn、Sr、Li和RE;后者包括Cu、Cr和As。每种元素对Mg-X二元合金的显微组织、力学性能、腐蚀抗力、生物相容性的影响规律如图 5所示。也包括是否推荐使用及用量范围的建议。
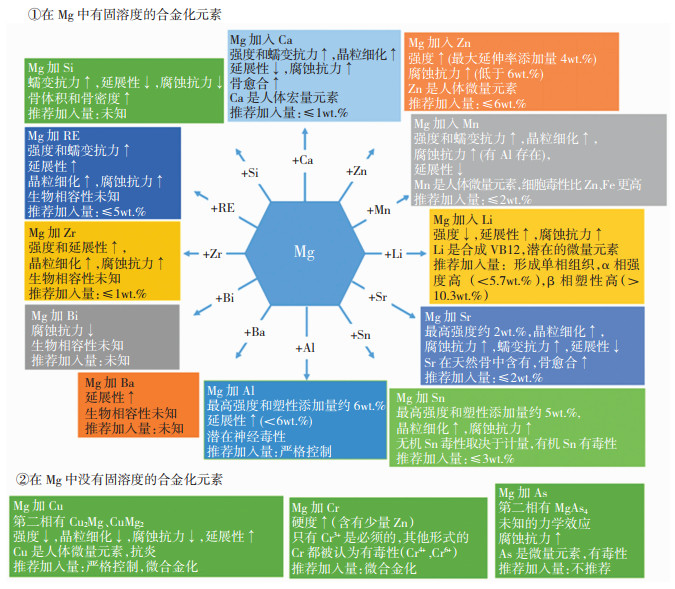
|
图 5 各种合金化元素加入镁中的作用和推荐加入量汇总 Fig.5 Summary of the role of various alloying elements playing after the addition into Mg to form an alloy and their recommended adding amounts |
与铁基和锌基生物可降解金属相比,镁基可降解金属具备与皮质骨最为接近的杨氏模量(约45 GPa)和密度(约1.74 g/cm3)。更重要的是镁基可降解金属具有独特的优势,即镁离子可积极刺激成骨作用,促进新的骨骼形成,这对骨折愈合是有益的。不同植入位置镁基可降解金属的降解速率与局部组织的血运状况密切相关,例如在皮质骨和松质骨所在区域的降解速率具有显著性差异,在骨髓腔中的降解速率高于在皮质骨中的部分。
血浆中镁的正常范围为0.70~1.05 mmol/L,毒性阈值为2.5 ~ 3.5 mmol/L,成人每日建议摄入量的镁(240~420 mg), 是铁(8~18 mg)和锌(8~11 mg)的52.5倍。人体缺乏镁会导致心血管疾病和神经系统疾病。镁基可降解金属制备的血管支架,优点是内皮化快,血栓源性低;缺点是力学性能和钴铬合金支架相比更差;且动物实验结果表明,其早期降解产物为氢氧化镁,逐渐与组织液中的磷酸根离子反应形成磷酸镁,最后镁离子被组织液中钙离子置换并代谢排出,在支架杆原位形成无定型啫喱状的羟基磷灰石。与永久植入性金属血管支架相反,由生物可降解的镁合金制成的血管支架的目标是通过腐蚀逐渐失去其机械支撑,并应及时降解以允许血管重塑和生长。在大多数情况下,现有的镁合金裸支架降解太快,致使无法维持足够长的机械完整性来完成其组织修复任务。
对镁基可降解金属进行表面改性是降低其降解速率的一种有效方式,可保证其在服役期间具有良好的力学性能。在镁及镁合金表面制备涂层的方法可以分为两类。一类是转化涂层,该类涂层主要通过反应物与基体发生化学反应,通常是将材料置于反应溶液中,在基底材料表面生成较为惰性的物质,以提高基体的耐腐蚀性。转化涂层由于直接在材料表面生长而形成,因此与基底的结合力非常好。另一类是沉积涂层,该类涂层主要通过一定的技术,在基体表面上沉积具有保护性的物质,以提高基底材料的耐腐蚀性。
2.2 铁基可降解金属的研究现状人体内的铁依据其功能可分为功能铁与非功能性储存铁两部分。功能铁铁占体内铁总量的70%,主要以血红素形式存在于血红蛋白、肌红蛋白、血红素酶类、辅助因子等。非功能性贮存铁,则主要以铁蛋白和含铁血黄素的形式存在于肝、脾和骨髓中。铁通过催化自由基的生成、促进脂蛋白的脂质和蛋白质部分的过氧化反应、形成氧化LDL等作用,参与动脉粥样硬化的形成。
与镁基可降解金属和锌基可降解金属相比,铁基可降解金属材料的强度要高很多,且通过材料冷加工、热处理、合金化或其他改性,甚至可以获得与钴铬合金媲美的优异综合力学性能。铁基可降解金属和钢铁材料类似,很容易通过材料(合金化和表面处理)和工艺(冷热加工)的改进,结合优化的支架设计,制造出综合力学性能优异且壁厚超薄的可吸收支架,从而最有望取代传统永久支架。铁基可降解金属材料的缺点是其体内腐蚀速率很慢,且固体腐蚀产物极难从植入位置被清除干净。
图 6为目前各种合金化元素加入铁中的作用和推荐加入量的汇总。通过合金化的方法,加入大量Mn元素获得奥氏体组织,可在提高腐蚀速率的同时提高核磁兼容性。或者是加入溶解度较小的元素,例如Ag、Pt、C等,在铁素体基体上析出电极电位更高的第二相颗粒,促进腐蚀。除通过合金化方法外,采用新的加工手段,如电铸成型、粉末冶金、电沉积等方法,获得与传统熔炼方法不同的组织调节腐蚀速率。但这些思路都容易出现在解决了腐蚀慢问题的同时,又引入了新的问题,如生物学风险或者综合力学性能被降低。同时,铁的腐蚀产物从植入位置清除的速度很慢, 仍是迄今未能解决的一大难题,有待各方研究人员和机构持续努力。
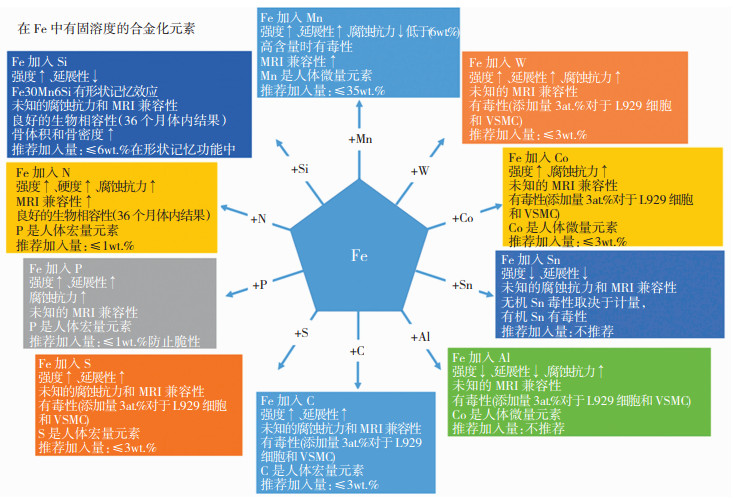
|
图 6 各种合金化元素加入铁中的作用和推荐加入量汇总 Fig.6 Summary of the role of various alloying elements playing after the addition into Fe to form an alloy and their recommended adding amounts |
与镁基金属和铁基金属相比,Zn的标准腐蚀电压(-0.762 VSCE)位于Fe(-0.440 VSCE)和Mg(-2.372 VSCE)之间,意味着其具备较为适宜的降解速率。锌元素作为一种必需元素,是蛋白质合成及能量代谢过程中最重要的元素之一,参与了机体多种酶促反应。人体内90%的锌储存于骨组织中,锌在骨形成和矿化过程中发挥着重要作用。研究表明,锌通过抑制破骨细胞骨吸收作用、促进成骨细胞骨形成发挥双相作用, 继而增加骨量。并且,锌已被证实可通过促进成骨细胞增殖,上调碱性磷酸酶活性,促进胶原合成,激活Runx-2及下游基因表达等机制促进新骨形成。相对应的,在绝经后骨质疏松妇女患者中常发现骨Zn含量的下降,且其与骨量的丢失成正比。此外, 与镁基可降解金属相比,锌基可降解金属具有显著更高的力学强度,且体内降解过程中无气体生成,不产生局部碱性环境,更适宜于骨科临床应用。除了良好的成骨潜能外,锌基金属的抗菌性能也得到了科学家们的关注。Zn2+可以与细菌表面相互作用,改变细菌细胞膜电荷平衡,导致细菌变形破裂。所以理论上所有锌基金属均具备抗菌潜能。
锌还是一种与心血管疾病密切相关的微量金属元素。锌在人体大量的酶和蛋白质中起到催化、结构组成以及调控的作用。因此,锌被认为在冠状动脉疾病和心肌病中具有保护作用。锌能够维持内皮细胞的完整性,从而降低血管对动脉粥样硬化的敏感性。在动脉粥样硬化的形成过程中,至关重要的一步是内皮细胞粘附分子表达的上调,这个过程由一种转录因子NF-κB调控,而锌参与调控NF-κB与DNA的结合。因此,锌可通过影响NF-κB,进而降低血管患动脉粥样硬化的风险。研究发现,在啮齿动物模型中,通过补充锌可以使心肌恢复率提高到100%,同时将心律失常的频率降低一半。一项针对糖尿病病人的临床研究发现,低的血清锌含量与高心肌梗死率相关,可以作为心血管疾病的一个独立风险因子。通过补充锌能够保护心肌细胞免受急性氧化还原应激,并可以防止心肌损伤时触发的炎症过程。锌还具有促进伤口愈合的功能,它可以通过支持心脏干细胞的存活帮助心脏修复。
纯锌的力学性能较差(抗拉强度20 MPa,延伸率0.3%,硬度25HV),不能满足一些承力部位植入物的要求。为了提高锌基可降解金属的性能,一系列合金化元素被引入锌合金体系,包括锂(Li)、镁(Mg)、钙(Ca)、锶(Sr)、铜(Cu)、银(Ag)、锰(Mn)和铁(Fe)等。自2011年起,Zn-Mg系、Zn-Ca系、Zn-Sr系、Zn-Li系、Zn-Cu系、Zn-Ag系和Zn-Mn系等可降解锌合金体系被开发,如图 7所示。锌基可降解金属材料具有适中的降解速率,降解过程以吸氧腐蚀为主,没有氢气产生。锌基可降解金属无铁磁性,不会干扰核磁共振的检测。通过引入合金元素,锌基可降解金属材料的力学性质得到很大改善,见图 8[16],其中锂元素带来的强度提升最为显著。但是锌锂合金在获得高强度的同时牺牲了塑性。
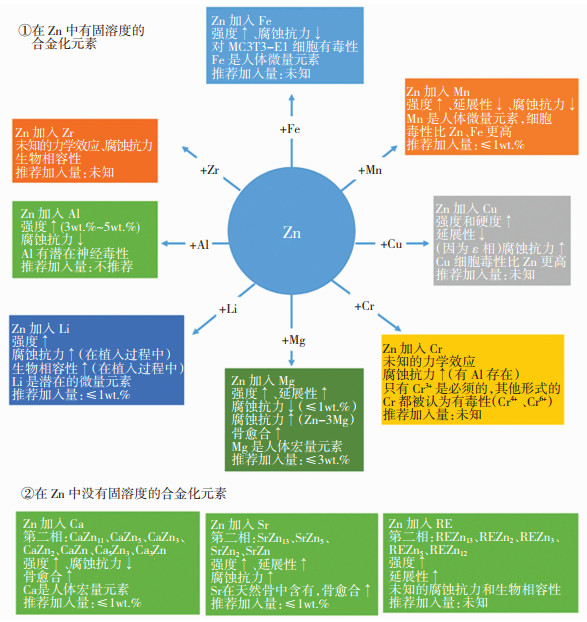
|
图 7 各种合金化元素加入锌中的作用和推荐加入量汇总 Fig.7 Summary of the role of various alloying elements playing after the addition into Zn to form an alloy and their recommended adding amounts |
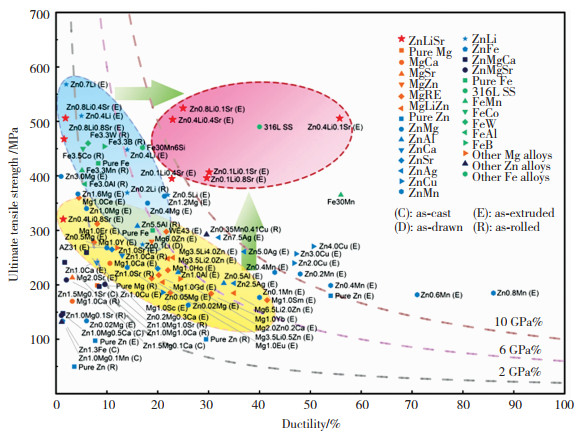
|
图 8 各种合金化元素加入锌中对力学性能的影响汇总[16] Fig.8 Summary of effects of various alloying elments on the mechanical properties of the resulting Zn alloys after adding into Zn[16] |
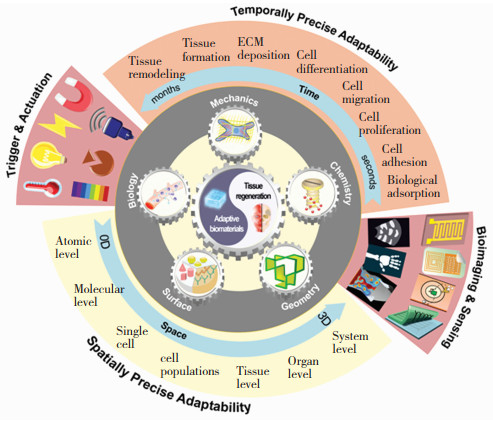
2021年,本文作者与王迎军院士在Matter杂志上发表观点文章[17],提出了精准生物适配理念并阐述了精准生物适配原理,如图 9所示,强调材料的力学、降解行为应在时间和空间维度上与组织修复生理过程精准适配。这将为可降解金属的材料设计提供指导性原则。精准生物适配是在生物安全和生物相容的基础上对生物材料更高层次的要求和更全面的理论诠释。基于精准生物适配理论设计的可降解金属,在组织修复过程中应主动适配和营造生物微环境,实现材料与生命体的整体适配。
精准生物适配理论指出,新型可降解金属材料发展的主要特点包括智能化、精准化、生命化和多功能化。可降解金属未来的发展方向包括的一些趋势,如图 10所示[18-21]。1)具有形状记忆效应的可降解金属,这方面Fe-Mn-Si合金、Mg-Sc体系都是已经明确具有形状记忆效应的可降解金属,前期也有相关的生物相容性研究。其中,对未来医学应用的一个关键是如何改变成分和加工工艺调控其相变温度,使得该材料能够在体温下具有形状记忆效应或者是体温超弹性特性。2)关于降解调控,对于可降解金属本体材料,已经有大量的成分配方和冷热加工处理工艺来初步调控材料的降解模式(均匀腐蚀还是点蚀,是否包括第二相和基体之间的电偶腐蚀等)获得合适的降解速度,目前的表面涂层构建也可以进一步对降解速度进行调控,包括既有加速降解的涂层,也有减缓降解的涂层,通常后者为主。然而目前这些主流的涂层不具备外场调控功能,未来的发展方向将会是新功能涂层,即可以利用外加光场、电场、磁场等手段,干预涂层的降解,进而调控可降解金属的降解周期和降解速度。从而能够在初期减缓可降解金属基体发生降解而保持整体结构的力学性能完整性,之后在不需要涂层保护的时间点上能够利用外场主动加速涂层自身被体液降解。另外从降解调控来说,研究者未来所追求的最高境界一定不是均匀降解,而是可控的不均匀降解。3)面向有源植入电子元器件器械的可降解金属薄膜开发,这个方面是跨界的交叉学科研究,一方面从事生物电子学研究的群体在巧妙地利用可降解高分子和可降解金属薄膜来构建各种电子元器件,另一方面很多生物电子器件要耦合到无源医疗器械上,实现对无源医疗器械功能的监控与示踪,将会为无源的植入物带来革新,因此,未来的医疗器械必将是无源植入物和有源暂态电子器件的耦合。4)可降解金属材料体系的拓展,从图 2可以看到,除Mg、Fe、Zn之外,还有一些元素在人体内有一定含量,比如最近就有针对开发可降解金属Mo的研究报道,将这样的元素做成薄膜器械,其进入人体的总质量足够低,每日降解释放出的含量低于该元素每日摄取量的水平,未来用于人体还是可以接受的。
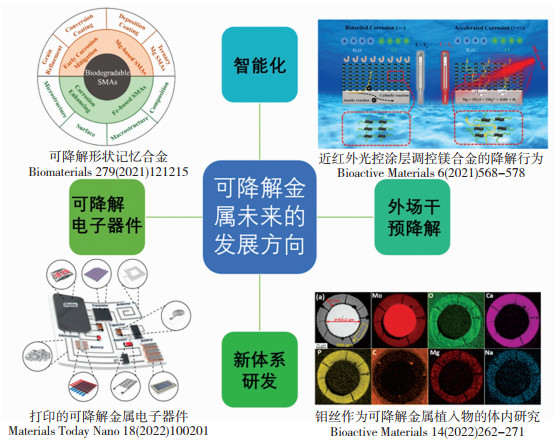
|
图 10 可降解金属的未来发展方向 Fig.10 Future development directions of biodegradable metals |
此外,未来将针对成分多元、微观组织结构、介观孔隙结构及制备工艺复杂、组织和性能多样化的特点,研发新型可降解金属材料高通量设计与制备新方法、新技术和新装备、高通量表征手段,显著提高可降解金属材料从需求-优化-制备- 检测-应用的研发效率。例如运用机器学习,实现快速可降解金属材料性能预测,加速可降解金属新材料设计开发与高通量理论计算,为材料设计提供指导,缩短材料研发周期;利用人工智能技术摸索相关材料的成分、工艺、组织、性能、体内服役环境的关联关系;计算可降解金属植入材料降解产物的药理学和药代动力学。
目前,可降解金属已在骨修复、口腔修复、神经修复、血管组织修复、腔道修复、外科、生殖避孕、生物电子器件等领域开展临床应用前的评价和临床应用研究,如图 11所示[22-30]。未来可降解金属虽然不能完全替代钛合金、钴基合金等用于大段骨缺损组织的替代物,或者是关节假体制造,但这类材料有望如镍钛合金凭借其独特的形状记忆和超弹性特性在植介入器械的制造方面被选择使用一样,将以其独特的可体液降解且降解产物具备一定生物学功能,而被在一些临床应用场景选择使用。

|
图 11 可降解金属的医学应用领域汇总 Fig.11 Summary of biomdeical application fields of biodegradable metals |
| [1] |
HENCH L L, POLAK J M. Third-generation biomedical materials[J]. Science, 2002, 295(5557): 1014-1017. DOI:10.1126/science.1067404 |
| [2] |
WAGNER William, SAKIYAMA-ELBERT Shelly, ZHANG Guigen, et al. Biomaterials science an introduction to materials in medicine[M]. 4th ed. Academic Press, 2020.
|
| [3] |
Implants for surgery-general guidelines and requirements for assessment of absorbable metallic implants: ISO/TS 20721-2020[S]. IX-ISO, 2020.
|
| [4] |
Standard guide for in vitro degradation testing of absorbable metals: ASTM F3268-2018[S]. US-ASTM, 2018.
|
| [5] |
可降解镁金属骨科植入物注册审查指导原则. https://www.nmpa.gov.cn/ylqx/ylqxggtg/20220117152242100.html.
|
| [6] |
ZHENG Y F, GU X N, WITTE F. Biodegradable metals[J]. Materials Science & Engineering R: Reports, 2014, 77: 1-34. DOI:10.1016/j.mser.2014.01.001 |
| [7] |
Standard guide for metallurgical characterization of absorbable metallic materials for medical implants: ASTM F3160-2016[S]. US-ASTM, 2016.
|
| [8] |
张兴栋, David Williams. 二十一世纪生物材料定义[M]. 赵晚露, 译. 北京: 科学出版社, 2021.
|
| [9] |
LIU Yang, ZHENG Yufeng, CHEN Xiehui, et al. Fundamental theory of biodegradable metals——definition, criteria, and design[J]. Adv Funct Mater, 2019, 29: 1805402. |
| [10] |
常元勋. 金属毒理学[M]. 北京: 北京大学医学出版社, 2008. CHANG Yuanxun. Metal toxicology[M]. Beijing: Peking University Medical Press, 2008. |
| [11] |
迟锡增. 微量元素与人体健康[M]. 北京: 化学工业出版社, 1997.
|
| [12] |
LI Wenting, QIAO Wei, LIU Xiao, et al. Biomimicking bone-implant interface facilitates the bioadaption of a new degradable magnesium alloy to the bone tissue microenvironment[J]. Advanced Science, 2021, 8(23): 2102035. DOI:10.1002/advs.202102035 |
| [13] |
HWANG S W, TAO Hu, KIM D H, et al. A physically transient form of silicon electronics[J]. Science, 2012, 337(6102): 1640-1644. DOI:10.1126/science.1226325 |
| [14] |
LIU Jianing, BIAN Dong, ZHENG Yufeng, et al. Comparative in vitro study on binary Mg-RE (Sc, Y, La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb and Lu) alloy systems[J]. Acta Biomater, 2020, 102: 508-528. DOI:10.1016/j.actbio.2019.11.013 |
| [15] |
郑玉峰, 刘嘉宁. 从可降解金属的角度审视医用镁合金的元素选择[J]. 中国材料进展, 2020, 39(2): 92-99. ZHENG Yufeng, LIU Jianing. Element selection of medical magnesium alloys from the perspective of degradable metals[J]. Materials China, 2020, 39(2): 92-99. DOI:10.7502/j.issn.1674-3962.201907012 |
| [16] |
ZHANG Zechuan, JIA Bo, YANG Hongtao, et al. Biodegradable ZnLiCa ternary alloys for critical-sized bone defect regeneration at load-bearing sites: In vitro and in vivo studies[J]. Bioactive Materials, 2021, 6(11): 3999-4013. DOI:10.1016/j.bioactmat.2021.03.045 |
| [17] |
XU Xiaoxue, JIA Zhaojun, ZHENG Yufeng, et al. Bioadaptability of biomaterials: Aiming at precision medicine[J]. Matter, 2021, 4(8): 2548-2650. DOI:10.1016/j.matt.2021.06.033 |
| [18] |
WANG Yuan, VENEZUELA Jeffrey, DARGUSCH Matthew. Biodegradable shape memory alloys: progress and prospects[J]. Biomaterials, 2021, 279: 121215. DOI:10.1016/j.biomaterials.2021.121215 |
| [19] |
LIU Li, HUANG Bo, LIU Xiangmei, et al. Photo-controlled degradation of PLGA/Ti3C2 hybrid coating on Mg-Sr alloy using near infrared light[J]. Bioactive Materials, 2021, 6(2): 568-578. DOI:10.1016/j.bioactmat.2020.08.013 |
| [20] |
LI J, LIU J, HUO W, et al. Micro and nano materials and processing techniques for printed biodegradable electronics[J]. Materials Today Nano, 2022, 18: 100201. DOI:10.1016/j.mtnano.2022.100201 |
| [21] |
SIKORA-JASINSKA Malgorzata, MORATH Lea M, KWESIGA Maria P, et al. In-vivo evaluation of molybdenum as bioabsorbable stent candidate[J]. Bioactive Materials, 2022, 14: 262-271. DOI:10.1016/j.bioactmat.2021.11.005 |
| [22] |
GUO Hui, HE Ying, ZHENG Yufeng, et al. In vitro studies of biodegradable Zn-0.1Li alloy for potential esophageal stent application[J]. Materials Letters, 2020, 275: 28190. DOI:10.1016/j.matlet.2020.128190 |
| [23] |
LIU Yang, LI Huafang, XU Jiankun, et al. Biodegradable metal-derived magnesium and sodium enhances bone regeneration by angiogenesis aided osteogenesis and regulated biological apatite formation[J]. Chemical Engineering Journal, 2021, 410: 127616. DOI:10.1016/j.cej.2020.127616 |
| [24] |
GUO Hui, HU Jili, SHEN Zhenquan, et al. In vitro and in vivo studies of biodegradable Zn-Li-Mn alloy staples designed for gastrointestinal anastomosis[J]. Acta Biomaterialia, 2021, 121: 713-723. DOI:10.1016/j.actbio.2020.12.017 |
| [25] |
BAO Guo, FAN Qianqian, GE Dongfeng, et al. In vitro and in vivo studies to evaluate the feasibility of Zn-0.1 Li and Zn-0.8Mg application in the uterine cavity microenvironment compared to pure zinc[J]. Acta Biomaterialia, 2021, 123: 393-406. DOI:10.1016/j.actbio.2020.12.048 |
| [26] |
ZHANG Zechuan, JIA Bo, YANG Hongtao, et al. Biodegradable ZnLiCa ternary alloys for critical-sized bone defect regeneration at load-bearing sites: In vitro and in vivo studies[J]. Bioactive Materials, 2021, 6(11): 3999-4013. DOI:10.1016/j.bioactmat.2021.03.045 |
| [27] |
QU Xinhua, YANG Hongtao, JIA Bo, et al. Zinc alloy-based bone internal fixation screw with antibacterial and anti-osteolytic properties[J]. Bioactive Materials, 2021, 6(12): 4607-4624. DOI:10.1016/j.bioactmat.2021.05.023 |
| [28] |
SHEN Danni, QI Haiping, LIN Wenjiao, et al. PDLLA-Zn-nitrided Fe bioresorbable scaffold with 53 μm-thick metallic struts and tunable multi-stage biodegradation function[J]. Science Advances, 2021, 7(23): eabf0614. DOI:10.1126/SCIADV.ABF0614 |
| [29] |
XIA Dandan, YANG Fan, ZHENG Yufeng, et al. Research status of biodegradable metals designed for oral and maxillofacial applications: A review[J]. Bioactive Materials, 2021, 6(11): 4186-4208. DOI:10.1016/j.bioactmat.2021.01.011 |
| [30] |
BAO Guo, WANG Kun, YANG Lijun, et al. Feasibility evaluation of a Zn-Cu alloy for intrauterine devices: In vitro and in vivo studies[J]. Acta Biomaterialia, 2022, 142: 374-387. DOI:10.1016/j.actbio.2022.01.053 |
 2023, Vol. 31
2023, Vol. 31