在众多骨植入材料中,镁(Mg)及镁合金表现出与人体骨骼组织相似的弹性模量,具有最小的应力屏蔽效应[1]。更重要的是,镁合金植入物可以在体内自降解而避免二次手术。尽管可生物降解镁合金的研究取得了一系列进展,如功能性可生物降解镁合金的合成,模拟体内环境腐蚀行为研究以及镁合金降解模型的设计等,但其大规模临床应用仍然面临着各种限制[2-4]。
与植入物相关的微生物感染同样带来了重大的临床挑战。因此,植入材料应具有一定的防止细菌附着和增殖的能力。一些研究人员发现镁及其合金在体外表现出一定的抗菌能力,这主要归因于金属镁的快速溶解导致的渗透压增加和局部化学条件碱化[5]。然而,镁基植入物的快速溶解不仅导致其完整性和机械强度过早丧失,还会产生大量的Mg2+,超过人体允许的镁摄入阈值浓度,从而诱发高镁血症。此外,人体体液的缓冲作用可有效防止与镁溶解相关的局部碱化,从而降低其抑制体内细菌入侵的能力[6-7]。
使用外加高电压的微弧氧化技术被认为是镁合金表面改性的理想方法。在微弧氧化过程中,镁合金作为一种典型的阀金属,其表面会原位生长出具有优异结合力的MgO陶瓷层,可有效提高镁合金的耐磨性和耐蚀性。陶瓷膜层的多孔结构可以促进与人体骨组织的相互作用,这也为药物、腐蚀抑制剂和纳米颗粒提供了容器以实现陶瓷层的功能化[8]。此外,通过调节微弧氧化电解质组分可简单实现对陶瓷层化学成份的调控。
锌(Zn)是人体必需的微量元素,能促进成骨细胞的增殖和分化,从而刺激骨的形成[9-11]。此外,锌是阻止细菌在植入材料表面粘附的有效元素。因此,利用微弧氧化技术将Zn引入MgO陶瓷层有利于镁合金骨植入体内的抗菌效果和成骨能力。在众多锌源中,氧化锌(ZnO)被认为是具有应用前景的生物活性纳米材料,可有效增强植入材料的生物响应行为。研究人员将ZnO纳米颗粒引入微弧氧化电解液中以制备Zn改性的陶瓷膜层[12-14]。尽管改性后的复合膜层表现出了一定的抗菌性能,但其表面的含Zn沉积物往往出现分布不均匀的情况,在一定程度上限制了膜层的整体抗菌性能。ZnO纳米颗粒在电解液中的团聚现象可能是引起上述现象的原因之一。因此改善ZnO在电解液中的分散性有望促进复合膜层的抗菌性能。
本文通过在ZnO纳米颗粒表面包覆聚二烯丙基二甲基氯化铵(PDDA)以改善其分散性,采用微弧氧化技术在纯镁表面制备了Zn掺杂MgO陶瓷层。系统研究了Zn掺杂MgO陶瓷层的微观组织结构、物相成分、亲水性、耐蚀性以及抗菌性。该研究可为功能元素改性微弧氧化膜层的均匀化制备提供一种可行方案。
1 实验 1.1 Zn改性MgO陶瓷层的制备高纯镁(99.99%,中诺新材科技有限公司)加工为直径15 mm,高3 mm的圆柱试样。试样经碳化硅砂纸逐级打磨至2 000#,并通过乙醇、甲醇交替清洗后冷风吹干。将ZnO纳米颗粒(粒径为(50±10) nm,上海麦克林生化科技有限公司)分散至质量浓度为0.1 mg/mL的聚二烯丙基二甲基氯化铵(PDDA,上海麦克林生化科技有限公司) 水溶液中超声搅拌1 h,离心洗涤干燥,记为ZnO-PDDA。分别配制质量浓度为10 g/L ZnO-PDDA、8 g/L NaOH和10 g/L Na3PO4 ·12H2O的电解液。微弧氧化过程中,高纯镁试样为阳极,不锈钢为阴极,电流密度稳定在50 mA/cm2,最佳频率和占空比为100 Hz和10%,经过600 s处理后得到Zn/MgO-PDDA膜层。作为对比,通过添加未经PDDA改性的ZnO纳米颗粒制备了Zn/MgO膜层,其它工艺参数不做改变。
1.2 材料表征采用场发射扫描电子显微镜和能量色散X射线(SEM,EDX,Gemini 300,德国)观察了陶瓷层的表面与截面形貌以及元素分布信息。通过场发射透射电子显微镜(TEM,Talos F200X,荷兰)分析了陶瓷层表面沉积物的成分信息。此外,接触角是通过光学接触角仪(JC2000D,中国)测量的,每个陶瓷层的水接触角值是5个随机位置测量数据的平均值。
1.3 电化学测试电化学测量在具有传统三电极配置的37 ℃生理盐水(0.9wt. % NaCl溶液)中进行,选用饱和甘汞电极和Pt电极为参比电极和对电极。在开路电位(OCP)稳定30 min后进行动电位极化,以0.5 mV/s的速率从-200 mV(vs.SCE)扫描到+200 mV(vs.SCE)。电化学阻抗谱(EIS)频率范围为0.01~105 Hz,交流幅值为10 mV。
1.4 抗菌性能测试使用金黄葡萄球菌(S.aureus)菌株评估陶瓷层的抗菌性能。严格灭菌后,将所有测试样品置于24孔培养板中,用移液管将浓度为105 cfu/mL的细菌悬液移至每个样品表面。在37 ℃下孵育24 h,所有样品用磷酸盐缓冲盐水(PBS)洗涤,然后通过涡旋混合器强力清洗,使细菌从样品表面分离。然后将分离的细菌在37 ℃营养琼脂平板中培养24 h。使用以下公式计算抗菌率(AR)
| $ \mathrm{AR}=\left(N_{\text {control }}-N_{\text {sample }}\right) / N_{\text {control }} \times 100 \% $ | (1) |
其中Ncontrol和Nsample分别是对照组和陶瓷层上的平均菌落数。
2 结果与分析 2.1 形貌及物相分析所制备的Zn/MgO膜层和Zn/MgO-PDDA膜层的表面形貌如图 1(a)、(b)所示,两种样品都表现出典型的微弧氧化膜层多孔结构。对样品表面进一步放大观察,Zn/MgO膜层表面出现非均匀局部沉积物,这些沉积物是由微米级颗粒团聚而成(图 1(c)中箭头所示)。由于PDDA的引入,Zn/MgO-PDDA膜层表面呈现出均匀微米级颗粒沉积(图 1(d)中箭头所示),证明PDDA有效改善了电解液中ZnO的分散性,并使其在微弧氧化过程中均匀负载到MgO膜层表面。

|
图 1 膜层表面形貌及孔隙分布: (a), (c)Zn/MgO形貌; (b),(d)Zn/MgO-PDDA形貌; (e)Zn/MgO孔隙; (f)Zn/MgO-PDDA孔隙 Fig.1 Surface microtopography and pore distribution of coating: (a), (c) surface microtopography of Zn/MgO and (b), (d) Zn/MgO-PDDA; pore distribution of (e) Zn/MgO and (f) Zn/MgO-PDD |
采用Image Pro Plus软件对图 1(c)、(d)的孔隙分布进行统计分析,结果对应于图 1(e)、(f)。显然,Zn/MgO-PDDA膜层表面的沉积颗粒起到了较为均匀的部分封孔作用,而Zn/MgO膜层表面的沉积团簇体仅在其沉积区域部分封孔,无沉积区域的孔隙则完全暴露。封孔的差异性可能会影响腐蚀性离子对镁基体的入侵速度。
采用EDX研究了Zn/MgO和Zn/MgO-PDDA膜层表面的化学成份, 如图 2所示。

|
图 2 表面元素分析 Fig.2 Analysis of elements |
如图 2(a)所示,Zn/MgO膜层在没有团簇沉积物区域元素分布相对均匀,而团簇沉积物相对于周边区域含有较高的Zn和P。Zn/MgO-PDDA膜层则表现出了元素分布的均匀性(图 2(b)),与其表面颗粒的均匀分布一致。根据微弧氧化膜层的元素分布可以确定表面沉积物贫Mg,富Zn、O、P。而无沉积物的陶瓷层贫Zn,说明基体中的Mg主要被氧化为陶瓷层中的MgO,Zn则更多存在于沉积物中。
为了进一步验证物相成分,将沉积物从两种陶瓷层表面机械剥离,分别分散在乙醇中,并使用TEM表征。图 3(a)显示了Zn/MgO膜层表面沉积物的典型TEM显微照片,呈现出数百纳米的团簇结构。其电子衍射图像(插图所示)反映出无任何衍射点的漫反射晕环,但通过高分辨图像仔细观察发现,部分区域证实了包括{101}和{002}晶面在内的ZnO相的存在。这种现象归因于未改性的ZnO纳米颗粒分散性较差,界面处的P元素难以与熔融态ZnO充分接触,使得只有部分P元素掺入到表面沉积物中,冷却后以ZnO晶体和Zn-O-P化合物共存。反观图 3(c)所示的Zn/MgO-PDDA膜层,其沉积物多以数十纳米的颗粒结构呈现,其电子衍射图像(图 3(d))同样表现为漫反射晕环。特别地,其任何区域在高分辨下都没有发现ZnO相的存在,说明PDDA改性后的ZnO纳米颗粒与P元素充分接触,使得P元素完全掺入ZnO中,形成Zn-O-P纳米沉积物。总之,两种陶瓷层表面沉积物在物相结构上的差异归因于PDDA对ZnO的改性作用。对于Zn/MgO膜层,沉积物的严重团聚导致电解液中P的扩散阻力增大;而对于Zn/MgO-PDDA,分布均匀的沉积物为P提供了更短的扩散路径。

|
图 3 表面沉积物TEM图像 Fig.3 TEM images of depositions: (a), (b) Zn/MgO; (c), (d) Zn/MgO-PDDA |
随后,观察了Zn/MgO和Zn/MgO-PDDA膜层的截面形貌,如图 4所示。

|
图 4 膜层截面形貌 Fig.4 Cross-section of coating: (a) Zn/MgO; (b) Zn/MgO-PDDA |
Zn/MgO膜层内部出现较大孔隙,外边缘沉积物(红色箭头所示)只出现部分沉积。Zn/MgO -PDDA膜层内部则较为致密,且外边缘沉积(红色箭头所示)更为均匀。随机选取5个不同位置计算内部MgO陶瓷层(黄色区域)的平均厚度。Zn/MgO膜层中的MgO的厚度为(3.36±0.05) μm,Zn/MgO-PDDA膜层中的MgO的厚度为(2.52±0.46) μm。显然,Zn/MgO-PDDA膜层中MgO陶瓷层的厚度更小,这是因为ZnO的介电常数约为8.7,低于MgO的9.7,介电击穿将优先发生在ZnO区域,进而降低了MgO周围的平均电流密度[15]。因此,沉积物更为均匀的Zn/MgO-PDDA膜层具有更低的生长速度,这赋予了其更为致密的膜层结构以及更小的膜层厚度。
2.2 亲水性植入材料往往需要理想的亲水性以促进成骨细胞的附着和增殖[16-17]。图 5为Zn/MgO和Zn/MgO-PDDA膜层表面亲水性的统计结果。由于Zn/MgO膜层表面的非均匀结构特点,其表现出较大误差的水接触角值(25.7±3.5)°,而Zn/MgO-PDDA膜层表面的水接触角值则较为稳定(21.8±1.3)°。相比之下,Zn/MgO-PDDA膜层表现出了更优异的亲水性,这是因为亲水性与材料的表面能有关。
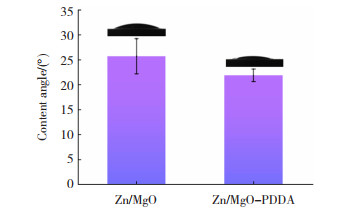
|
图 5 Zn/MgO和Zn/MgO-PDDA的表面亲水性 Fig.5 Hydrophilicity of Zn/MgO and Zn/MgO-PDDA |
通过TEM和SEM结果可知,Zn/MgO-PDDA膜层表面沉积物尺寸更小、面积更大,因此具有更高的表面能,进而赋予了其更优异的亲水性。可以预期,相比于Zn/MgO膜层,Zn/MgO-PDDA膜层可能会表现出更理想的生物相容性。
2.3 电化学腐蚀性能采用电化学技术测试了Zn/MgO和Zn/MgO-PDDA膜层的耐腐蚀性能,并与裸基体进行比较。Zn/MgO、Zn/MgO-PDDA膜层和裸基体的动电位极化曲线如图 6(a)所示。裸基体具有最大的自腐蚀电流(icorr=1.78×10-4 A/cm2),证明裸基体的耐蚀性较差。微弧氧化处理后,Zn/MgO和Zn/MgO-PDDA膜层的icorr分别降至7.22×10-5和4.55×10-6 A/cm2,说明陶瓷层的物理隔绝作用有效提高了基体的耐蚀性。其中,Zn/MgO-PDDA膜层的icorr相比于裸基体降低了2个数量级,说明PDDA的表面均匀性优化作用进一步提高了陶瓷层的耐蚀性。

|
图 6 裸基体、Zn/MgO和Zn/MgO-PDDA的电化学结果 Fig.6 Electrochemical results of bare substrate, Zn/MgO, and Zn/MgO-PDDA: (a) polarization curve; (b) Nyquist plot of EIS; (c) Bode plot of EIS; (d), (e) equivalent circuit of substrate and ceramic layer |
图 6(b)和(c)显示了Zn/MgO和Zn/MgO-PDDA膜层的电化学阻抗谱(EIS)。对于Nyquist图,裸基体的特征在于存在一个中频区的容抗弧和低频区的感抗弧,感抗弧的出现表明Cl-已侵蚀镁基体表面并引发点蚀。而Zn/MgO和Zn/MgO-PDDA膜层仅表现出两个容抗弧,说明两种陶瓷层有效阻止了Cl-对镁基体的侵蚀。通常,采用Bode图中0.01 Hz处的阻抗模值(|Z|0.01Hz)评估材料的整体防腐性能。显然,3种试样的|Z|0.01Hz按降序排列:Zn/MgO-PDDA膜层> Zn/MgO膜层> Bare Mg,这与极化曲线结果一致。随后,通过等效电路对EIS数据进行拟合,图 6(d)和(e)分别对用于裸基体和陶瓷层的EIS结果。其中,Rs代表电解液中的溶液电阻;Rcoat、Rct和Rpit分别代表陶瓷层电阻、电荷转移电阻和点蚀电阻;考虑到电极表面的不稳定性,采用常相位元件CPE来描述不同界面的电容元件,CPEcoat和CPEdl分别代表溶液/陶瓷层界面和溶液/镁基体界面的电容元件;电感L与Cl-在镁基体表面的吸附-脱附有关。拟合结果列于表 1中,通过Rtotal(Rtotal=Rct+Rcoat) 评价材料的总耐腐蚀抗性。由表 1可知, 镁基体经Zn掺杂微弧氧化处理后其耐蚀性显著提高,Rtotal从9.82×102 Ω/cm2(裸基体)分别增长至8.36×103 (Zn/MgO)和2.04×104 Ω/cm2 (Zn/MgO-PDDA),再次证明PDDA的引入可有效提高陶瓷层的耐蚀性能。
| 表 1 EIS拟合结果 Table 1 Fitting results of EIS |
采用金黄色葡萄球菌评价了Zn/MgO和Zn/MgO-PDDA膜层的抗菌性能。如图 7(a)所示,相比于对照组表面的菌落数,Zn/MgO和Zn/MgO-PDDA膜层表面的菌落数明显减少,说明Zn的引入显著提高了陶瓷层的杀菌能力。Zn2+的抗菌机制已经得到了充分的证实,它不仅可以穿透细菌膜与蛋白质相互作用,而且可以破坏细菌的DNA,阻止细菌的增殖[10, 18]。

|
图 7 Zn/MgO和Zn/MgO-PDDA表面金黄葡萄球菌菌落(a)及抗菌率(b) Fig.7 S.aureus bacterial colonies for Zn/MgO and Zn/MgO-PDDA (a) and calculated antibacterial rates (b) |
图 7(b)显示了Zn/MgO和Zn/MgO-PDDA膜层的统计学抗菌率,Zn/MgO膜层表现出79.6%的抗菌率,明显低于Zn/MgO-PDDA膜层的91.3%,说明PDDA的引入进一步加强了陶瓷层的抗菌性能。一方面,Zn/MgO膜层表面的细菌有一定的概率附着于贫Zn区域的陶瓷层表面,导致局部抗菌性能下降;另一方面,Zn/MgO-PDDA膜层表面富Zn沉积物的比表面积显著高于Zn/MgO膜层,加速了Zn2+的释放动力学过程,从而赋予其更理想的抗菌性能。
3 结论1) 通过PDDA改性ZnO纳米颗粒,采用微弧氧化技术制备了表面均匀的Zn改性MgO陶瓷层。
2) PDDA的引入促进Zn-O-P无定形沉积物的生成,并改善了陶瓷层的致密性和孔隙率。
3) Zn/MgO-PDDA膜层更致密的膜层结构、更低的孔隙率显著提高了陶瓷层的耐蚀性。
4) Zn/MgO-PDDA膜层优化的富Zn沉积物分布结果将抗菌率提升至91.3%。
| [1] |
CHEN Chenxin, CHEN Jiahui, WU Wei, et al. In vivo and in vitro evaluation of a biodegradable magnesium vascular stent designed by shape optimization strategy[J]. Biomaterials, 2019, 221: 119414. DOI:10.1016/j.biomaterials.2019.119414 |
| [2] |
CHEN Hewei, YUAN Bo, ZHAO Rui, et al. Evaluation on the corrosion resistance, antibacterial property and osteogenic activity of biodegradable Mg-Ca and Mg-Ca-Zn-Ag alloys[J]. Journal of Magnesium and Alloys, 2022, 10(12): 3380-3396. DOI:10.1016/j.jma.2021.05.013 |
| [3] |
MEI D, WANG C, LANAKA V S, et al. Clarifying the influence of albumin on the initial stages of magnesium corrosion in Hank's balanced salt solution[J]. Journal of Magnesium and Alloys, 2021, 9(3): 805-817. DOI:10.1016/j.jma.2020.07.002 |
| [4] |
BARZEGARI M, MEI D, LANAKA V S, et al. Computational modeling of degradation process of biodegradable magnesium biomaterials[J]. Corrosion Science, 2021, 190: 109674. DOI:10.1016/j.corsci.2021.109674 |
| [5] |
BROOKS K E, AHN R, TOBIAS E M, et al. Ehrensberger, magnesium alloy AZ91 exhibits antimicrobial properties in vitro but not in vivo[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2018, 106(1): 221-227. DOI:10.1002/jbm.b.33839 |
| [6] |
AGARWL S, CURTIN J, DUFFY B, et al. Biodegradable magnesium alloys for orthopaedic applications: A review on corrosion, biocompatibility and surface modifications[J]. Materials Science and Engineering: C, 2016, 68: 948-963. DOI:10.1016/j.msec.2016.06.020 |
| [7] |
WU G S, IBRAHIM J M, CHU K P. Surface design of biodegradable magnesium alloys—a review[J]. Surface and Coatings Technology, 2013, 233: 2-12. DOI:10.1016/j.surfcoat.2012.10.009 |
| [8] |
ZENG Rongchang, CUI Lanyue, JIANG Ke, et al. In vitro corrosion and cytocompatibility of a microarc oxidation coating and Poly(l-lactic acid) composite coating on Mg-1Li-1Ca alloy for orthopedic implants[J]. ACS Applied Materials & Interfaces, 2016, 8(15): 10014-10028. DOI:10.1021/acsami.6b00527 |
| [9] |
SHU Zhan, ZHANG Yi, YANG Qi, et al. Halloysite nanotubes supported Ag and ZnO nanoparticles with synergistically enhanced antibacterial activity[J]. Nanoscale Research Letters, 2017, 12(1): 135. DOI:10.1186/s11671-017-1859-5 |
| [10] |
YU Hanwu, HUANG Xiaobo, YANG Xiaoning, et al. Tang synthesis and biological properties of zn-incorporated micro/nano-textured surface on ti by high current anodization[J]. Materials Science and Engineering: C, 2017, 78: 175-184. DOI:10.1016/j.msec.2017.04.063 |
| [11] |
SIRELKHATIM A, MAHMUD S, SEENI A, et al. Review on zinc oxide nanoparticles: Antibacterial activity and toxicity mechanism[J]. Nano-Micro Letters, 2015, 7(3): 219-242. DOI:10.1007/s40820-015-0040-x |
| [12] |
KEYVANI A, ZAMANI M, BAHAMIRIAN M, et al. Role of incorporation of ZnO nanoparticles on corrosion behavior of ceramic coatings developed on AZ31 magnesium alloy by plasma electrolytic oxidation technique[J]. Surfaces and Interfaces, 2021, 22: 100728. DOI:10.1016/j.surfin.2020.100728 |
| [13] |
CHEBODAEVA V V, SEDELNIKOVA M B, LERNER M I, et al. Structure and properties of CaP coatings formed by micro-arc oxidation and modified by ZnO nanoparticles[C]//AIP Conference Proceedings. AIP Publishing LLC, 2020, 2310(1): 020055. DOI: 10.1063/5.0034120
|
| [14] |
BORDBAR-KHIABANI A, YARMAND B, MOZAFARI M. Enhanced corrosion resistance and in-vitro biodegradation of plasma electrolytic oxidation coatings prepared on AZ91 Mg alloy using ZnO nanoparticles-incorporated electrolyte[J]. Surface and Coatings Technology, 2019, 360: 153-171. DOI:10.1016/j.surfcoat.2019.01.002 |
| [15] |
NECULA B S, LEEUWEN van J P T M, FRATILA-APACHITEI L E, et al. Duszczyk in vitro cytotoxicity evaluation of porous TiO2-Ag antibacterial coatings for human fetal osteoblasts[J]. Acta Biomaterialia, 2012, 8(11): 4191-4197. DOI:10.1016/j.actbio.2012.07.005 |
| [16] |
杜春燕, 赵晖, 赵海涛. 纯钛表面载银微弧氧化陶瓷膜的制备及性能[J]. 材料工程, 2020, 48(8): 157-162. DU Chunyan, ZHAO Hui, ZHAO Haitao. Preparation and properties of Ag-carrying micro-arc oxidation ceramic film on pure titanium surface[J]. Journal of Materials Engineering, 2020, 48(8): 157-162. DOI:10.11868/j.issn.1001-4381.2019.000214 |
| [17] |
孙乐, 马颖, 李奇辉, 等. 表面等离子体电解渗硼与微弧氧化复合膜的制备及耐蚀性[J]. 表面技术, 2021, 50(6): 64-76. SUN Le, MA Ying, LI Qihui, et al. Fabrication and corrosion resistance of hybrid coatings on pure magnesium by combining plasma electrolytic boronizing with micro-arc oxidation[J]. Surface Technology, 2021, 50(6): 64-76. DOI:10.16490/j.cnki.issn.1001-3660.2021.06.006 |
| [18] |
TSUTSUMI H, TSUTSUMI Y, SHIMABUKURO M, et al. Investigation of the long-term antibacterial properties of titanium by two-step micro-arc oxidation treatment[J]. Coating, 2021, 11(7): 798. DOI:10.3390/coatings11070798 |
 2023, Vol. 31
2023, Vol. 31


