电解水是实现工业化廉价制备氢气的重要手段[1-4], 为减小阴极过电位, 降低能耗, 研究具有高电催化活性的阴极析氢材料具有重要的意义。制备析氢材料的方法较多,如化学气相沉积,水热法,电沉积法[5]等,但许多研究集中于通过电沉积制备析氢材料,且大多数通过电沉积制备的析氢材料是在水溶液中进行。然而许多金属的沉积电位比氢离子的要负,而水溶液电化学窗口比较窄(1.23 V),因此,不可避免地会有氢脆、表面不平整等现象发生[6],从而导致析氢性能较差。离子液体的出现克服了水溶液的缺点。离子液体具有电化学窗口高、电沉积过程中不析氢、环保安全、常温下为液体、合成简单等优点,具有比较广阔的应用前景[7-11]。目前已开发出许多种类的离子液体,其中,氯化胆碱类离子液体对空气和水不敏感,广泛应用于有机合成、电沉积、电催化等领域,具有巨大的发展与利用空间。而在离子液体方面,目前析氢反应材料的报道主要集中在电沉积Ni基和Co基复合材料上[12]。在离子液体中电沉积Ni及其合金方面,虽然有相关的研究报道[13],但用其做析氢材料的研究报道相对较少,并且在离子液体中电沉积钴铬合金[14-15]与析氢研究就更少,尚缺乏系统性的研究。由于铬的沉积电位比水的电势窗口更负,故水溶液中电沉积Co-Cr合金存在析氢问题,且水溶液中电沉积Co-Cr合金大多采用六价铬,易造成环境污染。相对其他材料,钴、铬原料易得,是因为来源广泛。目前已有文献报道[15],在离子液体中采用三价铬进行电沉积,可减少环境污染,但其尚未进行相关析氢研究。
本文采用脉冲电沉积法沉积Co-Cr合金,通过前期正交实验确定了离子液体中电沉积钴铬合金的最佳制备工艺,通过正交筛选优化工艺条件,在最佳制备工艺条件下,运用单一变量实验研究了钴盐浓度对钴铬合金镀层在碱性溶液中的催化析氢性能的影响,并与离子液体中电沉积的Co电极和Cr电极,水溶液中电沉积的Co-Cr合金电极进行了对比实验。
1 实验 1.1 实验仪器与试剂本实验采用辰华电化学工作站CHI660E[16-18],氯化胆碱(分析纯)、尿素(分析纯)、氯化铬(0.05~0.2 mol/L)、氯化钴(0.1~0.4 mol/L)、氢氧化钾(分析纯)、甲酸、柠檬酸钠、氯化铵、溴化钾、硼酸、氨基磺酸铵。辅助电极为石墨电极,参比电极为Hg/HgO电极,工作电极为1 cm2碳钢电极等仪器和试剂。扫描电镜(JSM7900F)及其配套的能谱仪,X射线衍射仪(D/Max-2500)。
1.2 电沉积Co-Cr合金电极的制备方案本实验采用脉冲电沉积钴铬合金,占空比设置为0.6,时间为3 600 s。为了研究氯化钴浓度、氯化铬浓度、温度和沉积电位对钴铬合金镀层的影响,将以在1 mol/L KOH溶液中析氢过电位作为评价指标。根据L16(43)正交表进行正交实验,结合极差分析、方差分析得出最佳制备工艺条件为0.4 mol/L CoCl2、0.15 mol/L CrCl3、温度为70 ℃、沉积电位为-1.2 V。在正交实验得出最佳制备工艺后,进行了Co盐浓度的单一变量实验,探究其对析氢性能的影响。再分别制备离子液体中电沉积Co电极,Cr电极,水溶液中的Co-Cr合金电极(氯化铬(125 g/L)、氯化钴(1.4 g/L)、甲酸(60 mL)、氯化铵(80 g/L)、溴化钾(15 g/L)、硼酸(30 g/L)、氨基磺酸铵(210 g/L)、电流密度(3 A/dm2)、温度(25 ℃)、pH(3))[5],与其进行对比实验。
2 性能测试与表征在25 ℃条件下,用三电极体系测试镀层的析氢性能,石墨棒电极作为相应的对电极,Hg/HgO电极作为参比电极,工作电极为电沉积后的1 cm2Co-Cr合金电极。电解液为1 mol/L的KOH溶液,测试镀层的析氢性能。首先采用计时电流法,设置电压为-1.5 V,时间为0.5 h,以去除电极表面的氧化膜[19];极化曲线的测试电位扫描范围为-0.8~-1.5 V,扫描速度为3 mV/s,灵敏度设置为自动灵敏度;方波电位测试起始电位为Co-Cr合金电极的开路电位,阶跃幅度为±5 mV,持续时间设置为10 s;计时电流法设置电压为-1.1 V,时间为12 h。交流阻抗法设置电压为-1.1 V,振幅5 mV,频率设置为10-2~105 Hz,以上性能测试均在1 mol/L KOH溶液中进行。
利用扫描电镜表征镀层的表面形貌,能谱仪分析镀层的元素组成及含量,X射线衍射仪分析镀层的物相。
3 结果与讨论 3.1 Co盐浓度影响分析电沉积钴铬合金,铬的还原电位比钴的还原电位还要更负,在相同的沉积电位下,钴还原的量比铬还原的量要多,因此需要考察钴盐浓度对制备的钴铬合金析氢性能的影响。从钴盐含量角度出发,探究最佳的制备工艺条件。分别设置钴盐浓度为0.1、0.2、0.3、0.4 mol/L,其他实验条件不变,进行脉冲电沉积实验。之后分别测试析氢过电位,真实表面积,微观形貌。
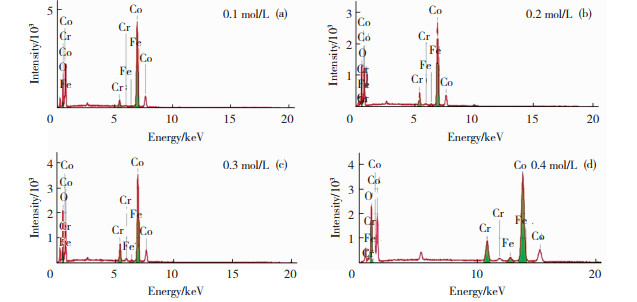
由图 1不同钴盐浓度下电极的EDS谱图可知,0.1、0.2、0.3、0.4 mol/L钴盐浓度所对应的Co和Cr质量分数分别为87.5%,3.2%、81.4%,5.8%、77.2%,7.7%、78.5%,8.5%,并含有少量的Fe元素和O元素,原因可能是镀层表面存在少量氧化物, 在后续的实验中,采用恒电位电解活化0.5 h方式,以去除电极表面氧化膜的存在,减少氧化物的影响。图 1结果表明,随着Co浓度变大,沉积在铁基体的Co的含量反而减小,Cr的含量反而变多,说明在一定范围内增加Co浓度,能够促进Co和Cr的共沉积。Co浓度变化范围为0.3 ~0.4 mol/L时,Co和Cr元素的质量分数变化不明显,说明在铁基体上的沉积量可能已经达到饱和。
|
图 1 不同钴盐浓度下电极的EDS谱图 Fig.1 EDS diagram of electrodes at different cobalt salt concentrations |
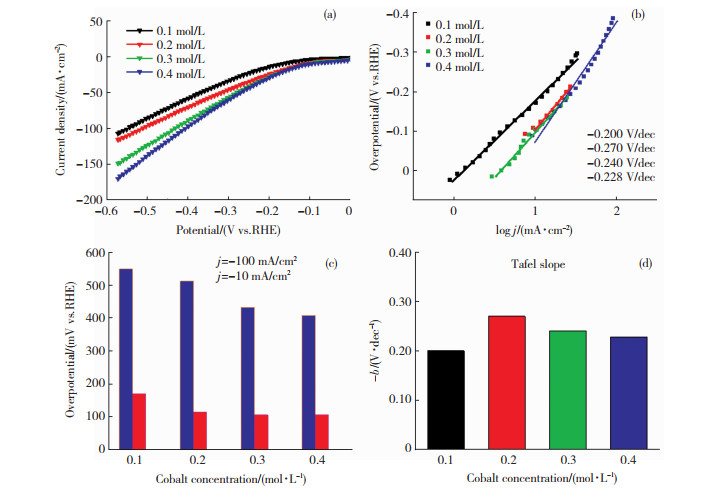
图 2为不同钴盐浓度下电极的极化曲线,其中,图 2(d)中的b为Tafel斜率。由图 1和图 2可知,钴盐浓度从0.2 mol/L到0.4 mol/L,Co的含量不断减小,Co-Cr合金的析氢电位正移,tafel斜率逐渐变小,表明析氢性能越来越好。斜率接近-0.12 V/dec理论值, 表明析氢机理为析氢反应动力学中的Volmer-Heyrovsky反应机理,Volmer反应为反应决定步骤,受Volmer反应所控制。
|
图 2 不同钴盐浓度下电极的极化曲线(a),Tafel图(b),过电位(c)及Tafel斜率(d) Fig.2 (a) Polarization curves, (b) Tafel diagram, (c) overpotential, and (d) Tafel slope of electrodes at different cobalt salt concentrations |
其原因可能是当钴的浓度较小时,由于电沉积在铁基体上的钴量比较大,同时造成镀层较粗,结构较疏松,从而降低了电极的催化析氢活性,因此析氢过电位比较负。随着钴含量的变小,电沉积在铁基体铬量的逐步增加,镀层进一步密集,增大了析氢表面积,出现了更多的活性位点。当钴盐浓度从0.3 mol/L增加到0.4 mol/L,EDS表明Co和Cr的含量变化不大,而析氢过电位进一步降低,说明电极表面可能获得了更好的修饰。
表面的微观粗糙度对析氢活性有很大的影响。材料表面越粗糙,相应的比表面积越大,氢气析出的活性位点就越多,析氢活性就越高。采用三电极为测试体系,用方波电位法测量了电极材料的实际表面积,得到电极的电流-时间(j-t)响应曲线,电位阶跃幅值为±5 mV。根据双电层电容(Cdl)计算公式
| $C_{\mathrm{dl}}=\Delta Q / \Delta \varphi=\int j \mathrm{~d} x / 5 $ | (1) |
式中:Cdl为电极的双电层电容,μF;ΔQ为双电层电量;Δφ为双电层电势差,V;j为电流密度,mA/cm2。
| $ S_{\text {真实 }}=C_{\mathrm{d}} / C_{\mathrm{Hg}} $ | (2) |
式中:S真实为电极真实表面积,cm2。单位面积纯汞的双电层电容CHg=20 μF/cm2,从而得到电极真实表面积(下同)。
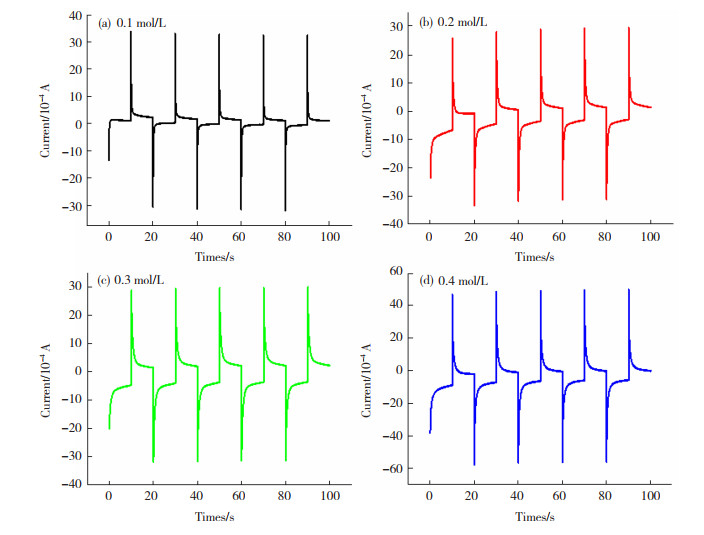
不同钴盐浓度下电极的方波电位参数见表 1。由表 1可知,随着钴盐浓度的增加,真实表面积逐步变大,与阴极极化曲线实验结果基本相符,真实表面积越大析氢活性越高。图 3的实验结果表明,0.4 mol/L钴盐浓度下离子液体中沉积的Co-Cr合金的表面粗糙度比较大。
| 表 1 不同钴盐浓度下电极的方波电位参数表 Table 1 Parameters of square wave potential of electrodes at different cobalt salt concentrations |
|
图 3 不同钴盐浓度下电极的方波电位图 Fig.3 Square wave potential diagram of electrodes at different cobalt salt concentrations |
图 4是不同钴盐浓度下电极的表面形貌,可以看到,随着钴浓度逐步变大,样片的表面粗糙度逐步变大,粒径逐步变小。不同含量的钴铬合金表面形貌差异很大,当钴盐浓度为0.1 mol/L时,电极表面比较疏松,表面不够均匀,相比之下粒径最大。随着镀层中钴含量的减小,离子液体中电沉积的钴铬合金电极的表面结晶变得更细,表面逐步均匀,从而具有更高的微观粗糙度,故增加了电极的实际面积。当钴盐浓度为0.4 mol/L时,电极表面比较均匀,粒径最小,表面粗糙度最大,镀层形貌较好。

|
图 4 不同钴盐浓度下电极的表面形貌 Fig.4 Surface topography of electrodes at different cobalt salt concentrations: (a) 0.1 mol/L; (b) 0.2 mol/L; (c) 0.3 mol/L; (d) 0.4 mol/L |
从图 4钴盐浓度影响可知,0.4 mol/L钴盐浓度所对应电极的析氢性能最佳,此条件即为最佳工艺条件,图 5为离子液体中电沉积最佳Co -Cr合金电极的X射线衍射(XRD)谱图。
|
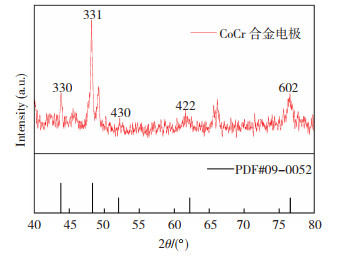
图 5 离子液体中电沉积最佳Co-Cr合金电极的XRD谱图 Fig.5 XRD spectrum of the best Co-Cr alloy electrode electrodeposited in ionic liquid |
由图 5可知,结合Co-Cr合金的PDF卡片,衍射角为43.781°、48.320°、52.036°、62.212°、76.588°所对应的晶面分别为330、331、430、422、602, 表明在碳钢片上形成的Co-Cr合金是多晶的,Co-Cr合金的存在形式为原始四面体结构,通过Jade6.5软件,同时结合Scherrer公式
| $d=0.89 \lambda /(\beta \cos \theta) $ | (3) |
计算得到平均晶粒尺寸为12.3 nm。晶粒尺寸较小。说明在相同的单位面积上,越小的晶粒尺寸,表面能越高,暴露的活性位点就越多,有利于提高析氢活性[20]。
分别进行最佳工艺条件电极,水溶液中Co-Cr电极,离子液体电沉积的钴电极,离子液体电沉积铬电极析氢活性比较。图 6为不同电极的极化曲线,可以看到,Cr电极在测试条件下未达到100 mA/cm2, 可见纯Cr电极的析氢活性并不高,这4种电极符合Volmer-Heyrovsky反应机理,Volmer反应为速率决定步骤。随着过电位的变大,析氢活性离子液体中Co-Cr合金电极>纯Co电极>水溶液中Co-Cr合金电极>纯Cr电极。在离子液体中沉积的Co电极的析氢活性大于水溶液中Co-Cr合金电极,原因可能是Co电极微观表面积远远大于水溶液中电沉积Co-Cr合金电极。离子液体电沉积出的Co-Cr合金的Cr的质量分数约为8.5%,Co的质量分数约78.5%,而水溶液中电沉积的Co-Cr合金的Cr的质量分数约为33%,Co的质量分数约为67%[5]。说明Cr的含量不能太高,含量较多,反而会使催化析氢活性降低。图 6结果证明,离子液体中电沉积的Co-Cr合金电极的析氢活性最高。可以说明在离子液体中电沉积的Co-Cr合金电极,可能有着最大的微观表面积。同时可以证明,离子液体中电沉积的Co-Cr合金电极之间的协同催化作用[21-22]较好。
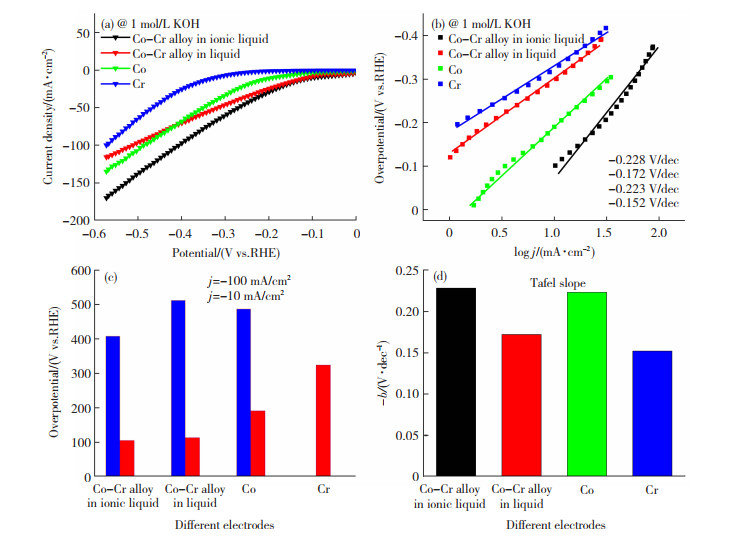
|
图 6 不同电极的极化曲线(a),Tafel图(b),过电位(c),Tafel斜率(d) Fig.6 (a) Polarization curves, (b) Tafel diagram, (c) overpotential, and (d) Tafel slope of different electrodes |
由图 7可知,Cr的质量分数约为8.5%,Co的质量分数约78.5%,此外还含有少量的Fe元素和氧元素,说明镀层表面存在少量的氧化物,后续可通过恒电位电解的方法减少氧化物。
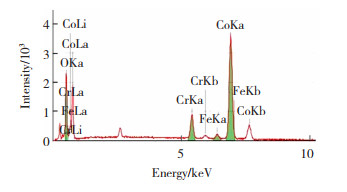
|
图 7 离子液体中电沉积最佳Co-Cr合金电极的EDS图 Fig.7 EDS diagram of the best Co-Cr alloy electrode electrodeposited in ionic liquid |
结合图 6(a)阴极极化曲线测试结果,说明少量Cr掺杂有利于提高析氢活性,这归因于金属元素间的协同作用,即Co-Cr金属间的相互作用,相互促进析氢活性提高,比单一金属的作用更强。原因可能是,少量Cr掺杂后,Cr原子是促进水吸附和解离的亲氧位点[21-24],并可以调节Co的电子结构,使Co原子具有最优的氢键结合能力,从而加速碱性Volmer和Heyrovsky反应动力学[23-24]。
采用电化学软件进行拟合,由于不是理想电极,故需要考虑到弥散效应,理想微分电容Cdl分别用常相位角元件(CPE-T, CPE-P)来替代。电极等效电路如图 8(a)插图所示,其中Rr表示电化学反应电阻,即析氢反应电阻。拟合后Nyquist图高频区和低频区一起呈现半圆形,表明反应主要受电化学反应控制,即受析氢电化学反应所控制,低频区未出现一条直线,表明没有浓度极化,是一个只受电化学反应控制的过程。电路各元件的拟合数据列于表 2。由图 8可知,不同电极之间的电化学反应电阻差距较大,在指定电压下离子液体中Co-Cr电极、水溶液中Co-Cr电极、Co电极、Cr电极所对应的电化学析氢电阻Rr分别为2.45,55.56,10.19,120.4 Ω/cm2,离子液体中Co-Cr电极双电层电容也是最高,与方波电位法测试得到的电容值差距较小。实验结果表明,在同一极化电位下,离子液体中电沉积的Co-Cr电极电化学析氢电阻最小,双电层电容最高,因此,相比之下催化析氢活性最高,与阴极极化曲线结果一致。
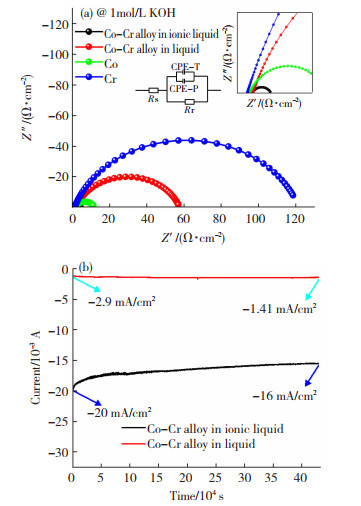
|
图 8 不同电极在1.0 mol/L KOH溶液中的奈奎斯特图(a)和电流时间图(b) Fig.8 (a) Nyquist diagram and (b) current-time diagram of different electrodes in 1.0 mol/L KOH solution |
| 表 2 不同电极的电化学拟合参数表 Table 2 Electrochemical fitting parameters of different electrodes |
另一方面,通过电流时间曲线可以看出,在相同的电压下,离子液体中电沉积的Co-Cr电极的电流密度大于水溶液中电沉积的Co-Cr电极。说明在相同的电压下,离子液体中电沉积的Co-Cr电极催化析氢性能远优于水溶液中电沉积的Co-Cr电极。恒电位电解结束之后,离子液体中电沉积的钴铬合金电极的电流密度从-20 mA/cm2衰减到-16 mA/cm2,电流密度下降了20%, 稳定性可达到80%,表明其在1.0 mol/L KOH中具有比较好的稳定性。而水溶液中电沉积的Co-Cr电极在恒电位电解结束后,电流密度从-2.9 mA/cm2到-1.41 mA/cm2,衰减了约50%,稳定性仅有50%。原因可能是由于在水溶液沉积过程中会产生氢气,镀层和碳钢表面之间可能会有氢气的空隙,导致结合力变差。水溶液中电沉积的Co-Cr电极在长时间恒电位电解过程中,产生氢气导致镀层容易脱落,因此稳定性变差,故没有离子液体中稳定性高。相比之下,离子液体中Co-Cr电极稳定性较好,电流密度较大,Co-Cr合金与电极表面结合力较好,不易脱落,在电极表面长时间附着仍比较稳定,且在12 h恒电位电解后,仍具有出色的电化学催化析氢活性[25-26]。
不同条件下电极的方波电位参数分别总结于表 3,可以看到,不同条件的电极表面积差距较大。从图 9可知,Co电极表面点球状比较多,相对来说,表面积较大,Co电极与Co-Cr(水溶液)的表面积相比,Co电极表面积大于Co-Cr(水溶液)中的表面积,这于图 6(a)中LSV曲线能够比较好的相互证明。Cr电极表面成块状,表面积较小。Co-Cr(水溶液)表面呈大球状,在大球面上有小球状,进一步增加了表面积。与图 7中的阴极极化曲线,阻抗图能够较好的相符。
| 表 3 不同电极的方波电位参数表 Table 3 Square wave potential parameters of different electrodes |

|
图 9 不同电极的表面形貌图:(a) Co-Cr(离子液体);(b) Co;(c) Cr;(d) Co-Cr(水溶液) Fig.9 Surface topography of different electrodes: (a) Co-Cr (ionic liquid); (b) Co; (c) Cr; (d) Co-Cr (aqueous solution) |
1) 对于离子液体中电沉积Co-Cr合金,最佳析氢的质量分数组成是:Cr的质量分数约8.5%,Co的质量分数约78.5%。当电流密度为10 mA/cm2时,离子液体中制备钴铬合金的析氢过电位为-0.105 V,晶粒尺寸为12.3 nm,析氢电阻为2.45 Ω,微观表面积为647.9 cm2。
2) 钴盐浓度越大,电沉积在碳钢表面的Co的质量分数反而减少,析氢活性更高。
3) 对离子液体中电沉积的钴铬合金,水溶液中电沉积的钴铬合金、离子液体中电沉积的纯钴、纯铬电极进行的析氢对比研究表明,离子液体中电沉积钴铬合金具有最高的析氢活性,钴和铬之间的协同作用最好,稳定性可达到80%,未来发展前景较好。
| [1] |
王宏智, 张晓振, 黄波, 等. 碳毡基体上电沉积Ni-Mo合金及其催化析氢性能[J]. 化学工业与工程, 2017, 34(1): 53-59. WANG Hongzhi, ZHANG Xiaozhen, HUANG Bo, et al. Electrodeposition of Ni-Mo alloy on carbon felt substrate and its catalytic performance for hydrogen evolution[J]. Chemical Industry and Engineering, 2017, 34(1): 53-59. DOI:10.13353/j.issn.1004.9533.20151015 |
| [2] |
葛静敏. 二硫化钼的电子结构调控及其电化学析氢性能研究[D]. 北京: 北京化工大学, 2021. GE Jingmin. Electronic structure regulation of molybdenum disulfide and its electrochemical hydrogen evolution performance[D]. Beijing: Beijing University of Chemical Technology, 2021. |
| [3] |
蔡迪, 朱远蹠, 翟婷婷, 等. Pd/WS2二维复合材料的制备及电解水制氢性能研究[J]. 化学工业与工程, 2019, 36(2): 48-52. CAI Di, ZHU Yuanzhi, ZHAI Tingting, et al. Preparation of Pd/WS2 two-dimensional composites and study on hydrogen production by electrolysis of water[J]. Chemical Industry and Engineering, 2019, 36(2): 48-52. DOI:10.13353/j.issn.1004.9533.20171013 |
| [4] |
ZHU Lili, LIN Haiping, LI Youyong, et al. A rhodium/silicon co-electrocatalyst design concept to surpass platinum hydrogen evolution activity at high overpotentials[J]. Nature Communications, 2016, 7: 12272. DOI:10.1038/ncomms12272 |
| [5] |
屠振密, 安茂忠, 胡会利编著. 现代合金电沉积理论与技术[M]. 北京: 国防工业出版社, 2016. TU Zhenmi, AN Maozhong, HU Huili. Theory and technology of modern alloy electrodeposition[M]. Beijing: National Defense Industry Press, 2016. |
| [6] |
杜登学, 孙健, 吕鸿飞, 等. 直流与脉冲电沉积Ni-Cr合金镀层的结构及耐蚀性[J]. 稀有金属材料与工程, 2016, 45(8): 2046-2050. DU Dengxue, SUN Jian, LU Hongfei, et al. Structure and corrosion resistance of Ni-Cr alloy coating by DC and pulse electrodeposition[J]. Rare Metal Materials and Engineering, 2016, 45(8): 2046-2050. |
| [7] |
MARIANA Ruesgas-ramón, FIGUEROA E, DURAND Erwann. Application of deep eutectic solvents (DES) for phenolic compounds extraction: overview, challenges, and opportunities[J]. Journal of Agricultural and Food Chemistry, 2017, 65(18): 3591-3601. DOI:10.1021/acs.jafc.7b01054 |
| [8] |
HERBERT Musarurwa, NIKITA T T. Deep eutectic solvent-based dispersive liquid-liquid micro-extraction of pesticides in food samples[J]. Food Chemistry, 2021, 342: 127943. DOI:10.1016/j.foodchem.2020.127943 |
| [9] |
ESPINO M, De LOS ANGELES FERNANDEZ M, GOMEZ F J V, et al. Natural designer solvents for greening analytical chemistry[J]. Trac-trends in Analytical Chemistry, 2016, 76: 126-136. DOI:10.1016/j.trac.2015.11.006 |
| [10] |
QIN Hao, HU Xutao, WANG Jingwen, et al. Overview of acidic deep eutectic solvents on synthesis, properties and applications[J]. Green Energy &: Environment, 2020, 5(1): 8-21. DOI:10.1016/j.gee.2019.03.002 |
| [11] |
FLORINDO C, BRANCO L C, MARRUCHO I M. Quest for green-solvent design: from hydrophilic to hydrophobic (deep) eutectic solvents[J]. Chemsuschem, 2019, 12(8): 1549-1559. DOI:10.1002/cssc.201900147 |
| [12] |
GAO Minrui, LIANG Jinxia, ZHENG Yarong, et al. An efficient molybdenum disulfide/cobalt diselenide hybrid catalyst for electrochemical hydrogen generation[J]. Nature Communications, 2015, 6: 5982. DOI:10.1038/ncomms6982 |
| [13] |
黄波. 离子液体中电沉积镍钼合金及其催化析氢性能[D]. 天津: 天津大学, 2014. HUANG Bo. Electrodeposition of Ni-Mo alloy in ionic liquid and its catalytic performance for hydrogen evolution[D]. Tianjin: Tianjin University, 2014. |
| [14] |
SAJI V S, CHOE H. Electrochemical Behavior of Co-Cr and Ni-Cr dental cast alloys[J]. Transactions of Nonferrous Metals Society of China, 2009, 19(4): 785-790. DOI:10.1016/S1003-6326(08)60350-7 |
| [15] |
SARAVANAN G, MOHAN S. Structure, composition and corrosion resistance studies of Co-Cr alloy electrodeposited from deep eutectic solvent (DES)[J]. Journal of Alloys and Compounds, 2012, 522: 162-166. DOI:10.1016/j.jallcom.2012.01.140 |
| [16] |
李宇春, 王兴平, 刘子涵, 等. 316L和HR-2不锈钢的盐酸露点腐蚀行为[J]. 材料保护, 2019, 52(9): 117-124. LI Yuchun, WANG Xingping, LIU Zihan, et al. Dew point corrosion behavior of 316L and HR-2 stainless steel in hydrochloric acid[J]. Material Protection, 2019, 52(9): 117-124. |
| [17] |
何壮, 王兴平, 刘子涵, 等. 316L和HR-2不锈钢在盐酸液膜环境中的钝化与点蚀[J]. 中国腐蚀与防护学报, 2020, 40(1): 17-24. HE Zhuang, WANG Xingping, LIU Zihan, et al. Passivation and pitting of 316L and HR-2 stainless steel in hydrochloric acid liquid film environment[J]. Chinese Journal of Corrosion and Protection, 2020, 40(1): 17-24. |
| [18] |
赵野, 何壮, 石文龙, 等. 317L不锈钢在模拟海洋环境中的耐蚀性能研究[J]. 材料保护, 2021, 54(5): 51-56. ZHAO Ye, HE Zhuang, SHI Wenlong, et al. Study on corrosion resistance of 317l stainless steel in simulated marine environment[J]. Material Protection, 2021, 54(5): 51-56. DOI:10.16577/j.cnki.42-1215/tb.2021.05.009 |
| [19] |
汪淑娟. 胆碱类离子液体电化学制备镍基电极材料及其析氢性能研究[D]. 上海: 上海大学, 2020. WANG Shujuan. Electrochemical preparation of nickel-based electrode materials by choline ionic liquids and its hydrogen evolution performance[D]. Shanghai: Shanghai University, 2020. |
| [20] |
宋利君, 孟惠民. 电沉积纳米镍合金在模拟海水溶液中的析氢性能[J]. 物理化学学报, 2010(9): 2375-2380. SONG Lijun, MENG Huimin. Hydrogen evolution performance of electrodeposited nano-nickel alloy in simulated seawater solution[J]. Journal of Physical Chemistry, 2010(9): 2375-2380. |
| [21] |
BREWER L. The generalized lewis acid-base theory: surprising recent developments[J]. J Chem Educ, 1984, 61: 101-104. DOI:10.1021/ed061p101 |
| [22] |
BREWER L. Bonding and structures of transition metals[J]. Science, 1968, 161: 115-122. DOI:10.1126/science.161.3837.115 |
| [23] |
PARSONS R. The rate of electrolytic hydrogen evolution and the heat of adsorption of hydrogen[J]. Transactions of the Faraday Society, 1958, 54: 1053-63. DOI:10.1039/TF9585401053 |
| [24] |
YAO Na, LI Peng, ZHOU Zirui, et al. Hydrogen evolution reaction: Synergistically tuning water and hydrogen binding abilities over Co4N by Cr doping for exceptional alkaline hydrogen evolution electrocatalysis[J]. Advanced Energy Materials, 2019, 9(41): 1902449. DOI:10.1002/aenm.201902449 |
| [25] |
PROTSENKO V, DANILOV F. Kinetics and mechanism of chromium electrodeposition from formate and oxalate solutions of Cr(Ⅲ) compounds[J]. Electrochimica Acta, 2009, 54(24): 5666-5672. DOI:10.1016/j.electacta.2009.04.072 |
| [26] |
王宏智, 黄波, 张卫国, 等. 深共融溶剂中电沉积Ni-Mo合金及其催化析氢性能[J]. 化工学报, 2014, 65(11): 4524-4529. WANG Hongzhi, HUANG Bo, ZHANG Weiguo, et al. Electrodeposition of Ni-Mo alloy in eutectic solvent and its catalytic performance for hydrogen evolution[J]. Journal of Chemical Industry and Engineering, 2014, 65(11): 4524-4529. DOI:10.3969/j.issn.0438-1157.2014.11.044 |
 2023, Vol. 31
2023, Vol. 31


