摘要
水环境中的抗生素污染问题已成为当前环境保护领域的重大挑战之一,这类污染物不仅会引起严重的水生生物生态毒性效应,破坏水生态系统的平衡,还可能会诱导产生抗性基因,对生态安全造成严重的风险和潜在威胁。高级氧化技术因其具有对抗生素的高效降解能力而备受关注,这一技术通过产生强氧化性的自由基,快速氧化分解抗生素,从而达到去除抗生素的目的。近年来,该技术已经被广泛研究并逐步应用于含抗生素废水处理中。然而在高级氧化降解过程中,抗生素因不完全降解和矿化会产生大量中间产物,这些中间产物的生态毒性不容忽视,其可能同样会对水生生态系统造成负面影响。关于中间产物的生态毒性研究是本领域的科研热点,也是关乎高级氧化技术安全性应用的关键。系统总结并分类对比各典型高级氧化技术降解抗生素的机制和技术特点,重点介绍抗生素高级氧化降解产物的生态毒性研究进展,并系统分析该方向研究未来发展趋势。
Abstract
The issue of antibiotic pollution in aquatic environments has become one of the major challenges in the field of environmental protection. These pollutants not only cause serious ecological toxicity effects on aquatic organisms, disrupting the balance of aquatic ecosystems, but may also induce the production of resistance genes, posing serious risks and potential threats to ecological safety. Advanced oxidation technology has attracted much attention due to its efficient degradation ability of antibiotics. This technology generates strong oxidizing free radicals, rapidly oxidizes and decomposes antibiotic components, thereby achieving the goal of removing antibiotics. In recent years, this technology has been widely studied and gradually applied in practical application of antibiotic-containing wastewater treatment. However, in the process of advanced oxidative degradation, antibiotics produce a large number of intermediate products due to incomplete degradation and mineralization. The ecological toxicity of these intermediate products cannot be ignored, as they may also have negative impacts on aquatic ecosystems. The research on the ecotoxicity of intermediate products is a hot topic in this field, and it is also crucial for the safe application of advanced oxidation technologies in the future. This article systematically summarizes and categorizes the mechanisms and technical characteristics of various typical advanced oxidation technologies for degrading antibiotics. It focuses on introducing the research progress on the ecological toxicity of antibiotic advanced oxidation degradation products, and systematically analyzes the future development trends in this research direction.
Keywords
自 1928 年弗莱明发现青霉素以来,经过近百年的发展,抗生素已经成为使用最广泛、最高效的一类抗菌药物。中国是抗生素生产大国,据统计,2020 年生产抗生素 2.23 × 10 5 t [1]。除用于临床治疗,50% 左右的抗生素进入养殖行业,抗生素人均年耗量 135 g,是美国(13 g)的 10 倍左右[2]。抗生素属于大分子有机化合物,进入人畜体内的抗生素仅有一小部分被代谢吸收,剩下的 70% 将以原始形态或者母体结构的形式被排出进入到环境中[3],抗生素进入水环境中的可能来源与路径见图1。长期低浓度的药物残留会对人类身体造成严重损害[4]。在抗生素生产和应用过程中,每年会产生大量含抗生素工农业废水和生活污水,这些废水造成了严重的抗生素点源和面源污染[5-6]。全世界现在共同面临非常严峻的抗生素污染问题,尤其在一些人口较多的发展中国家,各类江河湖等地表水、污水处理厂、土壤、甚至地下水和饮用水源中都有不同程度抗生素检出[7-8]。天津市地表水中喹诺酮类抗生素检测率达 43.18%~100%,其中,红霉素为主要污染物,其质量浓度高达 722. 04 ng / L [9]。付雨等[10] 在白洋淀水体中检测出 11 种喹诺酮类抗生素,恶喹酸和氟氧沙星的检出率分别为 61.7% 和 59.6%。其中,喹诺酮类抗生素代表性药物氟甲喹检出率更是高达 100%,其平均质量浓度为 168. 0 ng / L。
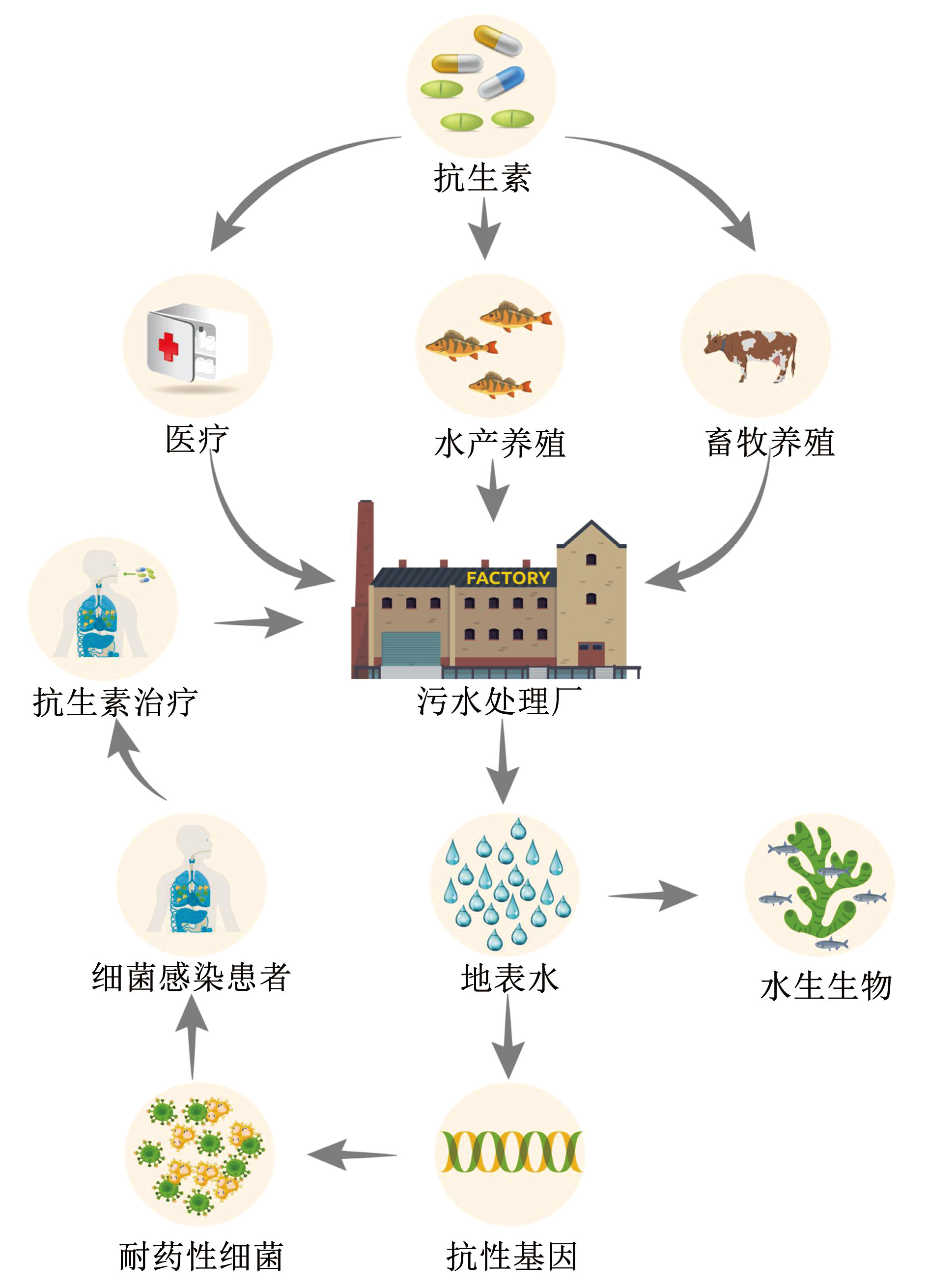
图1抗生素进入水环境中的可能来源与路径
Fig.1Possible sources and routes of antibiotics entering water environment
基于活性污泥法的常规污水处理方式不仅不能高效去除水中抗生素残留,更加速了水中抗性基因的产生,因此,污水处理厂也被称为是抗性基因的 “热点(hotspot)”,产生的抗性细菌以及抗性基因会随出水和污泥在环境中扩散和传播[11]。 Yin 等[12] 开展了一项持续 9 年的长期研究,结果表明,活性污泥中一些核心抗性基因与分布在城市污水、牲畜粪便、鱼塘沉积物中的抗性基因在类别上存在重叠性,从而揭示了抗性基因在这些微生态系统之间的相互传播效应。开发高效的抗生素降解技术,如通过化学氧化方法尤其是高级氧化技术( advanced oxidation processes,AOPs)对水中抗生素类有机污染物进行强力降解,是目前这类高风险难降解污染物废水处理的发展趋势,也是环境化学水处理和生态安全方向的研究热点。
目前,基于·OH 和 SO-4 ·的高级氧化降解抗生素的研究,主要集中于通过改进催化剂、改进工艺、开发新型组合技术以提升降解效能。由于抗生素的相对分子质量一般为 200~1 200,结构较为复杂,现阶段无论是基于哪种自由基的高级氧化技术,都很难将其完全矿化,抗生素在结构断裂同时会产生大量中间产物。目前,关于抗生素降解产物的生态毒性变化规律及影响机制方面的研究逐渐得到关注。本文参考了近些年国内外关于高级氧化降解抗生素方面的研究论文,系统性论述了抗生素生态毒性影响,以及高级氧化技术对降解产物生态毒性的研究进展。
1 抗生素污染引起的生态毒性
水环境抗生素污染导致的严重生态毒性可分为两大类:一是由其生态毒性导致的直接毒性,二是诱导产生抗性基因和改变微生物生态结构带来的生态风险。
水环境中长期存在低浓度抗生素污染物,会通过富集、浓缩等生物放大作用,并经过食物链的传递,对人和动物的肝肾以及生殖系统带来毒性影响,或引起过敏反应[13]。向刚等[14] 研究了高原水体浮游动物对抗生素的富集特征,发现红霉素在酸性条件下易水解生成脱水红霉素,在浮游动物体内,脱水红霉素富集能力最为突出,其质量浓度高达 92.40 ng / L。 Du 等[15]评估了南黄海盐城沿海地区的抗生素对藻类的环境风险,在 30 个采样点中,克拉霉素和恩诺沙星仅在第 8 个采样点的风险熵值(MRQ)高于 1,表明单独抗生素对物种的风险较低,而大多数采样点的抗生素混合物 MRQ 高于 1,结果表明对于水生生物,抗生素混合物可能比单一抗生素造成的损害更为严重。
抗生素不仅会对水中水蚤和藻类等低等水生生物有较强的生理毒性,还可严重影响鱼类等高等水生生物的胚胎和生殖系统[16]。赵凤等[17] 研究发现,暴露在 10 μmol / L 金霉素中的铜绿微囊藻,72 h 时的生长抑制率为68.58%。冯琳钧等[18]探究了阿莫西林、头孢哌酮、氨曲南对大型溞的生长毒性影响,结果表明,这 3 种抗生素对大型溞的 48 h-LC50分别为 129.30、141.11、29.30 mg / L,分别属于低毒性、低毒性、中毒性水平。 Han 等[19]用 2.5 mmol/ L 司帕沙星处理斑马鱼胚胎,发现在受精 6~72 h 后胚胎不仅出现心包水肿、心脏畸形和色素沉着异常,还出现头部变形、卵黄囊区域的血液积聚和脊柱弯曲等现象。
环境中重金属、卤代有机物以及微塑料等其他种类污染物还会和抗生素药物母体及降解产物形成协同效应,进一步增强其环境毒性[20]。李孟涵等[21]研究了重金属 Pb 和四环素类抗生素对费氏弧菌的联合毒性,结果显示,氯四环素(CTC)、氧四环素(OTC)和四环素(CT)的 EC50 值分别为 6.52、 21.40、29.19 mg / L,3 种抗生素与 Pb 组成复合污染物 Pb-CTC、 Pb-OTC 和 Pb-TC 的 EC50 值分别为 0.90、3.89、6.56 mg / L,比较发现复合污染物的 EC50 值显著低于单一抗生素的 EC50 值,表明抗生素与重金属的混合体系对费氏弧菌的毒性更强。姜航等[22]探究了聚苯乙烯微塑料(250 μg / L)和罗红霉素(5 μg / L)对大型溞的联合毒性,发现在暴露 48 h后,大型溞的超氧化物歧化酶( SOD)的活性抑制率为 20.8%,高于罗红霉素单独处理的抑制率(13.7%),低于聚苯乙烯微塑料单独处理的抑制率(26.1%); 而过氧化氢酶(CAT)活性的抑制率为 60%,高于聚苯乙烯微塑料和罗红霉素单独处理的抑制率(分别为 24% 和 56%),表明二者共同暴露会对大型溞造成氧化损伤。
抗生素可以选择性抑制和杀灭敏感性微生物,改变原有微生物群落结构和稳定性。尤其是一些水和土壤中功能性微生物比例和活性的改变,将引起严重的潜在生态问题[23]。 Katipoglu 等[24] 发现高质量浓度抗生素(50 mg / L 四环素)可致水处理反应器中氨氧化菌丰度由 10.4% 降为 0. 003%,同时,氨氧化菌体内 amoA mRNA 的表达受到抑制,amoA mRNA 的相对丰度由 2 × 10-5降为 1 × 10-6,进而影响其氨单加氧酶的合成和菌群脱氮性能。 Kim 等[25] 研究了低质量浓度抗生素(500 μg / L 环丙沙星)对好氧活性污泥菌群结构的影响,结果表明,菌群物种多样性显著下降 20%,Rhodobacteraceae 和 Nakamurellaceae 两种参与有机物和氮去除的关键菌丰度明显下降。细菌在抗生素胁迫下产生抗性是一种自然反馈调节和进化现象,即使环境中存在痕量的抗生素也可以诱导细菌产生抗性基因。抗性基因在微生物中表达后可通过降低细胞膜通透性、修饰抗生素作用靶点、钝化抗生素功能基团以及将其外排等途径实现对抗生素的抗性[26]。抗性基因不仅可传给子代,还可通过质粒、转座子、整合子、嵌合基因以及噬菌体作为载体,以转化、接合、转导等方式,跨越微生物种属屏障进行水平转移并传播[27](如图2),最终导致多重抗性致病菌甚至是超级细菌的出现[28]。联合国世界卫生组织在 2016 年发表的评论文章指出,在未来 30 年,如果情况得不到改善,抗生素耐药性问题每年将导致全球超 1 000 万人死亡[29]。 2016 年,中华人民共和国国家卫生健康委员会等 14 部门联合制订了《遏制细菌耐药国家行动计划》,显示出中国对抗生素污染及耐药性等问题的重视[30]。
图2抗性基因水平转移 3 种主要方式的机制
Fig.2Mechanism of horizontal transfer of resistance genes in three main ways
2 高级氧化降解抗生素技术分类及机制
高级氧化是指以羟基自由基(·OH)为强氧化性物种的化学法水处理技术,现阶段高级氧化中的活性氧化物种已不局限于·OH,还包括硫酸根自由基(SO-4 ·)、单线态氧( 1O2)和超氧自由基(·O-2)等。在这些活性氧化物种中,基于·OH 和 SO-4 ·的高级氧化技术是目前研究和应用最广泛,也是最为重要的两大类[31-32]。这两类自由基可通过氧化剂过氧化氢和过硫酸盐产生,两种氧化剂中都有相似的 O—O 键结构,H2O2 中一个 H 原子被 SO3 取代则为 HSO5—,O—O 键长由0.145 3 nm 增加至 0.146 0 nm; 两个 H 原子被取代则为 S2O2-8,S2O2-8 中 O—O 键长为 0.149 7 nm。
·OH 的氧化还原电位为 2.8 V,其可通过脱氢、电子转移、双键和苯环直接加成等反应机制对多数抗生素进行无选择性高效降解,速率常数可达10 8~10 10 L·mol-1·s-1。基于·OH 的各典型高级氧化技术如芬顿、类芬顿、催化臭氧、光催化以及这些技术的组合或衍生工艺,普遍具有操作简单、降解高效、设备投资省及成本低等优点,广泛应用于抗生素降解的研究[33]。
2.1 臭氧及催化臭氧氧化技术
臭氧自身具有较强的氧化性,其氧化还原电位为 2. 07 V,可以攻击污染物分子结构中电子云密度高的官能团,直接降解污染物。其反应主要包括克里吉(Criegee)臭氧化反应,加成反应、胺和硫的氧化、C—N 键和环的分解。也可以分解产生·OH,通过·OH 加成,H-迁移和电子转移等反应对污染物进行非选择性降解[34]。但单独使用臭氧仍存在一些局限性,臭氧与复杂化合物反应缓慢,并且在水中的溶解度和稳定性有限,导致污染物的去除效率降低[35]。为克服臭氧氧化的选择性和不完全性,催化臭氧技术逐渐成为热门研究,包括以溶液中金属离子进行的均相催化和以金属氧化物和固态金属以及他们负载形式催化剂等进行的非均相(多项)催化两大类。 Anjali 等[36]采用臭氧氧化法处理阿莫西林和环丙沙星,在臭氧投加量为 4 mg / L 时,2 min 内初始质量浓度为 5 mg / L 的阿莫西林和环丙沙星降解率分别为 98% 和 99%。 Zhang 等[37] 利用载铈沸石对青霉素臭氧氧化,研究表明,在铈加载量为 4%、沸石剂量为 2 g / L、臭氧剂量为 6 mg / L、pH 为 4.5 的条件下,15 min 后青霉素的去除率达到 99.5%。 Zhang 等[38]制备了 Fe 掺杂 CeO2 催化剂,利用非均相臭氧催化氧化反应降解阿莫西林,在最佳条件下,即 pH 为 7、FC-0.3(Fe 与 Ce 原子比为 0.3)的投加量为 0.5 g / L、臭氧投加量为 4 mg / min,初始质量浓度为 50 mg / L 的阿莫西林去除率达 98.1%,通过分析机制可知,FC-0.3 具有高度丰富的表面活性位点(·OH)使 H2O 和 O3 在催化剂上吸附,有利于活性氧自由基(ROS)的生成,并且 Ce4+ / Ce3+ 和 Fe3+ / Fe2+ 氧化还原对之间的协同作用促进了电子传递和 ROS 的形成,提高了阿莫西林直接和间接氧化的可能性。 Zheng 等[39] 在氧化石墨烯( GO)上负载 Fe3O4 形成金属复合材料 Fe3O4-rGO20% 用于在臭氧体系中降解四环素,15 min 内四环素被完全去除,这是由于 Fe3O4 与 rGO 彼此作用将 O3 分解成·O-2 和 H2O2,H2O2 与 O3 进一步反应生成·OH。此外,金属复合材料 Fe3O4-rGO20% 能够显著提升光电流密度,促进 Fe3O4 与 rGO 之间的电子转移。
2.2 芬顿/ 类芬顿氧化技术
芬顿(Fenton)是最早被开发的高级氧化技术,利用二价铁离子活化 H2O2 产生·OH 氧化降解污染物[40]。 ·OH 具有极高的氧化还原电位( E 0 = 2.8 V),可以将大多数污染物氧化成小分子化合物,通过原位生成的 ROS 将其矿化成 CO2。因其具有简单、高效等特点,被广泛地应用在降解难降解污染物中[41]。然而,在传统的芬顿反应中 pH 应用范围较窄,这是由于 pH >4 时,Fe3+ 以 Fe(OH)3 的形式存在,影响 Fenton 体系中 Fe3+ / Fe2+ 的稳定循环,且较高 pH 下会使 H2O2 稳定性下降,加速其分解为 H2O 和 O2。同时会出现铁离子浸出对水体造成二次污染等问题,使其在应用时面临很大的局限性[42]。为解决这些问题并提高催化效能,逐渐又开发出了光 Fenton、电 Fenton、金属异相催化以及微波超声辅助等多种类 Fenton 技术。类 Fenton 是一类利用固体催化剂代替二价铁离子催化 H2O2 产生自由基,进而氧化降解污染物的氧化反应。与传统芬顿氧化反应相比,类芬顿氧化反应具有催化性能高以及 pH 范围宽等优点[43]。周紫荆等[44] 在电芬顿降解诺氟沙星的实验中发现,在电流为 0. 08 A、氧气流量为200 mL/ min、pH 为3 的条件下反应 120 min,对初始质量浓度为 25 mg / L 的诺氟沙星的去除率为 73.6%。 Qin 等[45] 制备了 MnFe2O4 磁性纳米材料 MnFe2O4 -NH2 和 MnFe2O4-HS,发现氨基/ 硫醇基团可以促进 H2O2 的分解和·OH 自由基的生成,实现对阿奇霉素的高效降解。单独使用 H2O2 在 240 min 内阿奇霉素的降解率仅为 5.2%,总有机碳去除率为 1.9%; 而在 MnFe2O4、MnFe2O4-NH2、MnFe2O4-HS 的催化作用下,阿奇霉素的降解率分别可达55.5%、 82.3% 和 92.6%,240 min 后的总有机碳去除率亦可分别达 29.2%、48.55% 和 62.5%。
2.3 光催化氧化技术
光催化氧化技术是催化剂在光辐射作用下,吸收足够的光能后将电子从价带激发到催化剂的导带,产生光生电子( e-)和光生空穴( h +)。接着电子和空穴与水分子反应生成的 ROS 通过氧化和还原降解吸附在其表面的污染物[46]。但光催化氧化技术因其操作复杂,催化剂的带隙限制了其有效吸收可见光的能力,在实际应用中面临很多挑战[47],因此,提高光催化剂的光利用率和降低电子-空穴复合逐渐成为光催化氧化技术研究的热点。 Yao 等[48]构建了双 Z 型 V2O5 / FeVO4 / Fe2O3 纳米复合光催化体系用于降解诺氟沙星,V2O5 / FeVO4 / Fe2O3 纳米复合催化剂的降解速率常数为 0. 004 37 min-1,分别是 Fe2O3,V2O5 和 FeVO4 催化剂的 4.75、3.14 和 2.56 倍。这是由于在双 Z 型 V2O5 / FeVO4 / Fe2O3 光催化体系中存在 V2O5 和 FeVO4 两个价带氧化面,能够在催化过程中产生更多的 h + ,同时,h + 能使反应体系中的 H2O 氧化生成·OH,FeVO4 的导带还原表面上的 e-可以捕获并产生一些参与诺氟沙星降解的 O-2,从而提高光催化活性。 Song 等[49] 采用十二烷基苯磺酸钠(SDBS)辅助水热法合成氯氧化铋(BiOCl),在紫外可见光照射下,BiOCl-0.6 可使初始质量浓度为 20 mg / L 的盐酸土霉素在 45 min 内完全降解。其原因可能是 SDBS 可引起 BiOCl 纳米板团聚,形成的 3D 网络结构可以引入更多的氧空位,抑制光生电子和空穴的复合,有利于增强光催化剂降解污染物的能力。
2.4 电化学氧化技术
电化学氧化是有机污染物在电流作用下直接被氧化降解,或通过阳极产生的羟基自由基、超氧自由基等氧化降解[50]。与其他高级氧化技术相比,电化学氧化的优点在于不需添加化学物质促进反应体系生成·OH,且在该体系中,直接氧化有助于难降解有机物的矿化[51]。 Chen 等[52] 制备了 rGO@ Ti / SnO 复合电极对诺氟沙星进行氧化降解,发现0. 04% rGO@ Ti / SnO2-Sb 电极具有最佳的降解效率,在 90 min内对初始质量浓度为 50 mg / L 的诺氟沙星的降解率达 98.7%。这可能是由于 rGO 增加了电极涂层的比表面和电导率,从而提高了电催化活性。 Ni 等[53]制备了 Ce-PbO2 电极用于头孢拉定和头孢菌素的电化学降解,在反应时间为 90 min 时,头孢拉定和头孢菌素的降解率均高于 99%。这表明该电极不仅具有较高的析氢电位,还解决了电活性表面积小、腐蚀电流密度大的问题,使得·OH 的形成能力增强,从而达到去除抗生素的目的。
2.5 活化过硫酸盐高级氧化降解抗生素技术
过硫酸盐如过一硫酸盐( PMS)和过二硫酸盐(PDS)可通过热活化、过渡金属活化以及光催化活化等方式产生 SO-4·。 SO-4·的标准氧化还原电位为 2.6 V,虽然略低于·OH,但 SO-4 ·的氧化能力受 pH 的影响很小,半衰期为 30~40 μs,相比·OH( t 1 / 2 = 10-9 s)也更稳定[54]。过硫酸盐高级氧化技术具有反应条件温和、使用范围广等优点,同时,相比 H2O2,固体的 PMS 和 PDS 在应用时更加方便。所以,在过去十年中,关于过硫酸盐高级氧化降解有机污染物的研究得到了极大关注,并且发展迅速。目前,对于 SO-4·氧化降解抗生素的研究较多,该领域研究主要集中于氧化机制解析、新型活化技术开发以及催化剂制备等几个方向[55]。
过硫酸盐的活化主要靠外界能量的输入,包括金属催化剂活化、热活化、碳材料活化、紫外活化、超声活化、Cl-活化、电化学以及臭氧活化等方法[56]。这些活化过硫酸盐氧化技术对抗生素均表现出较强的降解效能[57-59]。 Li 等[60]制备了黑磷量子点和纳米银共修饰的钙钛矿催化剂(BPQDs/ Ag@ BiFeO3),在 PDS 为 2 mmol / L、催化剂的添加量为 0.2 g / L、 pH 为 7.5 的条件下,初始质量浓度为60 mg / L的磺胺嘧啶在 5 min 内完全降解。黑磷量子点独特的尺寸和表面效应能够促进钙钛矿的催化性能,并且,BiFeO3 和 Ag 之间发生的电子重排和电子转移促进了 PDS 的吸附和活性物质的激发,从而提升了磺胺嘧啶的降解效率。 Zhou 等[61] 利用 MnO2 / 热联合活化过硫酸盐降解磺胺甲恶唑,当 MnO2 的质量浓度为 1 g / L、PDS 的浓度为 2 mmol / L、温度为 50℃、pH 为 7. 0 时,在 150 min 内对初始质量浓度为 10 mg / L 的磺胺甲恶唑的降解率为 100%。在该体系中,热活化使过硫酸盐结构中的 O—O 键发生断裂,另一方面,溶液温度的升高极大地加速了亚稳态锰中间体的形成,也促进了 O—O 键的断裂,同时增强分子碰撞加速反应速率,使 MnO2 与过硫酸盐反应产生可降解磺胺甲恶唑的活性自由基 SO-4·和·OH。
2.6 高级氧化技术联合应用降解抗生素
尽管传统的高级氧化技术可以有效地去除抗生素,但由于无机离子会影响 ROS 的生成,从而降低去除效率,因此,高级氧化技术的联合应用对提高抗生素的降解速率、促进实际应用具有重要意义。高级氧化联用技术是指两种或两种以上高级氧化技术之间产生的协同作用。不同的单个氧化剂联用可以彼此相互促进,展现出协同氧化效应,降解效果在同条件下多数优于单个氧化剂的降解效果[62]。光催化法和电化学催化氧化法相结合的光电催化氧化法是代替传统抗生素处理技术的有效方法。在适当的光照下,光阳极在导带和价带中分别产生光生电子和空穴,价带上的空穴能直接氧化抗生素或与水反应生成高活性的·OH,而导带上的电子在外加电压的作用下转移到阴极,从而大大促进了电子空穴对的分离,提高光催化效率[63]。与富含氧空位碳量子点偶联的 TiO2 光阳极和涂有 Al2O3 保护层的 BiVO4 光阳极已成功应用于各种光电化学应用[64-65]。 Liu 等[66]制备的 F 掺杂 BiVO4 @ NiFe-LDH 光阳极用于四环素的光电催化降解。当外加偏压为 0.5 V( vs. Ag / AgCl)、模拟太阳光照为 100 mW/ cm 2 时,其光电催化反应速率常数为 0.936 h-1,20 mg / L 的四环素 2 h 内降解率达 86%,这个结果是单独光催化降解(29.3%)和电化学降解(13.3%)的 2.9 倍和 6.5 倍。 Fernandes 等[67] 采用改进的聚合物前驱体法制备得到 Ti / IrO2-Nb2O5 光阳极,在电流密度为 12.5 mA/ cm 2 紫外光光照(125 W)下,20 mg / L 的左氧氟沙星在 90 min 内完全降解。研究表明,在恒流模式下,光阳极处形成大量的 O2,半导体表面的电子将 O2 还原为超氧化物,从而促进左氧氟沙星的降解。此外,光催化与臭氧联用能够提高去除效率,臭氧可以快速捕获光生电子,从而促进光激发电荷载流子的传输和臭氧的利用,产生更多的活性物质,加快抗生素的分解和矿化[68]。 Xue 等[69] 设计了一种微波无极紫外光装置,用于在光催化臭氧耦合体系中去除诺氟沙星。在微波功率为 250 W、氧气流速为 10 L / min、pH 为 2.48 的条件下,初始质量浓度为 10 mg / L 的 NOR 溶液在 60 min 时降解效率可达 97%。机制分析表明,在 pH <7 时,臭氧以分子的形式存在,可以从 TiO2 的导带中提取电子,从而形成·OH,提高诺氟沙星的降解效率。 Kidak 等[70] 利用臭氧耦合超声体系去除阿莫西林,在超声强度为 75 W、溶解臭氧质量浓度为 0.15 mg / L、pH 为 10 的条件下,25 mg / L 阿莫西林的反应速率常数为 2.5 min-1,远高于单独超声和单独臭氧的反应速率常数(0. 04 min-1和 1.97 min-1)。研究发现,超声波的机械效应增强了臭氧的气液传质性能,并且臭氧在气相中热分解形成大量的·OH,进而提升阿莫西林的降解效率。
2.7 高级氧化技术对抗生素产物结构的影响
探究抗生素降解路径对了解高级氧化技术降解抗生素反应机制至关重要。通常利用质谱技术对降解产物进行分析,如液相色谱-串联质谱法、超高效液相色谱质谱法等。此外,密度泛函理论计算方法常与质谱技术相结合,应用于抗生素降解产物的检测。根据抗生素化学结构的不同可分为磺胺类抗生素、喹诺酮类抗生素、四环素类抗生素等,其结构如图3所示。大多数抗生素都含有环类结构,因此,在高级氧化体系中,断环是非常重要的一步。断环后会发生一系列的反应,如化学键的断裂或氧化。在这些反应中会生成大量的中间产物,经进一步反应,最后矿化成 CO2 和 H2O 等小分子物质[71]。本节以磺胺类抗生素和喹诺酮类抗生素在高级氧化体系中的降解机制为例进行讨论。
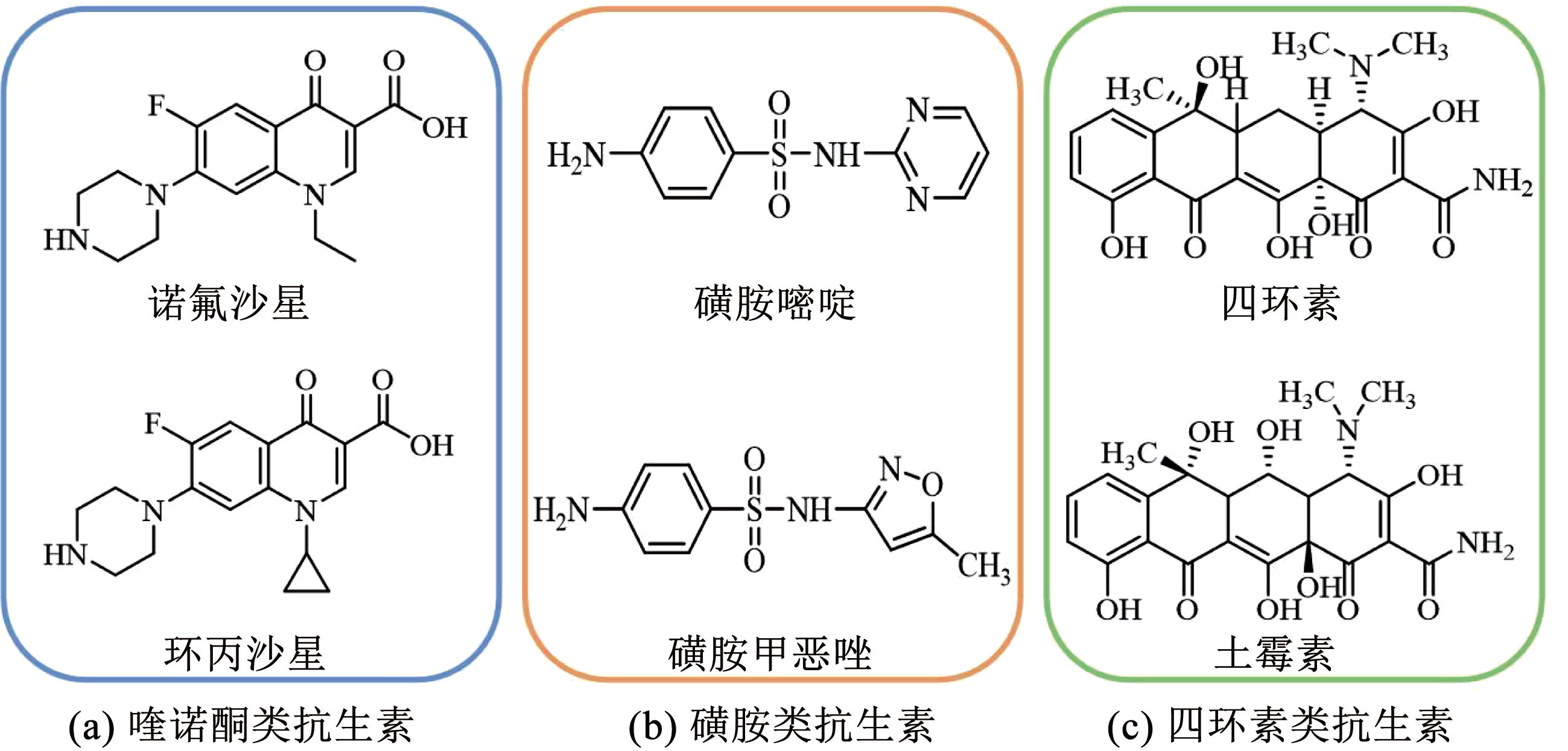
图3常用抗生素的种类和结构
Fig.3Types and structures of commonly used antibiotics
磺胺类抗生素( SAs)均含有磺胺基团结构、五元或六元杂环和 R 取代基。 R 取代基通常为嘧啶、恶唑、异恶唑和噻唑等[72]。因其 R 取代基的不同,不同的 SAs 降解效率存在明显差异,含有 R 取代基的 SAs 比不含 R 取代基的 SAs 更容易降解[73]。在高级氧化体系中,大部分 SAs 的降解是依靠 ROS 对化学键的攻击以及 R 取代基被氧化。根据磺胺类抗生素的降解特性,大概推测其降解路径可能为 S—N 键和 C—N 键的断裂、苯环的羟基化和 R 取代基的氧化,并且被 C  C 双键取代的 R 容易发生加成反应,被甲基取代的 R 容易被氧化为羧基。 R 取代基的环也容易受到自由基的攻击而开裂,生成开环产物。此外,具有六元环的 SAs 可以从分子结构中“挤出” SO2 基团,通过 N—N 重排生成新的中间产物[74]。最后,所有中间产物被进一步氧化并分解为小分子。
C 双键取代的 R 容易发生加成反应,被甲基取代的 R 容易被氧化为羧基。 R 取代基的环也容易受到自由基的攻击而开裂,生成开环产物。此外,具有六元环的 SAs 可以从分子结构中“挤出” SO2 基团,通过 N—N 重排生成新的中间产物[74]。最后,所有中间产物被进一步氧化并分解为小分子。
 C 双键取代的 R 容易发生加成反应,被甲基取代的 R 容易被氧化为羧基。 R 取代基的环也容易受到自由基的攻击而开裂,生成开环产物。此外,具有六元环的 SAs 可以从分子结构中“挤出” SO2 基团,通过 N—N 重排生成新的中间产物[74]。最后,所有中间产物被进一步氧化并分解为小分子。
C 双键取代的 R 容易发生加成反应,被甲基取代的 R 容易被氧化为羧基。 R 取代基的环也容易受到自由基的攻击而开裂,生成开环产物。此外,具有六元环的 SAs 可以从分子结构中“挤出” SO2 基团,通过 N—N 重排生成新的中间产物[74]。最后,所有中间产物被进一步氧化并分解为小分子。
喹诺酮类抗生素由喹诺酮类环和哌嗪取代基构成,QNs 的降解与 SAs 类似,也是通过 ROS 的攻击氧化降解。 QNs 的氧化降解主要涉及哌嗪环裂解、脱氟和羟基化。由于哌嗪环极易被氧化,会最先受到 ROS 的攻击而裂解。羧基和氟是 QNs 中的强吸电子取代基,容易受到 ROS 的攻击发生脱羧和脱氟反应,形成一系列中间产物。喹诺酮类部分与羧基相邻的 C  C 双键也容易被 ROS 攻击破坏。其他中间体则通过脱羰基化、脱羧进一步形成。最终上述有机中间体可进一步转化为小分子有机物和矿化无机产物[72]。
C 双键也容易被 ROS 攻击破坏。其他中间体则通过脱羰基化、脱羧进一步形成。最终上述有机中间体可进一步转化为小分子有机物和矿化无机产物[72]。
 C 双键也容易被 ROS 攻击破坏。其他中间体则通过脱羰基化、脱羧进一步形成。最终上述有机中间体可进一步转化为小分子有机物和矿化无机产物[72]。
C 双键也容易被 ROS 攻击破坏。其他中间体则通过脱羰基化、脱羧进一步形成。最终上述有机中间体可进一步转化为小分子有机物和矿化无机产物[72]。
3 抗生素高级氧化降解产物生态毒性研究进展
现阶段利用高级氧化技术降解抗生素或其他高风险难降解有机污染物,大部分研究主要围绕催化剂的制备、改性以提升性能及降解机制解析等方面开展[75]。然而,在氧化降解过程中抗生素生成的产物种类繁多,近些年一些相关研究发现部分降解产物仍具有生态毒性,甚至中间产物毒性大于母体抗生素。表1总结了近几年部分关于 AOPs 降解抗生素产物生态毒性的研究,可以看出,降解产物的生态毒性可能因其结构和降解机制而有很大差异。本文按照降解方法分类,对近些年关于高级氧化降解抗生素产物毒性变化的研究进行系统总结,并结合产物结构角度探讨产物结构与毒性的关系。
表1抗生素高级氧化降解产物生态毒性变化
Tab.1 Changes in ecotoxicity of antibiotic advanced oxidation degradation products
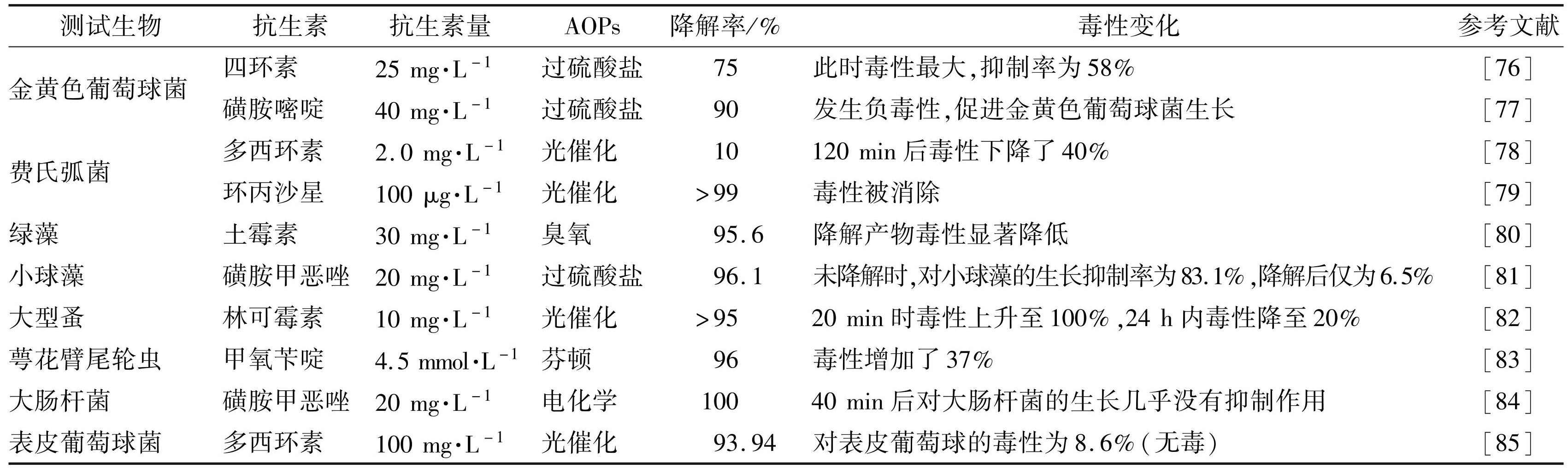
3.1 臭氧降解抗生素的中间产物毒性研究
由于矿化不完全等原因,臭氧氧化会因降解产物的形成问题而带来潜在的环境风险。一些研究使用发光细菌、藻类以及大型溞作为研究对象以评估臭氧氧化降解产物的毒性。 Kuang 等[86] 在评估甲氧苄氨嘧啶臭氧化产物毒性的研究中发现,当甲氧苄氨嘧啶经臭氧降解达 90% 时,降解产物对发光细菌表现出的毒性抑制能力甚至高于原抗生素。进一步分析表明,毒性增加可能是由环加成反应裂解初级产物的芳环,产生的小分子二级产物(如脂肪酸和醛)引起的。在臭氧降解磺胺甲恶唑中也发现了相似的现象。在降解过程中,由苯环羟基化生成的 TP-270 和异恶唑环上 C  C 氧化生成的 TP-288,这两种产物对小红藻和大水蚤具有一定的毒性抑制效应[87]。 Abromaitis 等[88] 研究了环丙沙星经光催化臭氧氧化后降解产物的毒性,结果表明,初始质量浓度为 20 mg / L 的环丙沙星对大型溞的毒性为 0,然而,当 TOC 去除率达 61%~63% 时,大型溞的死亡率为 100%,这是由于在降解阶段形成了有毒降解产物 m / z274 和 m / z330。根据臭氧氧化的选择性,这些降解产物无法被臭氧进一步去除,使得环丙沙星在臭氧氧化过程中的生态毒性反而变得更强。
C 氧化生成的 TP-288,这两种产物对小红藻和大水蚤具有一定的毒性抑制效应[87]。 Abromaitis 等[88] 研究了环丙沙星经光催化臭氧氧化后降解产物的毒性,结果表明,初始质量浓度为 20 mg / L 的环丙沙星对大型溞的毒性为 0,然而,当 TOC 去除率达 61%~63% 时,大型溞的死亡率为 100%,这是由于在降解阶段形成了有毒降解产物 m / z274 和 m / z330。根据臭氧氧化的选择性,这些降解产物无法被臭氧进一步去除,使得环丙沙星在臭氧氧化过程中的生态毒性反而变得更强。
 C 氧化生成的 TP-288,这两种产物对小红藻和大水蚤具有一定的毒性抑制效应[87]。 Abromaitis 等[88] 研究了环丙沙星经光催化臭氧氧化后降解产物的毒性,结果表明,初始质量浓度为 20 mg / L 的环丙沙星对大型溞的毒性为 0,然而,当 TOC 去除率达 61%~63% 时,大型溞的死亡率为 100%,这是由于在降解阶段形成了有毒降解产物 m / z274 和 m / z330。根据臭氧氧化的选择性,这些降解产物无法被臭氧进一步去除,使得环丙沙星在臭氧氧化过程中的生态毒性反而变得更强。
C 氧化生成的 TP-288,这两种产物对小红藻和大水蚤具有一定的毒性抑制效应[87]。 Abromaitis 等[88] 研究了环丙沙星经光催化臭氧氧化后降解产物的毒性,结果表明,初始质量浓度为 20 mg / L 的环丙沙星对大型溞的毒性为 0,然而,当 TOC 去除率达 61%~63% 时,大型溞的死亡率为 100%,这是由于在降解阶段形成了有毒降解产物 m / z274 和 m / z330。根据臭氧氧化的选择性,这些降解产物无法被臭氧进一步去除,使得环丙沙星在臭氧氧化过程中的生态毒性反而变得更强。
3.2 芬顿降解抗生素的产物毒性研究
抗生素的降解并不完全等同于毒性的降低,因此,对芬顿过程中所产生的降解产物毒性进行评估是十分必要的,以确保其适用性和安全性。 Piccirillo 等[89] 最新发表的关于新型类 Fenton 体系降解甲氧苄氨嘧啶的研究表明,降解产物相比于原抗生素对费氏弧菌和轮虫的毒性抑制更加明显,对微藻的毒性抑制能力相似。 Han 等[90] 通过光芬顿氧化降解土霉素,测定其对费氏弧菌的抑制率,30 min后,土霉素的降解率为 92.4%,此时对费氏弧菌的抑制率由最初的 42.9% 上升至 90% 以上。利用 ECOSAR 软件对土霉素及其降解产物进行毒性预测,发现在土霉素 C  C 双键上引入羟基后所得到的羟基化衍生物( m / z 447.15b),相比母体化合物,对鱼类和藻类表现出的急性毒性明显更高。 Yang 等[91]制备了 Ce4O7 修饰的 Bi4MoO9 异质结催化剂用于在光芬顿中降解四环素,研究了四环素在降解过程中的毒性变化,结果显示,在 0.5 h 内,降解产物对发光杆菌的抑制率由 53% 增长至 69%,2 h后降至 29%,此时四环素的降解率达 99.8%。在此降解过程中,部分降解产物的毒性大于原药物,但随着反应时间延长,降解产物的毒性随之减弱。
C 双键上引入羟基后所得到的羟基化衍生物( m / z 447.15b),相比母体化合物,对鱼类和藻类表现出的急性毒性明显更高。 Yang 等[91]制备了 Ce4O7 修饰的 Bi4MoO9 异质结催化剂用于在光芬顿中降解四环素,研究了四环素在降解过程中的毒性变化,结果显示,在 0.5 h 内,降解产物对发光杆菌的抑制率由 53% 增长至 69%,2 h后降至 29%,此时四环素的降解率达 99.8%。在此降解过程中,部分降解产物的毒性大于原药物,但随着反应时间延长,降解产物的毒性随之减弱。
 C 双键上引入羟基后所得到的羟基化衍生物( m / z 447.15b),相比母体化合物,对鱼类和藻类表现出的急性毒性明显更高。 Yang 等[91]制备了 Ce4O7 修饰的 Bi4MoO9 异质结催化剂用于在光芬顿中降解四环素,研究了四环素在降解过程中的毒性变化,结果显示,在 0.5 h 内,降解产物对发光杆菌的抑制率由 53% 增长至 69%,2 h后降至 29%,此时四环素的降解率达 99.8%。在此降解过程中,部分降解产物的毒性大于原药物,但随着反应时间延长,降解产物的毒性随之减弱。
C 双键上引入羟基后所得到的羟基化衍生物( m / z 447.15b),相比母体化合物,对鱼类和藻类表现出的急性毒性明显更高。 Yang 等[91]制备了 Ce4O7 修饰的 Bi4MoO9 异质结催化剂用于在光芬顿中降解四环素,研究了四环素在降解过程中的毒性变化,结果显示,在 0.5 h 内,降解产物对发光杆菌的抑制率由 53% 增长至 69%,2 h后降至 29%,此时四环素的降解率达 99.8%。在此降解过程中,部分降解产物的毒性大于原药物,但随着反应时间延长,降解产物的毒性随之减弱。
3.3 光催化抗生素的降解产物毒性研究
目前,对光催化氧化降解抗生素的产物毒性评价除费氏弧菌外,还可借助活性污泥呼吸抑制实验进行毒性评价。 Wang 等[92]使用 150 W 的氙弧灯模拟太阳照射,研究 C-N-S 三掺杂二氧化钛在模拟太阳光照射下催化降解四环素。在光照射之前,四环素溶液对费氏弧菌的发光抑制率为 21%~24%,当模拟太阳光照射 0.5 h 后,发光抑制率升高至 43%,这可能是由于四环素萘酚环失去羟基、N-甲基和氨基后,降解产物空间位阻变低,从而更容易通过费氏弧菌的细胞膜进行胞内扩散。 Truong 等[93] 在磁性可见光活化 ZnFe2O4 / BiVO4 / g-C3N4 降解洛美氟沙星研究中,采用活性污泥呼吸抑制实验测定光降解产物的毒性,结果表明,洛美氟沙星空白溶液抑制了活性污泥溶解氧消耗率为( 50.6 ± 3.2)%,当 m(ZnFe2O4)∶ m(BiVO4)∶ m( g-C3N4)= 1∶ 8∶ 10,光催化 7.5 min 时,抑制率增长至(58.4 ± 4.5)%,105 min时,抑制率下降至(8. 0 ± 1.8)%,此时洛美氟沙星的降解率为 96.1%。
3.4 电化学降解抗生素的产物毒性研究
在电化学高级氧化降解抗生素产物毒性相关研究中,除了采用常规毒性测试,有研究也结合生态毒性预测系统(ECOSAR)进行产物结构与其毒性的相关性模拟分析。 Meng 等[94]合成了对左氧氟沙星进行电催化降解,通过发光杆菌( Photobacterium phosphoreum)的微毒素实验对左氧氟沙星及其降解产物进行毒性分析,结果表明,在电降解 10 min 后,左氧氟沙星溶液的生物发光抑制率从 52.7% 增长到 72.1%,60 min 后下降至 19.7%。该研究进一步通过化合物生态毒性预测系统(ECOSAR)进行定量构效关系(QSAR)分析,以综合评价副产品的生态毒性。如表2所示,在前 10 min 处由左氧氟沙星的脱羧作用产生了 P2 和 P7,由于其对水生生物的高急性毒性,被归类为有毒化合物。因此,P2 和 P7 的产生可能是生物发光抑制率增加的主要原因。此外,在降解 10~30 min 中,产生了被归类为对水生生物有害化合物的中间体 P4 和 P5,并在 40~50 min 内完全分解。综合分析毒性评估结果和降解途径结果,可以总结出左氧氟沙星及其降解产物的主要毒性可能来自其哌嗪环的降解。在电化学高级氧化降解产物毒性研究中,有研究也指出,除降解产物具有生物毒性,产生的强氧化物质也会具有与毒性效应相似的生物抑制效应。石秋俊等[95]研究了 Ni 掺杂 Sb-SnO2 瓷环粒子电极催化氧化磺胺类抗生素,通过费氏弧发光细菌的抑制率对比了抗生素和降解产物的毒性,磺胺嘧啶、磺胺甲基嘧啶和磺胺甲恶唑未经处理时的发光抑制率分别为 37.1%、32.5% 和 40%,以 NaCl 为支持电解质降解 4 h 时,磺胺嘧啶、磺胺甲基嘧啶和磺胺甲恶唑对费氏弧发光细菌的发光抑制率分别增长至 83%、72% 和 75%,此时,对这 3 种抗生素的 TOC 去除率分别为 81. 0%、74.3% 和 72.2%。除了降解产物,费氏弧菌对电解过程中生成的强氧化性物质(H2O2、Cl-)也较为敏感,以及 Cl-可能转化为活性氯,与降解产物发生反应生成毒性更强的含氯有机物,这些因素都可能导致反应液毒性增强。
3.5 过硫酸盐氧化降解抗生素的产物毒性研究
在活化过硫酸盐高级氧化降解抗生素产物毒性相关研究中,除发光细菌和藻类等模式测试生物外,一些研究还探究了降解产物对污泥或鱼的肝脏的毒性影响。 Gao 等[96] 对诺氟沙星在微波辐射 3D-ZnCO2O4 活化过硫酸盐体系中的降解产物进行毒性分析,初始质量浓度为 5 mg / L 的诺氟沙星溶液在 PS 为 0.25 mmol/ L、pH 为 6.7、C-ZnFe2O4 为 1.5 g / L、微波功率为 400 W、温度为 70℃ 的条件下,40 min 内 NOR 的降解率达 86.2%。然而,诺氟沙星溶液的毒性在 10 min 时对海洋发光菌的发光抑制率达到最大值 53.7%,15 min 后急性生物毒性逐渐下降至 10% 以下。 Lai 等[97] 通过活性污泥抑制实验研究了 Co / Al2O3-EPM/ PMS 降解水溶液中磺胺甲恶唑降解产物的生态毒性,在 0~4 min 内,磺胺甲恶唑对耗氧抑制率由 20.2% 增长至最大值 39.5%,这种现象可能是在降解过程中生成的 4-氨基苯磺酸抑制了微生物的代谢活性。随着反应的进行,耗氧抑制率逐渐降至 16.5%。 Lofrano 等[98] 的研究也表明,质量浓度为 25 mg / L 的氯霉素经光催化完全降解后,产物对费氏弧菌和半蒴苣苔等的平均毒性仍可达到原抗生素的 10% 以上。 Zhu 等[99] 采用紫外/ 过硫酸盐(UV/ PDS)体系降解人工海水中的氧氟沙星(OFL),在 pH 为 7、Na2S2O8 为 0. 008 mmol / L、光功率为 240 W 的条件下,初始质量浓度为 18 mg / L 的 OFL 在 5 min 后被 UV/ PDS 完全降解。为了评估 UV/ PDS 降解后的 OFL 溶液残留毒性,将斑马鱼在 4 种不同的反应体系中培养,96 h 后取出鱼进行解剖,鱼肝变化如图4所示。图4(a)中,肝细胞结构虽正常,但血管扩张、充血,并伴有少量炎症细胞。在图4(b)、(c)中,肝细胞疏松、肿胀、增大,血管被少量炎症细胞浸润,肝窦内可见大量红细胞碎片,但肝结构未受损。图4(d)显示肝结构受损,肝细胞呈疏松、水肿,并伴有球囊样变性,血管扩张、充血,炎症细胞浸润间质,出现大面积坏死。以上研究表明,多种抗生素经过硫酸盐高级氧化降解后,由于产物主体药性结构未降解,或由于基团取代后产生的多种降解产物,仍能表现出一定毒性,甚至相比原抗生素毒性更高。
Tab.2 Ecotoxicity of Levofloxacin and its by-products on fish, daphnia and algae [95]
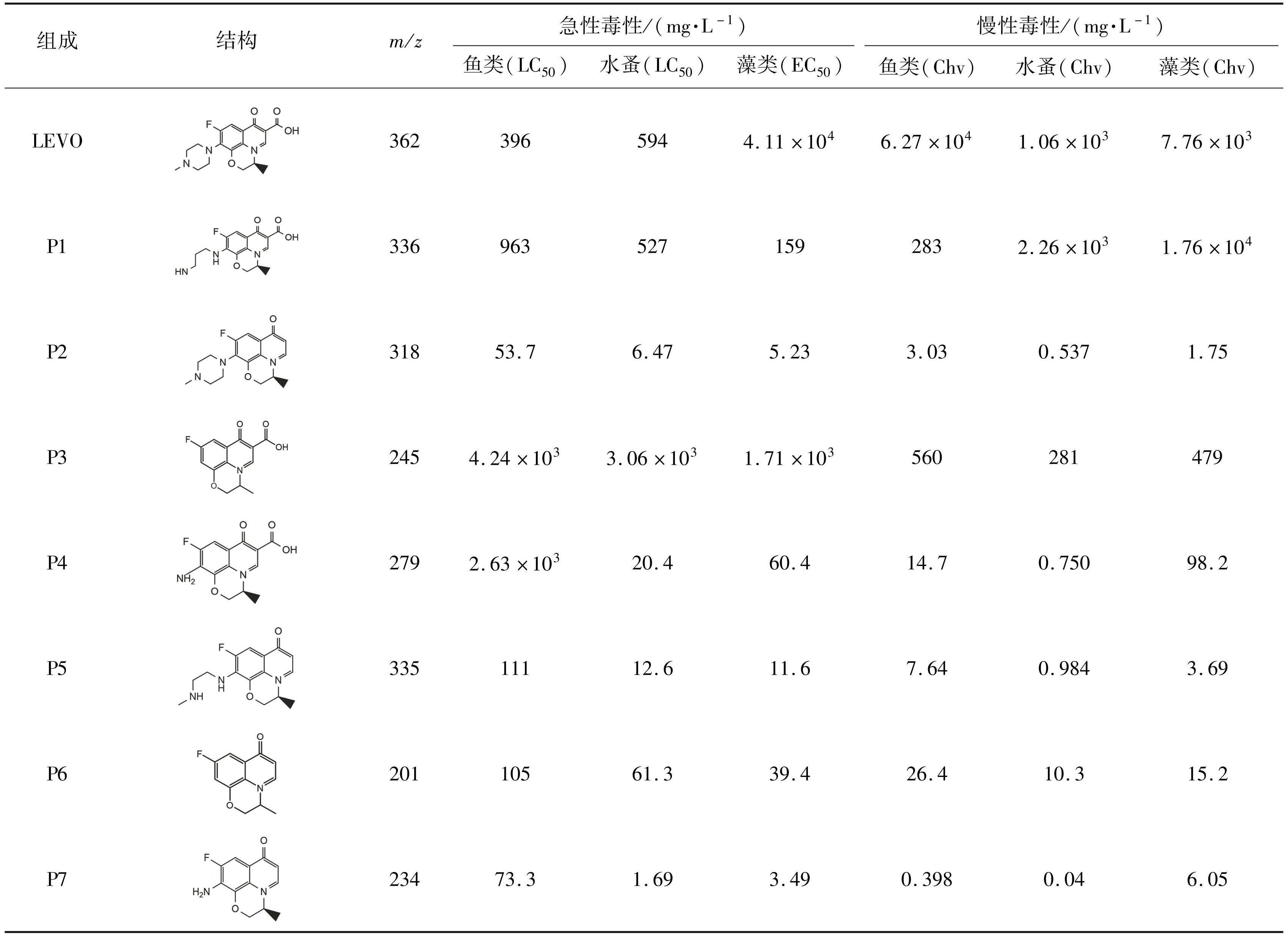
注:根据《全球化学品统一分类和标签制度》对预测毒性值进行分类。无害:LC50 / EC50 / Chv >100 mg / L; 低毒:10 mg / L <LC50 / EC50 / Chv <100 mg / L; 中毒:1 mg / L <LC50 / EC50 / Chv <10 mg / L; 剧毒:LC50 / EC50 / Chv <1 mg / L。
4 结语
高级氧化技术因其氧化效率高、操作简单、非选择性氧化等优点已成为环境修复的研究热点。本文对高级氧化工艺降解抗生素的技术特点进行了简要讨论,并总结了典型抗生素的降解途径,分析了抗生素污染引起的生态毒性问题,并对抗生素降解产物的生态毒性差异性的研究进展进行了梳理,发现抗生素降解产物的生态毒性可能因其结构和降解机制而产生很大差异。尽管高级氧化工艺已被广泛应用于抗生素的降解,但大多数研究重点都是在提高降解效率上,对中间体或降解产物的生态毒性关注较少,在后续的研究中,应深入研究不同大类抗生素在两大类自由基体系下产物结构演变、产物结构与生态毒性之间的构效关系,建立系统性评价体系,以期对抗生素废水处理出水安全性的快速评价起到关键作用。


