聚羟基脂肪酸酯(Polyhydroxyalkanoates, 简称PHAs)是由许多原核微生物在营养不均衡的生长条件下,存在于微生物体内的一类3-羟基脂肪酸组成的高分子生物聚酯.其生理功能是作为微生物体内的碳源和能量的储存物质.当微生物生长环境中有过量的碳源存在而缺乏必要的营养物质时,其体内氧化还原失衡,能量和还原当量过剩,微生物需要将过量的能量储存一起.由于PHA是一种渗透压惰性的物质,在微生物体内大量积累也不会影响到细胞的渗透压,是一种理想的储存载体; 而当碳源缺乏时,其他营养元素充足,PHA又可以作为碳源被降解利用.PHA具有与传统石化塑料如聚乙烯、聚丙烯等类似的材料学性质,可由碳水化合物、脂肪酸等可再生资源合成,并且在环境中可以完全降解进入自然界生态循环,具有替代传统不可降解塑料的潜力.可用于制造生物可降解的包装材料、生物可降解和生物相容性医用植入材料、可控药物缓释载体和各种环保化工产品,如热熔胶、压敏胶和水溶胶等,是一种环境友好型的绿色塑料.目前,生物合成PHA的方法主要有3类,即细菌发酵法、基因工程法和活性污泥法.前两种工艺运行过程中要求灭菌消毒,保证发酵系统无杂菌存在,工艺成本昂贵.大规模生产PHA的首要目标便是降低生产成本,近年来,大量研究集中于混合菌群的富集驯化工艺.由于城市污水处理厂的活性污泥可以作为混合菌群的良好来源,活性污泥利用廉价碳源合成PHA成为研究热点[1-3].而且本课题组前期的研究结果表明,利用活性污泥混合菌群达到的PHA含量占细胞干质量的比例甚至可超过部分纯菌培养[4-5].通过污水中的有机物质合成PHA,是利用生物技术实现变废为宝的有效途径.一方面,通过反应降解了有机污染物,起到污泥间接减量、污泥资源化的功能,还具有废水处理、有机废物资源化回收等多重功效,从而实现了环境保护这个大主题.另一方面,将环境污染物质转化为具有良好利用价值的环境友好塑料,对于可持续发展具有重大现实意义.
活性污泥合成PHA的工艺研究中,普遍采用三段式方法:1)底物准备阶段,制备适于PHA合成的底物,如工业与农业废水等含有复杂底物,需通过厌氧预处理将其转化为挥发性脂肪酸以适合微生物吸收利用;2)将活性污泥中的混合菌群进行驯化,通常使用底物充盈和饥饿模式(feast and famine,即好氧动态补料, ADF)筛选出能够合成PHA的菌群;3)利用第二阶段富集出的混合菌群,在限制氮源的情况下实现PHA在混合菌群细胞内的大量合成,见图 1.三段式工艺的优点是混菌不需要对培养基进行灭菌处理,不需要对发酵过程严格控制,节省能量[6].
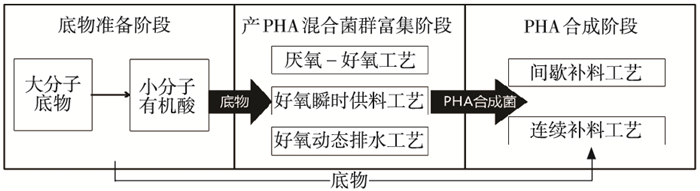
|
图 1 三段式工艺流程 |
其中厌氧酸化过程(三段式中第一段)普遍采用半连续或连续流厌氧混合反应器对原始底物(富含碳水化合物的废水/废物)进行水解、发酵,工艺较为成熟,不作为本文讨论的重点内容.本文对目前活性污泥合成PHA的工艺研究做一综述,重点介绍利用混合菌群合成PHA工艺中PHA合成菌群筛选阶段(三段式中的第二段)和PHA积累阶段(三段式中的第三段)的改进及相关新工艺的研发进展,并简述动力学模型在PHA合成工艺优化中的应用,最后对现有工艺合成PHA的经济性能进行总结.
1 产PHA混合菌群富集阶段活性污泥是污水处理厂常用的污水生物净化处理主体,是一种具有多种细菌、原生动物、后生动物的复杂生态系统.近年来,有研究发现活性污泥混合菌群中存在有合成PHA能力的菌种,此类微生物会以积累PHA作为一种抗逆机制,这为低成本合成PHA提供了充足的原材料,是污泥资源化利用的又一个渠道.在PHA生产过程中,菌群筛选是最关键的一步,通过定向的筛选策略获得稳定和高产的PHA菌群是此阶段的核心问题.
1.1 厌氧-好氧工艺厌氧-好氧活性污泥工艺最早用于上世纪70年代的污水处理工程,也是最早意识到在活性污泥中积累PHA的工艺——强化生物除磷(enhanced biological phosphate removal, EBPR).废水处理工艺中的聚磷菌(PAOs)和聚糖菌(GAOs)是典型具有PHA合成能力的混合菌群,EBPR是这两类微生物在厌氧/好氧交替的条件下进行.厌氧阶段,以多聚磷酸盐释放或糖原的分解提供能量,在废水中吸收短链脂肪酸等有机底物,以PHA的形式在细胞内贮存碳源;好氧阶段,微生物则分解细胞内存储的PHA,通过氧化磷酸化获得能量,进行自身增殖并摄取环境中的磷.Chua等[7]提出的厌氧-好氧工艺模型以传统的活性污泥处理污水为基础,增加了产PHA驯化环节,从而实现了污水处理与合成PHA的双重效果,但PHA产量有限,占细胞干质量的31%左右.Serafim[8]与Takabaka等[9]的研究表明,厌氧-好氧交替模式下微生物的代谢机制也存在多样性,其中典型的PAOs代谢包括在厌氧阶段胞内多聚磷酸盐的分解、胞外磷的释放、碳源基质的摄取和PHA的积累,这种机制下微生物积累PHA能力较低;而在厌氧阶段细胞处于休眠状态,在好氧阶段的初期快速吸收外部碳源并完成PHA存储, 且在碳源用完后继续利用PHA吸收磷的机制使微生物合成PHA占细胞干质量达40%以上.Satoh等[10]对厌氧-好氧和微氧-好氧工艺进行对比,发现前者微生物PHA占细胞干质量的33%,而后者PHA的最大积累量可达62%.郑裕东等[11]研究了厌氧-好氧模式下的PHA合成,发现在一般的污水处理中PHA的含量极少,大部分有机物在细胞内转化为糖原、聚磷酯等,PHA比重较低.当通入少量氧气形成微氧环境时,微生物就可以通过氧化少量有机物进行合成代谢,当控制的氧气量较严格且适当时,微生物倾向于大量积累PHA.
1.2 好氧瞬时供料(ADF)工艺通常ADF的运行在SBR中进行,此工艺是Majone等[12]在1996年首次提出,完全在好氧条件下的工艺合成PHA,称为好氧动态补料(aerobic dynamic feeding,也是充盈饥饿模式,FF).通过控制反应器内底物浓度变化,使微生物反复处于充盈和饥饿的状态.经过ADF工艺驯化的菌群的特点是微生物会立刻将底物用于合成PHA, 待碳源匮乏时分解PHA获得能源维持细胞分裂以及生存所需能量.ADF工艺具有微生物代谢路径明确,且SBR反应器容易控制,可以根据不同供料方式、反应周期等做出调整,对工艺优化参数调控效果显著等优点[13],在近十几年快速发展.研究发现,经ADF工艺驯化后的混合菌群可达89%[14],接近纯菌合成PHA的产率,是混菌合成PHA领域热门的研究工艺之一.
大量文献与本课题组前期研究证明,ADF工艺中底物浓度[15-17]与有机负荷、碳氮比、充盈和饥饿的周期持续时间、污泥停留时间SRT、充盈和饥饿阶段持续时间比值、温度、pH、反应器内溶解氧含量等均可以作为驯化富集阶段工艺优化的控制参数[13-15].Serafim等[8]通过瞬态进料方法获得了占细胞干质量达78.5%的PHA;Cai等[18]使用中温厌氧产酸相出水进行PHA的合成试验,通过动态供料方式实现了56.5%的PHA积累,其中PHB与PHV比为88:12,PHA产率为310 mg/(g·h). Dionisi等[19]对动态进料过程中的微生物群落进行了DGGE分析,甲基杆菌科(Methylobacteriaceae)、黄杆菌Flavobacterium sp.、假丝酵母菌Meganemaperideroedes、陶厄氏菌Thauera sp.是混菌中的4种优势菌.Dionisi等[20]对不同周期长度条件下的ADF工艺富集PHA效果进行了研究,结果表明,较长周期可起到良好的产PHA菌富集效果,但周期不宜超过12 h.若微生物底物吸收速率较高,即在单个周期内更小的充盈和饥饿的持续时间比值,可得到更强的PHA合成能力.
目前,关于利用混合菌群富集PHA的研究取得众多突破性进展,多处于实验室研究阶段,半工业化规模和工业化生产的研究少见报道.Tamis等[21]采用工业废水为底物开展了半工业化的PHA生产,即接种混合菌群到200 L的SBR中对PHA菌群富集,然后将富集到的菌群投入到200 L的反应器中使其单位细胞内的PHA含量最大化,最终其PHA产量为(0.70±0.05) g/g.此产量虽低于实验室规模,对于实现利用混合菌群合成PHA的产业化仍非常重要.
1.3 好氧动态排水(ADD)工艺在ADF工艺合成PHA基础上,针对ADF模式在PHA富集阶段表现不稳定和富集时间过长的问题[14, 22],本课题组开展了PHA富集阶段的优化研究,即好氧动态排水工艺(aerobic dynamic discharge,ADD),见图 2.研究发现当微生物具有PHA合成能力时,此类菌群占优势的活性污泥的细胞会重于非PHA合成菌群,故沉降性会增强,即细胞内存储物含量与沉降性有关,此结论与Rittmann等[23]的研究一致.利用此特点将PHA合成菌与非PHA合成菌通过沉降性能区分,从而进行合成PHA菌群的快速稳定富集.Chen等[24]通过沉降性对污泥进行筛选,称为“物理选择压”,通过长期的famine阶段对污泥进行的筛选称为“生态选择压”.ADD工艺便是在原有ADF生态选择压的基础上增加了物理选择压,增加了对污泥筛选的力度.反应器运行30 d左右达到稳定状态,与其他条件等同采用ADF工艺的反应器相比,ADD工艺运行模式下,污泥在充盈阶段底物吸收速率更快,且其充盈和饥饿的持续时间之比更小,可实现30 d运行后微生物PHA含量占细胞干质量达74%以上,其在降低污泥混菌驯化的时间成本方面效果显著.

|
图 2 ADD运行模式工艺流程 |
PHA积累阶段主要利用驯化阶段筛选到的PHA合成菌群进行PHA贮存量的提升.此过程的影响因素包括底物、pH、温度、有机负荷等已有综述报道,本文主要针对PHA积累阶段进料方式进行详细探讨.
2.1 批次试验工艺采用批次实验工艺进行PHA合成是使得PHA含量最大化的最好方法.然而, 细胞生长和PHA积累需要保持平衡,以避免PHA积累不完全导致其含量偏低.由于PHA菌群的特性是营养物质受限条件下会促使细胞吸收底物合成PHA,在批次试验中,许多研究均采取比驯化阶段更高有机负荷但不含营养成分的底物,同时实时监测溶解氧.当溶解氧突然跃增即表示底物基本消耗完成,此时沉淀并去除上清液,继续投加底物,即保证微生物始终在碳源充足的环境中生存,以令其达到细胞内合成PHA含量的极限[19].Katırcıglu等[25]通过监测溶解氧和限制氮源来进行PHA合成,在生物生长阶段不限制氮源,监测溶解氧变化;后续PHA合成阶段限制氮源供给,其最大生物增长速率可达0.265 h-1.Johnson从已稳定运行4年的SBR反应器中取泥,投加比SBR反应器中高5.5倍浓度的乙酸碳源,持续批次运行12 h得到最大PHA产量为89%细胞干质量,此项研究表明利用混菌合成PHA近乎接近纯菌生产PHA的水平.
2.2 连续补料工艺如2.1所述,大部分研究者认为批次补料的模式加入底物可以克服底物的抑制作用,然而Albuquerque等[1]认为,以上模式会使PHA产率降低,因为进行批次补料会中断反应进行,导致反应过程受阻而消耗掉部分PHA,于是首先尝试在PHA积累阶段进行批次补料试验与连续补料工艺对微生物合成PHA能力的对比.结果显示,采用连续流工艺后,微生物在PHA积累阶段始终处于底物浓度稳定丰富状态,底物比吸收速率和PHA比合成速率均比采用批次试验的污泥高.经过6 h的试验后,采用连续流工艺的反应器内微生物最大PHA含量为72%,高于采用批次试验的65%.而且由于连续流工艺中,当采用混合酸作为底物时,混合酸中各成分比例在PHA积累过程中保持一致,使得PHA最终产物中HB与HV比率仅与细胞对各组分底物吸收速率的不同有关,这为通过调控底物成分定向控制PHA产物成分提供了可能.然而,Serafim等[8]针对连续补料和分批补料有不同的结论.将碳浓度为180 mmol/L的乙酸分2种方式加入到反应器中,即连续补料和分批次补料模式.当批次补料时,将乙酸按碳浓度60 mmol/L分3次加入.加入控制点由溶解氧(DO)控制,通过对底物被耗尽时微生物进行检测获得了相应的实验结果.连续补料合成的PHA占细胞干质量的比例为56.2%,而分批次加入的比例可达78.5%.因此,Serafim认为通过对DO的控制、底物分批次加入消除了高浓度带来的抑制作用,还大大提高了PHA占细胞干质量的比例.
已有的PHA批次合成工艺在PHA含量上均取得了可观的结果,但是工艺底物利用效率(微生物净底物摄取量/供给反应体系的总底物量)偏低的问题并未引起足够的关注.另外,产PHA混合菌群在利用以小分子有机酸为主要成分的底物时,会出现反应液pH上升的现象,这是由于微生物在摄取游离酸分子时引起了反应体系内相应酸水解平衡向生成氢氧根离子一侧的移动.陈志强等[24]采用改进的连续补料工艺(如图 3所示),直接使用pH未调节(5.0)的废糖蜜酸酵解产物进行补料,在较低的生物量负荷(biomass loading rate,BLR)条件下,反应体系达到了酸碱自平衡状态,在获得较高PHA合成量(70.4%)的同时大幅度提升了工艺的底物利用效率.该工艺在底物制备、运行效率上均具备成本优势[26].

|
图 3 PHA合成阶段主要工艺模式 |
与传统的三段式不同,Rhu等[27]所采用PHA的合成流程是将微生物的富集驯化和PHA的合成在物理上是一体的,即使用同一种反应器,在时间上分为富集驯化和PHA合成,其运行方式最大可以积累PHA的量占细胞干质量的51%,PHA的组分主要是PHB和PHV.两段式PHA合成工艺具有操作简易及PHA产能可预知的优点,并且能够抗负荷波动冲击.将两段式工艺与剩余污泥定向产酸耦合,则能够在碳源利用和菌群富集两个阶段均实现污泥减量,有广阔的应用前景.陈玮等[28-29]提出了一种快速驯化污泥利用小分子有机酸合成聚羟基烷酸脂PHA的工艺,同样将PHA合成菌群的驯化与富集在一个反应器中完成.通过逐步减少氮、磷元素和一次性削减50%氮、磷元素对驯化结果进行考察,前者PHA的产率提升速度较慢,但反应器稳定期较长,后者PHA产率提升很快但稳定期较短.研究成果可以起到间接的污泥过程减量作用,同时令高浓度有机废水得到资源回收,实现废物的循环利用.课题的研究表明,试验提出的采用两段式运行, 通过逐步减少营养元素氮、磷的同步富集和驯化细菌合成PHA的途径是可行的.杨雪等[30-31]也采用两段式工艺,初步探索了污泥水解液合成PHA的研究,经20多天的富集后SBR反应器污泥平均PHA含量仅为污泥干质量的40%~50%.
此外,清华大学王慧教授课题组[32]提出采用模拟污泥水解液作为碳源,在不限氮、磷条件下从活性污泥中获取菌群,直接在充盈和饥饿模式进一步积累得到微生物的最大PHA含量.通过控制碳源浓度来实现充盈和饥饿的交替(碳源浓度小于0.25倍初始碳源浓度为判断进入饥饿的标准),每个周期人工保持饥饿时长为3倍的充盈时长,每个周期末通过离心机将泥水分离,去除上清液,再重复向污泥中注入碳源.直到持续3个周期的feast阶段时长、生物量、剩余碳源浓度保持稳定,则完成预处理进行批次试验.此研究提出的不限氮实现微生物PHA积累工艺中,人工控制充盈和饥饿的时长比例而不是整个周期长度,实际使得污泥经历了200 h左右的famine阶段(单周期288 h),“过度饥饿”使微生物在重新获得碳源的同时大量生长与贮存PHA作为备用碳源,从而达到一步获得62.43%的最大PHA含量的菌群.
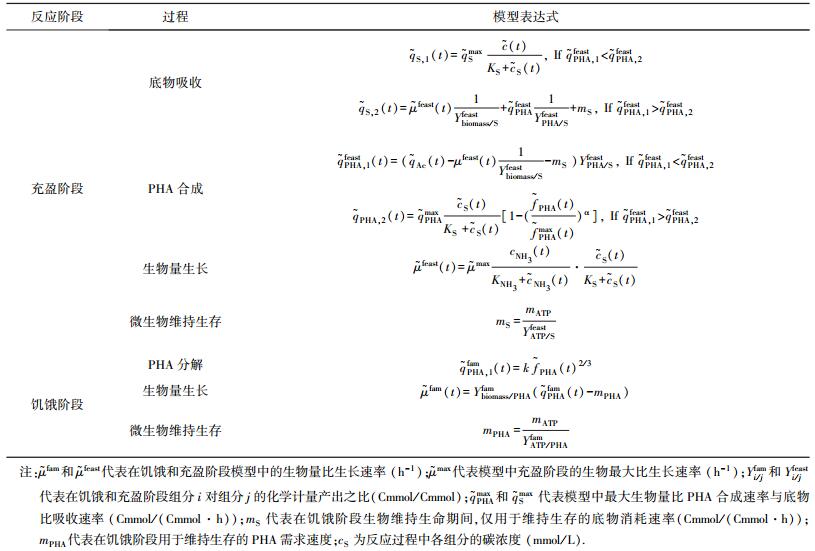
4 数值模型与参数控制在活性污泥富集并合成PHA的过程中,往往需要通过数学模型的手段对微生物微观代谢过程进行定量的认识,以及对反应器运行过程中难以测得的运行参数进行识别和评估,从而实现对混合菌群富集过程的模拟预测,对反应器运行机制进行优化控制.
4.1 代谢模型ASM3(activated sludge model number 3)是近年来用于定量描述活性污泥代谢过程的主要模型之一,以化学需氧量(COD)为计量单位,涉及到活性污泥碳氧化过程和硝化、反硝化过程,不包括生物除磷.其侧重点从ASM1的水解转向为有机物的贮存,因此,也可以用于模拟好氧异养菌吸收底物并存储PHA的过程[33].基于微生物在1个充盈和饥饿交替周期内的新陈代谢模型,最早由Aalst于1997年发表[34],后经不断完善[35-38]已经可以从底物吸收、PHA合成、生物量增殖、PHA降解、细胞呼吸作用、微生物维持生存等几个典型过程定量分析并预测组分随时间变化规律.其中涉及的动力学参数一方面可体现出产PHA混合菌群的基本性质,一方面也是调控优化反应器参数的重要依据.2009年Johnson建立的针对ADF工艺的混合菌群模型[14]见表 1.模型描述了微生物在一个充盈-饥饿周期内的代谢过程:1)微生物吸收碳源,消耗ATP的同时合成乙酰辅酶A、二氧化碳和烟酰胺腺嘌呤二核苷酸(NADH);2)PHB的聚合和维持;3)PHB分解过程;4)细胞的分解代谢作用;5)氧化与磷酸化作用;6)细胞生长与繁殖;以及7)在缺乏底物摄入的情况下,细胞内ATP逐渐减少,处在维持基本生命体征的状态,直到ATP基本耗尽.Reis课题组[39]在2012年针对挥发性脂肪酸的成分和富集阶段的时长对于PHA存贮效率的影响,提出代谢通量分析(metabolic flux analysis)和通量平衡分析(flux balance analysis),模型表明影响微生物菌群代谢机制结果的主要是缩短三羧酸循环的通量,使得PHA合成量最大化.
| 表 1 活性污泥富集与合成PHA过程新陈代谢模型 |
利用人工神经网络技术可以实现对反应器多影响因素耦合作用下,各因素对PHA合成影响的敏感性排名,从而更有利于识别出反应器运行过程中的控制参数[40].利用现代传感器系统在反应器运行过程中进行实时监测与自动控制,可进一步完善对活性污泥富集、合成PHA工艺的优化.Serafim等[8]利用Labview软件,通过溶解氧(DO)在线监测建立SBR智能补料系统.即当反应器内DO迅速上升时对其补料,通过控制补料次数达到控制feast持续时间,保持famine时间稳定的目的,并在富集阶段达到65%最大PHA含量;在底物消耗的过程中,随着有机酸浓度、氨氮浓度降低(细胞不吸收氢离子H+和NH4+),以及在细胞呼吸作用下产生的CO2会有一部分合成碳酸氢盐,均导致反应器运行过程中pH的不稳定.Tsuge等[41]成功地解决了该问题并以pH为指标控制微生物内环境为适合其合成PHA的状态;在已建立的活性污泥合成PHA模型基础上,可进行大量模拟试验,进一步论证复合酸中各成分对合成PHA的影响,以及充盈和饥饿的循环过程中周期、pH、温度等影响参数的敏感性和发展规律,并结合现有的在线监测设备实现反应器的自控与优化.尤其在更加便携的荧光光谱设备发展的条件下[42-43],将会实现污泥生物量和细胞PHA含量的在线监测,使建立PHA富集过程全参数化控制与优化系统成为可能.
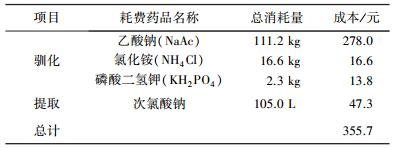
5 工艺整体经济性能分析活性污泥PHA合成工艺的经济性能可以用工艺末端产品的价格来衡量.相较于纯菌PHA合成工艺,关于混合菌群PHA产品价格分析的研究较少,这主要是由于成型的混菌工艺尚未进入规模化运行阶段,难以获得标准的运行参数和条件.陈玮[28]对PHA粗提过程进行了经济性能分析,定义成本即启动驯化合成PHA反应器的药剂费按平均的启动+驯化时间为25 d期间, 人工配水驯化所需消耗的配水药剂的量计算.而提取成本按驯化阶段的药剂费用+提取阶段的试剂费用计算.得到的粗提PHA过程的经济成本见表 2.
| 表 2 提取1 kg PHA粗产品的成本估算 |
Gurieff等[44]利用食品加工废水作为底物,使用典型的三段式工艺合成PHA,通过对过程中各碳源物质的流向分析,核算出混菌工艺产出PHA产品的价格,并与市场上商用的聚乙烯以及纯菌发酵PHA的价格进行了比对(图 4).研究认为,由于在废弃资源利用上带来的成本节约,混菌合成的PHA价格相较于其他两者占优势.
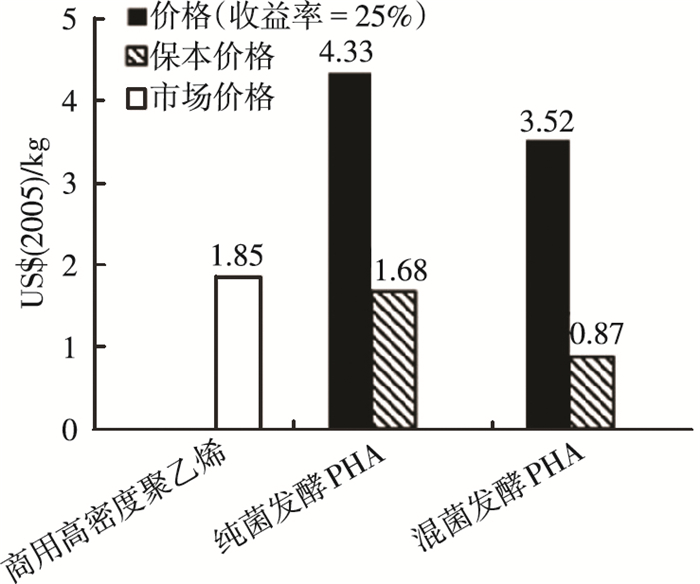
|
图 4 混合菌群PHA产品与纯菌发酵产品以及商用高密度聚乙烯的价格比对 |
PHA合成工艺过程的经济性能分析有3个重要参数,一是PHA产量的最大化,尽可能将底物消耗完全,底物占其合成PHA成本的50%以上.二是单位体积的PHA生产量,决定了PHA合成的效率.三是PHA纯度,即单位细胞中的PHA含量,在PHA回收过程中,需要进行细胞破壁和纯化.PHA含量直接影响后续成本,纯度越低,提取成本越高.
6 结果与展望利用活性污泥生产PHA可实现利用生物可降解材料替代石化塑料从而减轻环境压力,同时实现污泥减量和废物资源化,避免其形成二次污染,具有广阔的应用前景和经济前景.综合文献报道的研究成果可知,如今基本采用好氧反应器充盈与饥饿模式来进行高效的产PHA菌群富集与PHA合成.对反应器的基本调控参数优化,如周期时长、feast持续时间、环境温度、pH、底物种类与浓度、有机负荷等已做了大量工作,这些参数对微生物环境影响的认识基本成熟,利用这些成果已经可以成功富集出PHA最大含量占细胞干质量90%的混合菌群.然而需要一个漫长富集时间依然是很多文献中没有解决的问题,也成为利用活性污泥大规模合成PHA的商业化运营的瓶颈之一.而好氧动态排水(ADD)工艺在原有充盈与饥饿模式的基础上引入物理选择压概念,较好地解决了快速富集的问题.然而针对ADD模式,从运行工艺参数到模型建立机制研究,仍然有很多需要进一步探讨的问题.此外,通过对混合菌群数值模型的建立,日趋完善的反应器自动控制系统也将成为研究的热点.实现高效富集,降低PHA合成工艺运行成本,将围绕废弃碳源资源化和PHA合成工艺的低成本展开.
| [1] |
ALBUQUERQUE M G, MARTINO V, POLLET E, et al. Mixed culture polyhydroxyalkanoate (PHA) production from volatile fatty acid (VFA)-rich streams:effect of substrate composition and feeding regime on PHA productivity, composition and properties[J]. Journal of Biotechnol, 2011, 151(1): 66-76. DOI:10.1016/j.jbiotec.2010.10.070 |
| [2] |
CHEN H, MENG H, NIE Z, et al. Polyhydroxyalkanoate production from fermented volatile fatty acids:effect of pH and feeding regimes[J]. Bioresource Technology, 2013, 128: 533-538. DOI:10.1016/j.biortech.2012.10.121 |
| [3] |
CHUAA S M, TAKABATAKE H, SATOH H, et al. Production of polyhydroxyalkanoates (PHA) by activated sludge treating municipal wastewater:effect of pH, sludge retention time (SRT), and acetate concentration in influent[J]. Water Research, 2003, 37(15): 3602-3611. DOI:10.1016/S0043-1354(03)00252-5 |
| [4] |
陈志强, 李云蓓, 温沁雪. 利用丁酸合成PHA高效菌株的筛选及摇瓶发酵特性研究[J]. 环境科学, 2010, 31(3): 828-832. |
| [5] |
CHEN Z, LI Y, WEN Q, et al. , Biosynthesis of polyhydroxyalkanoate by Gamma proteobacterium WD-3 from volatile fatty acids[J]. Chemosphere, 2011, 82(8): 1209-1213. DOI:10.1016/j.chemosphere.2010.11.030 |
| [6] |
JIANG Y, MARANG L, KLEEREBEZEM R, et al. Polyhydroxybutyrate production from lactate using a mixed microbial culture[J]. Biotechnology and Bioengineering, 2011, 108(9): 2022-2035. DOI:10.1002/bit.v108.9 |
| [7] |
CHUA H, YU P, HO L. Coupling of waste water treatment with storage polymer production[J]. Applied Biochemistry and Biotechnology, 1997, 63(1): 627-635. |
| [8] |
SERAFIM L S, LEMOS P C, OLIVEIRA R, et al. Optimization of polyhydroxybutyrate production by mixed cultures submitted to aerobic dynamic feeding conditions[J]. Biotechnology and Bioengineering, 2004, 87(2): 145-160. DOI:10.1002/(ISSN)1097-0290 |
| [9] |
TAKABATAKE H, SATOH H, MINO T, et al. PHA (polyhydroxyalkanoate) production potential of activated sludge treating wastewater[J]. Water Science & Technology, 2002, 45(12): 119-126. |
| [10] |
SATOH H, IWAMOTO Y, MINO T, et al. Activated sludge as a possible source of biodegradable plastic[J]. Water Science and Technology, 1998, 38(2): 103-109. DOI:10.2166/wst.1998.0115 |
| [11] |
郑裕东, 钟青华. 厌氧-好氧驯化活性污泥生物合成PHA的研究[J]. 环境科学研究, 2001, 14(2): 41-44. |
| [12] |
MAJONE M, MASSANISSO P, CARUCCI A, et al. Influence of storage on kinetic selection to control aerobic filamentous bulking[J]. Water Science and Technology, 1996, 34(5/6): 223-232. |
| [13] |
陈玮, 陈志强, 温沁雪, 等. SBR启动方式对活性污泥合成PHA的影响[J]. 中国给水排水, 2012, 15: 85-88. |
| [14] |
JOHNSON K, JIANG Y, KLEEREBEZEM R, et al. Enrichment of a mixed bacterial culture with a high polyhydroxyalkanoate storage capacity[J]. Biomacromolecules, 2009, 10(4): 670-676. DOI:10.1021/bm8013796 |
| [15] |
陈志强, 邓毅, 黄龙, 等. 进水底物浓度对蔗糖废水产酸合成PHA影响研究[J]. 环境科学, 2013, 34(6): 2295-2301. |
| [16] |
陈玮, 陈志强, 温沁雪, 等. COD浓度对活性污泥合成聚羟基烷酸酯的影响[J]. 中国给水排水, 2010, 21: 148-151. |
| [17] |
JOHNSON K, KLEEREBEZEM R, LOOSDRECHT VAN M C. Influence of the C/N ratio on the performance of polyhydroxybutyrate (PHB) producing sequencing batch reactors at short SRTs[J]. Water Research, 2010, 44(7): 2141-2152. DOI:10.1016/j.watres.2009.12.031 |
| [18] |
CAI M, CHUA H, ZHAO Q, et al. Optimal production of polyhydroxyalkanoates (PHA) in activated sludge fed by volatile fatty acids (VFAs) generated from alkaline excess sludge fermentation[J]. Bioresource Technology, 2009, 100(3): 1399-1405. DOI:10.1016/j.biortech.2008.09.014 |
| [19] |
DIONISI D, MAJONE M, VALLINI G, et al. Effect of the length of the cycle on biodegradable polymer production and microbial community selection in a sequencing batch reactor[J]. Biotechnology Progress, 2007, 23(5): 1064-1073. |
| [20] |
DIONISI D, MAJONE M, VALLINI G, et al. Effect of the applied organic load rate on biodegradable polymer production by mixed microbial cultures in a sequencing batch reactor[J]. Biotechnology Bioengineering, 2006, 93(1): 76-88. DOI:10.1002/(ISSN)1097-0290 |
| [21] |
TAMIS J, LUŽKOVK, JIANG Y, et al. Enrichment of plasticicumulans acidivorans at pilot-scale for PHA production on industrial wastewater[J]. Journal of Biotechnology, 2014, 192: 161-169. DOI:10.1016/j.jbiotec.2014.10.022 |
| [22] |
WEN Q, CHEN Z, WANG C, et al. Bulking sludge for PHA production:energy saving and comparative storage capacity with well-settled sludge[J]. Journal of Environmental Sciences, 2012, 24: 1744-1752. DOI:10.1016/S1001-0742(11)61005-X |
| [23] |
MCCARTY R B. Environmental biotechnology[M]. New York: Mc Graw Hill, 2001.
|
| [24] |
CHEN Z, GUO Z, WEN Q, et al. A new method for polyhydroxyalkanoate (PHA) accumulating bacteria selection under physical selective pressure[J]. International Journal of Biological Macromolecules, 2015, 72: 1329-1334. DOI:10.1016/j.ijbiomac.2014.10.027 |
| [25] |
KATIRCIOǦLU H, ASLM B, YÜKSEKD-ADZ N, et al. Production of poly-β-hydroxybutyrate (PHB) and differentiation of putative Bacillus mutant strains by SDS-PAGE of total cell protein[J]. African Journal of Biotechnology, 2003, 6: 147-149. |
| [26] |
CHEN Z, HUANG L, WEN Q, et al. Efficient polyhydroxyalkanoate (PHA) accumulation by a new continuous feeding mode in three-stage mixed microbial culture (MMC) PHA production process[J]. Journal of Biotechnology, 2015, 209: 68-75. DOI:10.1016/j.jbiotec.2015.06.382 |
| [27] |
RHU D H, LEE W H, KIM J Y, et al. Polyhydroxyalkanoate (PHA) production from waste[J]. Water Science & Technology, 2003, 48(8): 221-228. |
| [28] |
陈玮. 利用活性污泥混合菌群合成聚羟基烷酸脂的研究[D]. 哈尔滨: 哈尔滨工业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10213-2011013003.htm
|
| [29] |
WEN Q, CHEN Z Q, TIAN T, et al. Effects of phosphorus and nitrogen limitation on PHA production in activated sludge[J]. Journal of Environmental Sciences, 2010, 22(10): 1602-1607. DOI:10.1016/S1001-0742(09)60295-3 |
| [30] |
YANG X, DU M, LEE D, et al. Enriching polyhydroxyalkanoates (PHA) producing microorganisms by complex organics from quickly alkaline fermentation liquor[J]. Journal of the Taiwan Institute of Chemical Engineers, 2012, 43(6): 953-957. DOI:10.1016/j.jtice.2012.06.004 |
| [31] |
YANG X, DU M, LEE D, et al. Enhanced production of volatile fatty acids (VFAs) from sewage sludge by b-cyclodextrin[J]. Bioresource Technology, 2012, 110: 688-691. DOI:10.1016/j.biortech.2011.08.122 |
| [32] |
JIA Q, WANG H, WANG X. Dynamic synthesis of polyhydroxyalkanoates by bacterial consortium from simulated excess sludge fermentation liquid[J]. Bioresource Technology, 2013, 140: 328-336. DOI:10.1016/j.biortech.2013.04.105 |
| [33] |
ZHOU M, GONG J, YANG C, et al. Simulation of the performance of aerobic granular sludge SBR using modified ASM3 model[J]. Bioresource Technology, 2013, 127: 473-481. DOI:10.1016/j.biortech.2012.09.076 |
| [34] |
AALST VAN M A, POT M A, LOOSDRECHT M V, et al. Kinetic modeling of poly (-hydroxybutyrate) production and consumption by paracoccus pantotrophus under dynamic substrate supply[J]. Biotechnology and Bioengineering, 1997, 55: 773-782. DOI:10.1002/(ISSN)1097-0290 |
| [35] |
BEUN J J, VERHOEF E V, LOOSDRECHT VAN M, et al. Stoichiometry and kinetics of poly-beta-hydroxybutyrate metabolism in aerobic, slow growing, activated sludge cultures[J]. Biotechnology Bioengineering, 2000, 67(4): 379-389. DOI:10.1002/(ISSN)1097-0290 |
| [36] |
KATJA J, KLEEREBEZEM R, LOOSDRECHT M V. Model-based data evaluation of polyhydroxybutyrate producing mixed microbial cultures in aerobic sequencing batch and fed-batch reactors[J]. Biotechnology Bioengineering, 2009, 104(1): 50-67. DOI:10.1002/bit.v104:1 |
| [37] |
TAMIS J, MARANG L, JIANG Y, et al. Modeling PHA-producing microbial enrichment cultures-towards a generalized model with predictive power[J]. New Biotechnology, 2014, 31(4): 324-334. DOI:10.1016/j.nbt.2013.11.007 |
| [38] |
FILIPA P. Dynamic metabolic modelling of volatile fatty acids conversion to polyhydroxyalkanoates by a mixed microbial culture[J]. New Biotechnology, 2014, 31(4): 335-344. DOI:10.1016/j.nbt.2013.06.008 |
| [39] |
PARDELHA F, ALBUQUERQUE M G E, REIS M A M, et al. Flux balance analysis of mixed microbial cultures:application to the production of polyhydroxyalkanoates from complex mixtures of volatile fatty acids[J]. Journal of Biotechnology, 2012, 162(2/3): 336-345. |
| [40] |
陈志强, 郭子瑞, 窦克忠, 等. 基于BP神经网络的污泥水解液合成PHA的多参数敏感性分析[J]. 环境科学学报, 2013, 12: 3244-3250. |
| [41] |
TSUGE T, TANAKA K, ISHIZAKI A. Development of a novel method for feeding a mixture of L-lactic acid and acetic acid in fed-batch culture of Ralstonia eutropha for poly-D-3-hydroxybutyrate production[J]. Journal of Bioscience and Bioengineering, 2001, 91(6): 545-550. DOI:10.1016/S1389-1723(01)80171-7 |
| [42] |
TAKAHASHI M B, LEME J, CARICATI C P, et al. Artificial neural network associated to UV/Vis spectroscopy for monitoring bioreactions in biopharmaceutical processes[J]. Bioprocess and Biosystems Engineering, 2015(1): 1-10. |
| [43] |
CALVET A, LI B, RYDER A G. A rapid fluorescence based method for the quantitative analysis of cell culture media photo-degradation[J]. Analyticachimicaacta, 2014, 807: 111-119. |
| [44] |
GURIEFF N, LANT P. Comparative life cycle assessment and financial analysis of mixed culture polyhydroxyalkanoate production[J]. Bioresource Technology, 2007, 98(17): 3393-3403. DOI:10.1016/j.biortech.2006.10.046 |
 2016, Vol. 48
2016, Vol. 48