2. 斯坦福大学 市政环境工程系, Stanford, CA 94305-4020, USA;
3. 中国海洋大学 环境科学与工程学院, 266100 山东 青岛
2. Department of Civil and Environmental Engineering, Stanford University, Stanford, CA 94305-4020, USA;
3. College of Environmental Science and Engineering, Ocean University of China, 266100 Qingdao, Shandong, China
微生物燃料电池(microbial fuel cell,MFC)是一种通过微生物的催化作用,将储存在有机物中的化学能转变成电能的工艺模式[1].近年来,MFC作为一种新的废水处理和能源回收工艺形式,受到广泛关注.深入探讨和分析影响MFC产电效能的各种环境因素,是进一步提升MFC普适性与工艺放大的重要步骤.探讨某些影响因素作用下的MFC产电效能时,以往采用单个的MFC研究污染物的降解和MFC产电,很少有报道设置多个平行的MFC反应器进行统计学的系统研究[2-4].由于MFC启动和运行存在较大的不确定性或潜在的操作失误,应用单个MFC反应器启动获得的数据其重复性和可靠性受到质疑[5].
MFC中有机物降解和产电过程是由微生物主导实现,MFC阳极生物膜中富集的产电微生物群落具有极高的多样性,广泛分布于变形细菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)以及酸杆菌门(Acidobacteria)[6-7].绝大多数产电微生物对系统的操作条件极为敏感,外部环境条件的微小改变往往引起微生物群落结构、组成和丰度的极大变化[8].这种变化会进一步影响MFC运行效率.微生物群落图谱是研究MFC过程中需要考虑的重要指征[1],探讨不同环境因素对MFC微生物群落图谱影响时,单个反应器中给出的微生物群落特征可能缺乏普遍性,根据单个MFC微生物群落的响应过程可能做出错误的判断.为此,有必要研究平行操作的MFC之间微生物群落的差异性,探讨可能对MFC产生的影响.本研究采用3个平行启动和运行的MFC反应器,应用高通量测序技术对接种污泥和阳极生物膜中微生物样品进行测序分析,对微生物群落的组成、丰度及多样性进行研究,并探讨其差异性与反应器效能的对应关系,为MFC的选择和操作提供微生物学依据.
1 实验 1.1 实验装置采用3个结构完全一致的单室空气阴极MFC,MFC主体为有机玻璃,内部为圆柱体形结构,直径3 cm,高4 cm,有效容积28 mL.圆柱体一侧为碳刷阳极,碳刷以钛丝缠绕碳纤维丝制成,直径2.5 cm,长3 cm;圆柱体另一侧为经过防水预处理的碳布空气阴极,预处理过程按照Cheng等[9]的方法进行.有机玻璃接缝、阳极碳刷、导线等穿孔处均用环氧树脂密封,以防止溶液渗漏,并保持极室的缺氧状态.阳极、阴极通过钛丝导出,外接1 000 Ω电阻,电阻两端接电压在线监测装置.
1.2 MFC的启动与运行3个MFC反应器分别记为Mfc-1、2、3,采用批式培养方式平行启动与运行.接种污泥取自青岛市李村河污水处理厂的好氧曝气池.人工配制的模拟废水中,乳酸钠500 mg/L(以COD计),并添加营养盐及微量元素,包括(L):0.31 g NH4Cl,0.13 g KCl,2 mL微量元素,100 mL 50 mmol/L磷酸盐缓冲液(pH7.4),0.2 mL维生素溶液,0.2 mL氨基酸溶液[10].
取10 mL污泥置于MFC反应器中,加满乳酸模拟废水,开始在线记录产电数据.每48 h换水一次,直至反应器电压输出升高并稳定.MFC反应器启动成功后,在运行过程中当输出电压低于10 mV时即更换阳极溶液,两次更换模拟废水之间的运行过程,计为一个周期.实验过程中,对阳极溶液及MFC极室未采取除氧处理,实验装置于25 ℃条件下运行.
1.3 化学及电化学监测分析COD应用重铬酸钾法[11]进行测定.输出电压(U)用数据采集卡(PISO-813型,泓格公司,台湾)在线纪录;电路中的电流、功率密度、极化曲线、库伦效率等MFC的表征电化学参数均按文献[10]计算.
1.4 微生物群落高通量测序分析分别对接种污泥和稳定运行的MFC阳极生物膜进行采样,用土壤DNA提取试剂盒(Mobio公司,美国)提取总DNA.参考文献[12]方法,以微生物总DNA为模板,对细菌16S rDNA V4区进行高通量测序,委托北京诺禾公司采用基于Illumina公司Miseq平台进行.测得的序列通过筛选后,以相似性97%为标准获得操作分类单元(OTU),OTU数据用RDP数据库(http://rdp.cme.msu.edu/)中的Classifer程序进行分类;按文献[12]方法,对微生物群落的多样性(包括Shannon指数、稀释曲线)、种类组成和相对丰度、群落在属水平的主成分进行分析.将获得的16S rDNA高通量测序序列提交至MG-RAST公共数据库,登录号分别为4565698.3(种泥);4614367.3(Mfc-1);4614364.3(Mfc-2);4614370.3(Mfc-3).
2 结果与讨论 2.1 MFC的启动与运行以乳酸为底物启动的3个MFC,电压随时间变化如图 1所示.虽然3个反应器的构造、启动条件均完全一致,启动成功的时间、达到的最高电压和最大功率密度却不同.

|
图 1 3个平行运行MFC启动及运行过程中电压变化 |
Mfc-1和Mfc-3反应器启动成功所需要时间大约为300 h,最高电压分别为240和220 mV;Mfc-2电压一直较低,最高仅为120 mV.在第400小时左右,3个MFC的最高功率密度分别为2.33、1.19和1.85 W/m3,对应的内阻分别为16、19和21 Ω.实验中,为了保证反应器的平行运行,反应器构型完全一致,反应器的接种、启动和运行控制条件也完全相同.即使这样,MFC的启动和运行仍然存在较大差异,尤其是本研究的Mfc-2.这种差异可能是MFC阳极、阴极结构上的微小差异,MFC运行过程中系统的气密性,以及一些实际存在但尚未注意的影响因子的不同造成的[13].此外,接种物活性污泥是混合菌群,细菌的分布存在非均相性,因而细菌的挂膜速度和效率以及膜成分均会受影响.Logan[5]指出,探索不同影响因素对MFC影响的实验时,需至少2组以上MFC的平行运行,并摒除明显存在运行意外的MFC实验组,以降低不确定环境因素的干扰.有研究者通过对同一条件下8组MFC反应器研究后甚至认为,为保证数据准确性和可信度需要至少4组MFC的平行运行[14],因为即使应用同一种接种物在同一个反应器中,其产电效率亦存在很大变数[15].本研究结果即证实了这一点,Mfc-2电压及功率密度一直处于较低水平,与其他两个MFC差异很大,其运行数据仅可作为参考.
MFC在单一周期内COD的去除率具有相似的趋势(图未给出).在最初的10 h内,Mfc-1对COD的去除率为78.6%,Mfc-2为65.6%,Mfc-3为73.6%.运行24 h后,阳极室内COD降至100 mg/L左右时,Mfc-2去除率提升最快,达85.6%;Mfc-1、Mfc-3仅为80.6%、75.6%.3个反应器的库仑效率均为9%左右,远低于同样以乳酸为底物的双室MFC反应器,也低于以乙酸为底物的MFC[10].由于乳酸并非发酵的末端产物,这一较低的库仑效率说明在MFC产电过程中,可能存在大量的发酵微生物、氧化物质如氧气,进而消耗了大量有机物氧化过程中产生的电子[16-17].因此,在MFC反应器运行过程中,需要保证较好的气密性,并协调产电微生物与其他辅助微生物的代谢关系.
可见,对于控制条件完全一致的平行MFC反应器,其启动时间、最大电压和功率密度却存在较大不同.在探讨某些影响因子对MFC的作用时,为保证数据的可信度,需要至少平行运行2个以上MFC反应器.
2.2 MFC阳极微生物群落多样性及组成微生物群落多样性分析发现,接种物活性污泥中微生物群落的多样性最高,Shanno多样性指数为8.7左右,包含的微生物种类达2 000种以上.种泥在MFC内经过底物选择、驯化后,微生物种群数量和多样性明显下降,一些无法参与乳酸代谢的微生物逐渐被淘汰.Mfc-2多样性指数为7.1,含有约800种微生物;Mfc-1和Mfc-3多样性更低.经过驯化后Mfc-2的多样性仍然较高,表明可能含有大量的乳酸发酵甚至乳酸降解非产电微生物存在,进而导致其产电效率的下降.一般而言,运行效率较高的MFC其微生物群落多样性往往较低[15, 18].
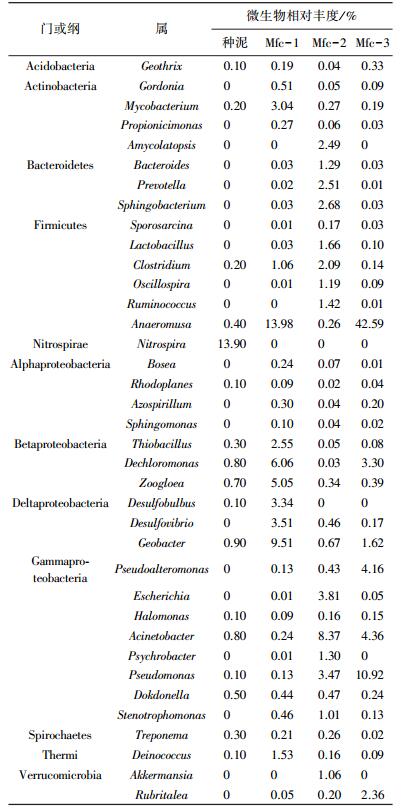
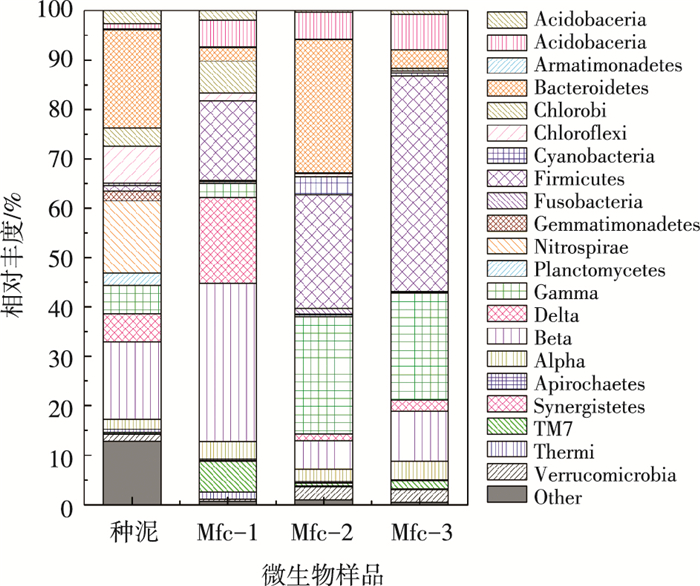
污泥中微生物群落的组成和丰度与乳酸底物富集后的群落存在显著差异,结果见图 2.在接种活性污泥中,丰度高于5%的优势类群依次为拟杆菌门(Bacteroidetes)(19.90%)、β变形细菌纲(Betaproteobacteria)(15.70%)、硝化螺菌门(Nitrospirae)(14.60%)、绿弯菌门(Chloroflexi)(7.50%)、δ变形细菌纲(Deltaproteobacteria) (5.80%)以及γ变形细菌纲(Gammaproteobacteria)(5.70%).然而,用乳酸富集后的优势类群明显不同.Mfc-1中β变形细菌纲丰度高达32.0%;样品Mfc-3中厚壁菌门(Firmicutes)的丰度更是高达43.6%;只有样品Mfc-2中优势菌群仍与种泥一致,均为拟杆菌门,其丰度为26.9%.
|
图 2 应用高通量测序技术分析微生物群落的组成及丰度 |
大量研究表明,产电微生物广泛分布在β变形细菌纲,厚壁菌门中,而在拟杆菌门较少发现[6-7],拟杆菌门微生物主要是人体肠道内的发酵细菌[19].这表明在Mfc-2中,乳酸底物并未完成对微生物群落的选择过程,最优势菌群仍然同种泥一致,这可能是导致该反应器一直处于较低产电水平的原因之一.
在接种污泥中,微生物群落的分布比较分散,在门或纲水平包含更多的类群.而经过乳酸底物驯化、筛选后,某些微生物类群的丰度进一步提高,进而更好地代谢利用乳酸底物,适应MFC反应器的环境.
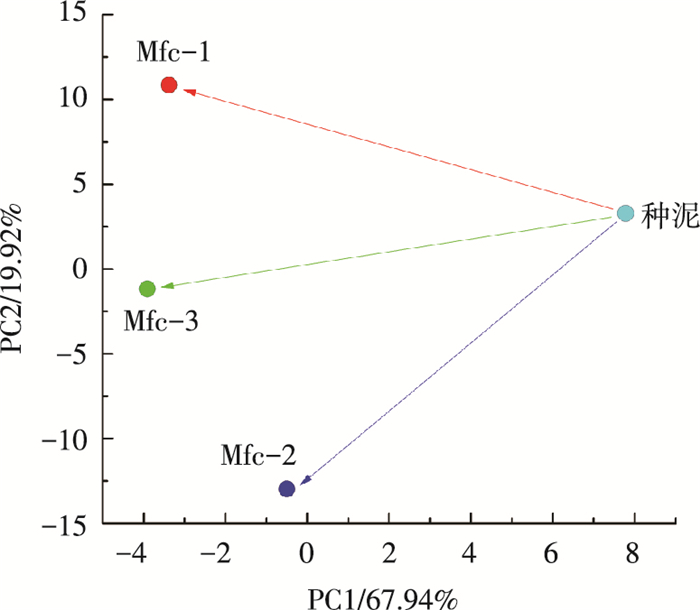
2.3 MFC阳极微生物群落差异在微生物种属水平探讨微生物群落的组成、丰度及差异,有助于理解某些特殊类群在MFC中的作用和功能.因此,在微生物属级水平,对MFC阳极生物膜微生物的差异进行主成分分析,结果如图 3.样品Mfc-1、Mfc-2和Mfc-3均背离初始种泥群落组成,并沿着坐标轴PC1的方向向左发展,表现出很大的分离距离;而3个平行运行的MFC微生物群落间,其差异主要沿着PC2的方向,在PC1的方向差异较小.这表明由乳酸富集的阳极生物膜微生物群落间的差异,同它们与种泥之间的差异不同.Mfc-1、2、3在PC1的方向具有很大相似性,表明这些生物膜内包含大量一致的类群;而沿着PC2的方向具有很大分离,表明确实包含许多比较独特的菌属.
|
图 3 各样品高通量测序数据的主成分分析 |
在微生物属级水平上,比较各样品中微生物群落的组成和丰度,结果见表 1.在接种污泥中,能够鉴定到属的微生物较少,最优势的微生物属是Nitrospira,其丰度达13.90%.同样以乳酸为底物富集的MFC阳极微生物群落,其组成和丰度存在明显差异,其中Mfc-1和Mfc-3微生物种属更为相似.在样品Mfc-1中,丰度为5%以上的优势菌属依次为Anaeromusa(13.89%)、Geobacter(9.51%)、Dechloromonas(6.06%)、Zoogloea(5.05%);在Mfc-3中,优势菌属依次为Anaeromusa(42.59%)、Pseudomonas(10.92%);与之相比,Acinetobacter (8.37%)是样品Mfc-2中的优势属,该样品中种属分布更加分散多样.
| 表 1 以乳酸为底物启动MFC阳极微生物群落在属级水平的差异 |
在好氧活性污泥中,Nitrospira的丰度达13.90%.在微生物氮循环中,硝化作用是关键的中心过程,在此过程中,NH4+依次被氧化成NO2-及NO3-,氨的氧化和亚硝酸盐的氧化是由系统发育学上两类不同的微生物催化完成的,即氨氧化菌和亚硝酸盐氧化菌.Nitrospira即为典型的氨氧化微生物[20],在好氧活性污泥中,高丰度的Nitrospira属微生物为李村河污水处理厂曝气池中良好的氨氧化过程提供了微生物佐证.
由表 1可知,Mfc-1和Mfc-3中具有相同的高丰度微生物种属,如Anaeromusa、Dechloromonas、Geobacter;Mfc-2则拥有较特殊的高丰度种属,如Acinetobacter、拟杆菌门中的种属.从微生物学角度而言,MFC反应器间这些种属的差异是决定MFC产电效率的关键因素.
在MFC阳极微生物群落中Anaeromusa属的微生物被乳酸富集,在Mfc-1和Mfc-3中,其丰度分别达13.98%和42.59%.该属微生物的高度富集表明其在乳酸的降解和MFC产电过程中发挥重要作用.该菌属最初认为是能够利用氨基酸的类群,后来Borole等[18]首次富集得到了具有很高产电能力的阳极微生物群落,其中Anaeromusa属微生物的丰度高达41%,从而证实该类微生物能够参与MFC的产电过程,本研究得到相似的结果.
Dechloromonas属中的有些菌种是重要的反硝化聚磷菌,能够在厌氧条件下完全降解芳香烃化合物产生二氧化碳,或者当硝酸盐存在时,利用硝酸盐为电子受体,实现反硝化过程[21].这类微生物在一些MFC阳极微生物群落中经常被检测到,而且一般丰度都很高[22].在Mfc-1和Mfc-3中,其丰度达6.06%和3.30%.
δ变形细菌纲中Geobacter属的微生物是典型的产电微生物[23],在氧化有机化合物的同时,能够利用产生的电子还原Fe(Ⅲ).这类微生物在厌氧微生物食物链中占有重要位置.在样品Mfc-1和Mfc-3中,Geobacter的丰度从种泥中的0.90%分别上升至9.51%和1.62%,而Mfc-2中仅为0.67%.由于MFC的功率密度与Geobacter属微生物的数量和丰度成正比[24],这类微生物的高丰度意味着MFC反应器有高的功率密度.3个MFC的产电性能与其产电微生物丰度一致,其中Geobacter丰度最高的Mfc-1产电性能最好.
Mfc-2中高丰度的Acinetobacter种属,是一类严格好氧、不能进行发酵的革兰氏阴性球状或杆状菌,能够引起人类感染的病源微生物,能够以乙酸、乳酸、丙酮酸为唯一碳源生长[25].是一类与产电微生物营养生态位相似但与产电不相关的类群.其大量富集除了有适合的碳源外,存在高浓度的溶解氧也是重要因素.这说明该MFC的密闭性较差,有空气进入导致该类群的大量繁殖.可见,在MFC的结构设计或运行方式上存在表面上观察不到的缺陷.
由此可见,用相似底物富集的MFC阳极微生物群落,由于反应器设计或操作原因可能出现显著差异.产电较差的Mfc-2与产电较好的Mfc-1/Mfc-3,其差异主要源于反应器的密闭性不同而导致的功能微生物类群的差异.Mfc-1/Mfc-3中富集了高丰度的有利于产电的微生物类群,而Mfc-2中富集了与产电相关性不大的微生物种属.
3 结论1) 表面上控制条件完全一致的平行MFC反应器,由于潜在的操作差异,其启动时间、最大电压和功率密度可能存在较大不同.应用MFC探讨其产电效能与影响因子关系时,需要运行2个以上平行MFC反应器,以提高数据可靠性.
2) 在接种污泥中,微生物群落的分布比较分散,在门或纲水平包含更多的类群.底物驯化、筛选后,微生物在某些类群中丰度进一步提高,从而更好地代谢利用底物.
3) 相似底物富集的MFC阳极微生物群落差异显著,产电性能较好的Mfc-1/Mfc-3中富集了高丰度的有利于产电的微生物,而产电较差的Mfc-2中富集了高丰度的非产电微生物.
| [1] |
LOGAN B E. Exoelectrogenic bacteria that power microbial fuel cells[J]. Nature Reviews Microbiology, 2009, 7(5): 375-381. DOI:10.1038/nrmicro2113 |
| [2] |
BOND D R, HOLMES D E, TENDER L M, et al. Electrode-reducing microorganisms that harvest energy from marine sediments[J]. Science, 2002, 295(5554): 483-485. DOI:10.1126/science.1066771 |
| [3] |
LIU R, GAO C, ZHAO Y G, et al. Biological treatment of steroidal drug industrial effluent and electricity generation in the microbial fuel cells[J]. Bioresource Technology, 2012, 123: 86-91. DOI:10.1016/j.biortech.2012.07.094 |
| [4] |
尹亚琳, 高崇洋, 赵阳国, 等. 好氧-厌氧混合污泥启动微生物燃料电池产电性能及微生物群落动态特征[J]. 微生物学报, 2014, 54(12): 1471-1480. |
| [5] |
LOGAN B E. Essential data and techniques for conducting microbial fuel cell and other types of bioelectrochemical system experiments[J]. Chem Sus Chem, 2012, 5(6): 988-994. DOI:10.1002/cssc.v5.6 |
| [6] |
LOGAN B E, REGAN J M. Electricity-producing bacterial communities in microbial fuel cells[J]. Trends Microbiol, 2006, 14(12): 512-518. DOI:10.1016/j.tim.2006.10.003 |
| [7] |
谢作甫, 郑平, 张吉强, 等. 产电微生物及其生理生化特性[J]. 科技通报, 2013, 29(3): 32-39. |
| [8] |
ZHOU G, YOKOYAMA N, YOSHINO Y, et al. Comparative study on the performance of microbial fuel cells and bacterial community at different temperatures[J]. Journal of Water and Environment Technology, 2013, 11(2): 71-79. DOI:10.2965/jwet.2013.71 |
| [9] |
CHENG S, LIU H, LOGAN B E. Increased performance of single-chamber microbial fuel cells using an improved cathode structure[J]. Electrochemistry Communications, 2006, 8(3): 489-494. DOI:10.1016/j.elecom.2006.01.010 |
| [10] |
刘茹, 赵阳国, 卢珊珊, 等. 微生物燃料电池利用乳酸产电性能与微生物群落分布特征[J]. 微生物学报, 2012, 52(6): 744-752. |
| [11] |
复盛. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 2002.
|
| [12] |
FREGUIA S, TEH E H, BOON N, et al. Microbial fuel cells operating on mixed fatty acids[J]. Bioresource Technology, 2010, 101(4): 1233-1238. DOI:10.1016/j.biortech.2009.09.054 |
| [13] |
SUN G, THYGESEN A, ALE M T, et al. The significance of the initiation process parameters and reactor design for maximizing the efficiency of microbial fuel cells[J]. Applied Microbiology and Biotechnology, 2014, 98(6): 2415-2427. DOI:10.1007/s00253-013-5486-5 |
| [14] |
LARROSA A, LOZANO L, KATURI K, et al. On the repeatability and reproducibility of experimental two-chambered microbial fuel cells[J]. Fuel, 2009, 88(10): 1852-1857. DOI:10.1016/j.fuel.2009.04.026 |
| [15] |
YATES M D, KIELY P D, CALL D F, et al. Convergent development of anodic bacterial communities in microbial fuel cells[J]. The ISME Journal, 2012, 6(11): 2002-2013. DOI:10.1038/ismej.2012.42 |
| [16] |
FAN Y, HU H, LIU H. Enhanced coulombic efficiency and power density of air-cathode microbial fuel cells with an improved cell configuration[J]. Journal of Power Sources, 2007, 171(2): 348-354. DOI:10.1016/j.jpowsour.2007.06.220 |
| [17] |
RINGEISEN B R, RAY R, LITTLE B. A miniature microbial fuel cell operating with an aerobic anode chamber[J]. Journal of Power Sources, 2007, 165(2): 591-597. DOI:10.1016/j.jpowsour.2006.10.026 |
| [18] |
BOROLE A P, HAMILTON C Y, VISHNIVETSKAYA T A, et al. Integrating engineering design improvements with exoelectrogen enrichment process to increase power output from microbial fuel cells[J]. Journal of Power Sources, 2009, 191(2): 520-527. DOI:10.1016/j.jpowsour.2009.02.006 |
| [19] |
KARLSSON F H, USSERY D W, NIELSEN J, et al. A closer look at bacteroides:phylogenetic relationship and genomic implications of a life in the human gut[J]. Microbial Ecology, 2011, 61(3): 473-485. DOI:10.1007/s00248-010-9796-1 |
| [20] |
SCHWIEGER F, TEBBE C C. A new approach to utilize PCR-single-strand-conformation polymorphism for 16S rRNA gene-based microbial community analysis[J]. Applied and Environmental Microbiology, 1998, 64(12): 4870-4876. |
| [21] |
CAROSIA M F, OKADA D Y, SAKAMOTO I K, et al. Microbial characterization and degradation of linear alkylbenzene sulfonate in an anaerobic reactor treating wastewater containing soap powder[J]. Bioresource Technology, 2014, 167: 316-323. DOI:10.1016/j.biortech.2014.06.002 |
| [22] |
KIM J R, JUNG S H, REGAN J M, et al. Electricity generation and microbial community analysis of alcohol powered microbial fuel cells[J]. Bioresource Technology, 2007, 98(13): 2568-2577. DOI:10.1016/j.biortech.2006.09.036 |
| [23] |
LOVLEY D R, UEKI T, ZHANG T, et al. Geobacter:the microbe electric's physiology, ecology, and practical applications[J]. Advances in Microbial Physiology, 2011, 59: 1-100. DOI:10.1016/B978-0-12-387661-4.00004-5 |
| [24] |
SUN Y, WEI J, LIANG P, et al. Electricity generation and microbial community changes in microbial fuel cells packed with different anodic materials[J]. Bioresource Technology, 2011, 102(23): 10886-10891. DOI:10.1016/j.biortech.2011.09.038 |
| [25] |
VISCA P, SEIFERT H, TOWNER K J. Acinetobacter infection-an emerging threat to human health[J]. IUBMB Life, 2011, 63(12): 1048-1054. DOI:10.1002/iub.v63.12 |
 2016, Vol. 48
2016, Vol. 48