2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学), 150090 哈尔滨;
3. 哈尔滨工业大学 市政环境工程学院, 150090 哈尔滨
2. State Key Laboratory of Urban Water Resource and Environment(Harbin Institute of Technology), 150090 Harbin, China;
3. School of Municipal and Environmental Engineering, Harbin Institute of Technology, 150090 Harbin, China
内分泌干扰物(endocrine disrupting chemicals,EDCs)在水环境中的频繁检出引起了人们对水生生态环境和人类健康的担忧[1].研究表明,痕量的EDCs就能够改变野生动物的内分泌功能[2-3].城市污水处理厂出水是水环境中EDCs的主要来源,污水中大部分的EDCs通过生物氧化和吸附可以被去除,但是仍然有一定数量的EDCs随出水排入到水环境中[4-5].因此,如何处理和控制EDCs正成为国内外研究的热点之一[6-9].各种化学氧化技术,如臭氧(O3)、液氯(HOCl)、二氧化氯(ClO2)、高铁酸盐(K2FeO4)被应用于水处理过程中EDCs的氧化处理,并得到很好的去除效果[10-15].Lee等[16]利用这些氧化剂氧化降解类固醇雌激素17α-乙炔基雌二醇(EE2),氧化后雌激素活性明显降低,且二级反应动力学常数受pH影响较大.然而,对于常见氧化剂高锰酸钾(KMnO4)与EDCs氧化反应动力学的研究少之又少[17],不像液氯和臭氧氧化时会形成氯代和溴代副产物.在过去的二十几年中,KMnO4由于其性质稳定,运输、贮存、操作方便,广泛用于去除和控制溶解性Mn(Ⅱ)、嗅味物质、藻毒素等[18-20].KMnO4通过加成、电子交换、氧转移反应可以高效地氧化降解一些含有不饱和官能团的EDCs[21].
本文以雌酮(estrone,简称E1)作为目标物,研究KMnO4氧化降解的反应动力学,并与其他常用水处理氧化剂(臭氧、液氯)进行对比,考察实际水体中的去除效能,利用液相-质谱联用仪(LC-MS/MS)对KMnO4氧化降解雌酮的产物进行分析测定,推测其反应机理.
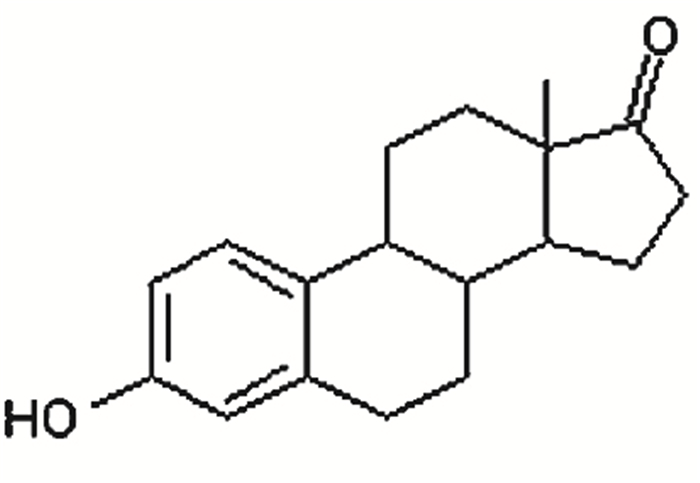
1 实验 1.1 化学试剂雌酮(E1)为分析纯,购于Sigma公司,其结构式见图 1.甲醇(Methanol)和乙腈(Acetonitril)为色谱醇,购于Merck公司,甲酸(Formic acid)为色谱纯,购于Sigma公司.实验所用其他试剂均为分析纯,购于国药集团上海化学试剂有限公司.所用试剂由Milli-Q(Millipore, 18.2 MΩ·cm)超纯水配制.
|
图 1 雌酮(E1)分子结构式 |
实验在25 ℃水浴条件下,含50 mL不同pH缓冲溶液(pH=5、6采用10 mmol·L-1乙酸盐缓冲,pH=7、8、9、10采用10 mmol·L-1硼酸盐缓冲)的100 mL锥形瓶中进行,向缓冲溶液中加入0.3 μmol·L-1E1,混合均匀,加入不同浓度的KMnO4起始反应,不同反应时间取出样品,用1 mol·L-1抗坏血酸终止反应.样品中剩余E1的浓度采用高效液相色谱(HPLC)测定.
一系列含10 μmol·L-1E1的纯水中(含体积分数10%乙腈),分别加入0、2、5、10、15、20 μmol·L-1的KMnO4起始反应,20~30 min反应完全后,即KMnO4完全被消耗,利用0.45 μm的玻璃纤维膜进行过滤,过滤后样品利用LC-MS/MS进行产物分析测定.
1.3 分析方法E1浓度采用Waters 1525高效液相色谱配以2475荧光检测器和717 Plus自动进样器进行测定.色谱柱为Symmetry反相C18柱(4.6×150 mm, 5 μm),流速为1 mL·min-1,进样量为100 μL,流动相甲醇/水(含体积分数1‰冰乙酸)为55/45,荧光检测激发/发射波长为230/296 nm,柱温为35 ℃,保留时间为4.9 min.
E1的KMnO4氧化降解产物采用AB SCIEX QTRAP 5500三重四级杆串联线性离子阱质谱仪配以Agilent 1260高效液相色谱(LC-MS/MS)进行分析测定.色谱柱为Agilent Poroshell 120 EC-C18(4.6×150 mm,2.7 μm),流动相为乙腈(A)和含体积分数0.1%甲酸的超纯水(B),流动相梯度为A先由5%开始,保持5 min,然后在30 min内由5%线性升到50%,保持10 min,再在0.1 min内降至5%,保持5 min,流速为200 μL·min-1,进样量为10 μL,柱温为35 ℃.离子源为电喷雾负离子模式(ESI-),利用信息关联数据采集方法(IDA)检测,即Q1质荷比全扫描串联增强子离子扫描模式(EPI).离子源电压和温度分别为-4 500 V和500 ℃,氮气作为气帘气,流速为35 L·min-1,Q1扫描范围为50~600 u,扫描速度为1 000 u·s-1,去簇电压(DP)和入口电压(EP)分别为-70和-10 V,EPI扫描速度为10 000 u·s-1,线性填充时间为1 ms,碰撞电压为-20~-50 V.
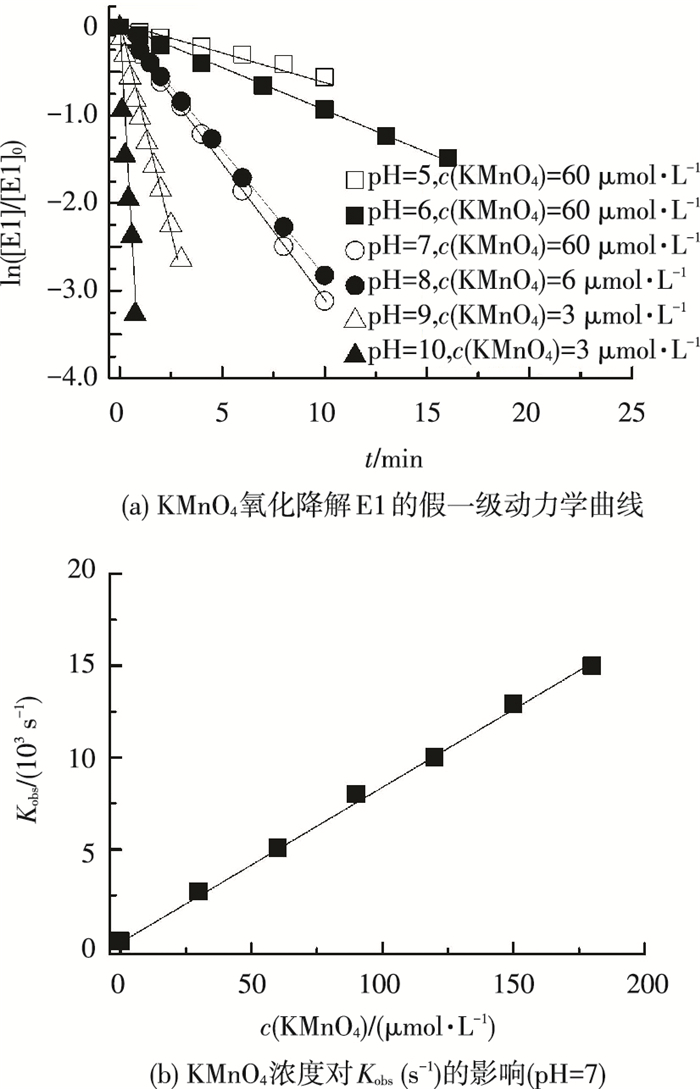
2 结果与讨论 2.1 KMnO4氧化降解E1的反应动力学图 2(a)给出了不同pH(5~10)条件下KMnO4氧化降解E1的动力学曲线(c(KMnO4)=3~60 μmol·L-1,c(E1)=0.3 μmol·L-1).可以看出,在KMnO4浓度为E1浓度10倍的条件下,E1的氧化降解符合假一级动力学规律,直线的斜率即为假一级动力学常数Kobs (s-1).
|
图 2 KMnO4氧化降解E1动力学 |
图 2(b)给出pH=7条件下,KMnO4氧化降解E1的假一级动力学常数Kobs (s-1)与KMnO4浓度的关系.可以看出,假一级动力学常数随着KMnO4浓度的增加呈线性增加.KMnO4与E1的反应可以用式(1)描述,即
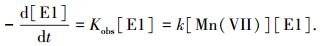
|
(1) |
其中k (L·mol-1·s-1)为二级反应动力学常数,可以通过KMnO4浓度与假一级动力学常数Kobs获得.图 2(b)中直线的斜率即为pH=7条件下KMnO4氧化降解E1的二级反应动力学常数.
图 3给出了不同pH条件下KMnO4氧化E1的二级反应动力学常数.可以看出,二级反应动力学常数受pH影响较大,随着pH升高二级反应动力学常数逐渐增加[17].这一实验现象与K2FeO4氧化降解酚类化合物相似[12],推测主要是在反应过程中KMnO4首先与分子态E1形成氧化络合物,形成的络合物再去氧化水中离子态的E1.在低pH条件下,形成的络合物多,而离子态化合物少,所以,E1的氧化降解速率慢.随着pH的升高,越接近pKa时(E1的pKa为10.4[11]),形成的络合物与离子态化合物浓度相当,所以,有机物的降解速率最快.

|
图 3 不同氧化剂氧化降解E1二级反应动力学常数对比 |
图 3将KMnO4氧化降解E1的二级反应动力学常数与液氯(HOCl)和臭氧(O3)的氧化速率进行对比,其中HOCl与O3氧化降解E1的二级反应动力学常数来自文献[11, 14, 17].可以看出,O3对E1的氧化速率远远高于KMnO4和HOCl,氧化降解速度非常快,与KMnO4的氧化规律一致,随着pH的增加氧化速率逐渐加快,在高pH条件时氧化速率快.HOCl氧化降解E1时,在低pH条件下氧化速率比较低,随着pH的升高先增加而后略有降低,在中性条件下氧化效果比较好,与KMnO4的氧化速率接近.
2.2 实际水体中KMnO4氧化降解E1的效能图 4给出了松花江天然水体(pH=8.0)中KMnO4氧化降解E1(0.15 μmol·L-1)的除污染效能,并与HOCl和O3氧化降解E1的除污染效能进行对比.可以看出,松花江实际水体中,当KMnO4浓度为3 μmol·L-1时,E1的去除率可达90%以上,而HOCl和O3对E1的氧化去除率不到30%.这种现象的主要原因是天然水体的背景成分会消耗氧化剂[22],尤其对HOCl和O3的消耗非常明显.当HOCl和O3的浓度继续增加时,E1的去除率迅速增加,可达90%.在本人前期的研究中,测定实际水体中各氧化剂的剩余浓度时发现,HOCl和O3在实际水体中的消耗速度比较快,有效剩余浓度低,而KMnO4在实际水体中的消耗速度比较慢,见文献[17]中图 3(c).因此,在实际水体中KMnO4氧化降解E1的除污染效能要高于HOCl和O3.

|
图 4 KMnO4、HOCl和O3在松花江天然水体中氧化降解E1效能对比 |
利用三重四级杆串联线性离子阱液相质谱联用仪(LC-MS/MS)对KMnO4降解E1的氧化产物进行分析,采用电喷雾离子源负离子模式(ESI-)和信息关联数据采集方法(IDA),结果见图 5.

|
图 5 LC-MS/MS测定E1色谱图 |
图 5(a)给出了利用LC-MS/MS测定E1标准样品的色谱图,在31.24 min处为E1的色谱峰,由于流动相或其他背景的干扰在色谱图上有7处杂质峰,分别用*号标出.图 5(b)给出了KMnO4氧化E1后利用LC-MS/MS测定的色谱图,可以清晰看出,KMnO4氧化后出现了10个氧化产物,在图中用数字(1~10)标出.
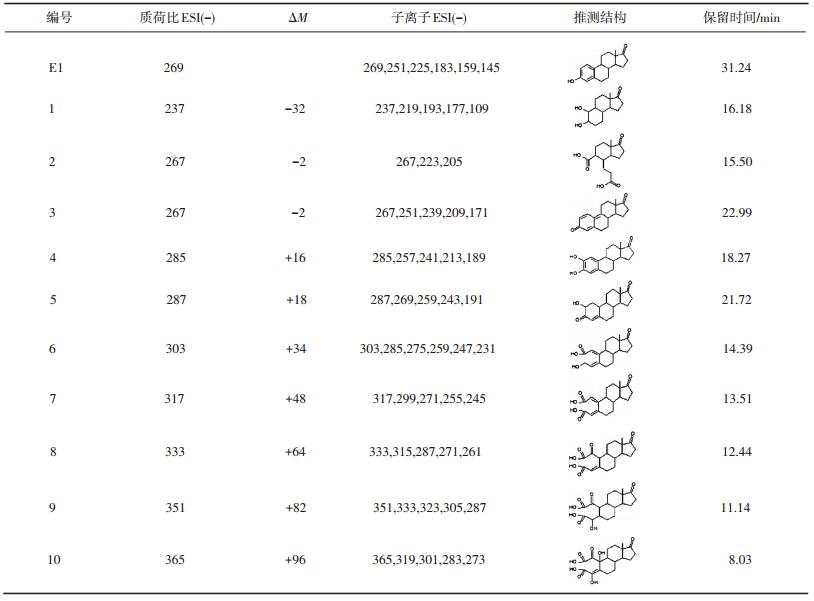
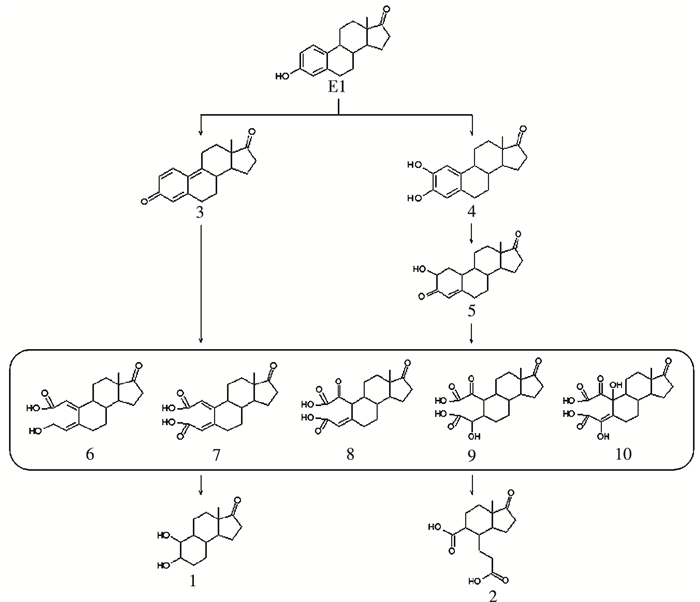
由图 5(b)的色谱峰明显看出,产生的10个产物(1~10)的保留时间均在目标有机物E1的前面,而且生成的大部分产物的质荷比增加,同时,离子碎片信息显示,大多数产物发生的是62(CO2+H2O)、46(CO2H2)、44(CO2)、28(CO)和18(H2O)的离子碎片信息.结合保留时间、产物的质荷比、子离子数等信息推测10个产物的结构式.表 1给出了目标物E1和测定的10个产物的质荷比、子离子信息及其推测的分子结构式.研究结果表明,KMnO4氧化进攻的活性位为苯环上的酚羟基,形成一系列羟基化、醌型和芳香环开环产物,同时E1结构中的羰基官能团依然存在,在反应中没有被氧化.大量研究结果证实,酚羟基是雌激素产生内分泌干扰活性的主要官能团,而醌型和芳香环开环产物的内分泌干扰活性非常弱[10, 16, 23-24].由此可见,KMnO4氧化降解E1的效率高,且能够有效地去除其内分泌干扰活性,降低其毒性.
| 表 1 LC-MS/MS测定KMnO4降解E1的氧化产物 |
推测KMnO4氧化降解E1的反应路径见图 6.首先E1被KMnO4氧化后形成羟基化和醌型产物,如产物3~5,继续被氧化形成一系列羧基化芳香开环产物,如产物6~10,然后继续被氧化去掉一个苯环形成产物1和2.
|
图 6 KMnO4氧化降解E1的反应机理 |
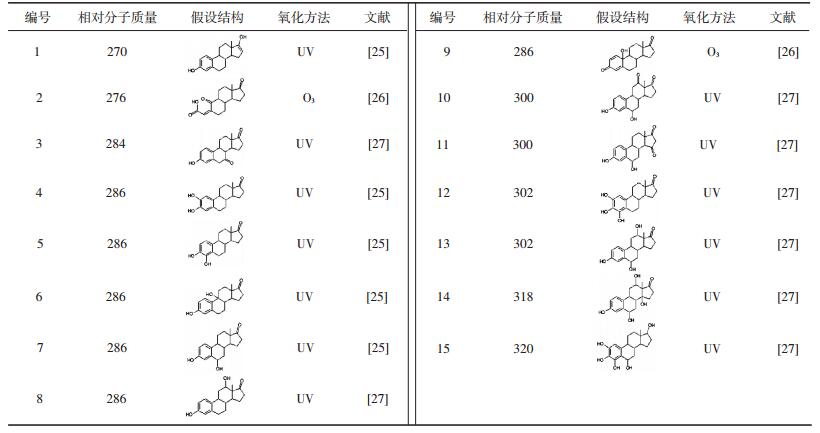
表 2给出了利用其他氧化剂(O3、UV)氧化E1产物的结构式[25-27].可以看出,O3和UV氧化降解E1易形成一些加氧、加羟基官能团和醌型产物.检测到的主要产物是相对分子质量为286的产物,与KMnO4氧化降解E1的测定结果一致.本研究中采用LC-MS/MS(ESI-)测得质荷比为285(相对分子质量为286)的产物为主要产物(见图 5(b)色谱图中产物4),其结构式、子离子信息、保留时间等见表 1.
| 表 2 其他氧化剂氧化E1的产物归纳 |
1) KMnO4氧化降解E1符合假一级动力学规律,且假一级动力学常数Kobs (s-1)随着KMnO4浓度的增加呈线性增加.通过KMnO4浓度与假一级动力学常数Kobs得到二级反应动力学常数k (L·mol-1·s-1),二级反应动力学常数受pH影响较大,随着pH升高逐渐增加.
2) 通过几种氧化剂(KMnO4、HOCl、O3)氧化E1效能的对比可以看出,在中性pH附近,KMnO4的二级反应动力学常数与HOCl相当,但远低于O3的反应速率.然而,实际水体中KMnO4的除污染效能明显高于HOCl和O3,主要是由于HOCl和O3在实际水体中的消耗速度比较快,有效剩余浓度低,而KMnO4在实际水体中的消耗速度比较慢.
3) LC-MS/MS测定KMnO4降解E1氧化产物的结果表明,KMnO4易氧化进攻E1苯环上的活性位酚羟基,形成一系列羟基化、醌型、羧酸化芳香开环产物,同时其内分泌干扰活性降低.
| [1] |
PICKERING A D, SUMPTER J P. Comprehending endocrine disruptors in aquatic environments[J]. Environ Sci Technol, 2003, 37: 331A-336A. DOI:10.1021/es032570f |
| [2] |
KIDD K A, BLANCHFIELD P J, MILLS K H, et al. Collapse of fish population after exposure to a synthetic estrogen[J]. Proc Natl Acad Sci U. S. A, 2007, 104: 8897-8901. DOI:10.1073/pnas.0609568104 |
| [3] |
FLORES-VALVERDE A M, HORWOOD J, HILL E M. Disruption of the steroid metabolome in fish caused by exposure to the environmental estrogen 17α-ethinylestradiol[J]. Environ Sci Technol, 2010, 44: 3552-3558. DOI:10.1021/es9039049 |
| [4] |
TERNES T A, JOSS A. The challenge of micropollutants in urban water management[M]. London: IWA Publishing, 2006.
|
| [5] |
JOHNSON A C, SUMPTER J P. Removal of endocrine-disrupting chemicals in activated sludge treatment works[J]. Environ Sci Technol, 2001, 35: 4697-4703. DOI:10.1021/es010171j |
| [6] |
GRIFFITH D R, KIDO SOULE M C, MATSUFUJI H, et al. Measuring free, conjugated, and halogenated estrogens in secondary treated wastewater effluent[J]. Environ Sci Technol, 2014, 48: 2569-2578. DOI:10.1021/es402809u |
| [7] |
MCROBB F M, SAHAGÚN V, KUFAREVA I, et al. In silico analysis of the conservation of human toxicity and endocrine disruption targets in aquatic species[J]. Environ Sci Technol, 2014, 48: 1964-1972. DOI:10.1021/es404568a |
| [8] |
BARBER L B, VAJDA A M, DOUVILLE C, et al. Fish endocrine disruption responses to a major wastewater treatment facility upgrade[J]. Environ Sci Technol, 2012, 46: 2121-2131. DOI:10.1021/es202880e |
| [9] |
文刚, 邵晓玲, 马军. 污水处理工艺中雌激素活性分布与去除途径分析[J]. 哈尔滨工业大学学报, 2012, 44: 94-98. |
| [10] |
HUBER M M, TERNES T A, VON GUNTEN U. Removal of estrogenic activity and formation of oxidation products during ozonation of 17α-ethinylestradiol[J]. Environ Sci Technol, 2004, 38: 5177-5186. DOI:10.1021/es035205x |
| [11] |
DEBORDE M, RABOUAN S, DUGUETJ P, et al. Kinetics of aqueous ozone-induced oxidation of some endocrine disruptors[J]. Environ Sci Technol, 2005, 39: 6086-6092. DOI:10.1021/es0501619 |
| [12] |
LEE Y, YOON J, VON GUNTEN U. Kinetics of the oxidation of phenols and phenolic endocrine disruptors during water treatment with ferrate (Fe(Ⅵ))[J]. Environ Sci Technol, 2005, 39: 8978-8984. DOI:10.1021/es051198w |
| [13] |
DEBORDE M, VON GUNTEN U. Reactions of chlorine with inorganic and organic compounds during water treatment-Kinetics and mechanisms:a critical review[J]. Water Res, 2008, 42: 13-51. DOI:10.1016/j.watres.2007.07.025 |
| [14] |
DEBORDE M, RABOUAN S, GALLARD H, et al. Aqueous chlorination kinetics of some endocrine disruptors[J]. Environ Sci Technol, 2004, 38: 5577-5583. DOI:10.1021/es040006e |
| [15] |
HUBER M M, KORHONEN S, TERNES T A, et al. Oxidation of pharmaceuticals during water treatment with chlorine dioxide[J]. Water Res, 2005, 39: 3607-3617. DOI:10.1016/j.watres.2005.05.040 |
| [16] |
LEE Y, ESCHER B, VON GUNTEN U. Efficient removal of estrogenic activity during oxidative treatment of waters containing steroid estrogens[J]. Environ Sci Technol, 2008, 42: 6333-6339. DOI:10.1021/es7023302 |
| [17] |
JIANG J, PANG S Y, MA J. Oxidation of phenolic endocrine disrupting chemicals by potassium permanganate in synthetic and real waters[J]. Environ Sci Technol, 2012, 46: 1774-1781. DOI:10.1021/es2035587 |
| [18] |
BENSCHOTEN J E, LIN W, KNOCKE W R. Kinetic modeling of manganese (Ⅱ) oxidation by chlorine dioxide and potassium permanganate[J]. Environ Sci Technol, 1992, 26: 1327-1333. DOI:10.1021/es00031a008 |
| [19] |
DIETRICH A M, HOEHN R C, DUFRESNE L C, et al. Oxidation of odorous and nonodorous algal metabolites by permanganate, chlorine, and chlorine dioxide[J]. Water Sci Technol, 1995, 31: 223-228. |
| [20] |
RODRIGUEZ E, MAJADO M E, MERILUOTO J, et al. Oxidation of microcystins by permanganate:reaction kinetics and implications for water treatment[J]. Water Res, 2007, 41: 102-110. DOI:10.1016/j.watres.2006.10.004 |
| [21] |
WALDEMER R H, TRATNYEK P G. Kinetics of contami-nant degradation by permanganate[J]. Environ Sci Technol, 2006, 40: 1055-1061. DOI:10.1021/es051330s |
| [22] |
LEE Y, VON GUNTEN U. Oxidative transformation of micropollutants during municipal wastewater treatment:comparison of kinetic aspects of selective (chlorine, chlorine dioxide, ferrateⅥ, and ozone) and non-selective oxidants (hydroxyl radical)[J]. Water Res, 2010, 44: 555-566. DOI:10.1016/j.watres.2009.11.045 |
| [23] |
PEREIRA R O, POSTIGO C, DE ALDA M L, et al. Removal of estrogens through water disinfection processes and formation of by-products[J]. Chemosphere, 2011, 82: 789-799. DOI:10.1016/j.chemosphere.2010.10.082 |
| [24] |
MAZELLIER P, MEITE L, LAAT J D. Photo degradation of the sterriod hormones 17β-estradiol (E2) and 17α-ethinylestradiol (EE2) in dilute aqueous solution[J]. Chemosphere, 2008, 73: 1216-1223. DOI:10.1016/j.chemosphere.2008.07.046 |
| [25] |
CAUPOS E, MAZELLIER P, CROUE J P. Photo degradation of estrone enhanced by dissolved organic matter under simulated sunlight[J]. Water Res, 2011, 45: 3341-3350. DOI:10.1016/j.watres.2011.03.047 |
| [26] |
RENATA DE O P, MIREN L A, JESUS J, et al. Identification of new ozonation disinfection byproducts of 17b-estra-dioland estrone in water[J]. Chemosphere, 2011, 84: 1535-1541. DOI:10.1016/j.chemosphere.2011.05.058 |
| [27] |
YASMINE S, SOPHIE B, STEPHANE B, et al. Estrone direct photolysis:by-product identification using LC-Q-TOF[J]. Chemosphere, 2012, 87: 185-193. DOI:10.1016/j.chemosphere.2011.12.016 |
 2016, Vol. 48
2016, Vol. 48