2. 哈尔滨工业大学 宜兴环保研究院, 214205 江苏 宜兴;
3. 台州学院, 318000 浙江 台州
2. HIT Yixing Academy of Environmental Protection, 214205 Yixing, Jiangsu, China;
3. Taizhou University, 318000 Taizhou, Zhejiang, China
印染废水具有水量变化大、色度深、碱性大、成分复杂等特点[1-5],常规的生物处理法虽处理成本低,但处理过程缓慢,占地面积大,且不能保证印染出水的达标排放;相比而言,物理吸附法在场地需求、操作管理以及处理效果方面均有明显的优势[6-9].粉末活性炭是常用的吸附剂,其比表面积大,具有很强的吸附能力,对于一般生物法难以去除的难降解物质具有很好的去除效果[10-13],广泛应用于工业废水的深度处理,以保证出水稳定达标排放.但由于粉末活性炭自身粒径小、比重轻的特点,在使用过程中存在与处理后水难以分离、易流失、成本高昂等缺点[14].
对粉末活性炭进行改性解决其与处理后废水分离困难、分离成本高的问题一直是关注的焦点,磁性分离是解决途径之一,且经过铁氧化物改性过后的粉末活性炭可能具有良好的再生性能(如高级氧化再生、热再生等),能有效降低其处理成本.近年来,关于制备磁性活性炭的报道有很多,但材料的制备条件普遍比较复杂,不利于实际工程的应用.王崇琳[15]以含有铁、钴、镍的金属盐溶液与活性炭混合,再浸入某些铵盐溶液中,在适宜的温度下通入H2和N2,对活性炭进行磁化,得到了磁性活性炭.Do等[16]将粉末活性炭与含Fe(NO3)3·9H2O的硝酸溶液在100 ℃条件下充分混合磁力搅拌8 h,再通过过滤脱水、通氮气600 ℃炉内加热后得到了磁性活性炭.本实验采用化学共沉淀法制备磁性活性炭,相比其他方法具有过程简单、反应快速的特点,且由于反应是在液相中进行,合成材料的表面负载物质均匀分布,合成效果稳定.对合成材料进行表征,将其应用于亚甲基蓝染料的吸附,考察pH、接触时间以及污染物质量浓度对其处理效能的影响以及合成材料的分离性能,为其在实际工程中应用的可行性提供指导.
1 实验 1.1 实验试剂六水合三氯化铁(FeCl3·6H2O)、四水合氯化亚铁(FeCl2·4H2O)、氢氧化钠(NaOH)、粉末活性炭(PAC)、亚甲基蓝(C16H18ClN3S·3H2O),以上试剂均为市售分析纯试剂.实验用水为高纯水.
1.2 实验方法 1.2.1 磁性活性炭的制备采用化学共沉淀法制备磁性活性炭,其制备主要依据反应为: 2Fe(OH)2++Fe(OH)++ 3OH-(Fe3+)2(Fe2+)(OH-)8Fe3O4↓+4H2O.分别取3.9 g FeCl3·6H2O及1.4 g FeCl2·4H2O溶解于烧杯中(即Fe3+与Fe2+摩尔比为2:1),加入1.65 g粉末活性炭,使之充分混合均匀,在75 ℃条件下,机械搅拌的同时缓慢逐滴加入50 mL 5.0 mol/L的氢氧化钠水溶液作为沉淀剂,反应1 h后将烧杯静置沉淀,移去上清液,将剩余悬浊液放入烘箱烘干,用超纯水将所得材料反复冲洗至上清液呈中性,磁力回收烘干后移入样品瓶中密封保存.
1.2.2 脱色实验在20 ℃恒温条件下,准确量取12.5 mL含亚甲基蓝的染料标准储备液(10 g/L)于1 000 mL烧杯中,加入高纯水配制成500 mL的模拟染料废水.置于恒温水浴锅中机械搅拌,控制转速3 rad/s,投加一定量的磁性活性炭或粉末活性炭,用配制的硫酸和氢氧化钠溶液调节pH至设定值,定时取样,将处理后的废水用0.45 μm的微孔滤膜过滤,部分滤液取样测定COD,剩余滤液稀释一定倍数后用紫外可见分光光度计测定吸光度,并计算染料的剩余质量浓度.
1.3 分析项目及方法磁性活性炭及PAC的孔结构分析采用全自动比表面和孔隙分析仪(Tristar II 3020,Micromeritics Instrument Corporation, America)进行表征.晶体参数采用全自动多晶粉末X射线衍射仪(XD-2/XD-3, 北京普析通用仪器有限责任公司)进行表征,Cu-Kα,波长λ=0.154 178 nm,管电压36 kV,电流20 mA,扫描范围10°~70°,扫描速度4(°)/min.形貌采用场发射扫描电子显微镜FESEM(日立S-4800冷场发射扫描电镜)进行表征.COD采用快速消解分光光度法(HJ/T 399-2007)测定,亚甲基蓝质量浓度采用亚甲基蓝分光光度法测定,仪器为紫外可见分光光度计(T6新世纪,北京普析通用仪器有限责任公司).
2 结果与讨论 2.1 材料的表征 2.1.1 XRD分析图 1、2分别为磁性活性炭和PAC的XRD图,可以看出,磁性物质的衍射谱峰出现在2θ= 30.29°、35.55°、43.08°、57.36°、62.74°处,与Fe3O4的X射线衍射标准卡JCPDS(19-0629)的图谱特征峰基本一致,PAC表面负载的物质为Fe3O4.从PAC的XRD图分析可知,在20°左右呈现一个大峰,而负载后的磁性活性炭不存在,说明在制备过程中对PAC的烧蚀作用较强,磁性活性炭中所含PAC呈现无定型结构.

|
图 1 磁性活性炭XRD图 |

|
图 2 粉末活性炭XRD图 |
图 3、4分别为磁性活性炭和PAC的FESEM图,可以看出,PAC表面较为平滑,形貌呈现片块状,而进行负载之后得到的磁性活性炭在PAC表面形成了许多类似小球状的颗粒物,对PAC的内部孔隙结构没有造成太大的影响.

|
图 3 磁性活性炭FESEM图 |

|
图 4 粉末活性炭FESEM图 |
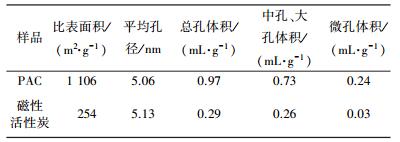
在523 K条件下将样品脱气4 h,以高纯氮(99.99%)为吸附介质进行测定,通过计算吸附等温线,得到样品的比表面积和孔结构等参数,结果如表 1所示.
| 表 1 材料的孔结构分析 |
由表 1可以看出,本实验采用的PAC比表面积很大,可达1 106 m2/g,且以中孔、大孔为主.负载后的磁性活性炭比表面积为254 m2/g,比表面积下降较明显,平均孔径略有上升,孔体积相对PAC明显减小.这一现象主要是因为磁性活性炭是由PAC和其表面负载的铁氧化物按质量比1:1合成的,而比表面积是以单位质量的吸附材料进行测量得出的结果,铁氧化物的比表面积相对PAC很小可忽略不计,所以表现为磁性活性炭的比表面积有明显下降.这一现象表明,负载前后PAC表面性质发生了明显的变化,该现象与XRD及FESEM分析结果吻合.
2.2 吸附等温线磁性活性炭对亚甲基蓝的吸附过程是动态平衡的,为了探讨其吸附过程的规律,使用描述固-液吸附等温线的Langmuir和Freundlich方程模型对其进行拟合.
Langmuir等温线是假设所有的吸附位点具有相同的能量,吸附过程为单分子层吸附,已经吸附的分子相互之间没有作用力,且吸附平衡是动态平衡;Freundlich模型假设吸附过程为多层吸附,吸附剂表面的吸附位点遵循能量指数分布.其方程形式分别为
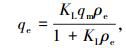
|
(1) |
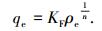
|
(2) |
式中:ρe为平衡质量浓度(mg/L);qe为平衡吸附量(mg/g);qm为饱和吸附量(mg/g);KL为Langmuir常数(L/mg),表示吸附剂对吸附质结合力的大小; KF为Freundlich平衡吸附常数,反应吸附能力的强弱;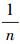
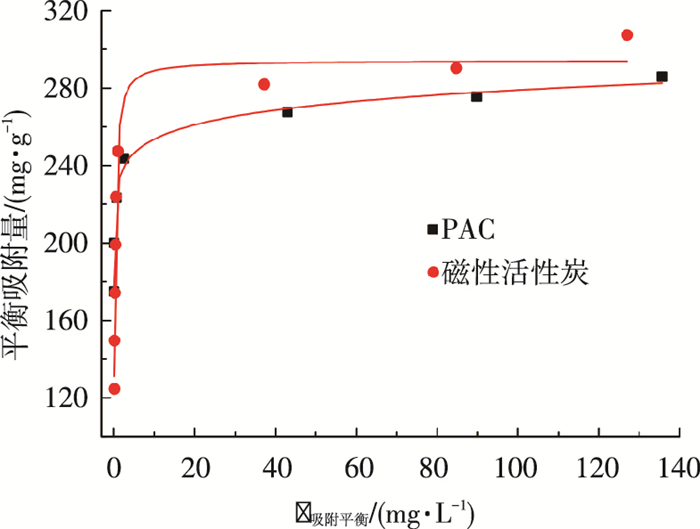
所用磁性活性炭和PAC比表面积分别为254、1 106 m2/g,在pH=9、温度293 K条件下,固定吸附剂的投量均为0.4 g/L,改变废水中染料的质量浓度,待其达到吸附平衡后测定水中残余染料质量浓度,绘制吸附等温线.图 5为磁性活性炭及PAC分别通过Langmuir方程模型及Freundlich方程模型进行非线性拟合所得吸附等温线.
|
图 5 磁性活性炭、PAC吸附等温线 |
由图 5可知,随着亚甲基蓝平衡质量浓度的增加,磁性活性炭对亚甲基蓝的吸附优势逐渐体现,磁性活性炭的最大吸附容量可达307.4 mg/g,而PAC的最大吸附容量为285.8 mg/g.图 6为不同初始质量浓度的亚甲基蓝对磁性活性炭及PAC的平衡吸附量的影响,可以看出,两者的平衡吸附量均随着亚甲基蓝初始质量浓度的增加先快速增加.在亚甲基蓝初始质量浓度小于100 mg/L时,两者均呈现良好的线性关系;当亚甲基蓝初始质量浓度大于100 mg/L时,两者的吸附量趋于稳定,直至平衡.应用式(1)和式(2)分别对温度为293 K的吸附实验数据进行非线性拟合,所得参数如表 2所示.
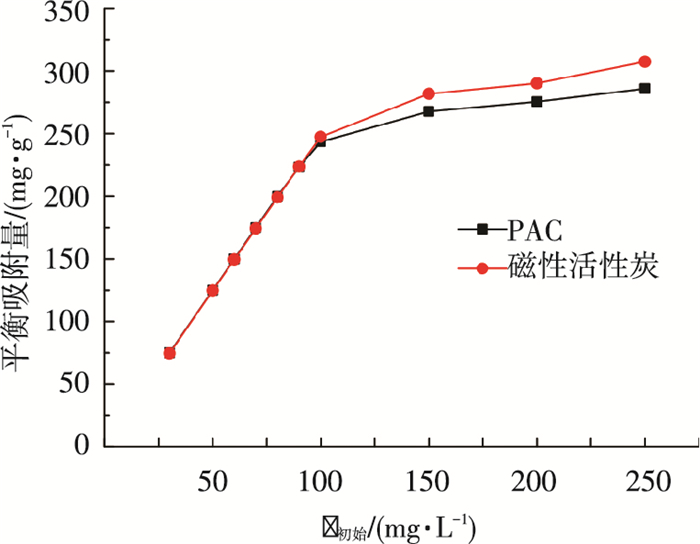
|
图 6 初始质量浓度对吸附亚甲基蓝的影响 |
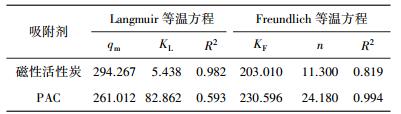
| 表 2 Langmuir、Freundlich等温方程拟合结果 |
由表 2可以看出,Langmuir方程模型能更好地反映磁性活性炭对亚甲基蓝的吸附特点,磁性活性炭表面性质较为均一,吸附位点分布均匀,吸附过程为单分子层吸附.Freundlich方程能更好地表征PAC对亚甲基蓝的吸附能力,PAC吸附过程为多分子层物理吸附,且Freundlich方程拟合指数n大于1,说明PAC对亚甲基蓝的吸附为优惠吸附[17].
2.3 亚甲基蓝去除效果分析 2.3.1 微孔滤膜过滤法对实验的影响如图 7所示,配制亚甲基蓝模拟染料废水0、50、100、150、200、250 mg/L 6个质量浓度,分别各自测定过滤前原水以及经0.45 μm微孔滤膜过滤后废水的吸光度和COD.可以看出,经0.45 μm微孔滤膜过滤后的废水染料质量浓度和COD均未发生变化,可以排除由于微孔滤膜本身对废水中污染物的分离作用而对实验造成的影响.

|
图 7 微孔滤膜对实验的影响 |
对于一般吸附过程,溶液pH对吸附有较明显的影响,主要涉及吸附剂的官能团、表面电荷、活性位点,同时还能影响吸附质的电离程度和结构,进而影响吸附剂表面化学性质以及吸附质在溶液中的存在形态[18].实验设计磁性活性炭及PAC投加量为0.4 g/L、亚甲基蓝废水初始质量浓度为250 mg/L、接触时间为300 min时,考察材料吸附容量随pH的变化,结果如图 8所示.

|
图 8 pH对磁性活性炭、PAC吸附容量的影响 |
由图 8可以看出,pH为3时,磁性活性炭及PAC对亚甲基蓝的吸附容量分别为148.5、232.6 mg/g;pH为9时,磁性活性炭及PAC的吸附容量分别提升至307.4、285.8 mg/g.可见提高pH可大幅提高磁性活性炭对亚甲基蓝的吸附容量,而对PAC的吸附容量影响较小.由于亚甲基蓝为阳离子型染料,即在水中以带正电荷的阳离子形式存在,而一般认为Fe3O4的等电点为pH=6.5[19],因此pH>6.5时,磁性活性炭颗粒表面大量吸附位点处于去质子化形式,表现为位点的负电荷增加,故在碱性条件下有利于阳离子型染料吸附,且在酸性条件下PAC表面带正电荷的基团影响了其对亚甲基蓝的吸附,当溶液转为中性所形成的双电荷层改变了PAC的表面极性[20],故pH在中性附近时磁性活性炭及PAC吸附效果均发生了明显变化.
此外,配制的染料废水投入对应比例的磁性活性炭后pH稳定在9左右,与磁性活性炭吸附亚甲基蓝的最佳pH刚好吻合,因此,整个处理过程无需人为调节pH,出水pH也可实现达标.
2.3.3 接触时间对染料去除率和COD去除率的影响磁性活性炭投加量为0.4 g/L,pH=9,亚甲基蓝废水质量浓度为100 mg/L,考察接触时间(10、20、30、60、120、180、300、360 min)对染料去除率和COD去除率的影响,结果如图 9所示.
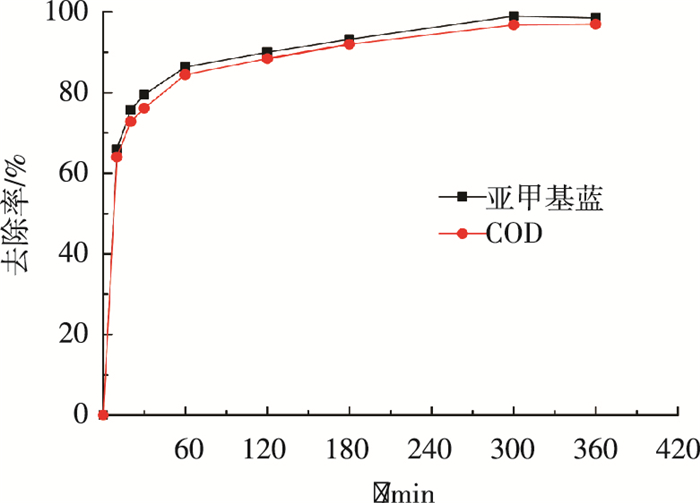
|
图 9 接触时间对去除率的影响 |
由图 9可以看出,在给定实验条件下,磁性活性炭处理染料废水吸附速度非常快,接触60 min后,亚甲基蓝去除率和COD去除率已分别达86.3%和84.4%.达到最大去除率所需时间为300 min,此时亚甲基蓝去除率和COD去除率为98.9%和96.8%.继续增加接触时间则去除率几无变化,表明磁性活性炭对亚甲基蓝已达吸附饱和.
2.4 吸附热力学磁性活性炭对亚甲基蓝吸附过程的ΔG0可通过式(3)计算,ΔH0和ΔS0通过式(5)计算:
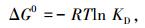
|
(3) |
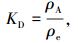
|
(4) |

|
(5) |
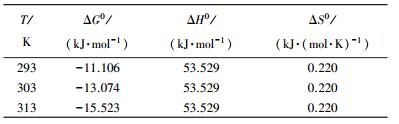
式中:ρA和ρe分别为平衡状态下亚甲基蓝在固相和液相中的质量浓度; ΔS0和ΔH0分别为吸附熵变和吸附焓变; R为通用气体常数,8.314 J·(mol·K)-1; T为热力学温度.得到相应的热力学参数见表 3.
| 表 3 磁性活性炭吸附亚甲基蓝的热力学参数 |
如表 3所示,ΔG0<0,说明磁性活性炭对亚甲基蓝的吸附过程是自发进行的,且随着温度的升高,ΔG0的绝对值逐渐增大,表明温度越高,磁性活性炭对亚甲基蓝的吸附量越大.吸附焓变ΔH0>0,说明磁性活性炭对亚甲基蓝的吸附是吸热过程,进一步说明升高温度有利于该吸附过程.一般认为当ΔH0<40 kJ·mol-1时,吸附过程以物理吸附为主,如氢键作用力、范德华力、偶极-偶极间作用力等;ΔH0>50 kJ·mol-1时,吸附过程以化学吸附为主.而由表 3可知,磁性活性炭对亚甲基蓝的吸附过程中ΔH0为53.529 kJ·mol-1,表明该吸附过程以化学吸附为主.ΔS0>0,表明亚甲基蓝在吸附界面上是无序随机被吸附的[21].通过分析发现,磁性活性炭对亚甲基蓝的吸附过程可能是化学键力、配位基交换、静电引力和氢键作用力等综合作用的结果[22].
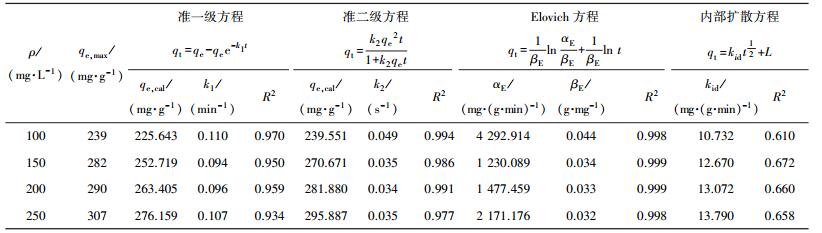
2.5 吸附动力学设置亚甲基蓝模拟染料废水初始质量浓度为100、150、200和250 mg/L,对亚甲基蓝在磁性活性炭上的吸附数据进行分析,并用准一级、准二级、Elovich及内扩散动力学方程对其吸附动力学数据进行非线性拟合,拟合所得参数如表 4所示.可以看出,准一级、准二级及Elovich方程的相关系数R2均较高,分别能达0.96、0.98、0.99;相比而言,内部扩散方程的拟合结果不是很好,表明颗粒内扩散不是该吸附过程的控速步骤,吸附过程受其他吸附阶段的共同控制.图 10分别为拟合相关系数较高的准一级、准二级以及Elovich动力学方程拟合曲线.可以看出,在吸附初期磁性活性炭对亚甲基蓝的吸附速率较快,在最初的30 min内已达到总吸附量的70%以上.而后随着时间的延长,吸附速率逐渐下降,吸附180 min后,吸附量趋于平稳.且随着亚甲基蓝初始质量浓度的增大,其吸附量也相应增大,该现象与等温吸附分析结果一致.
| 表 4 亚甲基蓝在磁性活性炭上的吸附动力学拟合曲线参数 |

|
图 10 磁性活性炭对亚甲基蓝的吸附动力学曲线 |
从图 10和表 4中的数据综合分析可以看出,尽管准一级、准二级方程的相关系数比较高,但是由方程计算得到的饱和吸附量qe, cal与实验得到的饱和吸附量qe, max相差较大,相比而言,Elovich动力学方程能更好地描述磁性活性炭在不同亚甲基蓝初始质量浓度时对亚甲基蓝的吸附动力学过程,吸附过程倾向于非理想化的单分子层化学吸附[23].
2.6 材料的分离效果图 11分别为磁性活性炭开始沉淀、自然沉淀10 min、磁力回收30 s、PAC自然沉淀5 h时的沉淀效果图.可以看出,磁性活性炭在自然重力沉降条件下10 min内沉淀完全,在外强磁场作用下30 s内可实现快速分离,而自然沉淀5 h后PAC混合液未见明显变化,需经过过滤装置进行过滤才能实现固液分离.

|
图 11 磁性活性炭及PAC沉淀效果对比 |
1) 经化学共沉淀法合成的磁性活性炭颗粒表面性质均一,具有良好的吸附性能,pH是影响其处理效能的关键因素.在偏碱性条件下,磁性活性炭对亚甲基蓝的吸附容量比PAC有所提升.当pH为9时,磁性活性炭对亚甲基蓝的脱色能力达到最佳,接触时间为300 min时,达到吸附饱和,饱和吸附容量为307.4 mg/g.
2) 磁性活性炭对亚甲基蓝的等温吸附过程符合Langmuir模型,磁性活性炭表面性质较为均一,吸附位点分布均匀,吸附过程为单分子层吸附.
3) 热力学分析结果表明,ΔG0<0,ΔH0>50 kJ·mol-1,说明磁性活性炭对亚甲基蓝的吸附过程是自发进行的吸热过程,且化学作用在吸附过程中占主导地位.
4) Elovich动力学方程能更好地描述磁性活性炭在不同亚甲基蓝初始质量浓度时对亚甲基蓝的吸附动力学过程,吸附过程倾向于非理想化的单分子层化学吸附.
5) 该合成材料解决了常规PAC在使用过程中分离困难的弊端,在自然重力沉降条件下10 min内沉淀完全,而在外强磁场作用下30 s内可实现快速分离.且该合成材料在再生方面(如高级氧化再生等)非常具有前景.相比常规PAC工艺,该合成材料实际应用价值很高.本文仅对特定制备条件下的磁性活性炭进行了吸附性能的探讨,结果表明该磁性活性炭相比PAC具有吸附容量大、可分离性能强等明显优势,但后期还需对材料的制备条件、大批量生产、再生以及在实际废水处理工艺中应用的稳定性等方面做进一步研究.
| [1] |
温珺琪. 印染废水处理回用工艺现状研究[J]. 环境科学与管理, 2014, 39(2): 156-158. |
| [2] |
刘圣厚, 张笑吟, 刘楠. 印染废水排放及处理现状综述[J]. 科技视界, 2014(8): 158. |
| [3] |
LU Xujie, LIU Lin, YANG Bo, et al. Reuse of printing and dyeing wastewater in processess assessed by pilot-scale test using combined biological process and sub-filter technology[J]. Journal of Cleaner Production, 2009, 17(2): 111-114. DOI:10.1016/j.jclepro.2008.03.003 |
| [4] |
KUMAR P, PRASAD B, MISHRA I M, et al. Decolorization and COD reduction of dyeing wastewater from a cotton textile mill using thermolysis and coagulation[J]. Journal of Hazardous Materials, 2008, 153(1/2): 635-645. |
| [5] |
ALLEGRE C, MOULIN P, MAISSEU M, et al. Treatment and reuse of reactive dyeing effluents[J]. Journal of Membrane Science, 2006, 269(1/2): 15-34. |
| [6] |
KADIRVELU K, PALANIVAL M, KALPANA R, et al. Activated carbon from an agricultural by-product, for the treatment of dyeing industry wastewater[J]. Bioresource Technology, 2000, 74(3): 263-265. DOI:10.1016/S0960-8524(00)00013-4 |
| [7] |
刘亮, 安晓玲, 李雅轩. 印染废水处理技术的研究现状[J]. 河北工业科技, 2008, 25(3): 177-180. DOI:10.7535/hbgykj.2008yx03015 |
| [8] |
史会剑, 朱大伟, 胡欣欣, 等. 印染废水处理技术研究进展探析[J]. 环境科学与管理, 2015, 40(2): 74-76. |
| [9] |
RANGABHASHIYAM S, ANU N, SELVARAJU N. Sequestration of dye from textile industry wastewater using agricultural waste products as adsorbents[J]. Journal of Environmental Chemical Engineering, 2013, 1(4): 629-641. DOI:10.1016/j.jece.2013.07.014 |
| [10] |
廖钦洪, 刘庆业, 蒙冕武, 等. 稻壳基活性炭的制备及其对亚甲基蓝吸附的研究[J]. 环境工程学报, 2011, 5(11): 2447-2452. |
| [11] |
NGUYEN L N, HAI F I, NGHIEM L D, et al. Enhancement of removal of trace organic contaminants by powdered activated carbon dosing into membrane bioreactors[J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(2): 571-578. DOI:10.1016/j.jtice.2013.05.021 |
| [12] |
NG C A, SUN D, BASHIR M J K, et al. Optimization of membrane bioreactors by the addition of powdered activated carbon[J]. Bioresource Technology, 2013, 138: 38-47. DOI:10.1016/j.biortech.2013.03.129 |
| [13] |
YENER J, KOPAC T, DOGU G, et al. Dynamic analysis of sorption of Methylene Blue dye on granular and powdered activated carbon[J]. Chemical Engineering Journal, 2008, 144(3): 400-406. DOI:10.1016/j.cej.2008.02.009 |
| [14] |
XU J C, XIN P H, HAN Y B, et al. Magnetic response and adsorptive properties for methylene blue of CoFe2 O4/CoxFey/activated carbon magnetic composites[J]. Journal of Alloys and Compounds, 2014, 617: 622-626. DOI:10.1016/j.jallcom.2014.08.059 |
| [15] |
王崇琳. 一种磁性活性炭的制备工艺: CN1026215[P]. 1990-12-13.
|
| [16] |
DO M H, PHAN N H, NGUYEN T D, et al. Activated carbon/Fe3O4 nanoparticle composite:fabrication, methyl orange removal and regeneration by hydrogen peroxide[J]. Chemosphere, 2011, 85(8): 1269-1276. DOI:10.1016/j.chemosphere.2011.07.023 |
| [17] |
FREUNDLICH H M F. Over the adsorption in solution[J]. Journal of Physical Chemistry, 2006, 57(3): 385-471. |
| [18] |
徐恩兵, 李坤权, 朱志强, 等. 双孔介孔碳的合成及其对亚甲基蓝的吸附[J]. 环境化学, 2015, 34(1): 137-143. DOI:10.7524/j.issn.0254-6108.2015.01.2014041403 |
| [19] |
CHEN M J, SHEN H, LI X, et al. Facile synthesis of oil-soluble Fe3O4 nanoparticles based on a phase transfer mechanism[J]. Applied Surface Science, 2014, 307: 306-310. DOI:10.1016/j.apsusc.2014.04.031 |
| [20] |
HAMEED B H, EL-KHAIARY M I. Equilibrium, kinetics and mechanism of malachite green adsorption on activated carbon prepared from bamboo by K2CO3 activation and subsequent gasification with CO2[J]. Journal of Hazardous Materials, 2008, 157(2/3): 344-351. |
| [21] |
FAKHRI A, ADAMI S. Adsorption and thermodynamic study of cephalosporins antibiotics from aqueous solution onto MgO nanoparticles[J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(3): 1001-1006. DOI:10.1016/j.jtice.2013.09.028 |
| [22] |
MITROGIANNIS D, MARKOU G, ÇELEKLI A, et al. Biosorption of methylene blue onto Arthrospira platensis biomass:kinetic, equilibrium and thermodynamic studies[J]. Journal of Environmental Chemical Engineering, 2015, 3(2): 670-680. DOI:10.1016/j.jece.2015.02.008 |
| [23] |
WU F C, TSENG R L, JUANG R S. Characteristics of Elovich equation used for the analysis of adsorption kinetics in dye-chitosan systems[J]. Chemical Engineering Journal, 2009, 150(2/3): 366-373. |
 2016, Vol. 48
2016, Vol. 48