2. 长江水环境教育部重点实验室(同济大学), 200092 上海;
3. 上海同济城市规划设计研究院, 200092 上海
2. State Key Laboratory of Pollution Control & Resource Reuse(Tongji University), 200092 Shanghai, China;
3. Shanghai Tongjii Urban Planning & Design Institute, 200092 Shanghai, China
微生物能够在管网入口和管道安装维修时进入供水管网[1-5],最终在管网中存活下来并在管壁形成生物膜[6],且导致过水断面缩小,降低管网输水能力,增加二级泵站的动力消耗,引起管道的跑冒滴漏,水质进一步恶化,危害人类健康[7-8].给水管网为贫营养环境,其中悬浮菌的数量较少,99%以上的微生物细胞均固着在某种介质表面,并可能形成生物膜[9].当生物膜脱落进入水中,会造成水中细菌数量的大幅增加,对用水安全产生较大威胁.Wende等[10]研究了管网水悬浮菌与管壁生物膜的关系,指出管网水中的悬浮菌大部分来源于管壁生物膜的脱落.目前,许多研究在用水终端发现条件致病菌.Kormas等[11]通过研究供水管网中细菌群落结构变化,发现β-变形细菌在最初占据主导并逐渐减弱,在最终的水龙头出水中以分枝杆菌含量最多.Feazel等[12]的研究发现淋浴设备上含有大量生物膜,并导致出水中的条件致病菌含量是原来的100多倍.
变形细菌是细菌中最大的一个门,在管网中含量最高且具有一定主导性[13-14].此外,变形菌门根据rRNA序列被分为5个纲,其中多种重要病原菌属于γ-变形菌纲.本文针对南方某城市的实际给水管网,利用分子生物学方法分析了管壁生物膜中3类变形细菌的组成比例,并探讨了管壁生物膜细菌与管网水悬浮菌、管壁生物膜与细菌再生长潜力(BRP)的相互关系,为饮用水系统的生物稳定性和微生物的控制策略研究提供了重要依据.
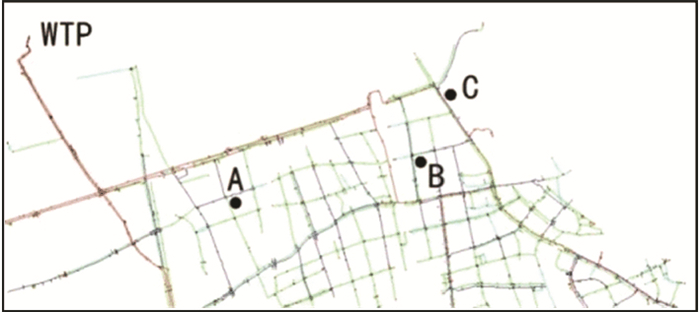
1 实验 1.1 取样点布设与取样方法研究管网区域位于南方某城市,净水厂处理工艺采用常规工艺结合臭氧活性炭深度处理工艺.实际给水管网不同区位分别设置A、B、C 3个取样点,其分布如图 1所示.
|
图 1 取样点分布 |
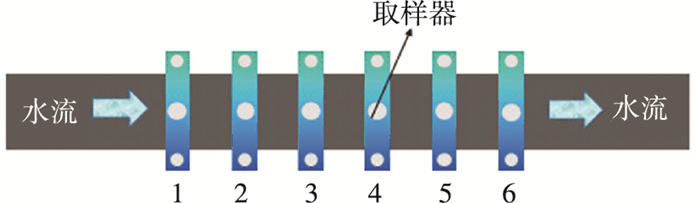
取样管道均为小区DN150入户管,管材为球墨铸铁管.管道上分别设置1只水嘴和6个生物膜采样口.取样前对所用容器进行灭菌,每次各取样点取得水样1.5 L.生物膜样品在加入50 mL生理盐水后超声震荡,得到混合液.按照水流方向,水嘴设置在管道前端,管壁生物膜采样口位于管道中段,每间隔30 mm设置一处,依次编号为1~6(如图 2),特制管壁分别安装在各取样口中.
|
图 2 取样装置 |
研究期间供水运行工况发生如下变化:2010年12月,本区域供水由常规处理工艺和深度处理工艺的两座水厂联合供水改为深度处理工艺水厂单独供水;2011年4月,本区域供水水源进行切换,原水水质由原来的Ⅲ~Ⅳ类水提高至Ⅱ类.
1.2 菌落总数检测水样和生物膜样品的菌落总数采用异养菌平板计数法(heterotrophicplate count,HPC)进行测定.
1.3 细菌再生长潜力1999年,日本学者Sathasivan等[15]采用细菌再生长潜力(bacterial regrowth potential, BRP)对日本东京管网水中细菌的限制因子进行了研究.即以水样土著细菌为接种液,通过对接种后水样进行培养并检测其菌落总数,以最终的细菌数量(CFU/mL)表示水样中各类营养物质和环境条件支持细菌再生长的潜力.
实验采用管壁生物膜样品混合液作为接种液以获得接近实际、具有代表性的结果.具体准备步骤如下:取500 mL管壁生物膜样品混合液于灭菌容器,加入1.5%质量分数的硫代硫酸钠溶液2 mL中和余氯;各取3个取样点的生物膜样品20 mL等量混合,经2 μm微孔滤膜过滤去除杂质微粒后,加入具塞磨口锥形瓶中,20 ℃避光培养5 d;取中和余氯后的水样100 mL于70 ℃水浴中巴氏灭菌30 min,冷却至室温;按1:100的比例接种培养后的生物膜混合液,摇匀后20 ℃避光培养5 d;采用R2A培养基22 ℃下培养7 d后进行细菌计数,结果以CFU/mL表示.
1.4 分子生物学检测方法 1.4.1 DNA提取预处理后的生物膜样品采用专用试剂盒提取管网生物膜中的微生物DNA,采用电泳方法观察DNA条带明暗程度.
1.4.2 实时荧光定量PCR选用α-、β-、γ-变形细菌为标准样品,采用实时荧光定量PCR技术分析给水管网生物膜中3类变形细菌的存在水平.定量实验所需的变形细菌质粒标准品应作预先处理,主要的实验操作包括:α-、β-、γ-变形细菌标样的复苏;感受态制备及连接;变形细菌的挑菌培养;变形细菌质粒的提取;变形细菌标样质粒DNA含量的测定.本实验采用的实时荧光定量PCR体系如表 1所示.其中,RTFQ PCR的特定正、反向引物如表 2所示.
| 表 1 RTFQ PCR反应体系 |
| 表 2 α-、β-、γ-变形细菌特定引物 |
将各变形细菌质粒原液分别稀释至(拷贝数)109、108、107、106、105、104、103 μL-1.根据以上RTFQ PCR反应体系及条件测定对应的α-、β-、γ-变形细菌标准曲线,各变形细菌取103~107 μL-1的稀释浓度为已知浓度.
将配定体系的原始DNA试样按顺序放入36孔离心孔板中(或96孔板),其他离心孔中加入同质量离心管以配平.
实时荧光定量PCR测定选用ABI 7500实时荧光定量PCR仪,扩增反应条件如下:预变性条件为95 ℃保持3 min;变性扩增条件为95 ℃保持15 s,延伸条件为60 ℃保持60 s,该过程共循环40次;最后在72~99 ℃解离.
对未知样品进行定量PCR,每个样品分别做2个平行,根据标准曲线计算获取每个样品微生物DNA含量.
1.4.3 生物膜变形菌分析针对致病菌种类较多的α-、β-、γ-变形细菌,于2010—2013年对管壁生物膜中的变形细菌进行了实时荧光定量PCR的分析,考察了变形细菌与管网水细菌再生长的关系.采用如下公式对结果进行换算:
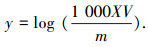
|
式中:y为变形细菌数,log(cm-2);X为变形细菌数(拷贝数),μL-1;V为生物膜样品体积,mL; m为生物膜取样器表面积,cm2.
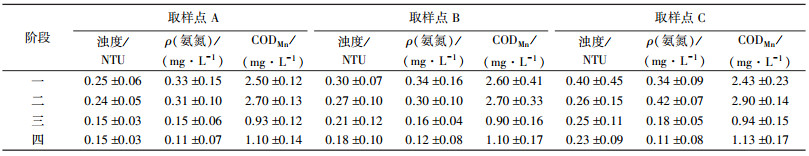
2 结果与讨论 2.1 生物膜变形细菌分析 2.1.1 变形细菌总数的变化图 3为2010年8月至2013年8月,A、B、C 3个取样点变形细菌数的变化.根据供水运行工况的变化进行分析,第一阶段为2010年8月至12月,水质无明显变化,细菌种类与数量相对稳定;第二阶段为2010年12月至2011年7月,由于运行工况的变化,管网水质与细菌种群也随之变化;第三阶段为2011年8月至2012年10月,供水条件回归稳定,管网水质与细菌种群也趋于稳定;第四阶段为2012年12月至2013年8月,供水水质稳定,水中细菌种群稳定.其取样点管网水质变化见表 3.由图 3可以看出,生物膜变形细菌总数在不同阶段表现出不同的变化规律.第一阶段,管网环境较为稳定,各取样点的变形细菌总数平均值分别为(10.43±0.57)log、(10.26±0.38)log和(10.20±0.50)log;第二阶段,随着运行工况的变化,管网水质有较大提高,管网的贫营养特点更加突出.由于此阶段管网水质在生物膜形成阶段出现了变化,生物膜中的细菌为适应新环境,一方面互相竞争营养物质与空间,另一方面在细菌繁殖中不断进化,提高对恶劣环境的耐受性,导致变形细菌数也出现了较大波动,在2011年4月出现陡降,随后不断增大至2011年7月达最大值;第三阶段,在运行工况逐渐达到稳定后,由于管网中营养物质含量很低,生长繁殖受到一定限制,变形细菌数呈减少趋势;第四阶段,由于细菌数量的持续减小,检测难度增大,延长生物膜的生长时间约为原来的2倍,变形细菌数出现了回升,B、C两点平均分别为(8.61±0.72)log和(9.18±0.67)log.
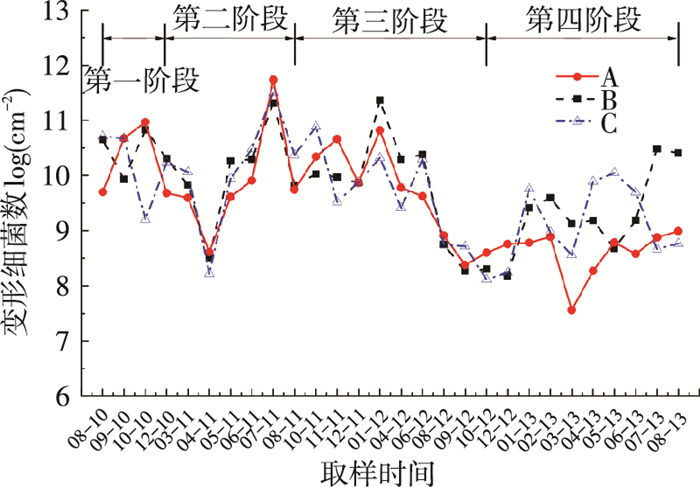
|
图 3 各取样点变形细菌总数变化 |
| 表 3 取样点管网水质指标 |
随着水源水质的变化,3种不同变形细菌的数量与比例也出现了相应变化,结果见图 4.可以看出,各取样点不同变形细菌所占比例随时间的变化规律基本一致.

|
图 4 α-, β-, γ-变形细菌组成比例 |
第一阶段,γ-变形细菌在3种变形细菌中所占比例最大,3个取样点的γ-变形细菌比例分别在52.14%~77.34%、51.02%~77.45%、51.86%~65.99%,均超过3类变形细菌总数的50%;β-变形细菌其次,比例分别在20.27%~43.06%、17.39%~47.13%、21.40%~44.14%;α -变形细菌所占比例最小,绝大多数在10%以下.相对其他两种变形细菌,γ-变形细菌中包含多种重要的病原菌,如肠杆菌科、假单胞菌科等,致病威胁较大.
第二阶段,三者的比例水平开始出现变化,γ-变形细菌的主导优势逐渐减弱,β-变形细菌的比例同样减小,出现了难以检出的情况,而α-变形细菌的比例逐渐提高.与变形细菌总数的变化相似,此阶段变形细菌比例的波动较大,这主要是由于水源的改善引起了管网环境的改变,使得生物膜的菌种结构发生了重组.
第三阶段,继续保持之前的变化趋势,α-变形细菌的比例继续增加,在3种变形细菌中逐渐占据了优势,各点α-变形细菌的比例分别达62.56%~91.36%、75.27%~96.20%、73.08%~96.76%;β-变形细菌进一步减少,各点的变形细菌最大比例仅为15.02%、6.74%和6.50%;γ-变形细菌的比例减小至α-变形细菌与β-变形细菌之间.
第四阶段,由于供水运行工况稳定,变形细菌比例关系的变化较小,3种变形细菌的比例由大到小依次为α-变形细菌、γ-变形细菌、β-变形细菌.β-变形细菌数无法检出的几率在A点与B点均高达44.44%.
管网生物稳定性,指水中营养基质能支持异养细菌生长的潜力.在水厂与水源变化前,出厂水水质虽然绝大多数能够满足饮用水水质标准的要求,但水中残留的多种物质仍然能够促进管网中细菌的生长,易于附着在管壁形成生物膜,此时γ-变形细菌在水中起主导作用,决定了变形细菌总含量的变化.水厂与水源变化后,出厂水的各项水质进一步改善,α-变形细菌对贫营养环境的适应能力较好[7, 16],因此,其含量的升高在一定程度上说明此阶段的管网生物稳定性较好.
2.2 生物膜细菌总数与管网水细菌总数的关系管壁存在生物膜是影响管网水质生物稳定性的重要原因之一[17-18].图 5为A、B、C 3个取样点生物膜样品与水样细菌总数的对比.

|
图 5 生物膜菌落总数与管网水菌落总数的对比 |
由图 5可以看出,管壁生物膜细菌菌落总数与管网水细菌菌落总数存在相关特性.当生物膜菌落总数低于8×104 CFU/cm2时,水中的菌落总数均小于20 CFU/mL,此时,生物膜内细菌存在水平越高,管网水中细菌生长繁殖的可能性越大,B点在2012年9月和2013年3月,生物膜与管网水均出现了细菌数量最大数值.这主要是由于生物膜细菌和水中细菌保持着一定的动态循环关系,生物膜细菌是水中细菌再生长的主要菌源,同时通过吸附、聚集水中的营养物质以及生物膜细菌自身的代谢产物,为水中细菌的生长提供有利条件;当水中细菌的含量逐渐升高时,细菌接触并黏附在管壁的几率增大,促进了生物膜的形成.在水温普遍较低的2~3月,3取样点管网水的菌落总数均出现了陡增现象,而生物膜细菌数量也较高,可能就是生物膜细菌进入水中带来的影响.
但在部分取样时间,生物膜细菌数量较高时,水中细菌表现出不同的生长情况.如A点4~5月,生物膜菌落总数达3.5×105 CFU/cm2以上,但管网水的菌落总数维持在较低的水平,表明生物膜的脱落需要在细菌容量饱和、大多数细菌进入衰亡期、适宜的水力冲刷作用、管壁的可黏附性能等多种条件均满足的条件下才会发生,当生物膜中细菌数量较大,但生物膜脱落条件并不满足时,管网水则基本不受此处生物膜的影响.
在实际给水管网中的各个位置均不同程度地存在着生物膜生长的情况,在维护中应当选择合理的周期对管道进行冲洗,尽量降低生物膜自然脱落的几率,并根据使用年限和管道腐蚀、结垢情况及时更换管道,以保证管网水的生物稳定性.
2.3 生物膜细菌总数与BRP的关系图 6为2013年A、B、C 3取样点生物膜细菌菌落总数与管网水BRP的对比,生物膜细菌的存在水平与水中细菌的再生长也表现出一定的相关性.图中A、B、C点的生物膜菌落总数与管网水BRP的变化整体上保持一致.生物膜的存在对BRP的影响表现在两个方面.一方面,作为水中细菌繁殖的菌源,生物膜细菌的数量在一定程度上能够代表水中细菌生长繁殖的基数,当生物膜细菌的存在水平较高时,其随着生物膜脱落后,水中细菌的初始浓度较高,导致生物污染风险的几率较高.另一方面,根据对生物膜结构组成的研究可知,生物膜的组成主要包括生物体和胞外聚合物(EPS)两部分,且EPS占生物膜的比例最高[19].EPS的主要成分为多糖和蛋白质,其次还有核酸、脂类、腐植酸等物质,这些物质主要来源于细胞分泌、细胞自溶和外界吸附[20].EPS不仅为细菌的生长提供空间,还能保护细胞不脱水、不受有毒物质侵害,同时为饥饿环境中的细菌提供碳源和能量[21].Obayashi等[22]认为,生物膜EPS可以被处于饥饿状态的它们自己的生产者和其他微生物生物降解,当微生物处于高度饥饿状态时,需要更长的时间来适应新的营养环境,这时EPS可以作为有机底物,且碳水化合物被利用的速率比蛋白质快.而给水管网为贫营养环境,包括EPS和生物膜吸附的其他营养物质均可能成为细菌生长的底物.因此,生物膜细菌数量较高时,生物膜中的营养物质也较丰富,当其因水力冲刷等作用脱落进入水中,使得管网水的营养物质浓度出现升高,促进了细菌的再生长.
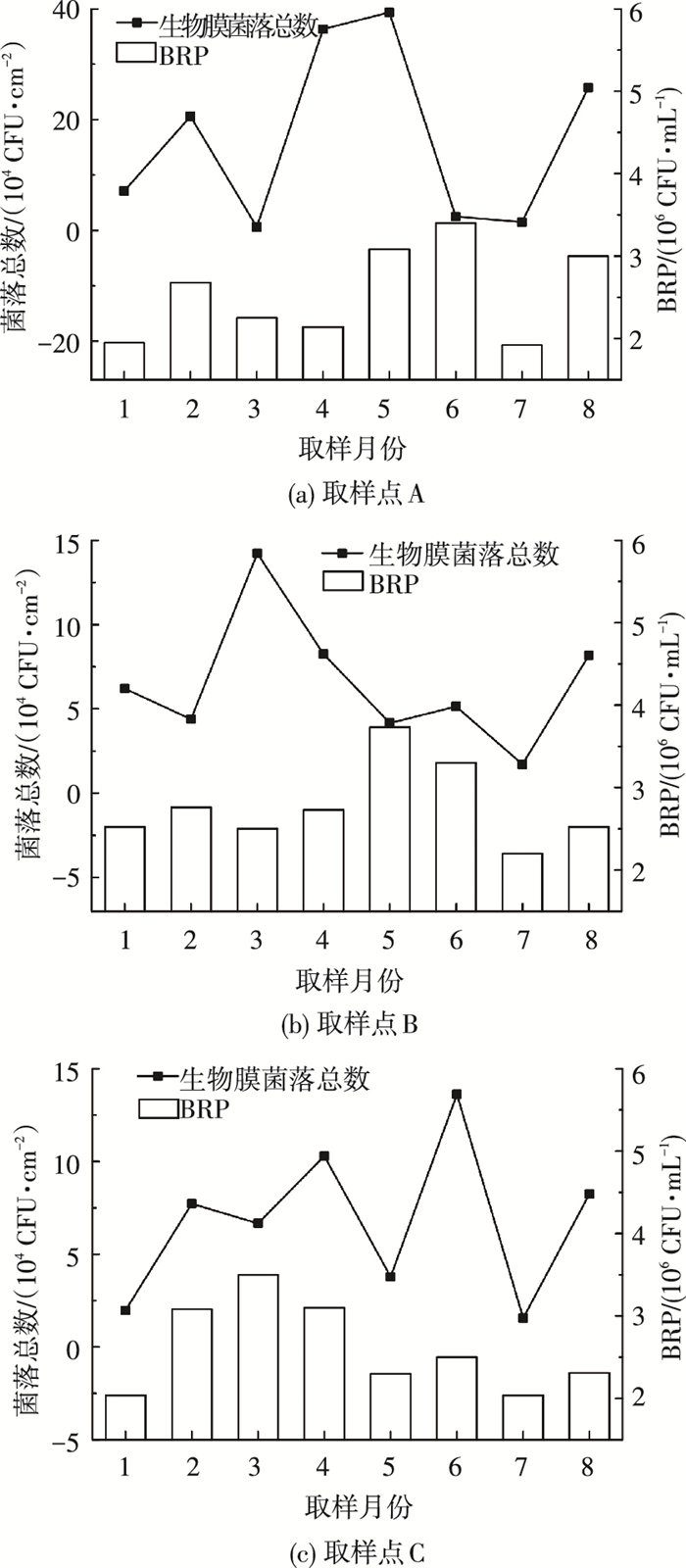
|
图 6 生物膜菌落总数与管网水BRP的关系 |
此外,B点3月的生物膜细菌菌落总数出现了突变,且与BRP的变化不一致,表明生物膜仍然处在生长旺盛的阶段,附着较紧密,菌体和EPS进入水体较少,对水质的影响较小.
3 结论1) 生物膜细菌的多样性与饮用水的生物稳定性有重要关系.2010—2013年期间,由于水源和水厂的变化,生物膜变形细菌数逐渐减少,α-、β-、γ-变形细菌的比例由γ-变形细菌>β-变形细菌>α-变形细菌转变为α-变形细菌>γ-变形细菌>β-变形细菌,致病威胁有一定程度的降低,生物稳定性有一定程度的提高.随着生物膜生长时间的延长,变形细菌在3个月内迅速生长,3个月后生物膜的细菌组成和数量逐渐达到稳定.
2) 管壁生物膜的存在是威胁管网生物稳定性的重要原因之一.生物膜中细菌的存在水平越高,管网水中细菌生长繁殖的可能性越大;但当生物膜脱落条件没有完全满足时,管网水受此处生物膜的影响较小.
3) 当生物膜中细菌数量较高时,生物膜中的营养物质丰富,其从管壁脱落进入水中的几率增加,由此造成管网水中的营养物质浓度升高,从而促进了水中细菌生长与繁殖.
| [1] |
SHANNON M A, BOHN P W, ELIMELECH M, et al. Science and technology for water purification in the coming decades[J]. Nature, 2008, 452: 301-310. DOI:10.1038/nature06599 |
| [2] |
LIU G, VAN DER MARK E J, VERBERK J Q J C, et al. Flow cytometry total cell counts:a field study assessing microbiological water quality and growth in unchlorinated drinking water distribution systems[J]. BioMed Research International, 2013, 2013: 1-10. |
| [3] |
VREEBURG I J H G, BOXALL D J B. Discolouration in potable water distribution systems:a review[J]. Water Research, 2007, 41: 519-529. DOI:10.1016/j.watres.2006.09.028 |
| [4] |
LIU G, VERBERK J Q J C, VAN DIJK J C. Bacteriology of drinking water distribution systems:an integral and multidimensional review[J]. Applied Microbiology and Biotechnology, 2013, 97: 9265-9276. DOI:10.1007/s00253-013-5217-y |
| [5] |
BESNER M C, PRÉVOST M, REGLI S. Assessing the public health risk of microbial intrusion events in distribution systems:conceptual model, available data, and challenges[J]. Water Research, 2011, 45: 961-979. DOI:10.1016/j.watres.2010.10.035 |
| [6] |
HENNE K, KAHLISCH L, BRETTAR I, et al. Analysis of structure and composition of bacterial core communities in mature drinking water biofilms and bulk water of a citywide network in Germany[J]. Applied of Environmental Microbiology, 2012, 78: 3530-3538. DOI:10.1128/AEM.06373-11 |
| [7] |
SUN H, SHI B, BAI Y, et al. Bacterial community of biofilms developed under different water supply conditions in a distribution system[J]. Science of the Total Environment, 2014, 472: 99-107. DOI:10.1016/j.scitotenv.2013.11.017 |
| [8] |
SIMOES L C, SIMOES M, VIEIRA M J. Influence of the diversity of bacterial isolates from drinking water on resistance of biofilms to disinfection[J]. Applied Microbiology and Biotechnology, 2010, 76: 6673-6679. |
| [9] |
管运涛, 赵婉婉, 蒋展鹏, 等. 给水系统附生生物膜发育的生物量和种群结构[J]. 清华大学学报(自然科学版), 2007, 47(6): 818-821. |
| [10] |
WENDE E V, CHARACKLIS W, SMITH D. Biofilms and bacterial drinking water quality[J]. Water Research, 1989, 23(10): 1313-1322. DOI:10.1016/0043-1354(89)90193-0 |
| [11] |
KORMAS K A, NEOFITOU C, PACHIADAKI M, et al. Changes of the bacterial assemblages throughout an urban drinking water distribution system[J]. Environmental Monitoring and Assessment, 2009, 165: 27-38. |
| [12] |
FEAZEL L M, BAUMGARTNER L K, PETERSON K L, et al. Opportunistic pathogens enriched in showerhead biofilms[J]. Proceedings of the National Academy of Sciences, 2009, 106: 16393-16399. DOI:10.1073/pnas.0908446106 |
| [13] |
HUANG K, ZHANG X X, SHI P, et al. A comprehensive insight into bacterial virulence in drinking water using 454 pyrosequencing and Illumina high-throughput sequencing[J]. Ecotoxicology and Environmental Safety, 2014, 109: 15-21. DOI:10.1016/j.ecoenv.2014.07.029 |
| [14] |
DOUTERELO I, HUSBAND S, BOXALL J B. The bacteriological composition of biomass recovered by flushing an operational drinking water distribution system[J]. Water Research, 2014, 54: 100-114. DOI:10.1016/j.watres.2014.01.049 |
| [15] |
SATHASIVAN A, OHGAKI S. Application of new bacterial regrowth potential method for water distribution system-a clear evidence of phosphorus limitation[J]. Water Research, 1999, 33(1): 137-144. DOI:10.1016/S0043-1354(98)00158-4 |
| [16] |
HENNE K, KAHLISCH L, HÖFLE M G, et al. Seasonal dynamics of bacterial community structure and composition in cold and hot drinking water derived from surface water reservoirs[J]. Water Research, 2013, 47: 5614-5630. DOI:10.1016/j.watres.2013.06.034 |
| [17] |
RUBULIS J, JUHNA T. Evaluating the potential of biofilm control in water supply systems by removal of phosphorus from drinking water[J]. Water Science and Technology, 2007, 55: 211-218. |
| [18] |
孙慧芳, 石宝友, 王东升. 供水管网内壁生物膜的特征及其对水质的影响[J]. 中国给水排水, 2011, 27(21): 40-45. |
| [19] |
蒋巍, 钟方丽, 史晋宜, 等. 生物膜胞外聚合物的研究进展[J]. 吉林化工学院学报, 2001, 18: 85-88. DOI:10.3969/j.issn.1007-2853.2001.03.028 |
| [20] |
李久义, 左华, 栾兆坤, 等. 不同基质条件对生物膜细胞外聚合物组成和含量的影响[J]. 环境化学, 2002, 21: 546-551. DOI:10.3321/j.issn:0254-6108.2002.06.005 |
| [21] |
杨义飞, 包常华, 周玲玲, 等. 胞外聚合物的生成特性及其对污水生物处理的影响[J]. 市政技术, 2006, 24: 405-408. DOI:10.3969/j.issn.1009-7767.2006.06.013 |
| [22] |
OBAYASHI A W, GAUDY JR A F. Aerobic digestion of extracellular microbial polysaccharides[J]. Journal of the Water Pollution Control Federation, 1973, 45(7): 1584-1594. |
 2016, Vol. 48
2016, Vol. 48