农业生产过程中含氮化肥的过量使用、工业废水排放及污染物自然净化过程导致地下水中硝酸盐氮(NO3--N)不断积累, 并与金属形成稳定的配合物[1].目前, 中国很多城市及农村地下水中NO3--N的质量浓度严重超过我国饮用水卫生标准(10 mg/L)[2-4].当NO3--N随饮用水进入人体后, 能够在人体酶的作用下转化成亚硝酸盐(NO2--N), 导致“蓝婴综合症”等疾病的发生[5], 危害居民健康.
目前, 去除水中NO3--N的技术主要包括物理化学处理[6](电渗析及反渗透)、化学法(离子交换[7]、电化学反硝化[8]及催化加氢还原[9]、生物反硝化[10]等.其中物理法、生物法及电化学方法存在运行成本高、反应周期长或反应副产物氨氮(NH4+-N)质量浓度高等缺点, 不适用于饮用水处理工程; 离子交换法仅仅是污染物的浓缩转移, 易造成二次污染; 化学催化工艺被称为“最具前景的脱氮工艺”, 但也存在还原剂(H2)利用率低等缺点, 能源浪费严重.本文通过对比电化学反硝化和催化加氢还原工艺的特点, 提出将催化剂加入电化学反应器中, 构成电化学/催化加氢还原耦合工艺, 从而有效避免电化学反硝化选择性差及化学催化工艺能源浪费等缺点, 并采用该工艺降解去除水中NO3--N, 重点考察NO3--N去除反应动力学及机理.
1 实验 1.1 试剂和材料实验试剂:氯化钯(PdCl2, ≥99%, Sigma-Aldrich), 硝酸铜(Cu(NO3)2·3H2O, ≥99%, 科密欧, 天津), 硼氢化钠(NaBH4, ≥99%, 科密欧, 天津), 纳氏试剂及显色剂采用标准方法在实验室配制[11].实验室常用药剂氯化铵(NH4Cl)、亚硝酸钠(NaNO2)、硝酸钠(NaNO3)、盐酸(HCl)、酒石酸钾钠及氨基磺酸均为分析纯(科密欧, 天津).
实验材料:γ纳米氧化铝(γ-Al2O3, 10 nm, BET 125 m2/g, 阿拉丁, 中国上海), 全氟磺酸型质子交换膜((2±0.2) meq/g(干), 2~3 Ω·cm2, <200 mA·cm2, 绿合环保, 上海), 石墨电极(巨星机电, 天津), 0. 45 μm滤膜为市售.
水样配制:实验使用水样(ρ(NO3--N)=50 mg/L)均采用超纯水(18.25 MΩ·cm, 新瑞分析仪器有限公司RUPT-I 10L型超纯水机, 滕州)配制, 使用前用高纯N2(99.99%, 200 mL·min-1)吹脱1 h以去除其中的溶解氧.
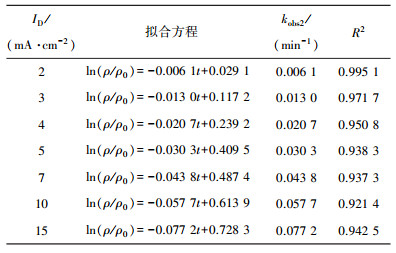
1.2 催化剂制备Pd(5.0%,质量分数)-Cu(1.5%,质量分数)/γ-Al2O3(10 nm)催化剂采用浸渍法制备[12], 并对其表面形貌、粒径、晶型、实际负载率、催化活性及N2选择性进行表征, 结果见图 1及表 1所示.
|
图 1 Pd-Cu/γ-Al2O3催化剂表征 |
| 表 1 Pd-Cu/γ-Al2O3催化剂表征 |
图 2为电化学/催化加氢耦合工艺反应装置.反应器材质为有机玻璃, 整体进行密封, 上部留有排气孔.装置包括两个极室, 容积均为L×B×H=12 cm×10 cm×20 cm, 工作容积为2 000 cm3.电化学/催化反应过程中, 阴极室中填充Pd-Cu/γ-Al2O3催化剂, 填充率为1 g/L.阴阳两极室均装有尺寸15 cm×12 cm×0.2 cm的石墨板作为电极, 并与直流电源(淮安亚光电子有限公司1791-3S)相连, 极板间距为2.0 cm.极室间采用质子交换膜进行分离, 并实现质子传递, 保证电流连通, 同时在一定程度上缓冲极室内反应液的pH变化.阴极室内设置pH探测设备并与HCl加入装置相连, 反应过程中pH探测器能够实时监测反应液pH, 并发出信号至HCl加入装置, 通过向极室内加入HCl溶液控制反应液pH在实验要求范围内.两极室外侧分别连接循环泵(0.5 L/min)进行水力循环, 保证反应体系处于完全混合状态, 提高传质过程.

|
图 2 电化学/催化加氢工艺装置 |
在N2保护的条件下, 向阴极室内加入2 000 mL水样, 开启循环泵进行水力搅拌, 同时调节反应体系pH在5.2±0.2内, 称取2.0 g Pd-Cu/γ-Al2O3催化剂投加到阴极反应液中; 向阳极室内加入2 000 mL浓度为0.1 mol/L的KNO3溶液, 保证极板间具有良好的电导性; 封闭极室, 开启直流电源并调节到预设电流强度(360、540、720、900、1 260、1 800及2 700 mA), 开启pH控制器, 反应计时开始, 反应温度为室温(25 ℃).在既定时间利用一次性注射器取样, 经过0.45 μm滤膜后置于50 mL比色管中, 并采用紫外-可见分光光度计(美国哈希公司DR5000)进行后续质量浓度测定分析.
1.5 分析方法NO3--N, 紫外分光光度法(B); NO2--N, N-(1-萘基)-乙二胺光度法; NH4+-N, 纳氏试剂法.总氮(TN)质量浓度假设为NO3--N、NO2--N及NH4+-N质量浓度的代数和.
计算中, 反应降解速率(mg·L-1·h-1)为单位体积单位时间内降解去除NO3--N的质量;反应对N2选择性指假设反应最终产物仅为NH4+-N和N2时, N2生成量与NO3--N去除量之比.
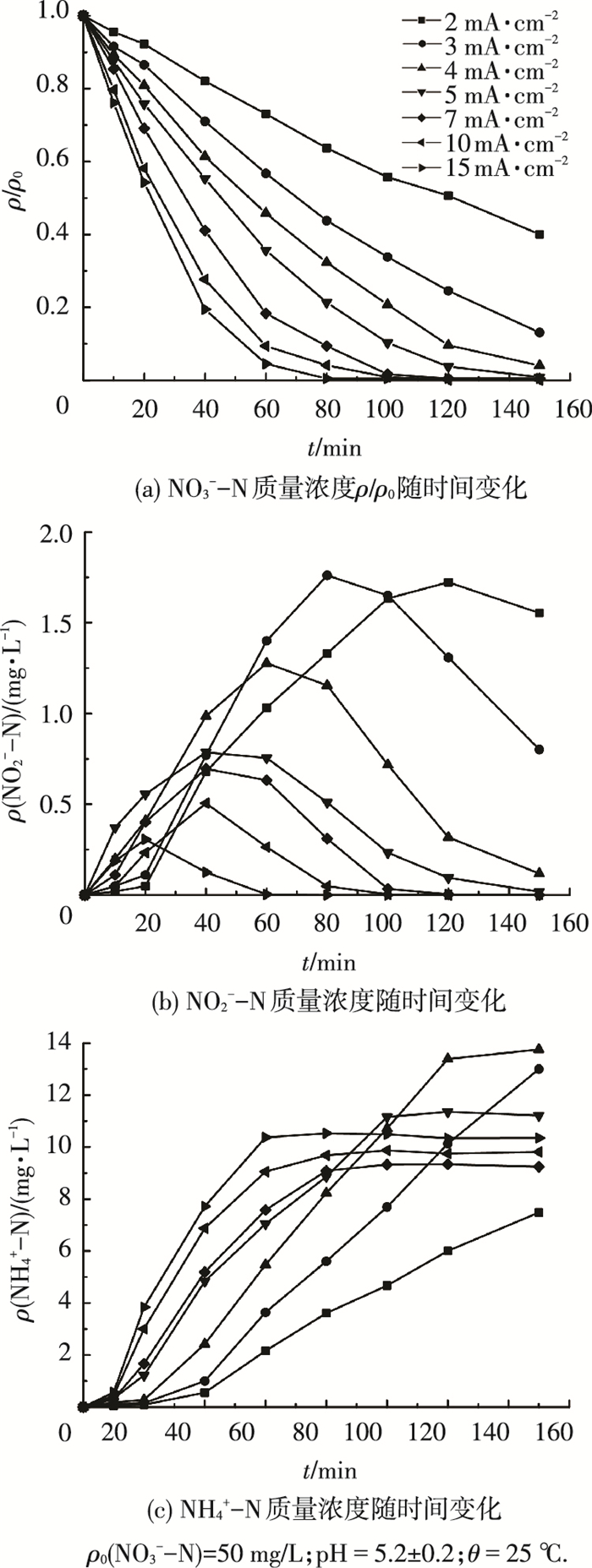
2 结果与讨论 2.1 电化学/催化加氢工艺去除水中硝酸盐的效能为考察电化学/催化加氢工艺降解去除水中NO3--N的效能, 在室温25 ℃、原水NO3--N质量浓度为50 mg/L的条件下, 采用不同电流密度进行反硝化反应, 结果见图 3.
|
图 3 电化学/催化加氢工艺降解NO3--N效能 |
由图 3(a)可以看出, 电化学/催化加氢工艺能够有效去除水中的NO3--N, 且去除效率随电流密度的增加而提高, 最大降解速率为72.6 mg·L-1·h-1.其中, 当反应时间为120 min、施加电流密度>3 mA·cm-2时, NO3--N的剩余质量浓度均小于10 mg/L, 去除率均可达80%以上;而当电流密度≥10 mA·cm-2时, 增加电流密度NO3--N的去除速率增加不再明显, 这是因为此时极板及催化剂上对目标物NO3-的活性吸附位接近饱和.由图 3(b)中NO2--N的质量浓度随反应过程的变化可以看出, 反应过程出现了不同程度中间产物NO2--N积累的现象, 说明该反应是分步进行的, 且其最大积累量与施加电流密度大小呈负相关性.原因可能是当电流密度增加时, 产生的H2促进催化反应进行, 且NO2--N更易被催化降解[12], 从而使NO2--N积累量减小;由图 3(c)NH4+-N生成方面发现, 在反应初期并没有氨根离子生成, 反应结束时, NH4+-N生成量整体上随施加电流密度的提高先减小后增加(按反应完全计).这是因为当电流增加时, 产生的H2量增多, 催化加氢反应所占比重增加, 导致NH4+-N生成量整体上有所降低, 而当电流密度增加到一定值以后(7~10 mA·cm-2), H2增加作用效果不再明显, 电流密度增加, NH4+-N生成量有所增加.
2.2 电化学/催化加氢工艺反应的动力学电化学及电化学/催化反硝化去除水中NO3--N的过程可表示为

|
(1) |
式中:ρ(NO3-)为体系中NO3--N的质量浓度, ID为施加电流密度(mA·cm-2), k为反应速率常数(cm2·mA-1·min-1), t为反应时间(min).
在单次反应过程中, 施加恒定的电流密度时, 可令kobs=kID, 因此, 式(1)可转换为式(2)
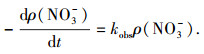
|
(2) |
kobs为假一级反应速率常数(min-1).
并对图 3数据进行假一级动力学拟合, 拟合结果见图 4(a)及表 2.
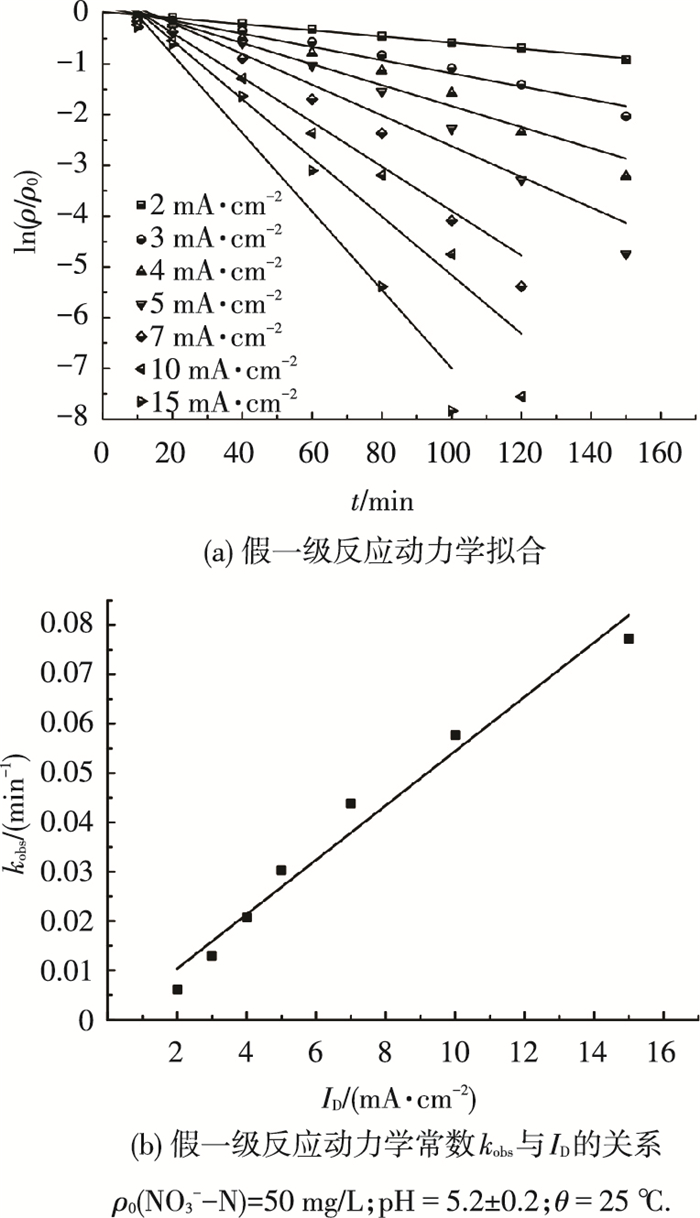
|
图 4 电化学/催化加氢工艺降解NO3--N的动力学 |
| 表 2 不同电流密度下电化学/催化加氢工艺降解NO3--N动力学拟合 |
由图 4(a)可以看出, 在施加恒定的电流密度条件下, 电化学/催化加氢去除水中NO3--N反应的ln(ρ/ρ0)与反应时间t呈现较好的线性关系, 说明电化学/催化加氢去除水中硝酸盐氮的反应符合假一级反应动力学规律, 随着电流密度的增加, 反应速率常数kobs由0.006 1 min-1增大到0.077 2 min-1.由表 2可知, 拟合方程相关系数R2均在0.92以上, 说明拟合方程回归相关性良好.将不同电流密度下的kobs与电流密度值进行拟合,结果见图 4(b).二者具有良好的线性相关性, 其中, 拟合方程为kobs=0.005 51ID-0.000 66, R2=0.97, 说明电化学/催化加氢工艺降解硝酸盐反应对于施加电流密度ID也同为一级反应, 整体为二级反应, 反应动力学常数为k=0.005 5 cm2·mA-1·min-1.
2.3 电化学/催化加氢工艺的反应机理电化学/催化加氢工艺去除水中NO3--N机理如图 5所示.在反应过程中, 中间产物NO2--N的积累及副产物NH4+-N的延迟生成(图 3(c))说明反应是分步进行的.首先, 水体中的部分NO3-离子会吸附到石墨电极板及催化剂表面活性点位上, 并在电极板的给电子还原及催化加氢还原作用下转化为NO2-离子, 类似地, NO2-进而被逐步还原成为N2及NH4+离子.
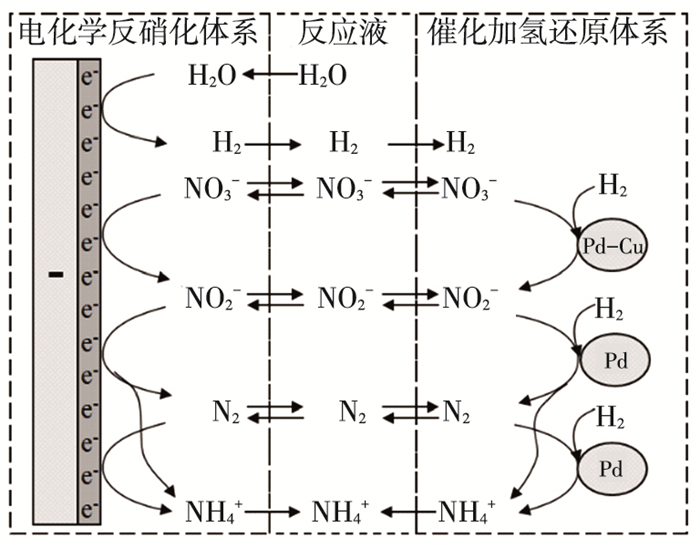
|
图 5 电化学/催化加氢降解NO3--N机理 |
在电化学反硝化体系中, 可能发生的反应:

|
同时, 在阴极石墨板上发生水的电解反应, 生成大量的H2微气泡, 从极板上脱离并扩散到反应液中.因此, 在阴极板上存在反应
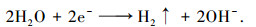
|
在催化加氢还原体系中, 以电解水产物H2为还原剂, 在Pd-Cu/γ-Al2O3催化剂的作用下发生催化加氢还原反应, NO3-被逐步还原成N2、NH4+.根据之前报道[5, 13], 其可能发生的反应如下:
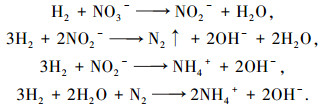
|
电化学反硝化反应与催化加氢还原反应通过电解水产生H2反应的桥联作用联结成为一个整体.由于催化加氢还原体系中还原剂H2来源于水的电解反应, 电化学/催化加氢工艺宏观总反应依然表现为电化学反硝化反应[14],即
主反应
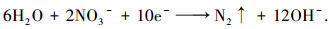
|
副反应
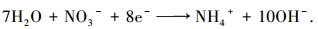
|
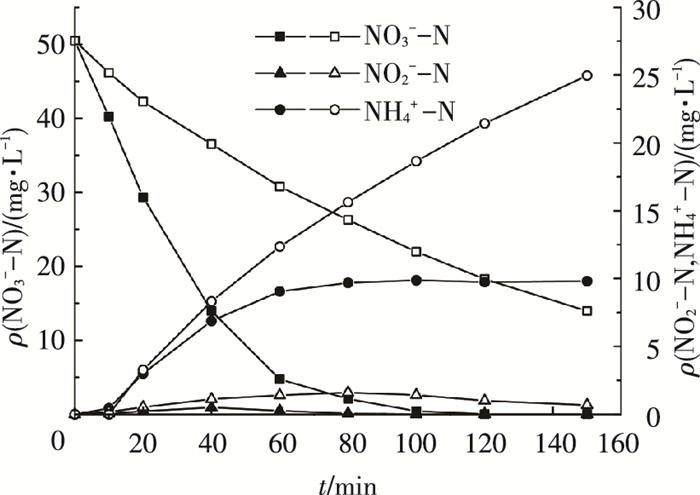
为进一步考察两种反应的协同性, 取施加电流密度为10 mA·cm-2, 其余反应条件均相同, 在同一实验装置内进行电化学反硝化实验, 对比Pd-Cu/γ-Al2O3催化剂投加与否对NO3--N去除效能的影响, 结果如图 6所示.可以看出, 在未填充催化剂的条件下, NO3--N有一定的降解速率.通过对比可以看出, Pd-Cu/γ-Al2O3催化剂的加入能够有效提高NO3--N的去除速率, 说明在电化学/催化加氢还原耦合工艺中电化学反硝化反应与催化加氢还原NO3--N反应是两种同时发生的独立且协同作用的反应, 整体反应可能是上述两种反应物理意义上的叠加.
|
ρ0(NO3--N)=50 mg/L;ID=10 mA·cm-2;pH=5.2±0.2;θ=25 ℃;实心标注:加入催化剂;空心标注:未加入催化剂. 图 6 电化学及电化学/催化加氢工艺对比 |
有必要说明的是, 由电解水产生的H2气泡尺寸小, 分散程度高, 更容易吸附在催化剂表面, 有效提高传质速率, 促进催化加氢反应的进行, 因此,能够有效提高H2的利用效率;催化剂的加入可有效降低副产物NH4+-N的生成量, 提高工艺整体对N2的选择性;同时, 两种条件下反应所采用的电流相同, 时间也相同, 根据法拉第定律可知二者消耗的电量相同, 而催化剂填充后能够很大程度提高NO3--N的降解效率, 即提高反应能源利用效率, 降低能量损耗, 进而降低制水成本.
3 结论与展望1) 电化学/催化加氢工艺能够有效去除水中NO3--N, 去除速率可达72.6 mg·L-1·h-1以上, 对N2选择性为80%~84%;反应符合二级反应动力学规律, 动力学常数k=0.005 5 cm2·mA-1·min-1.
2) 电化学/催化加氢还原耦合工艺中同时存在电化学反硝化反应与催化加氢还原NO3--N两种反应, 二者相互独立并通过电解水产H2反应的桥联作用联结成为一个整体.
3) 电化学/催化加氢工艺避免了电化学反硝化对N2的选择性差及催化加氢工艺需外加还原剂H2等缺点,且便于控制,运行稳定, 在处理NO3--N污染水体方面具有很好的应用前景.但目前该工艺应用于实际工程中仍存在许多不足和亟需解决的问题, 如地下水硬度及其他物质对降解反应的影响,如何更大程度提高工艺反应对N2的选择性等均需要进一步研究.
| [1] |
COTTON F A, WILKINSON G, MURILLO C A, et al. Advanced inorganic chemistry[M]. Wiley: [s.n.], 1988: 1455.
|
| [2] |
冯锦霞, 朱建军, 陈立. 我国地下水硝酸盐污染防治及评估预测方法[J]. 地下水, 2006, 28(4): 58-62. |
| [3] |
杜连凤, 赵同科, 张成军, 等. 京郊地区3种典型农田系统硝酸盐污染现状调查[J]. 中国农业科学, 2009, 42(8): 2837-2843. |
| [4] |
高新昊, 江丽华, 刘兆辉, 等. 山东省农村地区地下水硝酸盐污染现状调查与评价[J]. 中国农业气象, 2011, 32(1): 89-93. |
| [5] |
WANG Ying, QU Jiuhui, LIU Huijuan, et al. Adsorption and reduction of nitrate in water on hydrotalcite-supported Pd-Cu catalyst[J]. Catalysis Today, 2007, 126(3/4): 476-482. |
| [6] |
ABOU-SHADY A, PENG Changsheng, BI Jingjing, et al. Recovery of Pb (Ⅱ) and removal of NO3- from aqueous solutions using integrated electrodialysis, electrolysis, and adsorption process[J]. Desalination, 2012, 286: 304-315. DOI:10.1016/j.desal.2011.11.041 |
| [7] |
SONG Haiou, ZHOU Yang, LI Aimin, et al. Selective removal of nitrate from water by a macroporous strong basic anion exchange resin[J]. Desalination, 2012, 296: 53-60. DOI:10.1016/j.desal.2012.04.003 |
| [8] |
DASH B P, CHAUDHARI S. Electrochemical denitrificaton of simulated ground water[J]. Water Research, 2005, 39(17): 4065-4072. DOI:10.1016/j.watres.2005.07.032 |
| [9] |
SÁ J, VINEK H. Catalytic hydrogenation of nitrates in water over a bimetallic catalyst[J]. Applied Catalysis B:Environmental, 2005, 57(4): 247-256. DOI:10.1016/j.apcatb.2004.10.019 |
| [10] |
GONZÁLEZZ P J, CORREIA C, MOURA I, et al. Bacterial nitrate reductases:molecular and biological aspects of nitrate reduction[J]. Journal of Inorganic Biochemistry, 2006, 100(5/6): 1015-1023. |
| [11] |
EATON A D, CLESCERI L S, GREENBER A E. Standard methods for the examination of water and wastewater[M]. Washington, DC: American Public Health Association, 2005: 20001-23710.
|
| [12] |
CHEN Yingxue, ZHANG Yan, CHEN Guanghao. Appropriate conditions or maximizing catalytic reduction efficiency of nitrate into nitrogen gas in groundwater[J]. Water Research, 2003, 37(10): 2489-2495. DOI:10.1016/S0043-1354(03)00028-9 |
| [13] |
SHIN H, JUNG S, BAE S, et al. Nitrite reduction mechanism on a Pd surface[J]. Environmental Science & Technology, 2014, 48(21): 12768-12774. |
| [14] |
LI Hulin, ROBERTSON D H, CHAMBERS J Q, et al. Electrochemical reduction of nitrate and nitrite in concentrated sodium hydroxide at platinum and nickel electrodes[J]. Journal of the Electrochemical Society, 1988, 135(5): 1154. DOI:10.1149/1.2095900 |
 2016, Vol. 48
2016, Vol. 48