2. 中国地质大学(武汉) 环境学院, 430074 武汉;
3. 中国科学院生态环境研究中心 环境水质学国家重点实验室, 100085 北京
2. School of Environmental Studies, China University of Geosciences(Wuhan), 430074 Wuhan, China;
3. State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, 100085 Beijing, China
污水生化处理过程中会产生大量的剩余污泥,这些污泥的含水率通常超过99%.由于高的污泥含水率伴随着大的污泥体积,污泥的运输费用高、难度大、占用大量的处理场地[1],故2009年住建部出台的混合填埋用泥质标准中明确规定,污泥含水率必须降至50%以下.一般来讲,污泥中的水分包括游离水(约占70%)、间隙水(约占20%)、吸附水(约占7%)和结合水(约占3%)等[2].污泥的化学组成是决定其脱水性的关键.其中,胞外聚合物(extracellular polymeric substances,EPS)占污泥总量的60%~80%[3],EPS分布和组成对污泥脱水性的影响最为显著[4].传统的化学调理药剂如PAC、FeCl3和PAM等主要是通过电中和架桥作用促使污泥颗粒絮凝来改善污泥脱水性[5-7],而高级调理过程主要是利用氧化、酸碱、热处理等破坏污泥絮体结构,促使EPS溶解,从而使结合水转化为自由水,降低脱水污泥的含水率[8].
过氧乙酸(PAA)在污泥处理方面的研究较少,现有研究侧重于PAA对污泥破解减量方面.苏凤宜等[9]研究了PAA氧化对剩余污泥的减容效率,发现PAA的污泥破解率为10%左右, 经过超声分散后破解率可以进一步提高,处理后的污泥混合液具有较好的生物可降解性.孙德栋等[10]的研究表明,微波和PAA氧化同剩余污泥破解方面表现出明显的协同效应,处理后污泥上清液的蛋白质和多糖质量分数明显上升.截至目前,PAA处理过程中活性污泥的理化性质如何变化,尚未有深入认识.如何将PAA和重絮凝相结合,从而形成基于污泥深度脱水的化学调理技术,国内外均未见报道.为此,本研究旨在了解PAA处理对活性污泥脱水性及EPS组成和分布的影响,采用常规化学分析、三维荧光光谱和高效体积排阻色谱等方法深入解析PAA处理过程,研究不同无机混凝剂的重絮凝过程产生絮体形态及对污泥溶解性EPS特性的影响.
1 实验 1.1 实验材料 1.1.1 化学试剂实验用过氧乙酸为质量分数21%的溶液,其余化学药品均为分析纯.盐酸和氢氧化钠为质量分数10%的溶液.
1.1.2 活性污泥来源与特性污泥取自北京市北小河再生水厂的剩余污泥, 该水厂处理规模为10万m3·d-1,采用膜生物反应器(MBR)工艺.活性污泥的基本性质见表 1.
| 表 1 活性污泥的基本性质 |
室温条件下,取150 mL污泥体系,在不同pH条件下,投加相应剂量PAA,反应1 h后将污泥pH调节至7左右, 然后取50 mL样品提取EPS进行化学分析,剩余100 mL污泥进行污泥比阻的测定.
1.2.2 污泥脱水性的测定采用污泥比阻(RSF)来评价污泥的脱水性能,其测量方法取待测污泥样品100 mL于量筒中, 在恒定气压p=0.56 MPa的条件下过滤, 每隔10 s记录1次滤液体积, 直到漏斗中滤饼层出现裂缝为止, 停止抽滤, 利用差量法测定滤饼含水率, 然后进行污泥比阻测定.其表达式为
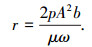
|
(1) |
式中:p为过滤压力(kg/m2),A为过滤面积(m2),μ为滤液的动力黏度(kg·s/m2), ω为滤过单位体积的滤液在过滤介质上截留的干固体质量(kg/m3), b为过滤方程t/V=bV+a所代表的直线的斜率,t为过滤时间(s),V为滤液体积(m3).
1.2.3 EPS的提取50 mL离心管取50 mL污泥在5 000 r/min下离心10 min,收集上清液中有机物即为溶解性EPS(soluble EPS, SEPS).然后向离心管中加入0.05% NaCl溶液至50 mL,通过搅拌使污泥重新悬浮后在20 kHz超声下处理10 min,重复离心操作,收集上清液中有机物即为疏松结合型EPS(LB-EPS).重新补充0.05% NaCl溶液至50 mL,在60 ℃水浴中放置30 min,紧接着在5 000 r/min下离心10 min,分离上清液中有机物为紧密结合型EPS(TB-EPS)[11].本实验采用溶解性有机碳(DOC)定量EPS.
1.2.4 EPS的分析和测定 1.2.4.1 EPS中多糖和蛋白质的测定所有化学分析均进行两次.蛋白质和多糖的分析按照Frølund等[12]提出的方法.多糖采用蒽酮法测定,以葡萄糖(Sinopharm)为标准.蛋白质采用Lowry法测定,牛血清蛋白(Sigma)为标准物质[12].
1.2.4.2 三维荧光三维荧光光谱采用荧光光度计(Hitachi F-4500,Japan)测定.激发波长区间为200~400,波长间距为10 nm,发射波长区间为220~550 nm,波长间距亦为10 nm.光谱的扫描速度为12 000 nm/min.Sheng等[13]的研究显示,荧光峰的位置、强度和不同荧光峰的强度比例均不受离子强度的影响.
1.2.4.3 高效体积排阻色谱(HPSEC)高效体积排阻色谱(HPSEC)采用Waters液相色谱系统,由Waters 2487双波长吸收检测器、Waters 1525泵组成.分离所用色谱柱为Shodex KW 802.5柱(Shoko co., Japan).流动相为用Milli Q水配制的5 mmol/L的磷酸盐缓冲液和0.01 mol/L NaCl溶液,配制后用0.22 μm的膜过滤,然后超声波脱气15 min.流动相流速为0.8 mL/min,进样量为200 μL.聚苯乙烯磺酸钠(PSS)作为分子质量的标准物质,标线中所用的PSS分子质量分别为1.8、4.2、6.5和32 ku (Sigma, Aldrich) [14-15].需要指出的是,由于多糖分子中不含有共轭双键,只有以糖蛋白或糖脂的形式存在时才能被紫外测出.
1.2.5 其他指标测定方法TOC采用Torch燃烧自动进样分析仪(Teledyne Tekmar,USA)测定.pH测定采用pHS-3C (中国上海) pH计.
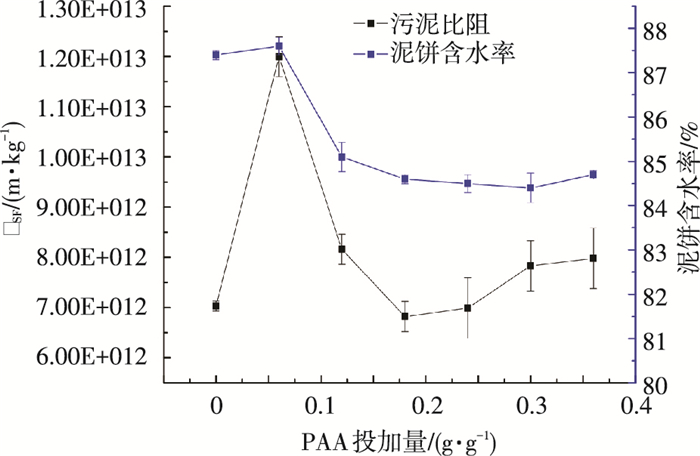
2 结果与讨论 2.1 PAA投加量对污泥特性的影响 2.1.1 RSF和滤后泥饼含水率PAA投加量对污泥RSF和泥饼含水率的影响如图 1所示.相比原泥,PAA在投加量0.06 g/g时,RSF明显上升,而滤后泥饼含水率无明显变化;而当PAA投加量大于0.1 g/g时,RSF下降至原泥的水平,而泥饼含水率由87.4 %降至84.4 %.这说明PAA处理有效破解了污泥EPS,促使结合水释放,从而提高了污泥的过滤脱水干化效果.
|
图 1 PAA投加量对污泥RSF和泥饼含水率的影响 |
PAA投加量对污泥EPS分布和组成的影响见图 2所示.随着PAA投加量的升高,TB-EPS降低,说明PAA对EPS有较强的破解作用,而LB-EPS和SEPS质量分数逐渐升高.由图 2(b)和(c)看出,随着PAA投加量的增加,SEPS中蛋白质呈下降趋势而多糖基本没有变化,而SEPS总量却明显增加,说明蛋白质和多糖被氧化为其他小分子有机物.当PAA投加量上升至0.06 g/g的过程中,LB-EPS和SEPS中蛋白质质量分数逐渐上升,而后随PAA投加量的进一步升高而降低.Yu等[16-17]的研究显示,污泥脱水性能(以SRF计)主要取决于SEPS和LB-EPS中蛋白质质量分数.不难看出,当PAA投加量为0.06 g/g时,污泥LB-EPS和SEPS中蛋白质质量分数达到最高,故此时SRF值也达到最高.

|
图 2 PAA投加量对污泥EPS分布和组成的影响 |
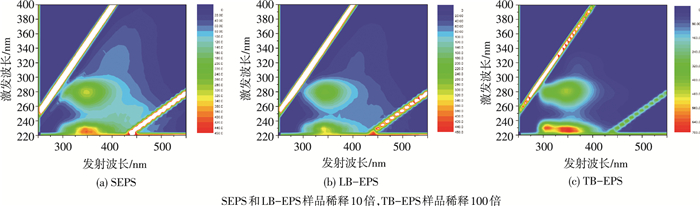
三维荧光光谱是一种高灵敏度和选择性的分析工具,在生物源物质的表征方面具有独特的优势[18].从图 3可以看出,原始污泥SEPS和LB-EPS光谱中有Peak A (λex/em=280/335)——色氨酸类蛋白、Peak B (λex/em=225/340)——芳香类蛋白、Peaks C (λex/em=330/410)——腐殖酸和Peak D(λex/em=275/425)——富里酸4个荧光峰;而TB-BEPS中仅有Peak A和Peak B两个峰[19].这与Zhang等[17]的研究结果一致,SEPS和LB-EPS的化学组成类似,同时含有蛋白质和腐殖酸类物质,而TB-EPS往往只含有蛋白质类有机物.Sheng等[13]的研究显示,当样品的DOC质量浓度小于10 mg/L时,EEM光谱中的荧光强度可以反映定量EPS的质量分数.PAA投加量对污泥不同EPS组分荧光峰强度的影响见表 2.经过PAA处理后,各个EPS组分中蛋白峰的荧光强度均减弱.例如,在SEPS中,PAA投加量由0.06 g/g上升至0.36 g/g,Peak A和Peak B的荧光强度分别由182.0和208.4降至42.5和32.4.这与化学分析的结果一致.当PAA投加量大于0.3 g/g时,SEPS和TB-EPS中蛋白峰荧光峰几乎无法检出.另外,PAA处理对SEPS腐殖酸和富里酸荧光强度影响不大.通常,EPS中各有机组分(蛋白质、多糖、腐殖酸和富里酸)以结合态的形式存在,PAA氧化导致EPS结构发生破解,蛋白质的分子结构被彻底破坏,但腐殖酸和富里酸具有较强的抗氧化性,在PAA的作用下无法有效降解.
|
图 3 原泥不同EPS层组分荧光光谱 |
| 表 2 PAA投加量对不同EPS组分荧光强度的影响 |
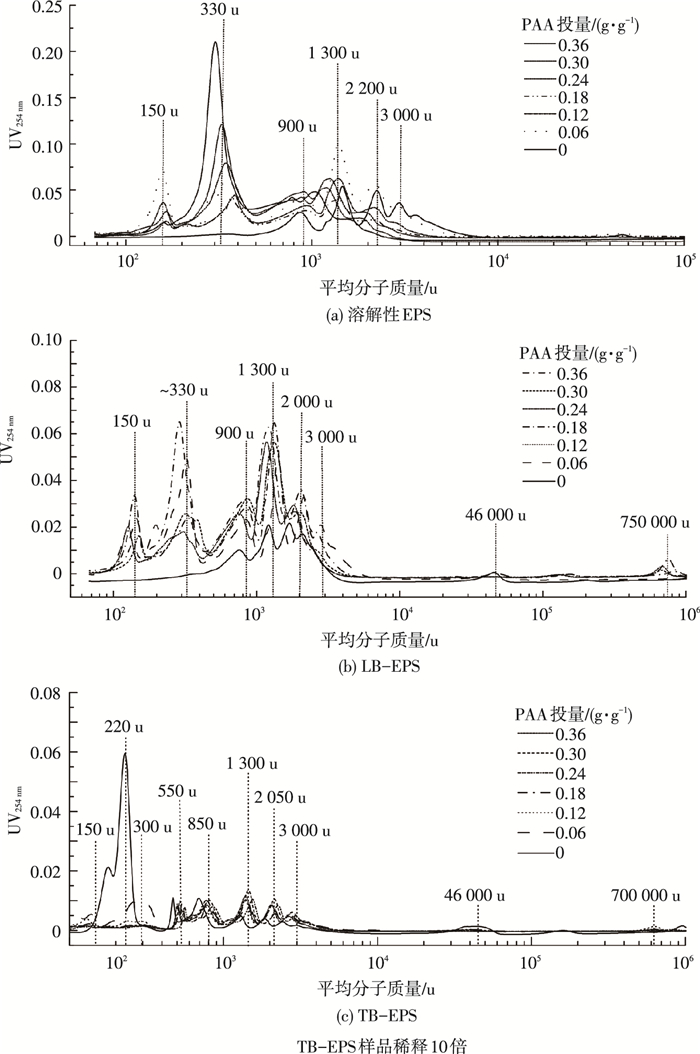
PAA投加量对污泥不同EPS组分分子质量的组成影响见图 4所示.SEPS包括3 000、2 200、1 300和900 u 4个峰;LB-EPS中分子质量峰为46 000、2 000、1 300和900 u;TB-EPS中存在46 000、2 500、1 200、850、500、220 u几个峰.Ramesh等[20]的研究结果显示SEPS包含一些小颗粒物质,而结合型EPS主要由更大的胶体颗粒物组成.根据Lyko等[21]的分类方法,EPS的分子质量可以大致分为3个部分:大分子有机物大分子组分(>5 000 u)——蛋白质和多糖、中分子质量组分(1 000~5 000 u)——主要为腐殖酸和低分子质量组分(<1 000 u)——分子骨架物质[21].经过PAA氧化处理后,SEPS的中分子质量区间强度增加,同时出现330和150 u两个小分子质量物质,且其强度随PAA投加量的增加而逐渐增强.结合化学分析,这两种小分子物质极有可能属于氨基酸类,说明腐殖酸类物质质量分数上升,同时高分子物质被溶解为小分子,这与荧光分析结果一致.经过PAA处理后LB-EPS和TB-EPS和SEPS表现出类似的现象,即小分子质量有机物明显增多,同时新出现一个高分子质量峰(750 000 u),这可能是PAA裂解污泥处理过程中产生的.在高PAA剂量条件下,该大分子质量物质被溶解.
|
图 4 PAA投加量对不同EPS组分分子质量分布的影响 |
先通过HCl和NaOH调理出几个不同pH梯度的污泥样品,然后向每组样品投加PAA(0.36 g/g)进行处理,对每组污泥的脱水性和滤后泥饼含水率的影响见图 5所示.可以看出,当pH由9降至3,污泥RSF和泥饼含水率分别由8.7E+012 m/kg减小至5.1E+012 m/kg和85%降至77.6%.上述现象表明,酸性条件有利于污泥的过滤脱水.为了揭示其机理,进一步分析污泥EPS的变化.

|
图 5 pH对PAA处理后污泥RSF和过滤脱水后泥饼含水率的影响 |
pH对PAA处理后污泥EPS分布和组成的影响见图 6.由图 6(a)可以看出,当pH为3时,SEPS质量分数达到最高,后随pH上升无明显变化.pH由3上升至9的过程中,LB-EPS和TB-EPS质量分数分别由62.0和16.8 mg/g上升至93.8和23.4 mg/g.上述结果说明,酸性条件下PAA对污泥的氧化破解效率更高,可以更加有效地将LB-EPS和TB-EPS溶解.污泥的EPS高度亲水,酸性条件强化了PAA对污泥的破解作用,促使结合水释放出来,故过滤脱水后泥饼含水率更低.pH对PAA处理后不同EPS组分中多糖和蛋白质质量分数的影响见图 6(b)和(c)所示.不难看出,SEPS中蛋白质和多糖的变化呈现相反的变化趋势.随着pH上升,蛋白质质量分数逐渐降低,而多糖质量分数持续增加.然而,在LB-EPS和TB-EPS中,多糖和蛋白质质量分数随pH的升高均有所增加,这与BEPS总量的变化一致.需要指出的是,PAA对蛋白质的溶解效率更强地依赖于pH.
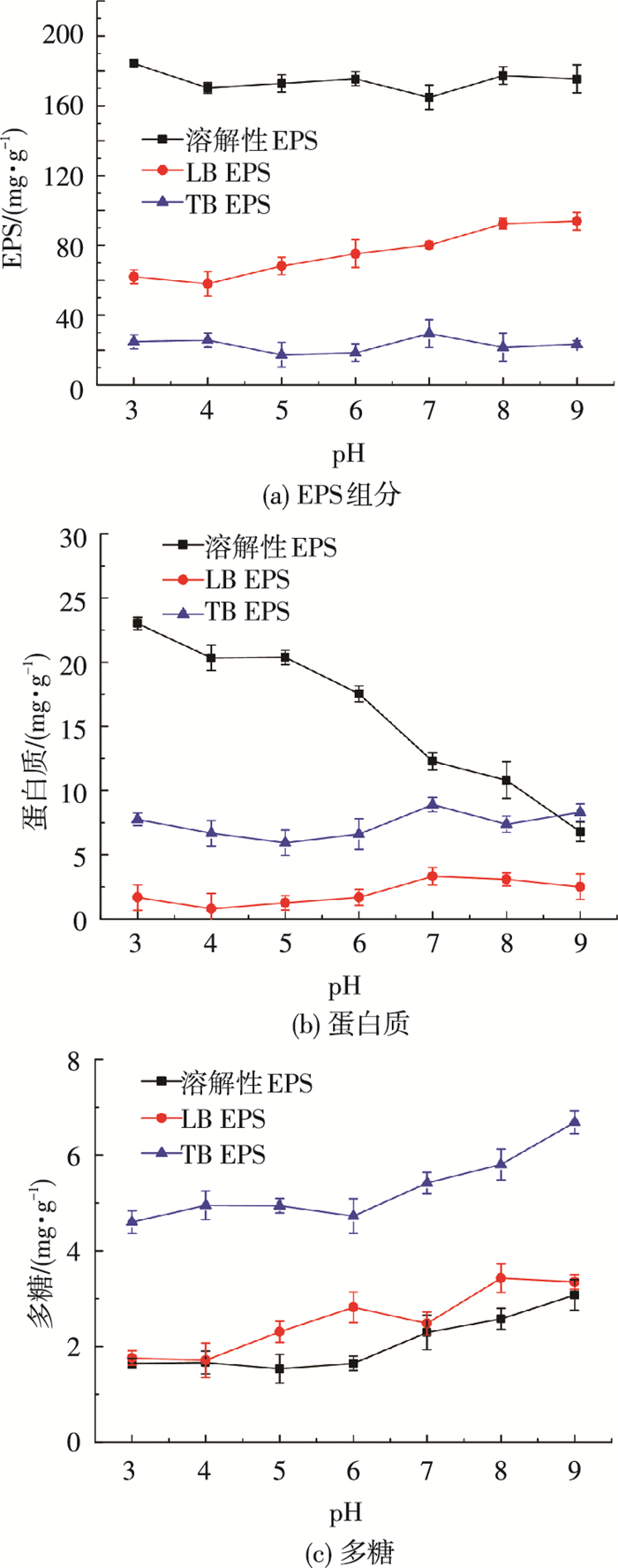
|
图 6 pH对PAA处理后污泥EPS分布和组成的影响 |
从表 3中可以看出,经过PAA处理后,两个蛋白峰强度明显降低,而腐殖酸和富里酸类有机物的荧光强度有所上升.这说明PAA可以有效破坏污泥EPS中蛋白质,而腐殖酸和富里酸类在污泥溶解过程中释放出来.诸多研究显示,EPS中的蛋白质组分是决定污泥脱水性的关键因素[22],高剂量下PAA对蛋白质的氧化溶解是导致污泥脱水性改善的主要原因.此外,在不同pH条件下,PAA氧化处理后SEPS和LB-EPS的荧光特性变化不大,而酸性条件下处理后的TB-EPS中两个蛋白峰强度低于中性和碱性条件下.这是由于PAA的解离常数pKa为8.2,发生解离后的PAA反应活性会下降[23].因此,酸性条件下PAA对蛋白质的氧化降解能力更强.
| 表 3 不同pH条件下PAA处理后EPS荧光强度 |
如图 7所示,在不同pH情况下,PAA处理后SEPS的中等分子质量有机物(1 000~3 000 u)均被有效去除,新出现分子质量为320和200 u两个小分子降解产物.在pH小于6时,PAA处理后的320 u分子质量峰强度较高,明显高于pH大于7的条件下,这说明酸性环境有利于PAA对污泥EPS的溶解.总体而言,对于PAA处理后的LB-EPS,中等分子质量有机物(800、1 300和2 200 u)随着pH的降低而减少,而300 u分子质量峰增强.前述已经提到中等分子质量的有机物主要为腐殖酸类,从而进一步证实酸性环境强化了PAA对LB-EPS中腐殖酸物质的氧化,这与荧光的分析结果一致.另外,随着pH的降低,PAA对TB-EPS中各分子质量有机物的去除效率均有所提高.
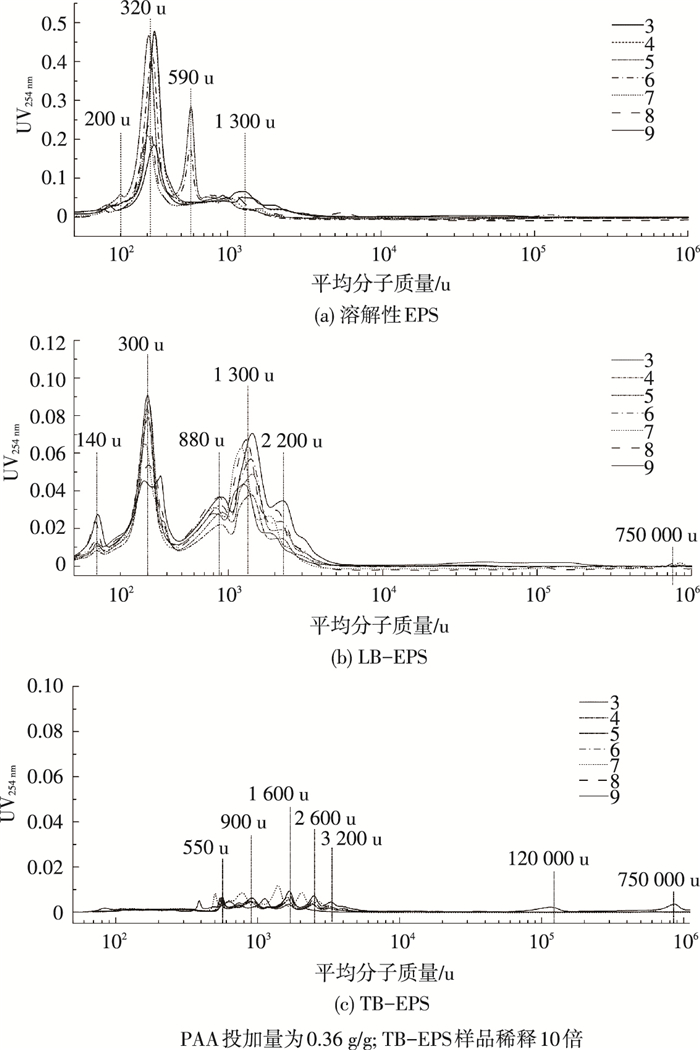
|
图 7 pH对PPA处理后污泥不同EPS组分分子质量分布的影响 |
氯化铁和PAC投加量对污泥RSF和泥饼含水率的影响见图 8.可以看出,经过化学重絮凝后,污泥RSF和泥饼含水率均明显下降,即达到了本研究的目的.当PAC和氯化铁的投加量为0.16 g/g,RSF和泥饼含水率降至最低,分别为1E+013和79%与3E+013和84.2%.总体而言,PAC在过滤速率和干化效果方面均优于氯化铁.这可能是由于高分子无机絮凝剂具有更强的电中和架桥作用,从而在混凝效果方面优于低分子无机盐.

|
图 8 不同混凝剂重絮凝对污泥脱水性的影响 |
不同处理阶段污泥的显微照片如图 9所示.原始污泥呈絮团状,丝状菌缠绕在絮体之间,起到架桥的作用,胶态的EPS包覆和镶嵌在絮体之中.经过PAA处理后,污泥絮体被有效破解,溶液中散落着菌胶团破解之后的碎片,无法观察到具有完整结构的絮体.投加混凝剂后,可见的污泥絮体重新形成,且新絮体的外周更加规则,无胶态状物质包裹.此外,从外观看,氯化铁和PAC重絮凝的絮体无明显的差别.

|
图 9 不同处理阶段污泥絮体的显微照片 |
由图 10可以看出,经过化学重絮凝后,污泥上清液有机物质量分数降低,且氯化铁对SEPS中有机物的去除效率略高于PAC.但总体而言,投加混凝剂后,污泥SEPS质量分数变化不大.这可能是由于经过氧化后大分子的蛋白质被转化为小分子物质,而混凝对小分子有机物的吸附去除效率较低,故对上清液有机物质量分数的影响并不是很大[6].氯化铁和PAC投加量对污泥EPS荧光光谱特性的影响如表 4所示.随着两种无机混凝剂投加量的升高,蛋白质荧光峰均明显减弱.此外,铁盐对蛋白荧光峰削减效果要高于铝盐.这是由于相比多糖,铁离子与蛋白质之间有更强的作用力,故铁离子的混凝作用对其去除效率更佳[22].
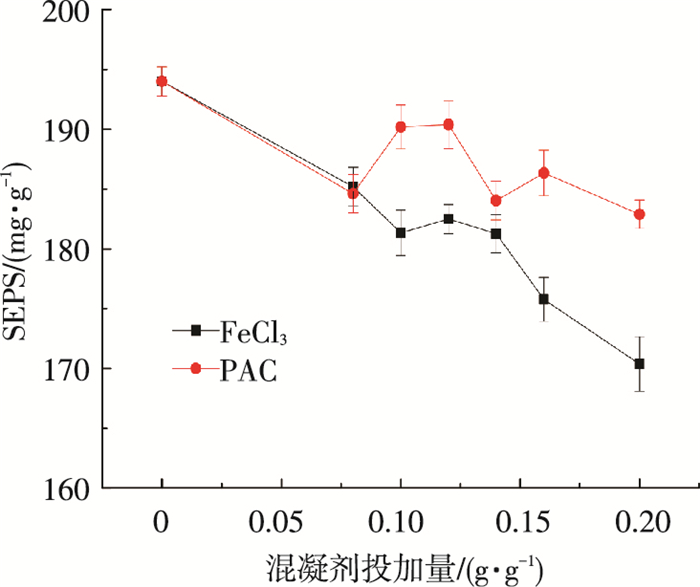
|
图 10 不同混凝剂絮凝对污泥SEPS质量分数的影响 |
| 表 4 不同絮凝剂投加量对SEPS荧光强度的影响 |
1) PAA在投加量0.06 g/g时,导致LB-EPS和TB-EPS质量分数上升,污泥絮体结构强度下降,从而污泥可滤性下降,在较高剂量PAA处理后有效破解了污泥BEPS组分,同时降解了其中的蛋白质类有机物,促使结合水释放,从而提高了污泥的过滤干化性能.
2) pH降低,PAA调理后污泥可滤性和泥饼含水率均下降.酸性条件下,PAA对污泥的氧化破解效率更高,使得TB-EPS质量分数降低,故提高了污泥的脱水效率.另外,相比多糖,pH对PAA氧化降解蛋白质的过程影响更大.
3) 化学重絮凝过程有效地提高了污泥的可滤性和干化效率.PAC絮凝在污泥可滤性和脱水效率的改善方面均优于氯化铁.这可能是由于高分子无机絮凝剂具有更强的电中和架桥作用,从而其混凝效果好于低分子无机盐.
| [1] |
张强, 刘欢, 刘鹏, 等. 调理剂对深度脱水污泥热解特性的影响[J]. 化工学报, 2014, 65(4): 1396-1402. |
| [2] |
VAXELAIRE J, CÉZAC P. Moisture distribution in activated sludges:a review[J]. Water Research, 2004, 38: 2215-2230. DOI:10.1016/j.watres.2004.02.021 |
| [3] |
LIU Y, FANG H H. Influences of extracellular polymeric substances (EPS) on flocculation, settling, and dewatering of activated sludge[J]. Crit Rev Environ Sci Technol, 2003, 33: 237-273. DOI:10.1080/10643380390814479 |
| [4] |
MIKKELSEN L H, KEIDING K. Physicochemical characteristics of full scale sewage sludges with implications to dewatering[J]. Water Research, 2002, 36: 2451-2462. DOI:10.1016/S0043-1354(01)00477-8 |
| [5] |
NIU M, ZHANG W, WANG D, et al. Correlation of physicochemical properties and sludge dewaterability under chemical conditioning using inorganic coagulants[J]. Bioresource Technology, 2013, 144: 337-343. DOI:10.1016/j.biortech.2013.06.126 |
| [6] |
ZHANG W, XIAO P, LIU Y, et al. Understanding the im-pact of chemical conditioning with inorganic polymer flocculants on soluble extracellular polymeric substances in relation to the sludge dewaterability[J]. Separation and Purification Technology, 2014, 132: 430-437. DOI:10.1016/j.seppur.2014.05.034 |
| [7] |
牛美青, 张伟军, 王东升, 等. 不同混凝剂对污泥脱水性能的影响研究[J]. 环境科学学报, 2012, 32: 2126-2133. |
| [8] |
NEYENS E, BAEYENS J, DEWIL R. Advanced sludge treatment affects extracellular polymeric substances to improve activated sludge dewatering[J]. Journal of Hazardous Materials, 2004, 106: 83-92. DOI:10.1016/j.jhazmat.2003.11.014 |
| [9] |
SU F, XING X, SUN X. Reduction of excess sludge by peracetic acid[J]. Journal of Chemical Engineering of Chinese Universities, 2004, 18: 471-476. |
| [10] |
SUN D, GUO S, MA N, et al. Pretreatment of excess sludge by microwave combined with peracetic acid[J]. Environmental Pollution and Control, 2011, 33: 50-53. |
| [11] |
ZHANG H, LEI Ming, LI Ying, et al. Extraction of extra-cellular polymeric substances from activated sludge in membrane bioreactor[J]. Journal of Chemical Industry and Engineering (China), 2008, 59: 1531-1534. |
| [12] |
FRØLUND B, PALMGREN R, KEIDING K, et al. Extraction of extracellular polymers from activated sludge using a cation exchange resin[J]. Water Research, 1996, 30: 1749-1758. DOI:10.1016/0043-1354(95)00323-1 |
| [13] |
SHENG G P, YU H Q. Characterization of extracellular polymeric substances of aerobic and anaerobic sludge using three-dimensional excitation and emission matrix fluorescence spectroscopy[J]. Water Research, 2006, 40: 1233-1239. DOI:10.1016/j.watres.2006.01.023 |
| [14] |
WANG D S, XING L N, XIE J K, et al. Application of ad-vanced characterization techniques to assess DOM treatability of micro-polluted and unpolluted drinking source waters in China[J]. Chemosphere, 2010, 81: 39-45. DOI:10.1016/j.chemosphere.2010.07.013 |
| [15] |
CHOW C W K, FABRIS R, VAN LEEUWEN J, et al. Assessing natural organic matter treatability using high performance size exclusion chromatography[J]. Environmental Science & Technology, 2008, 42: 6683-6689. |
| [16] |
YU G H, HE P J, SHAO L M. Novel insights into sludge dewaterability by fluorescence excitation-emission matrix combined with parallel factor analysis[J]. Water Research, 2010, 44: 797-806. DOI:10.1016/j.watres.2009.10.021 |
| [17] |
ZHANG W, PENG S, XIAO P, et al. Understanding the evolution of stratified extracellular polymeric substances in full-scale activated sludges in relation to dewaterability[J]. RSC Advances, 2015, 5: 1282-1294. DOI:10.1039/C4RA13379J |
| [18] |
HENDERSON R K, BAKER A, MURPHY K R, et al. Fluorescence as a potential monitoring tool for recycled water sys-tems:a review[J]. Water Research, 2009, 43: 863-881. DOI:10.1016/j.watres.2008.11.027 |
| [19] |
CHEN W, WESTERHOFF P, LEENHEER J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environ-mental Science & Technology, 2003, 37: 5701-5710. |
| [20] |
RAMESH A, LEE D J, HONG S. Soluble microbial products (SMP) and soluble extracellular polymeric substances (EPS) from wastewater sludge[J]. Applied Microbiology and Biotechnology, 2006, 73: 219-225. DOI:10.1007/s00253-006-0446-y |
| [21] |
LYKO S, AL-HALBOUNI D, WINTGENS T, et al. Polymeric compounds in activated sludge supernatant characterisation and retention mechanisms at a full-scale municipal membrane bioreactor[J]. Water Research, 2007, 41: 3894-3902. |
| [22] |
YU G H, HE P J, SHAO L M, et al. Stratification structure of sludge flocs with implications to dewaterability[J]. Environ-mental Science & Technology, 2008, 42: 7944-7949. |
| [23] |
KITIS M. Disinfection of wastewater with peracetic acid:a review[J]. Environment International, 2004, 30: 47-55. DOI:10.1016/S0160-4120(03)00147-8 |
 2016, Vol. 48
2016, Vol. 48






