在实际应用过程中, 水中大量存在的蛋白类溶解性有机污染物极易吸附累积于超滤膜面及膜孔内, 造成膜的不断污染, 严重影响其高效运行[1-2].研究表明,待处理废水的离子强度对控制离子与蛋白质分子中的氨基、羧基及羟基等官能团之间络合、中和, 或者电荷屏蔽等效应甚为重要, 可导致蛋白质分子与膜界面及蛋白质分子之间的作用发生重要变化[3-4], 进而影响蛋白质分子的聚集沉降性能及膜污染行为.因此,揭示离子强度对蛋白质膜污染行为的影响机理对科学决策减缓膜污染行为技术措施有重要价值.
关于水中离子强度对膜污染的影响机制问题, 目前认识不尽一致.根据DLVO理论[5], 在离子强度增加时, 双电层压缩效应加剧, 蛋白质分子之间静电排斥力减小, 致使蛋白质分子在膜面或者膜孔内的吸附沉降速率加快, 因而膜污染加剧.但Chan等[6]得出随着离子强度的增加膜污染减缓的结果, 并且认为是Na+离子的溶解效应所致. Salgin等[7]又得到在高离子条件下膜污染大幅度减缓的结果, 推测主要是水溶液中的抗衡离子屏蔽了膜表面及蛋白质表面的电荷, 减小了分子之间的静电吸引力所致.She等[8]推测高离子强度下膜污染减缓的主要原因是蛋白质构相发生了变化.而Wang等[9]认为在高离子条件下由于两种混合共存蛋白质的等电点不同, 抑制了不同类型蛋白质分子间的静电吸引力, 从而减轻膜污染.上述关于离子强度对蛋白质膜污染行为的影响分析主要是基于宏观膜通量变化趋势而作的简单推测性解释, 并未进行深入的机制探讨.本研究采用QCM-D技术定量考察不同离子强度下典型蛋白质BSA在PVDF表面的吸附沉降行为,BSA吸附层结构变化特征, 以及不同离子强度对宏观膜过滤、膜通量恢复性能变化特征的影响, 旨在解析离子强度对蛋白质膜污染行为的影响机理, 为减缓膜污染的调控策略选择提供依据.
1 实验 1.1 实验材料及制备 1.1.1 实验材料聚偏氟乙烯(PVDF; 美国苏威先进聚合物公司, Solef 1015), 无水氯化锂(LiCl, 天津化学试剂有限公司), N, N-二甲基乙酰胺(DMAc;分析纯, 天津市福晨化学试剂厂), 牛血清蛋白(BSA, 98%纯度, Sigma-Aldrich, St. Louis, Mo).
1.1.2 PVDF超滤膜制备将PVDF与制孔剂无水LiCl按一定比例溶解于有机溶剂DMAc中, 在60 ℃环境下共混搅拌24 h形成均质铸膜液, 静置脱泡后将其均匀涂覆于玻璃板表面, 然后将涂覆有铸膜液的玻璃板至于恒温水浴中分相, 得到PVDF超滤膜, 经充分漂洗后浸入去离子水中待用.其纯水通量为(600±50) L/(m2·h), 切割分子质量为195 ku, 接触角为73°, 表面平均粗糙度为35.8 nm.
1.1.3 BSA溶液的配制将BSA溶于超纯水中配置1 g/L的BSA储备液, 稀释至25 mg/L的BSA溶液进行实验分析.使用1 mol/L的氯化钠溶液调节BSA溶液的离子强度, 0.01 mol/L的氢氧化钠及0.01 mol/L的盐酸调剂pH.
1.1.4 PVDF膜片制备1) 将PVDF和LiCl按一定的比例(与超滤膜制备时PVDF与LiCl的比例相同)溶于DMAC制备成质量分数为5%的聚合物溶液, 在60 ℃环境充分搅拌、溶解、静置、脱泡后形成均质混合液; 2)将膜片(QSX301 Au, Q-Sense)置于75 ℃体积比为5:1:1的超纯水、质量分数分别为25%的氨水及30%的双氧水配制的混合液中浸没清洗5 min, 超纯水中充分漂洗后用氮气吹干; 3)将膜片固定于旋转涂膜机(KW-4A, 中国科学院微电子研究所)旋转平台上, 于膜片表面滴5 μL PVDF/LiCl聚合物混合液, 旋转吹干得到涂有PVDF的膜片, 超纯水中充分漂洗后用氮气吹干待用.
1.2 实验方法 1.2.1 膜污染实验使用死端过滤系统进行超滤膜的污染实验[10], 有效膜过滤面积为3.32×10-3 m2.采用氮气为驱动压力, 压力调节阀保持恒定的跨膜压差, 通过与电脑相连的电子天平实时监测所测膜的通量变化.
具体膜污染实验步骤如下:先在0.15 MPa下, 用去离子水预压超滤膜, 以保证膜通量稳定;其后将跨膜压差调节至0.1 MPa, 进行去离子水的过滤实验, 直至膜通量到达一稳定值(J).在同样的跨膜压差条件下, 针对特定离子强度的BSA污染物溶液继续过滤, 并实时监测膜通量变化.
过滤实验后将污染膜取下浸渍于装有500 mL去离子水的烧杯中, 将烧杯置于振荡器内振荡2 min, 接着取出清洗后的膜, 用去离子水冲洗后在0.1 MPa下再次测定其纯水通量(Jr), 使用Jr/J表征通量恢复率.
1.2.2 QCM-D测试使用耗散型石英晶体微天平(QCM-D, E1, Q-Sense, 瑞典)考察BSA在PVDF膜面的吸附量、膜面BSA吸附层结构随离子强度的变化特征[11-13].
将涂有PVDF的膜片安装于QCM-D上, 首先引入超纯水, 直至PVDF膜片频率达到一稳定值;其后引入特定离子强度的BSA溶液运行30 min, 通过实时测定的膜片振动频率及耗散变化特征, 评价特定离子条件下BSA在PVDF膜片表面吸附量及BSA污染层的结构变化.实验过程中液体流速始终为0.1 mL/min, 测试温度为25 ℃, 同一组实验至少重复进行3次.
1.2.3 分析技术使用Zeta电位仪(ZS90 Zeta, 马尔文, 英国)测定BSA的Zeta电位随离子强度的变化.使用安东帕公司的固体表面Zeta电位仪(SurPASS, Anton Paar GmbH, 奥地利)分析PVDF表面Zeta电位随离子强度的变化.
2 结果与讨论 2.1 不同离子条件下PVDF膜面及BSA带电特性图 1为不同离子强度下PVDF超滤膜及BSA的带电特性.可以看出, 在所考察的离子强度范围内, PVDF超滤膜及BSA皆带负电荷, 且随着离子强度的增加, 无论是BSA还是PVDF膜的所带净电荷均显示出减小趋势, 这主要是因为随着离子强度的增加, 抗衡离子所引起的压缩双电层及阳离子的电荷屏蔽效应逐渐加剧, 致使二者的表面Zeta电位逐渐降低.
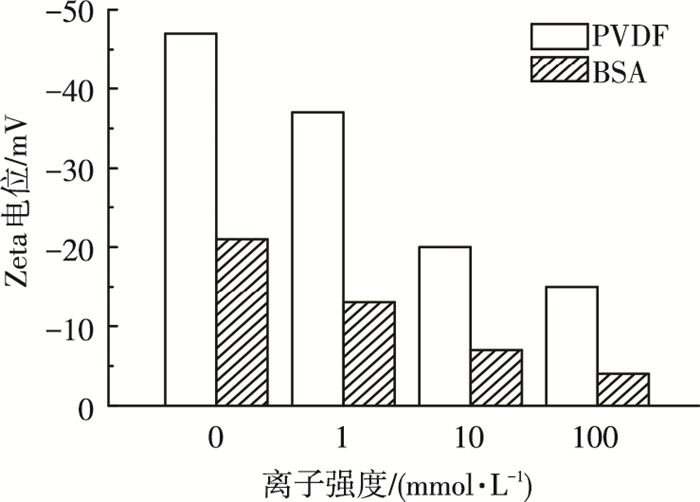
|
图 1 不同离子条件下PVDF超滤膜及BSA带电特性 |
表 1为BSA平均水力学半径随离子强度的变化.可以看出:离子强度从0增加到1 mmol/L时, BSA平均水力学半径由296 nm增大到320 nm.这可能是因为随着离子强度的增大, BSA分子之间的静电排斥力减小, 致使BSA分子之间相互吸附团聚形成较大尺寸的聚集体; 离子强度大于1 mmo/L后, BSA平均水力学半径随离子强度的增大而大幅度减小.这是因为高离子条件下BSA分子间的水合排斥力起主导作用, 致使其水力学半径减小.
| 表 1 不同离子强度下BSA的平均水力学半径 |
使用QCM-D系统考察了离子强度为0、1、10及100 mmol/L的BSA在PVDF表面的沉降吸附行为及BSA吸附层结构特征.在测试过程中,首先引入超纯水获得稳定的基线, 然后针对特定离子条件的BSA溶液进行测试, 研究膜片频率及耗散随着BSA在PVDF表面的吸附累积所发生的变化.利用计算机实时记录的各阶段频率获得的频率减小量(Δf)及耗散的变化特征, 评价BSA在PVDF表面的吸附行为及BSA吸附层结构特征.
2.3.1 不同离子强度下BSA在PVDF表面吸附行为图 2为针对不同离子强度的BSA溶液, PVDF膜片频率的变化特征.可以看出:在BSA吸附阶段,与离子强度为0 mmol/L时相比, 离子强度为1 mmol/L时PVDF膜片频率减小量Δf由18.6增大到24.3 Hz;当离子强度增大到10及100 mmol/L时, Δf变化量分别为17.2和14.3 Hz; 由于PVDF膜片频率减小量与膜片表面的吸附量成正比关系, 上述结果表明BSA在PVDF表面的吸附速率及吸附量皆随着离子强度增加呈现先增大后减小的趋势.
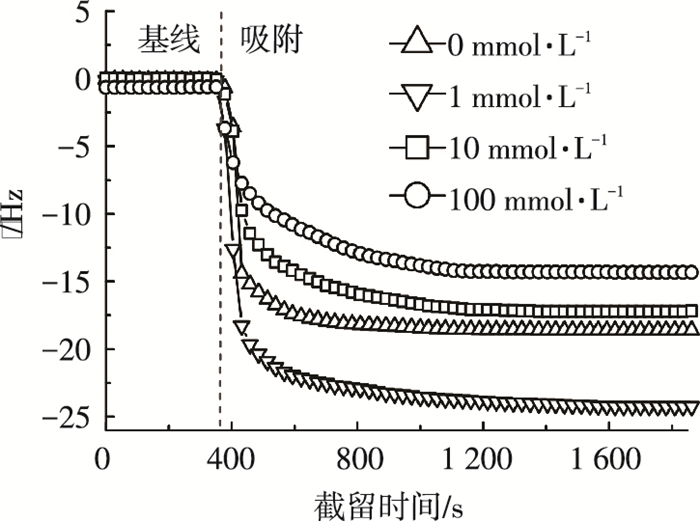
|
图 2 不同离子强度的BSA在PVDF吸附行为特征 |
耗散(ΔD)表征的是QCM-D测试过程中膜片振动所需能耗损失, 其随着吸附量的增加不断变化, 是表征吸附层结构特性的有效参数.为了便于比较, 使用单位质量的耗散值│ΔD/Δf│考察吸附层结构特征.较低的│ΔD/Δf│表示密实刚性的吸附层结构, 相反, 较大的│ΔD/Δf│值说明吸附层结构较为松散柔软[14].│ΔD/Δf│随离子强度的变化见图 3.可以看出:当离子强度由0增加到1 mmol/L时, │ΔD/Δf│从0.026减小到0.017, 说明随离子强度的增加, PVDF膜表面形成的BSA吸附层刚性密实的程度增加.这主要是因为阳离子的电荷屏蔽及压缩双电层效应,致使PVDF-BSA与BSA-BSA之间静电排斥力减弱[15], 加强了BSA在PVDF表面的吸附速率及吸附量, 从而膜表面形成刚性密实的BSA吸附层; 当离子强度由1 mmol/L增大到10及100 mmol/L时, │ΔD/Δf│随离子强度的增大而大幅度增加, 分别为1 mmol/L离子强度时的3.5及8倍.此现象表明在高离子条件下, PVDF表面形成松散柔软的BSA吸附层.这与Chang等[16]考察胶体微颗粒在固体界面的吸附行为时,发现│ΔD/Δf│随离子强度的增大而逐渐增大的现象一致.
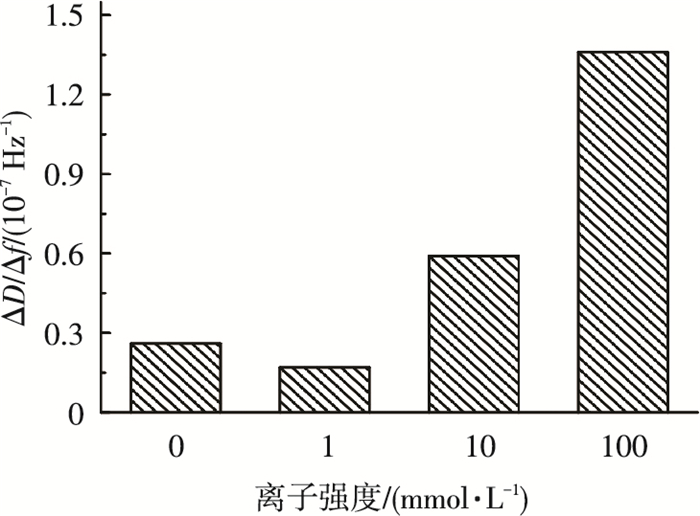
|
图 3 │ΔD/Δf│随离子强度的变化 |
上述PVDF膜片频率与能耗变化均证明:当离子强度由0增加到1 mmol/L, BSA在PVDF表面的吸附量增加.这主要是因为PVDF-BSA及BSA-BSA之间的静电排斥力随离子强度的增大而减小, 致使BSA在PVDF表面的吸附速率加快, BSA之间较强的相互作用力使BSA分子之间紧密结合, 形成密实的BSA吸附层; 当离子强度由1增加到100 mmol/L时, 由于随着离子强度的增大, 带负电的PVDF及BSA表面吸附聚集的水合Na离子数量不断增多,导致PVDF-BSA、BSA-BSA之间水合排斥力随离子强度的增大而增大[17], 有效减弱了PVDF-BSA、BSA-BSA之间的相互作用力, 致使BSA在PVDF表面的吸附速率及吸附量减小, 膜表面形成松散柔软的BSA吸附层.
2.4 离子强度影响下BSA污染超滤膜的通量变化与恢复性能为了进一步验证不同离子条件下BSA在PVDF表面的吸附沉降行为, 考察了相应离子强度下BSA对PVDF超滤膜的污染行为及膜通量恢复性能.
2.4.1 不同离子强度下BSA污染膜的通量衰减分析图 4为过滤不同离子强度的BSA溶液时膜通量随运行时间的变化.可以看出,在60 min的运行时间内, 离子强度为0、1、10及100 mmol/L的BSA污染膜的通量衰减率分别为77%、88%、63%和37%.显然, 随着离子强度的增加, 膜通量衰减速率及衰减幅度亦是呈现先增加后减小的特点.

|
图 4 膜通量随运行时间的变化 |
离子强度由0增加到1 mmol/L时, 膜通量衰减速率随着离子强度的增大而明显增大, 这与Ang等[3]考察不同离子强度的BSA对RO膜的污染行为研究结果相同.主要是因为随着离子强度的增大, BSA在膜面的累积沉降速率加剧, 相应膜污染加剧.当离子强度继续增大到10及100 mmol/L时, 虽然BSA和膜表面静电荷继续减小, 但水合排斥力的逐渐增强掩盖了分子间静电排斥力的减小, 减缓了BSA在PVDF表面的沉降速率及累积量, PVDF膜面形成松散的BSA污染层, 膜污染随着离子强度的增大而大幅度减缓.
2.4.2 不同离子强度下BSA污染膜通量恢复性能表 2为不同离子强度的BSA污染膜通量恢复性能.可以看出, 膜通量恢复率随离子强度的增加呈现先减小后增大的趋势.离子强度由0 mmol/L增大到1 mmol/L时, 受BSA污染的超滤膜通量恢复率均很低, 并由25%减小到16%, 这正是形成密实污染层所致;离子强度大于1 mmol/L, 通量恢复率随着离子强度的增加而持续增大.离子强度为100 mmol/L时, 通量恢复率可达85%.此现象与微观的QCM-D实验及膜污染实验所形成的松散柔软污染层的结果一致.主要是因为高离子条件下BSA之间相互作用力减小, 致使BSA分子之间的团聚密实度降低, 形成松散的污染层[18], 从而膜通量恢复性能大大提升.
| 表 2 离子强度对膜通量恢复性能的影响 |
上述BSA吸附层的结构确切地阐释了离子强度对BSA在PVDF膜表面沉降行为的影响特点,及在实际应用中的膜性能恢复特点, 为效控制膜污染提供了重要依据.
3 结论1) 不同的离子范围内, 离子强度对BSA污染行为的影响规律并不相同.当离子强度由0增加到1 mmol/L时, BSA及PVDF膜面的带电量随离子强度的增大而减小, PVDF-BSA及BSA分子之间静电排斥力减小, 致使BSA在PVDF表面的累积吸附量及膜通量衰减速率随离子强度的增大而增大;相反, 当离子强度继续增大到10及100 mmol/L时, 水合排斥力的急剧增大掩盖了静电排斥力的变化, 导致PVDF表面BSA的吸附量及膜污染速率随离子强度的增大而大幅度减缓.
2) 不同的离子强度条件下PVDF表面BSA吸附层结构特征存在明显差异.低离子强度条件下, 膜面形成刚性密实的BSA污染层, 高离子条件下形成松散柔软的污染层.
3) 低离子条件下, 膜通量恢复率很小, 但在高离子强度条件下膜通量恢复率大幅度增加, 主要是因为高离子条件下PVDF表面形成松散柔软的BSA污染层, 致使水分子极易进入BSA污染层破坏其完整性, 提升通量恢复性能.
4) 该研究结果对利用水中离子强度调控减缓膜污染提供了一定的依据.
| [1] |
史慧婷, 杨艳玲, 李星, 等. 腐殖酸对超滤膜污染特性的研究[J]. 哈尔滨工业大学学报, 2010, 26(5): 537-540. |
| [2] |
尤朝阳, 蒋金平, 韩苏娟, 等. 膜表面凝胶层形成机理[J]. 哈尔滨工业大学学报, 2009, 41(10): 225-228. DOI:10.3321/j.issn:0367-6234.2009.10.049 |
| [3] |
ANG W S, ELIMELECH M. Protein (BSA) fouling of reverse osmosis membranes:implications for wastewater reclamation[J]. Journal of Membrane Science, 2007, 296(1/2): 83-92. |
| [4] |
SALGIN S. Effects of ionic environments on bovine serum albumin fouling in a cross-flow ultrafiltration system[J]. Chemical Engineering Technology, 2007, 30(2): 255-260. DOI:10.1002/(ISSN)1521-4125 |
| [5] |
BHATTACHARJEE S, CHEN J Y, ELIMELECH M. DLVO interaction energy between spheroidal particles and a flat surface[J]. Physicochemical and Engineering Aspects, 2000, 165: 143-156. DOI:10.1016/S0927-7757(99)00448-3 |
| [6] |
CHAN R, CHEN V. The effects of electrolyte concentration and pH on protein aggregation and deposition:critical flux and constant flux membrane filtration[J]. Journal of Membrane Science, 2011, 185: 177-192. |
| [7] |
SALGIN S, TAKAC S, OZDAMAR T H. Adsorption of bovine serum albumin on polyether sulfone ultrafiltration membranes:determination of interfacial interaction energy and effective diffusion coefficient[J]. Journal of Membrane Science, 2006, 278: 251-260. DOI:10.1016/j.memsci.2005.11.008 |
| [8] |
SHE Q H, TANG C Y, WANG Yining, et al. The role of hydrodynamic conditions and solution chemistry on protein fouling during ultrafiltration[J]. Desalination, 2009, 249: 1079-1087. DOI:10.1016/j.desal.2009.05.015 |
| [9] |
WANG Y N, TANG C Y. Fouling of nanofiltration, reverse osmosis, and ultrafiltration membranes by protein mixtures:the role of inter-foulant-species interaction[J]. Environmental Science and Technology, 2011, 45: 6373-6379. DOI:10.1021/es2013177 |
| [10] |
王磊, 冯玲, 王旭东, 等. 二级出水残留有机物对PVDF超滤膜污染行为研究[J]. 哈尔滨工业大学学报, 2014, 46(4): 105-109. |
| [11] |
QUEVEDO I R, TUFENKJI N. Influence of solution chemistry on the deposition and detachment kinetics of a CdTe quantum dot examined using a quartz crystal microbalance[J]. Environmental Science and Technology, 2009, 43(9): 3176-3182. DOI:10.1021/es803388u |
| [12] |
CHOWDHURY I, DUCH M C, MANSUKHANI N D, et al. Deposition and release of grephene oxide nanomaterials using a quartz crystal microbalance[J]. Environmental Science and Technology, 2014, 48: 961-969. DOI:10.1021/es403247k |
| [13] |
FEILER A A, SAHLLHPLM A, SANDBERG T, et al. AdsoMin (BSM) and bovine serum albumin (BSA) studied with quartz crystal microbalance (QCM-D)[J]. Journal of Colloid and Interface Science, 2007, 315(2): 475-481. DOI:10.1016/j.jcis.2007.07.029 |
| [14] |
KWON K D, GREEN H, BJOORN P, et al. Model bacterial extracellular polysaccharide adsorption onto silica and alumina:quartz crystal microbalance with dissipation monitoring of dextran adsorption[J]. Environmental Science and Technology, 2006, 40(24): 7739-7744. DOI:10.1021/es061715q |
| [15] |
BOWEN W R, HILAL N, LOVITT R W, et al. A new technique for membrane characterisation:direct measurement of the force of adhesion of a single particle using an atomic force microscope[J]. Journal of Membrane Science, 1998, 139(2): 269-274. DOI:10.1016/S0376-7388(97)00255-X |
| [16] |
CHANG X, BOUCHARD D C. Multiwalled carbon nanotube deposition on model environmental surfaces[J]. Environmental Science and Technology, 2013, 47: 10372-10380. DOI:10.1021/es402200h |
| [17] |
WANG L L, WANG L F, YE X D, et al. Hydration interactions and stability of soluble microbial products in aqueous solutions[J]. Water Research, 2012, 40: 5921-5959. |
| [18] |
THIO B J, MONTES M O, MAHMOUD M A, et al. Mobility of capped silver nanoparticles under environmentally relevant conditions[J]. Environmental Science and Technology, 2012, 46: 6985-6991. DOI:10.1021/es203596w |
 2016, Vol. 48
2016, Vol. 48




