2. 哈尔滨工业大学 市政环境工程学院, 150090 哈尔滨;
3. 北京市自来水集团有限责任公司 第四水厂, 100073 北京
2. School of Municipal and Environmental Engineering, Harbin Institute of Technology, 150090 Harbin, China;
3. The 4th Waterworks, Beijing Waterworks Group, 100073 Beijing, China
传统废水生物脱氮一般是通过硝化和反硝化过程实现, 需要大量曝气、额外投加有机碳源, 运行费用高, 还会产生二次污染[1].厌氧氨氧化技术(Anammox)是荷兰Delft大学于20世纪90年代提出的一种新型生物脱氮技术, 其机理是在厌氧或缺氧条件下, 厌氧氨氧化菌直接以NH4+为电子供体, 以NO3-或NO2-为电子受体, 将NH4+、NO3-或NO2-转变成N2的生物转化过程[2].Anammox反应途径较短, 不会造成二次污染, 无需曝气和投加有机碳源, 排泥量少, 运行成本低[3-4].Anammox反应在地球氮素循环中发挥着不容忽视的作用[5-6].
目前, Anammox工艺的研究已取得一定的成果和实践经验,主要集中于处理高氨氮废水[7], 用于城市生活污水处理的研究尚属起步阶段[8].厌氧氨氧化菌生长缓慢, 倍增时间长达11 d[9], 反应器启动困难.因此,Anammox反应器的启动问题成为制约其工程应用的瓶颈.折流板反应器作为一种新型、高效的厌氧反应器, 具有运行管理方便、出水水质好、运行稳定可靠、对有毒物质适应性强等优点.本文以人工配水模拟生活污水, 采用折流板附加填料的折流板生物膜反应器快速启动Anammox反应, 并对稳定运行期氮素的去除规律进行了研究, 以期为Anammox技术在城市生活污水处理中的应用提供借鉴.
1 实验 1.1 实验装置折流板厌氧氨氧化生物膜反应器装置如图 1所示.反应器外壳材质为有机玻璃, 长40 cm, 宽20 cm, 高70 cm, 有效容积32 L, 且分为6个相同单元, 每个单元顶端均有一取样口, 并分为大小格室, 大格室中充满填料, 小格室中放置加热棒, 底部用钢支架托起, 上部加盖密封创造厌氧环境, 整个反应器使用黑塑料纸包裹避光(厌氧氨氧化菌属光敏性微生物, 光能抑制其活性, 降低30%~50%的氮去除率[10]), 悬挂填充于各大格室的内部填料为中空塑料圆环周围绑扎纤维束, 其覆盖范围与大格室内部容积几乎相等.原水通过蠕动泵连续泵至反应器, 在相互串联的6个单元格中水流方向在小格室中向下流动, 在大格室中向上流动, 并与生物膜充分接触, 在厌氧氨氧化微生物作用下进水氮素转化为N2从反应器的顶部逸出, 处理后出水经出水口排放.

|
图 1 折流板厌氧氨氧化生物膜反应器示意 |
实验采用人工配水, 其中NH4+-N和NO2--N分别由NH4Cl和NaNO2提供, 质量浓度为30~45 mg/L, 控制水温为(30±2) ℃, 无机碳源由NaHCO3提供, 质量浓度为15 mg/L, 碱度和pH通过投加碳酸氢钠和稀酸、稀碱来调节.
1.3 种泥来源反应器接种污泥取自实验室内运行良好的上流式生物滤池厌氧氨氧化反应器[11], 污泥MLSS为28 120 mg/L, 呈红褐色, 具有良好的沉降性能.从各大隔室上部分别向反应器内加入1~1.5 L的泥水混合液.
1.4 实验方法采用低负荷连续进水的方式启动Anammox反应器, 共分为4个阶段, 各阶段进水质量浓度、水力停留时间(HRT)等运行参数如表 1所示.启动成功后对反应器沿程各单元出水水质进行监测, 分析NH4+-N与NO2--N的去除规律及沿程的DO、pH和MLSS的变化, 并对生物膜进行扫描电镜分析.
| 表 1 实验各阶段反应器的运行参数(平均值) |
NH4+-N:纳氏试剂分光光度法; NO2--N:N-(1-萘基)-乙二胺分光光度法; NO3--N:麝香草酚分光光度法; MLSS:重量法; DO及水温:WTW Multi340i多功能溶氧仪; pH: WTW inoLab pH计; 扫描电镜:日本JSM-6390LV型号电镜.
2 结果与讨论 2.1 Anammox反应器的快速启动Anammox反应器的启动过程实质上是厌氧氨氧化菌的活化和富集培养过程.启动阶段历时83 d, 整个过程可划分为4个阶段.启动阶段反应器的进、出水NH4+-N和NO2--N质量浓度的变化如图 2所示.

|
图 2 启动阶段氮素的变化 |
第一阶段:适应期(0~38 d).实验初期设计进水NH4+-N及NO2--N的质量浓度分别为20、10 mg/L, HRT为24 h, 即平均进水氨氮、亚硝氮负荷分别0.01和0.02 kg/(m3·d).室温条件下水温(25±2) ℃.运行7 d后发现效果不理想, NH4+-N、NO2--N的去除率仅为35%、15%, 原因是种泥接种量少、生物数量增值慢、停留时间短、温度低.低质量浓度时氨氮和亚硝酸盐可作为Anammox反应的基质[12], 厌氧氨氧化速率会随进水基质质量浓度的增加而提高.因此,提高进水NH4+-N与NO2--N质量浓度分别至30、30 mg/L, 并延长HRT至48 h、提高水温至(30±2) ℃.经过13 d的培养, 出水氨氮并无明显下降.降低亚硝氮质量浓度至15 mg/L, NH4+-N与NO2--N的去除率在3周内逐步提高, 后期二者的去除率可保持在93%以上.
第二阶段:调整期Ⅰ(39~52 d).该阶段维持其他条件不变,将HRT缩至24 d.由图 2可知, 第二阶段初期, 由于HRT缩短, 生物处于适应阶段, NH4+-N与NO2--N的去除率明显降低.驯化培养10 d后, NH4+-N与NO2--N的去除率稳步上升至95%以上.
第三阶段:调整期Ⅱ(53~61 d).进一步缩减HRT至12 h, 经过短时间适应后, NH4+-N与NO2--N去除率稳步上升至95%以上.
第四阶段:稳定运行期(62~83 d).进一步缩短HRT至6 h, 经过两周的培养驯化, 出水效果仍不理想.维持进水NH4+-N质量浓度30 mg/L, 提高NO2--N质量浓度至45 mg/L, 经过10 d驯化后, 在进水氨氮、亚硝氮负荷分别为0.12和0.18 kg/(m3·d)的情况下, 平均出水NH4+-N、NO2--N及TN质量浓度为1.5、1及10 mg/L, NH4+-N与NO2--N去除率均达95%以上, TN去除率达80%以上.
NH4+-N、NO2--N按特定比例去除是Anammox反应的本质特征.由图 3可以看出, 从第52天起, NH4+-N、NO2--N的去除有一定的规律性, 特别是在第四阶段, NH4+-N、NO2--N去除量和NO3--N生成量的比值为1:(1.20~1.37):(0.10~0.19), 与文献报道的Anammox反应的理论值(1:1.32:0.26)接近[13].反应器刚开始运行时, 几乎没有气泡生成, 而在第四阶段能够明显看到有气泡冒出, 近距离观察发现大量气泡附着在器壁和纤维上.以上分析说明, 经过83 d的连续培养, Anammox生物膜逐渐驯化成功, 折流板厌氧氨氧化生物膜反应器启动成功.稳定运行期, Anammox反应器平均出水NH4+-N、NO2--N及TN质量浓度为1.5、1及10 mg/L, NH4+-N、NO2--N去除率达95%以上, TN去除率达80%以上, 出水氮素达《城镇污水处理厂污染物综合排放标准》(GB18918—2002)一级A标准要求(ρ(NH4+-N)≤5 mg/L, ρ(TN)≤15 mg/L).

|
图 3 反应器启动过程中氮的去除特性 |
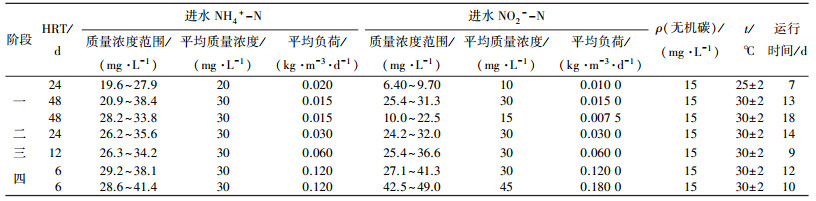
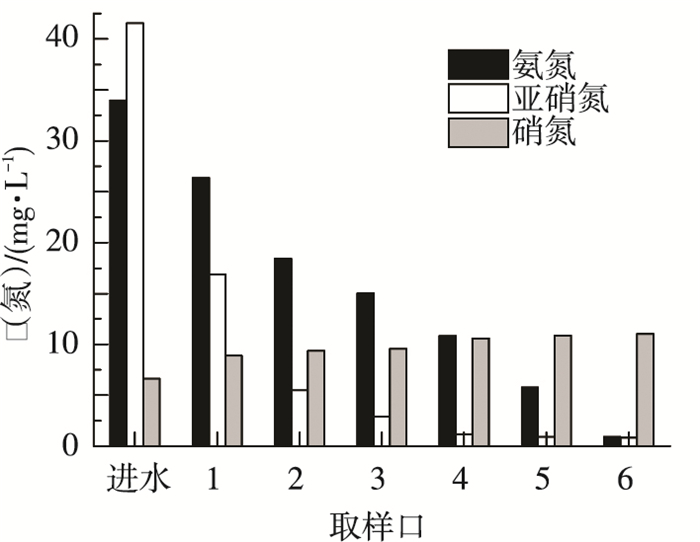
折流板反应器作为一种推流式反应器, 各单元格内微生物的活性及群落结构不同, 反应器沿程各单元格对氮素的去除能力不同[14-15].为研究折流板厌氧氨氧化生物膜反应器沿程中的氮素去除规律, 在反应器稳定运行期, 分别从反应器的6个取样口同时多次取样.反应器沿程氮素、DO、pH及MLSS变化规律如图 4~7所示.
|
图 4 反应器内氮素的沿程变化 |

|
图 5 稳定运行期间反应器沿程DO变化 |
|
图 6 稳定运行期间反应器沿程pH变化 |

|
图 7 稳定运行期间反应器沿程MLSS变化 |
如图 4所示, 在第一个单元格中, NH4+-N、NO2--N去除量和NO3--N生成量的比值为1:3.40:0.38.其中NO2--N的去除量明显高于理论值, 这与已有的报道类似[16], 意味着在反应系统中除发生Anammox反应外还存在其他的反应类型使NO2--N快速减少.分析原因, 首先是进水未进行除氧操作.如图 5所示, 在反应器的进水中始终存在少量的DO, 并在0.3~0.8 mg/L波动, 系统中除存在厌氧氨氧化细菌外, 还存在少量的亚硝化细菌和硝化细菌, 各类菌群之间存在着协同竞争关系[17].随着水流在反应器内的流动, DO的质量浓度快速下降, 低氧环境会导致好氧的亚硝化菌及硝化菌受到抑制[18], 有利于Anammox反应的进行.在第二个单元格中NH4+-N、NO2--N去除量和NO3--N生成量的比值为1:2.65:0.29, 较第一个单元格更接近Anammox的理论值1:1.32:0.26.但沿着水流方向在第三单元格之后, NH4+-N、NO2- -N去除量和NO3--N生成量的比值发生变化, 出现NH4+-N去除量明显高于理论值的现象.分析产生这一现象的原因, Anammox菌的代谢途径主要有以下两种模型:①van de Graaf等[19]提出, Anammox反应是以NO2-作为电子受体, NH2OH和N2H4为其中间产物, 生成物是N2; ②Strous等[20-21]认为, NO2-先被还原成NO, 然后NO与NH4+生成N2H4, 最后N2H4氧化成N2.以上两种模型均表明, 在Anammox反应中, 都需要先将NO2-转化为中间体, NH4+再与中间体发生反应.据此推断, NO2-转化为中间体这一过程主要发生在第一、二个单元格, NH4+与中间体发生反应则主要发生在第三格以后.NO2--N在第一、二个单元格中去除速率较快, 而后趋缓.相对于NO2--N, NH4+-N的去除从宏观看表现出明显的滞后性.
pH是厌氧氨氧化反应的重要指示参数[22].稳定运行期pH的变化如图 6所示.由于Anammox反应嗜酸致碱, pH不断上升, 且在氮素去除效果最好的第一、二个单元格中上升也最明显, 而后上升速度趋缓.
在整个实验过程中, 除取样及排水造成污泥损失外无额外排泥, 稳定运行期间生物膜的MLSS分布如图 7所示, 在基质丰富的第一、二个单元格中MLSS处于较高水平, 在5 000 mg/L左右.充足NH4+-N和NO2--N为Anammox菌提供了适宜的生长环境, 此时丰富的无机碳源也促使微生物合成足够的营养物质, 形成微生物的大量积累.在随后的单元格中, 随着氮素质量浓度下降, MLSS呈现下降趋势, 但此时经过长期驯化成功的微生物已适应反应器内环境, 其生长与衰亡形成动态平衡, MLSS仍能维持在3 500 mg/L左右.
2.3 Anammox生物膜的观察取稳定运行期的Anammox生物膜用日本JSM-6390LV型号电镜扫描, 获得的SEM照片如图 8所示.

|
图 8 反应器中生物膜的SEM照片 |
现有研究表明[23-24], 厌氧氨氧化菌为圆形或椭圆形的革兰氏阴性菌, 形态多样, 菌落油滴状, 直径较大, 有攀爬现象, 细胞外无荚膜, 细胞壁表面呈火山口状结构, 少数有菌毛.由图 8可以看出,反应器中生物膜主要由球状菌组成, 聚集成簇, 并存在少量丝状菌, 形态与已报道的厌氧氨氧化菌极为相似.厌氧氨氧化菌因含有丰富的细胞色素c而呈现红色, 在整个启动过程中, 随着运行时间的延长, 厌氧氨氧化菌活性逐渐提高, 肉眼可见填料表面逐渐形成淡红色生物膜, 透过反应器的外壁可以观察到生物膜由底部向顶部颜色逐渐变浅.
3 结论1) 采用折流板生物膜反应器, 在温度为(30±2) ℃、DO为0.2~0.5、pH=7.6~8.0, 进水氨氮、亚硝氮负荷分别为0.12和0.18 kg/(m3·d)的条件下, 经83 d的连续运行成功启动厌氧氨氧化反应.稳定运行期, NH4+ -N、NO2- -N及TN平均出水质量浓度分别为1.5、1及10 mg/L, NH4+-N、NO2--N去除率达95%以上, TN去除率达80%以上, 出水氮素达《城镇污水处理厂污染物综合排放标准》(GB18918—2002)一级A标准.
2) 反应器沿程中NO2--N的去除速率先快后慢, NH4+-N的去除表现出明显的滞后性.
| [1] |
廖小兵, 许玫英, 罗慧东, 等. 厌氧氨氧化在污水处理中的研究进展[J]. 微生物学通报, 2010, 37(11): 1679-1684. |
| [2] |
JETTEN M S M, HORN S J, VAN LOOSDRECHT M C M. Towards a more sustainable municipal wastewater treatment system[J]. WaterScience and Technology, 1997, 35(9): 171-180. |
| [3] |
MULDER A, VAN DE GRAAF A A, ROBERTSON L A, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor[J]. FEMS Microbiology Ecology, 1995, 16(3): 177-183. DOI:10.1111/fem.1995.16.issue-3 |
| [4] |
HU Z, LOTTI T, VAN LOOSDRECHT M, et al. Nitrogen removal with the anaerobic ammonium oxidation process[J]. Biotechnology Letters, 2013, 35(8): 1145-1154. DOI:10.1007/s10529-013-1196-4 |
| [5] |
洪义国, 李猛, 顾继东. 海洋氮循环中细菌的厌氧氨氧化[J]. 微生物学报, 2009, 49(3): 281-286. |
| [6] |
DALSGAARD T, CANFIELD D E, PETERSEN J, et al. N2 production by the anammox reaction in the anoxic water column of Golfo Dulce, Costa Rica[J]. Nature, 2003, 422(6932): 606-608. DOI:10.1038/nature01526 |
| [7] |
ZHANG J, ZHOU J, HAN Y, et al. Start-up and bacterial communities of single-stage nitrogen removal using anammox and partial nitritation (SNAP) for treatment of high strength ammonia wastewater[J]. Bioresource Technology, 2014, 169: 652-657. DOI:10.1016/j.biortech.2014.07.042 |
| [8] |
GILBERT E M, AGRAWAL S, KARST S M, et al. Low temperature partial nitritation/anammox in a moving bed biofilm reactor treating low strength wastewater[J]. Environmental Science & Technology, 2014, 48(15): 8784-8792. |
| [9] |
STROUS M, HEIJNEN J J, KUENEN J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 1998, 50(5): 589-596. DOI:10.1007/s002530051340 |
| [10] |
JETTEN M S M, STROUS M, VAN DE PAS-SCHOONEN K T, et al. The anaerobic oxidation of ammonium[J]. FEMS Microbiology Reviews, 1998, 22(5): 421-437. DOI:10.1111/j.1574-6976.1998.tb00379.x |
| [11] |
鲍林林, 李刚强, 李冬, 等. 常温低基质下磷酸盐对厌氧氨氧化反应的影响[J]. 环境工程学报, 2013, 7(11): 4389-4392. |
| [12] |
郑平, 胡宝兰. 厌氧氨氧化菌混培物生长及代谢动力学研究[J]. 生物工程学报, 2001, 17(2): 193-198. |
| [13] |
STROUS M, KUENEN J G, JETTEN M S. Key physiology of anaerobic ammonium oxidation[J]. Applied and Environmental Microbiology, 1999, 65(7): 3248-3250. |
| [14] |
张文艺, 夏绍凤, 翟建平, 等. 曝气生物滤池反应器的沿程生化特性研究[J]. 中国给水排水, 2006, 22(15): 71-74. DOI:10.3321/j.issn:1000-4602.2006.15.019 |
| [15] |
刘涛, 李冬, 曾辉平, 等. 常温下CANON反应器中功能微生物的沿程分布[J]. 哈尔滨工业大学学报, 2012, 44(10): 22-27. DOI:10.11918/j.issn.0367-6234.2012.10.005 |
| [16] |
QUAN Z X, RHEE S K, ZUO J E, et al. Diversity of ammonium-oxidizing bacteria in a granular sludge anaerobic ammonium-oxidizing (anammox) reactor[J]. Environmental Microbiology, 2008, 10(11): 3130-3139. DOI:10.1111/emi.2008.10.issue-11 |
| [17] |
贾方旭, 彭永臻, 杨庆. 厌氧氨氧化菌与其他细菌之间的协同竞争关系[J]. 环境科学学报, 2014, 34(6): 1351-1361. |
| [18] |
祝贵兵, 彭永臻, 郭建华. 短程硝化反硝化生物脱氮技术[J]. 哈尔滨工业大学学报, 2008, 40(10): 1552-1557. DOI:10.3321/j.issn:0367-6234.2008.10.009 |
| [19] |
VAN DE GRAAF A A, MULDER A, DE BRUIJN P, et al. Anaerobic oxidation of ammonium is a biologically mediated process[J]. Applied and Environmental Microbiology, 1995, 61(4): 1246-1251. |
| [20] |
STROUS M, PELLETIER E, MANGENOT S, et al. Deciphering the evolution and metabolism of an anammox bacterium from a community genome[J]. Nature, 2006, 440(7085): 790-794. DOI:10.1038/nature04647 |
| [21] |
KARTAL B, MAALCKE W J, DE ALMEIDA N M, et al. Molecular mechanism of anaerobic ammonium oxidation[J]. Nature, 2011, 479(7371): 127-130. DOI:10.1038/nature10453 |
| [22] |
唐崇俭, 郑平, 陈建伟, 等. 中试厌氧氨氧化反应器的启动与调控[J]. 生物工程学报, 2009, 25(3): 406-412. |
| [23] |
EGLI K, BOSSHARD F, WERLEN C, et al. Microbial composition and structure of a rotating biological contactor biofilm treating ammonium-rich wastewater without organic carbon[J]. Microbial Ecology, 2003, 45(4): 419-432. DOI:10.1007/s00248-002-2037-5 |
| [24] |
SLIEKERS A O, HAAIJER S, SCHMID M, et al. Nitrification and anammox with urea as the energy source[J]. Systematic and Applied Microbiology, 2004, 27(3): 271-278. DOI:10.1078/0723-2020-00259 |
 2016, Vol. 48
2016, Vol. 48