2. 长春卫尔赛生物药业有限公司, 130616 长春;
3. 黑龙江八一农垦大学 生命科学学院, 163319 黑龙江 大庆
2. Changchun Weresai Biotic Pharmaceutical Co. Ltd., 130616 Changchun, China;
3. College of Life Science, Heilongjiang Bayi Agricultural University, 163319 Daqing, Heilongjiang, China
肥胖发生的原因很多,能量摄入过多导致的热能入超以及脂肪堆积,是当今世界肥胖群体增加的普遍原因[1].机体脂肪堆积尤其是腹腔内的脂肪累积影响机体器官结构,还能引起一系列疾病.有研究报道,腹型肥胖和腹部脂肪所占比例增加是冠心病和2型糖尿病及相关死亡的主要危险因素[2-3].
成纤维细胞生长因子-21(FGF-21)是FGF家族的新成员,能够高效并持续调节机体糖脂代谢[4-5],刺激脂肪细胞的葡萄糖吸收[6],降低ob/ob和db/db小鼠血浆中葡萄糖和甘油三酯的浓度,在转基因小鼠中过表达时可有效抵抗由饮食引起的肥胖[7].与以往研究相比,本研究采用的谷氨酸钠(MSG)诱导的肥胖模型属于下丘脑性肥胖,是由于大剂量谷氨酸钠选择性地破坏了大鼠下丘脑腹内侧核的饱食中枢,致使大鼠进食量增加、食欲旺盛.并且因其交感神经处于抑制状态而自发活动显著减少,从而导致肥胖,特别是腹部脂肪堆积明显,酷似人类肥胖的形成过程[8-10].本研究应用MSG诱导的肥胖模型,研究FGF-21改善脂肪堆积的效果,以及对肝脂代谢的调节作用,以期为临床应用FGF-21治疗肝脂代谢异常提供理论基础.
1 实验 1.1 实验材料 1.1.1 试验动物SD大鼠(20只雌雄各半)由上海斯莱克实验动物有限责任公司提供,动物合格证号为SCXK(沪)2007-0005.
1.1.2 主要药品及试剂FGF-21由本实验室提供,纯度>90%;MSG (Amresco);逆转录酶M-M LVRT (Promega);TRIzol reagent (Invitrogen);SYBR GREEN PCR MasterMix(ABI).
1.1.3 引物所用引物均由Invitrogen公司合成.实时荧光定量PCR引物序列如下:
大鼠GLUT1
上游引物:5’- CCATCCACCACACTCACCAC -3’
下游引物:5’- GCCCAGGATCAGCATCTCAA -3’
大鼠Leptin
上游引物:5’- GACACCAAAACCCTCAT -3’
下游引物:5’- CAGTGTCTGGTCCATCT -3’
大鼠FGF-21
上游引物:5’- AGGCTTTGACACCCAGGATT -3’
下游引物:5’- ACAGATGACGACCAGGACAC -3’
大鼠PPARα
上游引物:5’- TGTCGAATATGTGGGGACAA -3’
下游引物:5’- AAACGGGATTGCATTGTGTGA -3’
大鼠PPARγ
上游引物:5’- GATCCTCCTGTTGACCCAGA -3’
下游引物:5’- TCAAAGGAATGGGAGTGGTC -3’
大鼠β-actin
上游引物:5’- ATCATGTTTGAGACCTTCAACA -3’
下游引物:5’- CATCTCTTGCTCGAAGTCCA -3’
1.2 动物造模及处理选择10窝新生(由买来的20只SD大鼠交配获得)的1日龄SD大鼠,每窝随即分成2组,一组为空白组(以剪尾做标记),另一组为MSG组.MSG组大鼠按2 mg/kg体质量剂量连续5 d皮下注射(颈背部)质量分数为0.3的MSG溶液,空白组大鼠连续5 d皮下注射(颈背部)等量0.9% NaCl溶液.22 d断奶后[11-12],筛选出造模成功的大鼠进行后续试验.造模成功的标准:体质量超过空白组平均体质量的20%[13].将MSG成模肥胖大鼠随即平均分成FGF-21组和MSG组(每组n﹥10),采用电子天平1周1次定时测量体质量和进食量.MSG肥胖大鼠模型建立后饲喂至20周龄时,FGF-21组按1 mg/kg剂量连续32 d腹腔注射FGF-21[14].MSG组连续32 d腹腔注射等量0.9% NaCl溶液.采用电子天平1周1次定时测量体质量和进食量.
1.3 样品采集停药后检测大鼠空腹糖耐量水平,将葡萄糖溶液按2 g/kg剂量腹腔注射到大鼠体内,监测其0 (注射葡萄糖前)、30、60、90和120 min的血糖值.利用公式AUC (min·mmol·L-1)=30 min×[1/2×(BG0+ BG120)+1×(BG30+BG60+BG90)]分析糖耐量情况.麻醉称质量测体长(鼻子至肛门)后,心脏采血(3~5 mL),血样经3 000 r/min离心后吸出血清并标号,所有血清在-80 ℃条件下保存.甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和碱性磷酸酶(ALP)用酶法通过全自动生化分析仪检测.采血完毕后将大鼠安乐处死,取大鼠肾、睾丸、肠系膜脂肪及肝脏称质量后,部分经液氮速冻数分钟后放入-80 ℃条件下保存,部分放入10%的甲醛中准备制备石蜡切片.
1.4 大鼠肝脏及脂肪组织RNA的提取取各组大鼠组织,每0.1 g组织用1 mL TRIzol试剂裂解,按常规方法提取RNA,用NanoDrop紫外分光光度计检测RNA纯度和浓度(OD260 nm/OD280 nm>1.8,OD260 nm/OD230nm> 2.0).
1.5 cDNA合成使用逆转录酶M-MLVRT,按说明书操作合成cDNA,cDNA产物作为荧光定量PCR反应的模板.
1.6 实时荧光定量PCR使用实时荧光定量PCR技术检测脂肪中葡萄糖转运蛋白-1(Glut-1)、瘦素(Leptin),肝脏中FGF-21、过氧化物酶体增殖物激活受体α(PPARα)、过氧化物酶体增殖物激活受体γ(PPARγ) mRNA的相对表达情况,以β-actin的表达量作为内参.将cDNA连续10倍稀释,分别用两对引物进行反应,构建两个基因的相对定量标准曲线,根据曲线斜率计算各引物的扩增效率.反应体系按试剂盒说明书操作.每组反应3个复孔,取平均值.每对引物均设空白对照,空白对照孔不加任何形式的模板,其余成分浓度与检测组相同.荧光定量PCR反应程序:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min 40个循环;95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s(生成溶解曲线).通过分析溶解曲线确定是否产生引物二聚体和非特异性扩增.
1.7 石蜡切片脂肪细胞和肝细胞病理形态学观察:取甲醛固定好的脂肪和肝组织,酒精梯度脱水,常规石蜡包埋,冠状切片,厚度为4~6 μm,HE染色,显微镜下随机采集3~4个视野的图像观察脂肪细胞和肝细胞的组织形态学状态.
1.8 统计学方法利用SPSS10.0统计软件,计量资料多个样本均数之间的比较用单因素方差分析,计量资料数据用x±s表示.
2 结果与分析 2.1 FGF-21的制备及纯化取蛋白纯度达90%,能够调节脂肪细胞吸收葡萄糖且具有剂量依赖性的FGF-21蛋白用于实验[7].
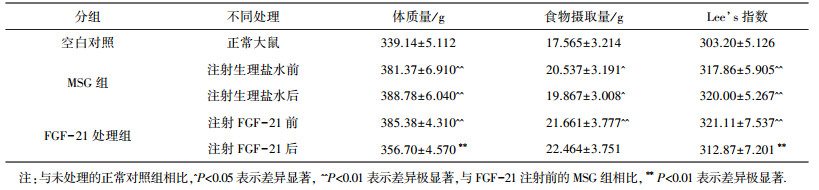
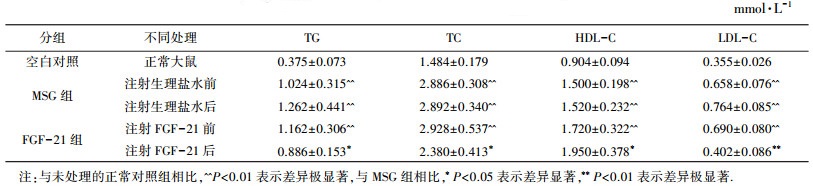
2.2 MSG肥胖模型MSG造模大鼠的体质量、Lee’s指数((体质量/g)1/3×103/体长/cm)、进食量(表 1)、TG、TC、LDL-C(表 3)显著高于同期正常对照组(P<0.01),提示大鼠造模成功.
| 表 1 FGF-21对体质量、食物摄取、Lee’s指数的影响 |
| 表 3 FGF-21注射后各组大鼠血清脂类代谢情况 |
由图 1和表 1可以看出,经过FGF-21的治疗,试验组的MSG大鼠体质量和Lee’s指数显著下降(n=6,P<0.01),并且体质量下降趋势稳定,对照组未经治疗的MSG大鼠体质量呈上升趋势.结果表明,FGF-21可以促使MSG肥胖大鼠体质量下降.同时,MSG对照组的进食量明显高于正常饲养的空白组(n=6,P<0.05),这一结果符合MSG肥胖模型高进食量的特点.经FGF-21注射以后试验组大鼠的进食量并没有受到影响,说明FGF-21降低MSG大鼠体质量并不是通过对进食量的抑制(表 1).
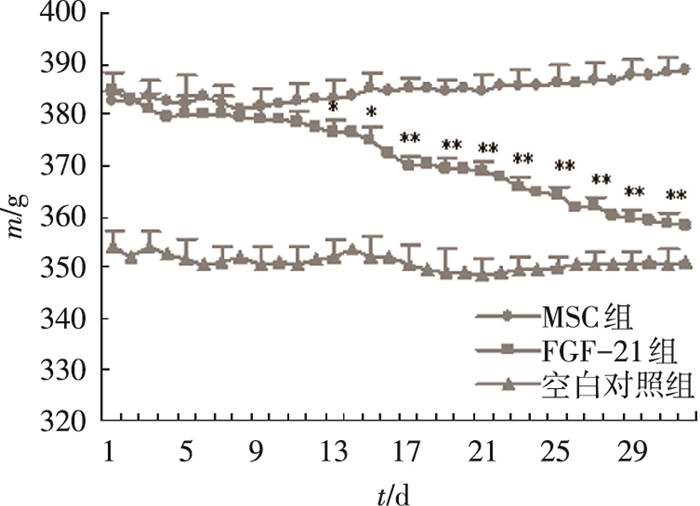
|
*P<0.05, **P<0.01 图 1 FGF-21注射后MSG大鼠模型体质量变化 |
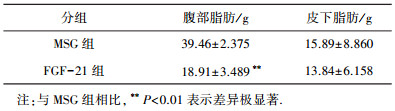
表 2显示,试验组大鼠的腹部脂肪质量显著低于MSG对照组(n=6,P<0.01),减少52.08%,而试验组和MSG对照组相比大鼠皮下脂肪质量变化不大,减少12.9%.结果表明,FGF-21主要是通过减少肥胖大鼠腹部脂肪的质量来降低其体质量.
| 表 2 FGF-21对腹部及皮下脂肪的影响 |
经过FGF-21干预32 d后,试验组的TG、TC水平显著下降,并明显低于模型对照组(n=6,P<0.05),提示FGF-21具有降低MSG大鼠血清甘油三酯和胆固醇的作用.FGF-21处理组HDL-C水平较MSG组显著提高(n=6,P<0.05),而LDL-C水平较MSG组显著下降(n=6,P<0.01),说明FGF-21对MSG肥胖大鼠的脂代谢具有调节作用.结果见表 3.
2.5 各组大鼠给药后餐后血糖和葡萄糖耐受的比较由图 2(a)可以看出,MSG肥胖大鼠餐后血糖值显著高于正常组(n=6,P<0.01),而经过FGF-21治疗后其血糖值恢复正常.MSG肥胖大鼠的葡萄糖耐受能力低于正常组,经过FGF-21治疗后其葡萄糖耐受能力提高,如图 2(b)所示.各组AUC值分别为:正常组,933 min·mmol·L-1; FGF-21组, 1 013.5 min·mmol·L-1; MSG组,1 050 min·mmol·L-1.
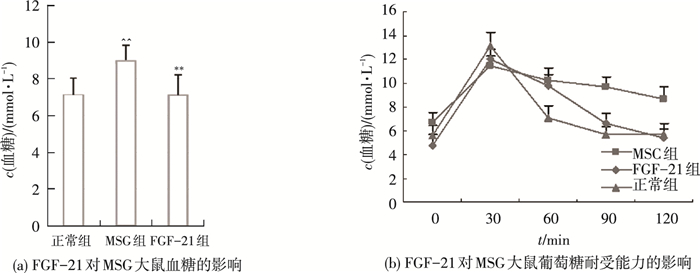
|
与未处理的正常对照组相比,^^P<0.01表示差异极显著,与MSG组相比,**P<0.01表示差异极显著 图 2 FGF-21对MSG大鼠血糖和葡萄糖耐受能力的影响 |
图 3(a)结果表明,MSG组肝脏中的FGF-21 mRNA水平是未处理正常组的10倍(n=6,P<0.01),这与Fisher等[15]报道的FGF-21在肥胖中高表达的结果相一致,经过FGF-21治疗后其内源高表达的FGF-21水平下降至正常.
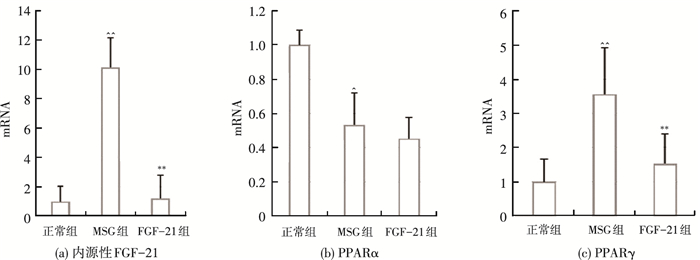
|
与未处理的正常对照组相比,^P<0.05表示差异显著,^^P<0.01表示差异极显著,与MSG模型组相比,**P<0.01表示差异极显著 图 3 FGF-21对MSG模型大鼠内源性FGF-21, PPARα和PPARγ mRNA表达水平的影响 |
图 3(b)、(c)显示MSG组肝脏中的PPARα mRNA水平显著低于未处理的正常组(n=6,P<0.05),而PPARγ mRNA水平显著高于正常组(n=6,P<0.01).经过FGF-21的治疗后,PPARα和PPARγ mRNA水平较MSG对照组有所下降.
2.7 荧光定量PCR检测各组大鼠脂肪中Glut-1、Leptin mRNA水平经过FGF-21的治疗后,试验组大鼠脂肪中Glut-1 mRNA水平显著高于MSG模型组和正常未处理组,说明FGF-21在脂肪细胞中起到了调节作用.MSG模型对照组大鼠脂肪中Leptin mRNA水平显著高于正常未处理组(n=6,P<0.01),经过FGF-21治疗后试验组大鼠脂肪中Leptin mRNA水平显著低于MSG模型组(n=6,P<0.01),结果如图 4所示.
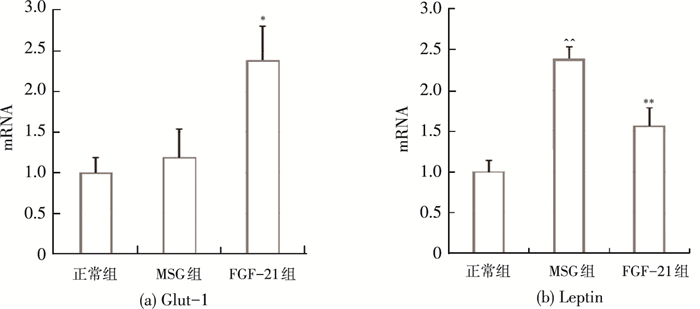
|
与未处理的正常对照组相比,^^P<0.01表示差异极显著,与MSG模型组相比,*P<0.05表示差异显著, **P<0.01表示差异极显著 图 4 FGF-21对MSG大鼠脂肪Glut-1和Leptin mRNA表达水平的影响 |
图 5显示,与正常组相比,MSG模型对照组大鼠脂肪细胞面积增大,同一视野下的细胞数目减少;与MSG模型对照组相比,经FGF-21治疗后试验组脂肪细胞面积明显减小,而且同一视野下的细胞数目明显增多;FGF-21组和正常组差别不明显.从肝细胞形态可以看出,与正常组相比,MSG模型组大鼠肝细胞大部分发生脂肪变性,肝细胞肿大变圆且形态不规则,伴有肝细胞水样变化及炎症细胞浸润,细胞质着色变淡,胞质充满微小脂泡.与MSG组相比,FGF-21治疗后肝细胞形态明显得到恢复,肝细胞脂肪变性显著减少,细胞结构清晰,细胞质丰富.

|
图 5 组织切片分析 |
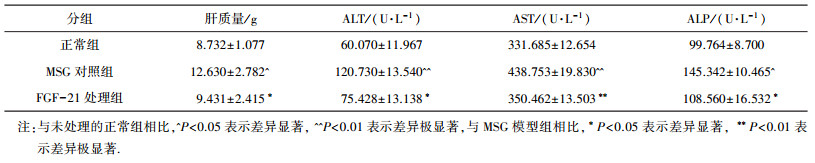
表 4表明,MSG模型对照组的肝质量、ALT、AST和ALP显著高于正常组(n=6,P<0.05),经过FGF-21的治疗后MSG大鼠肝脏各项参数均显著下降(n=6,P<0.05)且与正常组无显著差异.
| 表 4 FGF-21对MSG大鼠肝代谢的影响 |
肥胖,尤其是腹型肥胖与糖、脂代谢异常的关系已得到公认.而且腹部脂肪的堆积与致动脉粥样硬化的脂质紊乱关系密切,也是增加机体患心血管疾病的危险因素[16].本研究采用的MSG诱导的大鼠肥胖模型具有类似人体肥胖的形成特点.通过对刚出生大鼠脑后注射高剂量MSG,利用颅脑未闭合的特点,大量的MSG进入大鼠脑部,对下丘脑造成永久性破坏,使大鼠进食量显著增加,日常能量摄入量远超消耗量,进而导致向心性肥胖.与其他造模方法(高脂饮食、转基因动物)相比,该方法成膜率高,成本较低,动物基因表达谱正常,脂肪堆积原理更接近人类肥胖模式.利用上述方法,成功制备了体质量显著高于同窝正常组的肥胖大鼠模型,而且解剖观察发现模型鼠的腹部脂肪堆积严重.采用该模型评估FGF-21生物学效应可以更真实地反映FGF-21对人类肥胖的预期治疗效果.
经过FGF-21干预后,MSG诱导的肥胖大鼠体质量和Lee’s指数明显下降,尤其是腹部脂肪湿质量显著减轻,镜下观察脂肪细胞明显缩小,一个视野内脂肪细胞数增多,说明FGF-21有减少肥胖大鼠脂肪组织的作用,尤其是腹部脂肪.这一结果证明FGF-21具有显著减少脂肪堆积的效果,其减少腹部脂肪堆积的作用尤为突出,可以有效降低因腹部脂肪堆积而带来的心血管等其他危险因素.同时,FGF-21能显著降低MSG肥胖大鼠血清中TG、TC和LDL-C浓度,升高HDL-C浓度,提示FGF-21可以有效改善肥胖大鼠的脂代谢环境.
除脂肪外,肝脏也是FGF-21在机体内部重要的靶器官[17].肝脏细胞中的脂肪累积是形成脂肪肝的主要原因[18].从肝细胞形态可以看出,与正常组相比,MSG模型对照组大量肝细胞发生脂肪变性,肝细胞肿胀明显,伴有肝细胞水样变化及炎症细胞浸润,细胞质着色变淡,胞质充满微小脂泡.而经过FGF-21治疗后,肝细胞几乎无脂肪变性,细胞结构清晰,细胞质丰富,和正常组无明显差异.我们还对MSG肥胖大鼠的肝代谢环境做了研究.因肥胖引起的肝脏病变导致MSG模型组肥胖大鼠的肝重、ALT、AST、ALP显著高于正常组(P<0.05),经FGF-21治疗后均显著下降(P<0.05),提示FGF-21可以显著改善内脏脂肪引起的肝细胞炎症水平.同时发现不管是模型组还是正常组,其肝脏均普遍受到损害,表现为AST数值高于理论数据.在排除测量误差外,认为可能是在长期饲养过程中,外界环境对大鼠造成的损害.
瘦素是一种脂源性激素,具有减少摄食和增加能量消耗的作用,肥胖患者普遍存在瘦素抵抗而非缺失瘦素.本研究结果表明,MSG肥胖大鼠脂肪中的Leptin mRNA表达水平显著升高,但经过FGF-21治疗后其表达水平显著下降,而进食量未发生改变,提示FGF-21减少MSG肥胖大鼠脂肪组织可能没有通过Leptin的调节.下丘脑肥胖模型伴有的显著特征为胰岛素抵抗、高胰岛素血症[19-20].实验证实MSG肥胖大鼠的血糖较高,而葡萄糖的不耐受直接反应出其胰岛素敏感性的降低.经过FGF-21的治疗后,其血糖恢复正常,葡萄糖耐受、胰岛素敏感性提高.提示FGF-21可以有效降低MSG肥胖大鼠的血糖并且促进其胰岛素敏感性的提高.Glut-1是公认的FGF-21发挥生物活性的生物标志物.荧光定量PCR结果显示,FGF-21可显著上调靶器官中Glut-1的水平,可见本研究中所获得的生物学变化与FGF-21直接相关.
PPARα通路在脂质代谢中的作用一直是近年来国际上研究的热点,其主要在肝细胞中表达.在本研究结果中,MSG模型对照组肝脏中PPARα mRNA表达水平显著下降(P<0.05),PPARα表达的减弱,使脂肪酸在肝脏中的氧化能力下降,增加了脂质在肝脏中的沉积[21].经过FGF-21治疗后其表达量略有降低但并无统计学差异,提示FGF-21在改善肝脏代谢环境时可能没有通过PPARα的调节.值得注意的是,PPARα被认为是肝脏FGF-21表达调控位点[22],在以往的研究中,发现外源注射FGF-21后能够显著降低机体自身FGF-21表达水平[7],PPARα表达降低可能是机体自身对FGF-21血清浓度提高的生理反应.
PPARγ的作用广泛,其目的基因可直接参与脂肪细胞的分化成熟,并影响体内脂肪的合成及蓄积,目前普遍认为PPARγ在脂肪细胞系统调节中有至关重要的作用.但也有报道称非酒精性脂肪肝的形成可能与肝脏组织中PPARγ的高表达,促进了肝细胞的成脂性改变有关[23].本研究中,MSG模型对照组肝脏中PPARγ mRNA表达水平显著升高(P<0.01),进而证明,肝脏中PPARγ表达升高可以诱导成脂性基因转录增多从而促进脂肪在肝脏细胞中合成[24].经FGF-21治疗后其表达量显著下降(P<0.01),这一结果进一步证明FGF-21能够有效治疗因肥胖引起的脂肪肝.
综上,FGF-21可以有效治疗由高进食量引起的肥胖、糖代谢紊乱,有效减少脂肪堆积,促进脂肪(尤其是腹部脂肪)的燃烧,恢复脂肪肝,平衡其肝脂代谢,有望成为治疗肥胖及其引起的脂肪肝,预防心血管疾病的新基因药物.
| [1] |
王从容, 杨锡让. 肥胖发生机制的生理学分析[J]. 北京体育大学学报, 1994, 17(1): 39-43. |
| [2] |
SAITO Y, KOBAYASHI J, SEIMIYA K, et al. Contribution of visceral fat accumulation to post prandial hyperlipidemia in human obesity[C]//Eighth International Congress on Obesity. Paris: [s. n. ], 1998: 496.
|
| [3] |
郑洪来, 周俊, 冯征. 腹部脂肪分布与冠心病的相关性研究[J]. 中国医学影像学杂志, 2003, 11(3): 210-212. |
| [4] |
王文飞, 李校堃, 李德山. 糖尿病治疗的新视点——成纤维细胞生长因子[J]. 中国药理学通报, 2009, 25(4): 433-435. |
| [5] |
ZHANG Jun, LI Yang. Fibroblast growth factor 21, the endocrine FGF pathway and novel treatments for metabolic syndrome[J]. Drug Discov Today, 2014, 5(19): 579-589. |
| [6] |
姜媛媛, 刘铭瑶, 任桂萍, 等. 鼠源成纤维生长因子-21对脂肪细胞糖代谢的作用[J]. 生物化学与生物物理进展, 2009, 36(2): 157-164. |
| [7] |
COSKUN T, BINA H A, SCHNEIDER M A, et al. Fibroblast growth factor-21 corrects obesity in mice[J]. Endocrinology, 2008, 149(12): 6018-6027. DOI:10.1210/en.2008-0816 |
| [8] |
NAKAQAWA T, UKAI K, OHYAMA T, et al. Effects of chronic administration of sibutramine on body weight, food intake and motor activity in neonatally monosodium glutamate-treated obese female rats:relationship of antiobesity effect with monoamines[J]. Exp Anim, 2000, 49(4): 239-249. DOI:10.1538/expanim.49.239 |
| [9] |
BUNYAN J, MURRELL E A, SHAH P P. The induction of obesity in rodents by means of monosodium glutamate[J]. Br J Nutr, 1976, 35(1): 25-39. DOI:10.1079/BJN19760005 |
| [10] |
郭淑芳, 韩国柱, 李卫平, 等. 长期应用重组人睫状神经因子(rhCNTF)对谷氨酸钠肥胖大鼠血脂的影响[J]. 实验动物科学, 2009, 26(1): 7-10. |
| [11] |
NAKANISHI Y, TSUNEYAMA K, FUJIMOTO M, et al. Monosodium glutamate (MSG):a villa in and promoter of liver inflammation and dysplasia[J]. J Autoimmun, 2008, 149(12): 6018-6027. |
| [12] |
谭正怀, 莫正纪, 陈岷. 西布曲明对谷氨酸钠诱导的肥胖动物模型的影响[J]. 中国药理学通报, 2001, 17(6): 675-678. |
| [13] |
CHANDLER P C, VIANA J B, OSWALD K D, et al. Feeding response to melanocortin agonist predicts preferencefor and obesity from a high-fat diet[J]. Physiol Behav, 2005, 85(2): 221-230. DOI:10.1016/j.physbeh.2005.04.011 |
| [14] |
XU Jing, LLOYD D J, HALE C, et al. FGF21 reverses hepatic steatosis, increases energy expenditure and improves insulin sensitivity in diet-induced obese mice[J]. Diabetes, 2009, 58(1): 250-259. DOI:10.2337/db08-0392 |
| [15] |
FISHER F M, CHUI P C, ANTONELLIS P J, et al. Obesity is an FGF21 resistant state[J]. Diabetes, 2010, 59(11): 2781-2789. DOI:10.2337/db10-0193 |
| [16] |
陈静, 田志强, 罗志丹, 等. 腹部脂肪分布与代谢综合征组分关系的研究[J]. 解放军医学杂志, 2005, 30(8): 683-686. |
| [17] |
LIU Wenyue, HUANG Sha, SHI Keqing, et al. The role of fibroblast growth factor 21 in the pathogenesis of liver disease:a novel predictor and therapeutic target[J]. Expert Opin Ther Targets, 2014, 18(11): 1305-1313. DOI:10.1517/14728222.2014.944898 |
| [18] |
周砚, 陆伦根. 肥胖症与非酒精性脂肪性肝病的关系及其治疗进展[J]. 胃肠病学, 2007, 12(8): 502-505. |
| [19] |
HERNANDEZ-BAUTISTA R J, ALARCON-AGUILAR F J, DEL C ESCOBAR-VILLANUEVA M, et al. Biochemical alterations during the obese-aging process in female and male monosodium glutamate (MSG)-treated mice[J]. Int J Mol Sci, 2014, 15(7): 11473-11494. DOI:10.3390/ijms150711473 |
| [20] |
MIRANDA R A, AGOSTINHO A R, TREVENZOLI I H, et al. Insulin oversecretion in MSG-obese rats is related to alterations in cholinergic muscarinic receptor subtypes in pancreatic islets[J]. Cell Physiol Biochem, 2014, 33(4): 1075-1086. DOI:10.1159/000358677 |
| [21] |
李玉中, 王朝晖, 应力. 复方甘正浸膏对非酒精性脂肪性肝炎CYP2E1和PPARα表达的影响[J]. 中国中医急诊, 2008, 17(8): 1118-1120. |
| [22] |
VERNIA S, CAVANAGH-KYROS J, GARCIA-HARO L, et al. The PPARα-FGF21 hormone axis contributes to metabolic regulation by the hepatic JNK signaling pathway[J]. Cell Metab, 2014, 20(3): 512-525. DOI:10.1016/j.cmet.2014.06.010 |
| [23] |
李晓翠, 孙丹莉, 张子蜀, 等. 非酒精性脂肪性肝病大鼠肝脏PPAR-γ的表达[J]. 现代生物医学进展, 2011, 11(14): 2620-2623. |
| [24] |
YU S, MATSUSUE K, KASHIREDDY P, et al. Adipocyte-specitic gene expression and adipogenic steatosis in the mouse liver due to PPARγ overexpression[J]. J Biol Chem, 2003, 27(8): 498-505. |
 2016, Vol. 48
2016, Vol. 48