目前, 城市污水处理厂多采用活性污泥法去除生活污水中的有机物、氮和磷, 然而,传统活性污泥法会产生大量的污泥, 而处理这些污泥的费用占水厂总运行费用的60%[1].因此,为降低污泥处理成本, 需对污泥进行减量化.污泥减量化处理常用的方法有厌氧消化和好氧消化[2-4].其中厌氧消化又以能产生甲烷气体、氢气, 活性污泥法脱氮除磷的重要有机碳源——短链脂肪酸(SCFAs)等能源质引起广泛关注[5-9].城市生活污水的碳氮比、碳磷比较低, 污水处理厂为了提高脱氮除磷效果, 需要外加碳源, 方法之一是直接加入化学制成的碳源, 如乙酸钠、乙醇等,该方法无疑增加了污水处理厂的处理成本.近年来,有文献报道污泥厌氧发酵不仅可以达到污泥减量, 还可以获得大量的易生物降解碳源——SCFAs[10-11].污泥厌氧消化包括3个阶段:水解、酸化和产甲烷.其中水解是整个消化过程的限制性过程[12-13].从产酸的角度出发, 提高水解过程并且抑制产甲烷过程才能使得SCFAs积累.研究表明, 污泥在碱性条件下发酵产酸量比酸性或中性时高得多[14-15], 但是达到最大SCFAs产量的发酵时间仍需要8~10 d.
厌氧条件下污泥的水解、酸化和产甲烷各过程是通过大量的细菌或者古菌实现的.因此, 污泥厌氧发酵过程中微生物起着很重要的作用[16-18].该过程引进水解菌、发酵菌或许会进一步提高剩余污泥产酸量, 缩短发酵时间.接伟光等[19]通过分离剩余污泥中的耐碱性菌株HIT-01和HIT-02, 并将2种细菌单独或者同时投加到新鲜污泥中, 观察其在碱性条件下的产酸量情况.结果表明,接种耐碱性菌株可以增加剩余污泥发酵产酸, 同时接种2种菌株时SCFAs积累量最多.然而该研究依然控制整个发酵过程为碱性条件, 未考查不控制pH(即中性)的情况, 并且投加的菌种是通过分离纯培养得到的, 操作复杂.基于以上研究, 将pH=10下长期发酵的污泥作为种泥接至新鲜剩余污泥中, 在不同条件下(碱性条件、不控制pH条件)考察其对新鲜剩余污泥厌氧发酵过程中产生SCFAs的影响, 并进一步从产酸所需的底物(蛋白质和多糖)方面分析不同条件下影响产SCFAs的原因.
1 实验 1.1 剩余污泥实验所用新鲜剩余污泥均取自以实际生活污水为处理对象的中试SBR (有效体积6 m3).此SBR的1个运行周期为12 h, 运行方式为:进水(0.25 h)、好氧(6 h)、缺氧(1 h)、厌氧(2 h)、沉淀(2.25 h)、排水(0. 5 h).其中好氧段主要是短程硝化, 缺氧段则是短程反硝化, 剩余污泥在厌氧末端排出.排出的污泥在4℃下沉淀浓缩, 浓缩后污泥的主要成分如表 1所示.
| 表 1 实验用剩余污泥性质 Table 1 Characteristics of sewage sludge after sedimentation mg·L-1 |
采用5 L的半连续厌氧发酵反应器(SAFR).控制污泥发酵的pH在10±0.2, 温度为(30±2)℃, 污泥停留时间SRT为6 d, 即每天排833 mL发酵污泥, 并加入等体积(833 mL)的新鲜剩余污泥至SAFR中.该反应器的污泥来源为上述新鲜剩余污泥, 运行30 d后监测其产酸量, 在90 d时测定发酵污泥的微生物菌群结构.
1.2.2 厌氧发酵种泥对剩余污泥发酵产酸的影响取SAFR中的厌氧发酵种泥1 200 mL, 离心弃上清液, 再用蒸馏水清洗离心2次.本实验共有4组反应器:1)不控制pH(pH=7.4±0.2), 投加新鲜剩余污泥(1#); 2)不控制pH(pH=7.4±0.2), 投加新鲜剩余污泥, 并接种厌氧发酵种泥(2#); 3)控制pH(pH=10±0.2), 投加新鲜剩余污泥(3#); 4)控制pH(pH=10±0.2), 投加新鲜剩余污泥, 并接种厌氧发酵种泥(4#).每组反应器设有2个平行实验, 将4组反应器置于磁力搅拌器上, 转速为120 r/min, 温度θ在(30±2)℃.每组反应器吹氮气3 min, 去除反应器中的溶解氧, 保持厌氧环境.反应期间, 为了保证各反应器的pH在10±0.2, 用2 mol·L-1的NaOH和2 mol·L-1HCl调节.取样周期为1 d, 取出的水样在转速为4 000 r/min的离心机中离心10 min, 然后用0.45μm的滤膜抽滤, 滤液用来分析各项指标, 过滤后的水样立即测定, 最终数据为每组平行实验的平均值.
1.3 DNA提取、PCR扩增和Miseq测序在SAFR运行到第90天并且投加新鲜剩余污泥前取发酵污泥.首先, 泥样在转速为4 000 r/min的离心机中离心5 min, 弃上清液, 然后将泥样放置冷冻干燥机进行冷冻干燥.称取0.034 6 g干污泥, 用DNA试剂盒(FastDNA Spin Kit for Soil)提取DNA.设计的引物用于扩增16S rRNA基因的V3+V4区[20], 引物系列见表 2. PCR反应体系(20μL)如下:5×FastPfu Buffer,4μL; 2.5 mmol/L dNTPs, 2μL; Forward Primer (5μmol/L), 0.4μL; Reverse Primer (5μmol/L), 0.4μL; FastPfu Polymerase, 0.4μL; Template DNA, 10 ng; ddH2O, 20μL.
| 表 2 PCR扩增所用引物 Table 2 Ssequence information of primers for PCR amplified |
PCR扩增条件如下:95℃预变性2 min; 然后, 95℃变性30 s, 55℃退火30 s, 72℃延伸45 s, 共25个循环; 72℃最终延伸10 min, 最终4℃保存.Illumina Miseq测序平台为PE300, 测得的原始数据可在NCBI数据库通过检索号SRA230879获得, 序列的基本信息见表 3.
| 表 3 Illumina Miseq测序序列信息 Table 3 Statistics of sample |
TSS、VSS采用称重法测定.TCOD、SCOD采用5B-3(B)型COD快速测仪, 碳水化合物采用苯酚-硫酸比色法; 蛋白质采用Lowry-Folin试剂.SCFAs采用Agilent7890A气相色谱仪测定, FID检测器, 色谱柱型号及尺寸:AgilentdB-WAXetr, 30 m×0.53 mm×0.001 mm, N2为载气, 载气流量为20 mL·min-1, 进样口和检测器分别维持在220和250℃, 烘箱起始温度为80℃, 最后升温至240℃, 进样体积2μL.实验中检测到的SCFAs包括乙酸、丙酸、正丁酸、异丁酸、正戊酸和异戊酸, 将其浓度分别乘以比例系数1.07、1. 51、1. 82、1.82、2.04、2.04转化为COD浓度[21]后的加合计为总SCFAs浓度.采用WTWpH/Oxi340i测定仪测定pH.
2 结果与讨论 2.1 SAFR中的SCFAs产量及微生物菌群如图 1所示, SAFR反应器在运行30 d后, 经过60 d的稳定运行, 其平均产酸量为(1 721.4±91.2) mg/L. Illumina Miseq测序表明:在phylum水平上分析可得到10种细菌(图 2), 其中Chloroflexi, Proteobacteria, Bacteroidetes和Firmicute是主要的菌属, Chloroflexi为SAFR中最丰富的菌属, 占30.1%[22].为了进一步确定检测的细菌在污泥发酵过程所起的作用, 又从genus水平上对Illumina Miseq测序结果进行分析, 见表 4.水解细菌——Alcaligenes(3.47%)和Anaerolinea(3.34%)、产酸细菌——Erysipelothrix(7.31%), Paludibacter(4.96%)和Tissierella(3.59%)分别得到富集[22].
|
图 1 SAFR中随时间变化的产酸量 Figure 1 SCFAs production from excess sludge with the fermentation time |
|
图 2 SAFR中微生物在门水平上的相对丰度 Figure 2 Distribution of bacterial community in SAFR |
| 表 4 SAFR中16 s rRNA基因序列的系统分类(属的水平, 相对丰度>1%) Table 4 Phylogenetic classification of the 16 s rRNA gene sequences (relative abundance>1% at genus level) at SAFR |
因此, 综合SAFR反应器稳定的产酸性及富有水解菌和产酸菌, 其发酵污泥可用作种泥.
2.2 剩余污泥厌氧发酵产生的SCFAs图 3表明新鲜剩余污泥在不同条件下产短链脂肪酸(SCFAs)的情况.发酵前期, 1#(1~9 d)、2#(1~9 d)、3#(1~10 d)、4#(1~6 d)反应器的产酸量均呈现增长的趋势.而反应后期, 1#、2#、4#呈下降趋势, 3#则趋于稳定.这是因为1#、2#反应器的pH均是中性, 随着发酵时间的进行, 产甲烷菌出现, 消耗了SCFAs.而3#反应器的碱性条件短时间内抑制了产甲烷菌的生长, 4#反应器虽然是碱性条件, 但是接种的厌氧发酵种泥中含有极少量的产甲烷菌[17、22], 待适应了厌氧发酵环境后便消耗SCFAs.因此, 为了获取不同条件下的最大产酸量, 需要控制各自的SRT, 即1#~9 d、2#~9 d、3#~10 d、4#~6 d.
|
图 3 4组反应器中短链脂肪酸产量 Figure 3 SCFAs production from excess sludge (ES) at four reactors |
从图 3还可以看出, 在发酵第6天, 4#反应器(控制pH=10±0.2, 并接种厌氧发酵种泥)产酸量达187.2 mg /g VSS, 而1#、2#、3#反应器的最大产酸量分别是36.1 (9 d)、41.0 (9 d)和170.8 mg /g VSS(10 d).这是因为碱性条件利于剩余污泥发酵产酸[14-15], 其次接种的厌氧发酵种泥引入了产酸菌, 提高了产酸效率, 将最大产酸量的时间提前了3~4 d.另外, 在pH不控的条件下, 投加种泥的最大产酸量(2#)较不投加种泥的最大产酸量(1#)提高了4.9 mg/g VSS(显著性P < 0.05);在碱性条件下, 投加种泥(4#)较不投加种泥的最大产酸量(3#)提高了16.4 mg/g VSS.这说明投加发酵种泥可提高新鲜剩余污泥厌氧发酵过程中SCFAs的产生效率, 并且碱性条件及厌氧发酵种泥对剩余污泥厌氧发酵产酸具有协同促进作用.由于碱性条件利于剩余污泥发酵产酸[14-15], 均接种发酵污泥的剩余污泥在pH=10±0.2下的最大产酸量较pH=7.4±0.2的高146.2 mg /g VSS.此外, 相对于2#反应器, 3#反应器的最大产酸量提高了129.8 mg/g VSS, 这表明碱性条件较厌氧发酵种泥对新鲜剩余污泥厌氧发酵产酸更具促进作用.
2.3 剩余污泥厌氧发酵产生的溶解性蛋白质和多糖污泥胞外聚合物(extracellular polymeric substances, EPS)是附着于微生物细胞壁上的大分子有机多聚物, 主要来源为进水基质、微生物新陈代谢和细胞自溶, 是产生SCFAs所需要的主要基质.EPS具有复杂的化学组成, 占总量70%~80%的蛋白质和多糖是最主要的2种成分, 而核酸、腐殖质、糖醛酸、脂类和氨基酸等的含量相对较低[23].因此, 本文主要研究了溶解性蛋白质和多糖, 从产酸所需的基质进一步分析剩余污泥在不同条件下产酸量不同的原因.
图 4、5表明, 溶解性的多糖浓度低于蛋白质的浓度, 这与污泥中蛋白质含量高于多糖有关.另外, 溶解性的多糖浓度变化较蛋白质的波动大.相对于中性条件, 溶解性蛋白质在碱性条件下的溶出量较高, 这是因为碱性导致EPS中的酸性基团分离,使得带负电的EPS相互排斥, 进而增加蛋白质和多糖的溶解性[24].然而接种了厌氧发酵种泥的4#反应器又比3#的溶解性蛋白质高, 这是因为接种种泥引入了水解菌, 这些细菌会释放胞外酶[23], 进而促进了蛋白质、多糖的释放.
|
图 4 4组反应器中溶解性蛋白质的释放量 Figure 4 Soluble protein release from ES at four reactors |

|
图 5 4组反应器中溶解性多糖的释放量 Figure 5 Soluble carbohydrate release from ES at four reactors |
短链脂肪酸是产酸菌利用溶解性蛋白质和多糖的水解产物(氨基酸、单糖)生成的, 而蛋白质的水解伴随有NH4+-N的生成.因此,发酵液中NH4+-N的释放可以表征溶解性蛋白质的水解作用[25].由图 6可以看出, 随着发酵时间不断增加, 4组反应器发酵液中的NH4+-N含量逐步升高, 这表明溶解性有机物不断水解生成小分子有机物, 为产酸菌发酵产酸提供了所需的基质.4组反应器的NH4+-N含量高低顺序为4#>3#>2#>1#.显然4#反应器的产酸基质最充足, 这与产酸量最多相吻合.另外, 碱性条件抑制产甲烷菌的活性, 也造就了SCFAs的积累.因此, 接入的产酸菌、足够的发酵产酸所需基质以及产甲烷过程受抑制是4#反应器产酸效率高的原因.
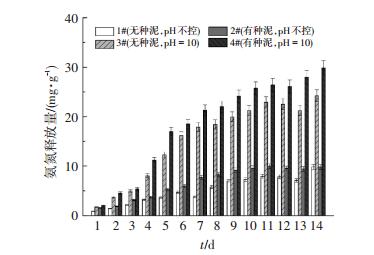
|
图 6 4组反应器中氨氮(NH4+-N)的释放量 Figure 6 NH4+-N release from ES at four reactors |
1)投加厌氧发酵种泥提高了剩余污泥厌氧发酵产短链脂肪酸的效率.在pH不控的条件下, 投加种泥的产酸量较不投加提高了4.9 mg/g VSS; 在碱性pH条件下, 投加种泥较不投加种泥的产酸量提高了16.4 mg /g VSS.接入的产酸菌以及足够的发酵产酸所需基质是产酸效率高的原因.
2)种泥的投加与碱性条件对剩余污泥发酵产酸具有协同促进作用.
3)碱性条件比投加种泥对剩余污泥发酵产酸更具促进作用.
| [1] |
WEI Yuansong, VAN-HOUTEN R T, BORGER A R, et al. Minimization of excess sludge production for biological wastewater treatment[J].
Water Research,2003, 37 (18) : 4453-4467.
DOI: 10.1016/S0043-1354(03)00441-X ( 0) 0)
|
| [2] |
FOLADORI P, ANDREOTTOLA G, ZIGLIO G.
Sludge reduction technologies in wastewater treatment plants[M]. London: IWA Publishing, 2010 .
( 0) 0)
|
| [3] |
ZHANG Dong, CHEN Yinguang, ZHAO Yuxiao, et al. New sludge pretreatment method to improve methane production in waste activated sludge digestion[J].
Environmental Science and Technology,2010, 44 (12) : 4802-4808.
DOI: 10.1021/es1000209 ( 0) 0)
|
| [4] |
CARRÈRE H, DUMAS C, BATTIMELLI A, et al. Pretreatment methods to improve sludge anaerobic degradability: a review[J].
Journal of Hazardous Materials,2010, 183 (1/2/3) : 1-15.
( 0) 0)
|
| [5] |
YAN Yuanyuan, CHEN Hanlong, XU Wenying, et al. Enhancement of biochemical methane potential from excess sludge with low organic content by mild thermal pretreatment[J].
Biochemical Engineering Journal,2013, 70 : 127-134.
DOI: 10.1016/j.bej.2012.10.011 ( 0) 0)
|
| [6] |
GUO Liang, LI Xiaoming, ZENG Guangming, et al. Effective hydrogen production using waste sludge and its filtrate[J].
Energy,2010, 35 (9) : 3557-3562.
DOI: 10.1016/j.energy.2010.04.005 ( 0) 0)
|
| [7] |
LU Lu, XING Defeng, LIU Bingfeng, et al. Enhanced hydrogen production from waste activated sludge by cascade utilization of organic matter in microbial[J].
Water Research,2012, 46 (4) : 1015-1026.
DOI: 10.1016/j.watres.2011.11.073 ( 0) 0)
|
| [8] |
JIANG Su, CHEN Yinguang, ZHOU Qi, et al. Biological short-chain fatty acids (SCFAs) production from waste-activated sludge affected by surfactant[J].
Water Research,2007, 41 : 3112-3120.
DOI: 10.1016/j.watres.2007.03.039 ( 0) 0)
|
| [9] |
LIU He, WANG Jin, LIU Xiaoling, et al. Acidogenic fermentation of proteinaceous sewage sludge: effect of pH[J].
Water Research,2012, 46 (3) : 799-807.
DOI: 10.1016/j.watres.2011.11.047 ( 0) 0)
|
| [10] |
TONG Juan, CHEN Yinguang. Enhanced biological phosphorus removal driven by short-chain fatty acids produced from waste activated sludge alkaline fermentation[J].
Environmental Science and Technology,2007, 41 (20) : 7126-7130.
DOI: 10.1021/es071002n ( 0) 0)
|
| [11] |
GAO Yongqing, PENG Yongzhen, ZHANG Jingyu, et al. Biological sludge reduction and enhanced nutrient removal in a pilot-scale system with 2-step sludge alkaline fermentation and A(2)O process[J].
Bioresource Technology,2011, 102 (5) : 4091-4097.
DOI: 10.1016/j.biortech.2010.12.051 ( 0) 0)
|
| [12] |
KIM M, GOMEC C Y, AHN Y, et al. Hydrolysis and acidogenesis of particulate organic material in mesophilic and thermophphilic anaerobic digestion[J].
Environmental Technology,2003, 24 (9) : 1183-1190.
DOI: 10.1080/09593330309385659 ( 0) 0)
|
| [13] |
BOUSKOVA A, DOHANYOS M, SCHMIDT J E, et al. Strategies for changing temperature from mesophilic to thermophilic conditions in anaerobic CSTR reactors treating sewage sludge[J].
Water Research,2005, 39 : 1481-1488.
DOI: 10.1016/j.watres.2004.12.042 ( 0) 0)
|
| [14] |
CHEN Yinguang, JIANG Su, YUAN Hongying, et al. Hydrolysis and acidification of waste activated sludge at different pHs[J].
Water Research,2007, 41 (3) : 683-689.
DOI: 10.1016/j.watres.2006.07.030 ( 0) 0)
|
| [15] |
JIE Weiguang, PENG Yongzhen, REN Nanqi, et al. Volatile fatty acids (VFAs) accumulation and microbial community structure of excess sludge (ES) at different pHs[J].
Bioresource Technology,2014, 152 : 124-129.
DOI: 10.1016/j.biortech.2013.11.011 ( 0) 0)
|
| [16] |
RIVIERE D, DESVIGNES V, PELLETIER E, et al. Towards the definition of a core of microorganisms involved in anaerobic digestion of sludge[J].
International Society for Microbial Ecology,2009, 3 (6) : 700-714.
( 0) 0)
|
| [17] |
ZHENG Xiong, SU Yinglong, LI Xiang, et al. Pyrosequencing reveals the key microorganisms involved in sludge alkaline fermentation for efficient short-chain fatty acids production[J].
Environmental Science and Technology,2013, 47 (9) : 4262-4268.
DOI: 10.1021/es400210v ( 0) 0)
|
| [18] |
LI Xiaoling, PENG Yongzhen, REN Nanqi, et al. Effect of temperature on short chain fatty acids (SCFAs) accumulation and microbiological transformation in sludge alkaline fermentation with Ca(OH)2 adjustment[J].
Water Research,2014, 61 : 34-45.
DOI: 10.1016/j.watres.2014.03.030 ( 0) 0)
|
| [19] |
JIE Weiguang, PENG Yongzhen, REN Nanqi, et al. Utilization of alkali-tolerant stains in fermentation of excess sludge[J].
Bioresource Technology,2014, 157 : 52-59.
DOI: 10.1016/j.biortech.2014.01.107 ( 0) 0)
|
| [20] |
DENNIS K L, WANG Y, BLATNER N R, et al. Adenomatous polyps are driven by microbe-instigated focal inflammation and are controlled by IL-10-producing T cells[J].
Cancer Research,2013, 73 (19) : 5905-5913.
DOI: 10.1158/0008-5472.CAN-13-1511 ( 0) 0)
|
| [21] |
EASTMAN J A, FERGUSON J F. Solubilization of particulate organic carbon during the acid phase of anaerobic digestion[J].
Journal of the Water Pollution Control Federation,1981, 53 (3) : 352-366.
( 0) 0)
|
| [22] |
YUAN Yue, WANG Shuying, LIU Ye, et al. Long-term effect of pH on short-chain fatty acids accumulation and microbial community in sludge fermentation systems[J].
Bioresource Technology,2015, 197 : 56-63.
DOI: 10.1016/j.biortech.2015.08.025 ( 0) 0)
|
| [23] |
FROLUND B, PALMGREN R, KEIDING K, et al. Extraction of extracellular polymers from activated sludge using a cation exchange resin[J].
Water Research,1996, 30 (8) : 1749-1758.
DOI: 10.1016/0043-1354(95)00323-1 ( 0) 0)
|
| [24] |
WINGENDER J, NEU T R, FLEMMING H C.
Microbial extracellular polymeric substances: characterisation, structure and function[M]. Berlin: Springer, 1999 .
( 0) 0)
|
| [25] |
PIJUAN M, WANG Qilin, YE Liu, et al. Improving secondary sludge biodegradability using free nitrous acid treatment[J].
Bioresource Technology,2012, 116 : 92-98.
DOI: 10.1016/j.biortech.2012.04.016 ( 0) 0)
|
 2016, Vol. 48
2016, Vol. 48


