2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨 150090
2. State Key Lab of Urban Water Resource and Environment(Harbin Institute of Technology), Harbin 150090, China
微生物燃料电池(microbial fuel cell,MFC)利用电化学活性微生物将废水中污染物的化学能转化为电能,实现了废水同步处理与产电,得到越来越多的关注,但其较低的输出功率是限制其应用的瓶颈之一[1].胞外电子传递(extracellular electron transfer,EET)指电子从阳极微生物向阳极传递的过程,直接影响MFC的能量转换效率,因此, 研究阳极微生物胞外电子传递过程的影响因素对提高MFC功率输出具有重要的意义.金属离子对MFC系统性能的提高或恶化具有不同的作用,可以改变溶液的电导率、影响MFC的内阻、产电量及电化学活性微生物的活性等[2],这使得金属离子成为了MFC优化运行条件与提高产电功率的研究热点.目前,一些贵金属如Pt、Au等可以作为阳极催化剂[3-4],提高MFC的产电性能;此外,如铜离子存在生物毒性,对MFC产电存在抑制作用[5],也有学者据此设计了基于MFC的重金属传感器[6].
镁离子是细胞内含量最高的二价离子[7],大多数细胞中镁离子的总浓度约为20 mmol/L,而细胞质内游离的镁离子为0.5~1.0 mmol/L[8].在生理作用上,镁离子是核糖体和细胞膜必需的结构物质[9],也是糖酵解途径、三羧酸循环及一些物质合成重要的酶激活剂[10].总体来说,镁离子参与了细胞内多种生理过程,对于微生物的生长增殖必不可少,但目前镁离子对MFC阳极微生物作用的研究却未见报道.本文对3组阳极底物中含有不同浓度镁离子的混菌MFC进行研究,并与对照组比较稳定运行时的阳极电势与输出功率.采用循环伏安法和交流阻抗谱的电化学分析方法测试比对不同镁离子浓度下MFC阳极微生物电化学活性的差异,同时通过扫描电子显微镜观察、阳极总生物量测定、阳极微生物群落结构测序鉴定比较各实验组与对照组阳极微生物膜形态与结构的不同,旨在揭示镁离子浓度对混菌培养下的MFC阳极产电性能的影响.
1 实验 1.1 反应器的构建采用单室空气阴极微生物燃料电池[11],反应器腔体为直径3 cm、高4 cm的圆柱体,有效容积28 mL.阳极采用碳纤维刷[12],碳刷的外径与长度均为3 cm.阴极按照文献报道[13]制作,碳布上固定0.40 mg/cm2铂催化剂.
1.2 反应器的运行各实验组分别在阳极底物添加0.5(M1)、2.0 (M2)、5.0 mmol/L(M3)镁离子3种条件下运行,其中0.5 mmol/L约为细胞中游离的镁离子浓度、2.0 mmol/L为MFC研究中人工配水常添加的镁离子浓度[14]、5.0 mmol/L则为镁离子相对过量的条件,同时设置不添加镁离子的对照组(CK).在系统的启动阶段,使用哈尔滨某污水处理厂污泥回流泵房污泥与含有不同浓度镁离子的阳极底物按1∶10比例混合并进行接种.阳极底物成分为1 g/L葡萄糖、0.5 g/L NH4Cl、17.1 g/L Na2HPO4·12H2O、3.0 g/L KH2PO4、0.3 g/L NaCl、0.01 g/L CaCl2、10 mL/L微量元素液(0.37 g/L MnSO4·H2O、0.01 g/L CuSO4·5H2O、0.02 g/L KAl(SO4)2、0.01 g/L H3BO3、0.1 g/L FeSO4·7H2O、0.1 g/L CoCl2·6H2O、0.1 g/L ZnSO4·7H2O、0.01 g/L Na2MoO4)及对应不同浓度的MgSO4.其pH为7.0~7.2,ICP测得对照组阳极底物中镁离子浓度为2.38μmol/L,电导率使用电导率仪测定(上海雷磁,中国).系统外电路负载1 000Ω电阻,反应器的阳极电势以Ag/AgCl电极(饱和KCl,+0.197 V vs. SHE)作为参比,通过数据采集器(12位A/D转换芯片,美国)实时记录电压值.此外,所有反应器置于25℃恒温箱内,成功启动后,以序批的方式运行,当总电压小于50 mV时更换阳极底物.
1.3 测试分析方法 1.3.1 电化学测试方法循环伏安法控制电极电势按一定的速率,随时间以三角波多次反复扫描,使电极上交替发生不同的还原和氧化反应,通过电压-电流曲线分析阳极微生物的电化学反应活性.本文采用周转和非周转循环伏安两种测试方法,周转循环伏安法是在有底物存在条件下测试的,细胞拥有充足的电子供体,在每个扫描电势下,电极表面的电化学活性蛋白都会被多次氧化和还原,通过最大的响应电流可以判断电极表面微生物电化学活性的强弱;而非周转循环伏安法是在无底物存在情况下测试的,通过饥饿运行,使细胞失去所有电子供体,电化学活性蛋白只在特定电位发生一次氧化和还原过程,以此可以检测电极表面蛋白的特征电势,分析电化学过程的差异.循环伏安测试通过电化学工作站(上海辰华仪器有限公司,中国)完成,采用三电极体系,以Ag/AgCl电极作为参比电极,阳极为工作电极,阴极为对电极,扫描电势范围为-0.8~0.2 V,扫描速率为2 mV/s.
电化学阻抗谱可以确定阳极的电化学参数.测试采用与循环伏安法相同的三电极体系进行实验,在开路电压下,扫描的频率范围为100 kHz~10 mHz,外加交流电压振幅为5 mV,测得数据使用Zsimpwin软件进行拟合.
1.3.2 扫描电子显微镜分析采用金属镀膜法观察附着在微生物燃料电池阳极上的微生物.首先将稳定产电、附着有微生物的阳极碳刷剪下,使用磷酸盐缓冲液清洗,戊二醛固定1.5 h,随后使用乙醇和乙酸异戊酯梯度脱水,并将干燥后的样品粘在样品台上,最后镀上金属膜送入电镜观察(FEI公司,美国).
1.3.3 阳极微生物分析阳极微生物膜总生物量可以通过总蛋白量定量衡量.使用一步法细菌活性蛋白提取试剂盒与改良型BCA蛋白浓度测定试剂盒(上海生工生物工程有限公司,中国)对各组反应器阳极碳刷进行总蛋白的提取与测定.
阳极微生物群落结构分析中,首先使用DNA提取试剂盒(OMEGA公司,美国)提取阳极生物膜DNA,再利用添加标签的341F引物:CCCTACACGACGCTCTTCCGATCTG (barcode) CCTACGGGNGGCWGCAG和805R引物GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHVGGGTATCTAATCC对基因组的16S rDNA序列进行PCR扩增(BIO-RAD公司,美国),回收并进行定量后,送入MiSeq测序平台进行测序分析.
1.4 计算方法MFC面积功率密度Pa的计算公式为
| $ {P_{\rm{a}}}=\frac{{{U^2}}}{{R{S^ \cdot }}} $ | (1) |
式中:U为MFC总电压,V;R为外接负载电阻,取1 000Ω;S为MFC阳极的表面积,m2.
通过非周转循环伏安曲线可计算阳极氧化还原蛋白的表面覆盖度[15],即
| $Γ=\frac{Q}{{nF{A^ \cdot }}} $ | (2) |
式中:Q为法拉第电荷即法拉第电流的积分,C;n为转移的电子数目,mol;F为法拉第常数,为96 485 C/mol;A为阳极表面积,m2.表面覆盖度Г与各组非周转循环伏安曲线的峰面积成正比.
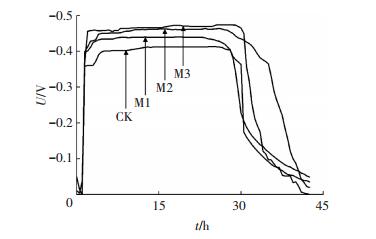
2 结果与讨论 2.1 镁离子对微生物燃料电池产电性能的影响各反应器在接种后,经10 d成功启动并稳定运行,一个运行周期阳极电势变化曲线如图 1.阳极产电微生物将电子传递至阳极通过外接负载到达阴极,使阳极产生相对于阴极的负电势,因此,MFC阳极电势越低则表明阳极产电性能越好.
|
图 1 阳极电势变化曲线 Figure 1 Anode potential variation curve |
由图 1可以看出,M3阳极电势最低,最小值可达-0.477 V,M2最小值为-0.469 V,M1最小值为-0.443 V,均低于对照组阳极电势最小值-0.419 V(CK),且MFC阳极电势随镁离子浓度提高而降低,功率密度相应增大.当阳极底物镁离子浓度由2.38μmol/L增加至5.0 mmol/L,对应功率密度提高了24.09%.上述结果表明,在一定范围内,阳极底物镁离子浓度的提高可以明显地提高微生物燃料电池阳极的产电性能.Jayapriya等[16]在碳棒阳极中掺杂了Mg2+-GECE,得到了相对于不掺杂镁离子及掺杂其他金属离子更高的阳极产电性能.在25℃下,本研究所考察的阳极底物电导率分别为9.71(CK)、9.67(M1)、9.79(M2)和9.77 mS/cm(M3),运行40 h后阳极底物电导率变化为10.25 (CK)、9.98(M1)、10.23(M2)和10.22 mS/cm(M3),由此可知,在阳极底物中添加毫摩每升浓度量级的镁离子并不会明显影响溶液的电导率,且在产电过程中阳极底物的电导率随时间也并未发生明显的改变.因此,阳极产电性能的提高,主要来源于镁离子对胞外电子传递过程与阳极微生物电化学活性的影响.
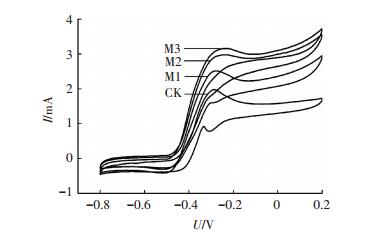
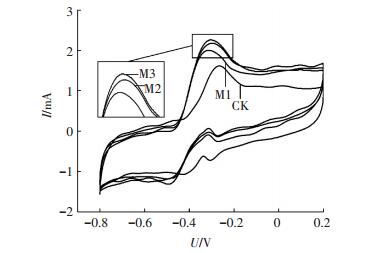
2.2 镁离子对微生物燃料电池阳极微生物电化学活性的影响为确定镁离子对阳极微生物电化学活性的作用,进行了周转、非周转循环伏安法与电化学阻抗谱测量实验.图 2为周转循环伏安曲线,各组曲线均呈S型,说明葡萄糖底物在周转的条件下被阳极微生物催化氧化[17].同时,氧化峰电流分别为1.98(CK)、2.51(M1)、2.98(M2)和3.16 mA(M3),即加入镁离子提高了阳极氧化峰电流,促进了其电化学反应活性.此外,非周转循环伏安法在各反应器使用不含葡萄糖的阳极底物饥饿运行36 h后进行实验,以确保非周转条件,测得的电压-电流曲线如图 3.计算得M1、M2、M3氧化还原蛋白的表面覆盖度分别为对照组的1.05、1.11及1.96倍.另外,利用非周转循环伏安曲线的表观电位(氧化峰电位与还原峰电位的平均值)可以鉴定阳极产电微生物表面电化学活性蛋白的种类[18].如Fricke等[19]测试了Geobacter sulfurreducens阳极的非周转循环伏安曲线,得到了表观电位分别为-0.515、-0.376、-0.295和+0.059 V(vs. Ag/AgCl)的4个氧化还原体系,并指出不同表观电位的氧化还原体系代表了不同的电化学过程.本研究中各反应器阳极均有表观电位为-0.29 V(vs. Ag/AgCl)的氧化还原体系,M1、M2、M3的另一氧化还原体系表观电位为-0.40 V,而对照组CK为-0.35 V.由此可知,在阳极底物中加入镁离子会影响参与电子传递相关蛋白的类型与途径.
|
图 2 周转循环伏安曲线 Figure 2 Turnover cyclic voltammetry curve |
|
图 3 非周转循环伏安曲线 Figure 3 Nonturnover cyclic voltammetry curve |
细胞内镁离子含量较高,因此,微生物对镁离子的吸收需要特定的镁运输蛋白参与[20].Tai等[21]通过对希瓦氏菌全基因组进行的生物信息学分析推测镁传递蛋白编码基因mgtE与电子传递途径中起重要作用的OmcA、OmcB、MtrA、MtrB 4种蛋白存在共表达的作用,这表明镁离子传递途径与电子传递途径可能存在重要的相互关联.微生物具有多种镁传递体系,而mgtE镁离子转运蛋白则较广泛地分布于原核生物中,并被认为是微生物传递镁离子的主要机制之一[22].Dann等[23]证明镁离子会调控mgtE基因的表达,因此,本研究中阳极微生物和微生物燃料电池底物中镁离子浓度的不同会影响镁传递蛋白mgtE的表达,进而通过共表达作用影响电子传递途径相关蛋白的表达,使得阳极随镁离子浓度的改变表现出不同的电化学活性.
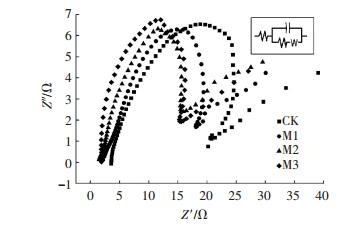
为进一步确定阳极各电化学参数,进行了电化学阻抗谱实验,图 4与表 1分别为测得的能斯特图与拟合得到的阳极电化学参数.对照组的电荷传递电阻最大为16.33Ω,M3的电荷传递电阻最小为11.17Ω,电荷传递电阻随镁离子浓度的提高而逐渐减小.电荷传递电阻由电极反应动力学决定[24],其值越小说明电极上的电子传递过程进行越快,可知加入镁离子可以促进MFC阳极电子传递.而阳极双电层电容则与电极上的产电微生物量有关[25],M2的双电层电容最大为3 371μF,与M3相差不大,是M1的2.61倍、对照组的8.39倍.这说明在阳极底物中加入镁离子一定程度上可以提高阳极双电层电容,即促进产电微生物的富集,使阳极表现出更高的电化学活性.而当镁离子浓度为2.0 mmol/L时,镁离子已能满足产电微生物的需求,进一步提高其浓度产电微生物量并不会得到提高.加入镁离子能够使得MFC阳极电荷传递电阻减小、双电层电容增大,促进了阳极电子传递过程与产电微生物的富集.
|
图 4 电化学阻抗谱能斯特图 Figure 4 Electrochemical Impedance Spectroscopy(EIS) Nyquist plot |
| 表 1 EIS测试MFC阳极电化学参数拟合结果 Table 1 MFC anode electrochemistry parameters fitting result of EIS test |
图 5为阳极碳刷的扫描电子显微镜图像.各组阳极碳刷表面均附着有较多微生物,但对照组阳极碳刷微生物膜的覆盖率较低,其他实验组阳极微生物膜相对致密.进而以蛋白质含量比较各组阳极总微生物量,测得的蛋白质含量分别为0.220(CK)、0.243(M1)、0.266(M2)和0.292 mg/cm3(M3),可知在阳极底物中添加镁离子可以提高阳极附着的微生物总量,且变化趋势与电镜观察及阳极双电层电容分析一致,镁作为微生物生长的必要元素,对其生长繁殖有促进作用,而阳极微生物量的增加也是阳极产电性能提高的原因之一.此外,在M3阳极碳刷表面观察到了大量的杆菌,其他各组则以球菌为主.电镜分析结果表明,较高浓度镁离子不仅会促进微生物在阳极碳刷上的附着能力还可能影响阳极优势种群结构.

|
图 5 阳极扫描电子显微镜图像 Figure 5 Scanning electron microscope image of anode |
群落结构测序得到阳极微生物门水平结构如图 6所示,各组阳极微生物主要门类包括Proteobacteria、TM7及Bacteroidetes3种,而在M3中,Firmicutes菌门的丰度也占优(17.5%).Kim等[26]发现Firmicutes菌门丰度在双室MFC隔膜较MFC其他部件高得多,Firmicutes菌门主要参与葡萄糖的降解,而不涉及产电过程.由于镁离子在微生物代谢生长中的重要作用,镁离子浓度对产电与非产电微生物均会产生影响.在M3条件下,Firmicutes菌门代谢活性可能得到促进,能够更有效地竞争底物中的葡萄糖,丰度提高.这一定程度上限制了产电微生物对于底物的利用,也使得将镁离子浓度由2.0 mmol/L提高到5.0 mmol/L后,MFC阳极微生物产电性能变化不大.M3丰度最高的菌目为Bacteroidales菌目(拟杆菌目),为19.24%,而其在CK、M1、M2中的丰度分别为10.34%、11.56%、13.46%,可能为M3阳极碳刷SEM图像中观察到的杆菌.在属水平上,目前得到广泛研究的产电模式菌属包括Shewanella菌属、Pseudomonas菌属、Geobacter菌属等[27].各组均检测到产电菌属Geobacter,且其丰度随镁离子浓度增加而提高,分别为0.60%(CK)、1.74%(M1)、3.89% (M2)、4.21%(M3),产电微生物丰度的提高也是阳极产电性能得到提高的直接原因.钙作为微生物同样所需的金属元素,对MFC阳极微生物也存在重要的影响作用.Lisa等[28]发现钙离子会促进Shewanella oneidensis MR-1纯菌的产电性能,而Liu等[29]指出在混菌MFC中加入钙离子会使非产电菌成为阳极生物膜中的优势菌群,使系统电流密度下降.本研究对微生物群落结构的分析表明,镁离子对产电菌与非产电菌也均有不同程度的促进作用,合理控制其浓度将有助于优化阳极微生物膜结构,促进产电性能的提高.

|
1—Proteobacteria; 2—TM7; 3—Bacteroidates; 4—Firmicutes; 5—Synergistetes; 6—其他 图 6 阳极微生物群落门水平结构 Figure 6 Phylum frequency of anode microorganisms |
1)在MFC阳极底物中投加镁离子可以降低阳极电势,并提高MFC的功率密度.当镁离子浓度为5.0 mmol/L时,功率密度可达45.48 mW/m2,相比对照组提高了24.09%.
2)镁离子会影响产电微生物电子传递过程并促进产电相关蛋白的活性,提高镁离子浓度可以显著提高阳极电容,降低电荷传递电阻,但当镁离子浓度高于2.0 mmol/L时,MFC阳极的电化学活性基本不再提高.
3)镁离子可以促进微生物在MFC阳极碳刷上形成更为致密的生物膜,并提高产电菌的丰度,其中Geobacter菌属的丰度最高为对照组的7.02倍.同时,随着镁离子浓度的提高,部分非产电菌的丰度也会得到提高,其对于底物的竞争可能是限制MFC产电性能得到进一步提高的原因之一.
| [1] |
尹航, 胡翔. 不同阳极微生物燃料电池产电性能的比较[J].
环境工程学报,2013, 7 (2) : 608-612.
YIN Hang, HU Xiang. Comparison of power generation performance of different types of anodes in microbial fuel cells[J]. Chinese Journal of Environmental Engineering,2013, 7 (2) : 608-612. (  0) 0)
|
| [2] |
常定明, 张海芹, 卢智昊, 等. 金属离子在微生物燃料电池中的行为[J].
化学进展,2014, 26 (7) : 1244-1254.
CHANG Dingming, ZHANG Haiqin, LU Zhihao, et al. Behavior of metal ions in microbial fuel cells[J]. Progress in Chemistry,2014, 26 (7) : 1244-1254. (  0) 0)
|
| [3] |
KUMAR G G, KIRUBAHARAN C J, UDHAYAKUMAR S, et al. Conductive polymer/graphene supported platinum nanoparticles as anode catalysts for the extended power generation of microbial fuel cells[J].
Industrial & Engineering Chemistry Research,2014, 53 (43) : 16883-16893.
( 0) 0)
|
| [4] |
KANG Haigang, ZHU Yihua, YANG Xiaoling, et al. Gold/mesoporous silica-fiber core-shell hybrid nanostructure: a potential electron transfer mediator in a bio-electrochemical system[J].
New Journal of Chemistry,2010, 34 (10) : 2166-2175.
DOI: 10.1039/c0nj00094a ( 0) 0)
|
| [5] |
牟姝君, 李秀芬, 任月萍, 等. 铜离子对双室微生物燃料电池电能输出的影响研究[J].
环境科学,2014, 35 (7) : 2791-2797.
MU Shujun, LI Xiufen, REN Yueping, et al. Effect of Cu2+ on the power output of dual-chamber microbial fuel cell[J]. Environmental Science,2014, 35 (7) : 2791-2797. (  0) 0)
|
| [6] |
吴锋, 刘志, 周奔, 等. 单室MFC型生物毒性传感器对重金属离子的检测研究[J].
环境科学,2010, 31 (7) : 1596-1600.
WU Feng, LIU Zhi, ZHOU Ben, et al. The detection of heavy metal ions using single chamber MFC biological toxicity sensor[J]. Environmental Science,2010, 31 (7) : 1596-1600. (  0) 0)
|
| [7] |
WACKER W E. The biochemistry of magnesium[J].
Annals of the New York Academy of Sciences,1969, 162 (2) : 717-726.
DOI: 10.1111/nyas.1969.162.issue-2 ( 0) 0)
|
| [8] |
PAYANDEH J, PFOH R, PAI E F. The structure and regulation of magnesium selective ion channels[J].
Biochimica Et Biophysica Acta-Biomembranes,2013, 1828 (11) : 2778-2792.
DOI: 10.1016/j.bbamem.2013.08.002 ( 0) 0)
|
| [9] |
KLEIN D J, MOORE P B, STEITZ T A. The contribution of metal ions to the structural stability of the large ribosomal subunit[J].
RNA,2004, 10 (9) : 1366-1379.
DOI: 10.1261/rna.7390804 ( 0) 0)
|
| [10] |
WALKER G M. Magnesium and cell-cycle control-an update[J].
Magnesium,1986, 5 (1) : 9-23.
( 0) 0)
|
| [11] |
LIU Hong, LOGAN B E. Electricity generation using an air-cathode single chamber microbial fuel cell in the presence and absence of a proton exchange membrane[J].
Environmental Science & Technology,2004, 38 (14) : 4040-4046.
( 0) 0)
|
| [12] |
LOGAN B, CHENG Shaoan, WATSON V, et al. Graphite fiber brush anodes for increased power production in air-cathode microbial fuel cells[J].
Environmental Science & Technology,2007, 41 (9) : 3341-3346.
( 0) 0)
|
| [13] |
CHENG Shaoan, LIU Hong, LOGAN B E. Increased performance of single-chamber microbial fuel cells using an improved cathode structure[J].
Electrochemistry Communications,2006, 8 (3) : 489-494.
DOI: 10.1016/j.elecom.2006.01.010 ( 0) 0)
|
| [14] |
ZHANG Guodong, WANG Kun, ZHAO Qingliang, et al. Effect of cathode types on long-term performance and anode bacterial communities in microbial fuel cells[J].
Bioresource Technology,2012, 118 : 249-256.
DOI: 10.1016/j.biortech.2012.05.015 ( 0) 0)
|
| [15] |
RUSLING J F, FORSTER R J. Electrochemical catalysis with redox polymer and polyion-protein films[J].
Journal of Colloid and Interface Science,2003, 262 (1) : 1-15.
DOI: 10.1016/S0021-9797(03)00148-6 ( 0) 0)
|
| [16] |
JAYAPRIYA J, RAMAMURTHY V. The role of electrode material in capturing power generated in Pseudomonas catalysed fuel cells[J].
Canadian Journal of Chemical Engineering,2014, 92 (4) : 610-614.
DOI: 10.1002/cjce.v92.4 ( 0) 0)
|
| [17] |
JADHAV D A, GHANGREKAR M M. Effective ammonium removal by anaerobic oxidation in microbial fuel cells[J].
Environmental Technology,2015, 36 (6) : 767-775.
DOI: 10.1080/09593330.2014.960481 ( 0) 0)
|
| [18] |
CARMONA-MARTINEZ A A, HARNISCH F, FITZGERALD L A, et al. Cyclic voltammetric analysis of the electron transfer of Shewanella oneidensis MR-1 and nanofilament and cytochrome knock-out mutants[J].
Bioelectrochemistry,2011, 81 (2) : 74-80.
DOI: 10.1016/j.bioelechem.2011.02.006 ( 0) 0)
|
| [19] |
FRICKE K, HARNISCH F, SCHROEDER U. On the use of cyclic voltammetry for the study of anodic electron transfer in microbial fuel cells[J].
Energy & Environmental Science,2008, 1 (1) : 144-147.
( 0) 0)
|
| [20] |
MOOMAW A S, MAGUIRE M E. The unique nature of Mg2+ channels[J].
Physiology,2008, 23 (5) : 275-285.
DOI: 10.1152/physiol.00019.2008 ( 0) 0)
|
| [21] |
TAI S K, WU G, YUAN S S, et al. Genome-wide expression links the electron transfer pathway of Shewanella oneidensis to chemotaxis[J].
BMC Genomics,2010 : 11-319.
( 0) 0)
|
| [22] |
丛悦玺, 骆东峰, 陈坤明, 等. 生物镁离子转运体研究进展[J].
农业生物技术学报,2012, 20 (7) : 837-848.
CONG Yuexi, LUO Dongfeng, CHEN Kunming, et al. The development of magnesium transport systems in organisms[J]. Journal of Agricultural Biotechnology,2012, 20 (7) : 837-848. (  0) 0)
|
| [23] |
DANN C E, WAKEMAN C A, SIELING C L, et al. Structure and mechanism of a metal-sensing regulatory RNA[J].
Cell,2007, 130 (5) : 878-892.
DOI: 10.1016/j.cell.2007.06.051 ( 0) 0)
|
| [24] |
HE Zhen, MANSFELD F. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies[J].
Energy & Environmental Science,2009, 2 (2) : 215-219.
( 0) 0)
|
| [25] |
LU Zhihao, GIRGUIS P, LIANG Peng, et al. Biological capacitance studies of anodes in microbial fuel cells using electrochemical impedance spectroscopy[J].
Bioprocess and Biosystems Engineering,2015, 38 (7) : 1325-1333.
DOI: 10.1007/s00449-015-1373-z ( 0) 0)
|
| [26] |
KIM G T, WEBSTER G, WIMPENNY J W T, et al. Bacterial community structure, compartmentalization and activity in a microbial fuel cell[J].
Journal of Applied Microbiology,2006, 101 (3) : 698-710.
DOI: 10.1111/jam.2006.101.issue-3 ( 0) 0)
|
| [27] |
SHARMA V, KUNDU P P. Biocatalysts in microbial fuel cells[J].
Enzyme and Microbial Technology,2010, 47 (5) : 179-188.
DOI: 10.1016/j.enzmictec.2010.07.001 ( 0) 0)
|
| [28] |
FITZGERALD L A, PETERSEN E R, GROSS B J, et al. Aggrandizing power output from Shewanella oneidensis MR-1 microbial fuel cells using calcium chloride[J].
Biosensors and Bioelectronics,2012, 31 (1) : 492-498.
DOI: 10.1016/j.bios.2011.11.024 ( 0) 0)
|
| [29] |
LIU Ting, CAI Xixi, DING Guochun, et al. Calcium-dependent electroactive biofilm structure and electricity generation in bioelectrochemical systems[J].
Journal of Power Sources,2015, 294 : 516-521.
DOI: 10.1016/j.jpowsour.2015.06.104 ( 0) 0)
|
 2016, Vol. 48
2016, Vol. 48


