抗生素对细菌等致病微生物有良好的抑制和杀灭作用,广泛应用于人体疾病防治和畜牧养殖业领域.但是,人体、动物对其吸收能力有限,30%~90%的抗生素未经吸收随粪便、尿液等排入周围环境[1].据报道,不同种类抗生素已在中国不同水体[2-4]、土壤[5-6]中频繁检出,自然环境中残留抗生素的命运及其带来的风险引起广泛关注.由于传统水处理工艺难以去除水中有机污染物,发展高效的抗生素降解新技术已成为环境工作者的迫切任务之一.其中,基于硫酸根自由基(SO4-·)的高级氧化技术由于其特有的优势开始受到关注:一方面,SO4-·氧化还原势较高(E0=2.6 V),具有很高的降解有机污染物的潜能[7];另一方面,硫酸自由基及其反应产物硫酸根对于微生物影响较小[8],且过硫酸盐对水体产生的附加污染小[9].SO4-·可以由系统中过硫酸盐(S2O82-,PS)在紫外激活、热激活、碱激活、金属激活等条件下生成[10].紫外工艺在部分水厂中已得到应用,因而对于紫外激活过硫酸盐技术(UV/PS工艺)的研究更有实际意义.目前,已有研究证明, UV/PS工艺可有效降解多种有机污染物.Gao等[11]在UV/PS工艺降解磺胺甲嘧啶(SMT)的研究中发现,选定初始底物浓度0.02 mmol/L,PS投加量0.2 mmol/L,45 min内SMT的去除率高达97%.Deng等[12]发现,PS投加量为1 mmol/L时,UV/PS工艺对卡马西平(21.26μmol/L)的去除效率高达99%.
金霉素(chlortetracycline, CTC),又称氯四环素,是一种广谱四环素类抗生素[13],主要用于防治动物肠道感染和促进动物生长.在中国,每年用于动物饲料添加剂的金霉素高达750~1 000 t[14],并且已在不同水体中不同程度地检测到其残留.Jiang等[15]在黄浦江中检测到其最大质量浓度为84.54 ng/L.作为一类难降解有机物,金霉素对环境的污染及生态毒性已引起重视[16].国内外已有学者研究采用超声波[17]、二氧化锰[13, 18]、光电催化氧化(PECO)[19]、UV/H2O2氧化[20]等方法降解水中金霉素,但缺少基于硫酸根自由基的高级氧化法去除金霉素的相关研究.本文首次采用紫外激活过硫酸盐方法降解金霉素,考察金霉素初始浓度、过硫酸盐投加量、pH对金霉素降解效果的影响,鉴定了参与反应的自由基,为UV/PS工艺降解水中金霉素提供理论参考.
1 实验 1.1 实验材料盐酸金霉素(纯度>99.9%)、苯甲酸(纯度>99.5%)分别购自阿拉丁(Aladdin)试剂集团有限公司和上海国药集团化学试剂有限公司,用超纯水配制质量浓度为100 mg/L的储备液,使用时根据需要进行稀释.流动相甲醇、乙腈(色谱纯)购自美国西格玛药剂公司.其他所用试剂均为分析纯,购自上海国药集团化学试剂有限公司.所用溶液均采用Milli-Q超纯水配置.
1.2 实验方法与装置实验对比了UV/PS工艺、单独UV工艺、单独PS工艺对溶液中金霉素的去除效果,并采用UV/PS工艺进行不同金霉素初始浓度、不同PS投加量、不同反应pH的对照实验.实验装置如图 1所示[21],所用紫外灯管为Philips公司生产,功率为75 W,额定工作电压为220 V,紫外灯主波长为254 nm,光强度为142μm/cm2.在反应前30 min制备50 mmol/L的过硫酸钠溶液,反应开始时按比例将PS投加至盛有金霉素原液(200 mL)的光照培养皿中并将光照培养皿移至紫外灯筒的中央,开启磁力搅拌器,在不同反应时间取0.8 mL的样品加入到预先投加了0.2 mL甲醇的液相小瓶中,震荡5 s,保证活性自由基淬灭,之后利用高效液相色谱仪对水样中金霉素浓度进行测定.

|
图 1 实验装置示意 Figure 1 Experimental schematic |
有机物浓度采用高效液相色谱仪(Agilent 1200)测定,采用Symmetry C18柱(250 mm×4.6 mm×5μm,岛津),UV检测器(VWD-FLD).金霉素检测波长为360 nm,流动相乙腈与水(水中含0.1%甲酸)体积比为60:40,流速为1 mL/min,柱温为35℃.苯甲酸检测波长为230 nm,流动相甲醇与0.02 mol/L的磷酸二氢钠溶液体积比为60:40,流速为1 mL/min,柱温为35℃.溶液pH通过梅特勒-托利多(Mettler Toledo)pH计测定.
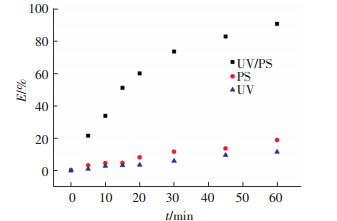
2 结果与分析 2.1 UV、PS及UV/PS联用降解金霉素考察UV/PS联用工艺与单独UV工艺和单独PS工艺对金霉素的降解效果.实验条件为:金霉素初始浓度为0.019 mmol/L(10 mg/L),过硫酸钠投加量为0.97 mmol/L,实验温度为(25±2) ℃,初始pH 7.0. 3种工艺对金霉素的去除率如图 2所示.各工艺对金霉素的去除率为
| $ E/%\text{=}\frac{{{[CTC]}_{ & 0}}-[CTC]}{{{[CTC]}_{ & 0}}}\times 100\text{%}\text{.}\ $ | (1) |
式中:[CTC]0为金霉素的初始浓度,[CTC]为任意反应时间系统中金霉素的浓度.E值越高,表示此工艺对金霉素的去除效率越高.由图 2可以看出,单独UV工艺或者单独PS工艺下,仅有少部分金霉素分子直接光降解或者被过硫酸钠直接氧化,反应60 min时金霉素的去除率分别为11%和18%;而UV与PS联用工艺对金霉素有很好的去除效果,反应60 min时去除率高达90%.一方面,过硫酸钠氧化还原电位较低(E0=2.1 V),不能直接破坏金霉素的分子结构;另一方面,UV与PS工艺产生了协同作用,过硫酸盐经紫外激活产生的SO4-·(见式(2))具有较强的氧化能力,从而使得金霉素快速降解.
| $ {{\text{S}}_{\text{2}}}\text{O}_{\text{8}}^{\text{2-}}\underrightarrow{\text{UV}}\text{2SO}_{\text{4}}^{\text{-}}\cdot . $ | (2) |
|
图 2 UV、PS及UV/PS工艺对金霉素的去除率 Figure 2 Degradation rates of CTC in different systems |
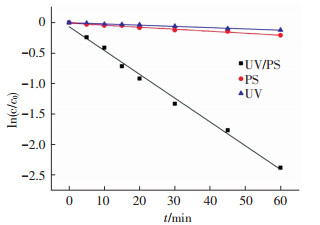
不同工艺下ln([CTC]/[CTC]0)与反应时间的关系如图 3所示.可以看出,金霉素的UV降解、PS降解和UV/PS降解均符合表观一级反应动力学模型(r2>0.95) ,可由式(3)表示:
| $ ln\frac{{[CTC]}}{{{{[CTC]}_0}}}=-{k_{obs}} \cdot t或\frac{{d[CTC]}}{{{\rm{d}}t}}=-{k_{obs}} \cdot t $ | (3) |
式中:kobs为表观速率常数,表示金霉素的降解速率.实验得出,UV/PS联用工艺对金霉素的降解速率为0.039 1 min-1,远远高于单独UV工艺(0.002 1 min-1)、PS工艺(0.003 3 min-1)的降解速率,UV/PS系统中生成的SO4-·大大提高了金霉素的降解速率.高乃云等[22]在研究这3种工艺降解卡马西林的实验中也得到了相同的规律,在卡马西林初始浓度为21.16μmol/L,过硫酸钠投加量为1.00 mmol/L时,UV/PS联用工艺的降解速率为0.048 min-1,而单独UV、PS工艺的降解速率分别为0.001、0.002 min-1.
|
图 3 UV、PS以及UV/PS工艺下金霉素降解一级反应拟合曲线 Figure 3 First-order kinetics of CTC degradation in different systems |
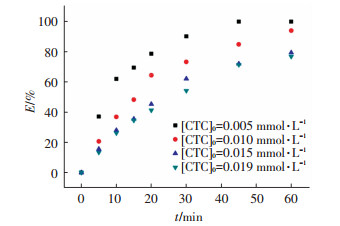
实验中控制过硫酸钠投加量0.5 mmol/L,通过改变金霉素初始浓度在0.005~0.019 mmol/L(2.5~10 mg/L)考察其对降解效果的影响.图 4表示了不同金霉素初始浓度下金霉素去除率与反应时间的关系,随着金霉素初始浓度由0.005 mmol/L增加至0.010、0.015和0.019 mmol/L,其60 min内去除率由100%下降至94%、79%和76%.虽然金霉素初始浓度不断升高,UV/PS系统中没有足够的SO4-·与之反应,因而,金霉素的初始浓度会对其降解效果表现出明显的抑制作用.
|
图 4 不同初始浓度下UV/PS工艺对金霉素的去除率 Figure 4 CTC degradation rates for different initial CTC concentrations |
用准一级反应动力学拟合实验数据结果,所得拟合直线的方程、速率常数kobs、半衰期θ1/2及相关系数r2如表 1所示.随着金霉素初始浓度的增高,其降解速率也明显受到抑制,经过拟合,其降解速率和初始摩尔浓度呈指数下降关系(kobs=0.106 8 e-82.47[CTC]0,r2=0.95) .UV/PS工艺降解金霉素的本质是,系统中激活生成的SO4-·与金霉素分子发生有效碰撞,将金霉素分子氧化成其他物质进而达到去除金霉素的目的.而当系统中过硫酸盐投加量和紫外照射强度恒定时,激活生成的SO4-·数量相同,增加反应底物的初始浓度实质上提高了溶液中单位体积内的金霉素分子数量,降低了其与SO4-·有效碰撞的几率,因而导致了金霉素降解速率的降低.同时,溶液中金霉素分子在单位时间内受到紫外光裂解的机会也会减少,影响了其降解速率.
| 表 1 不同初始浓度下金霉素的一级动力学参数 Table 1 Effect of initial CTC concentration on first-order kinetic parameters of CTC degradation |
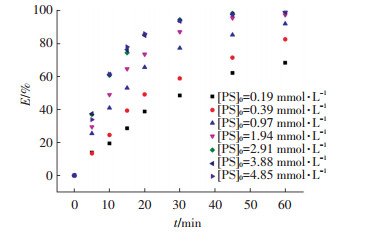
在UV/PS工艺中,过硫酸钠作为提供SO4-·的载体,其投加量是一个重要参数.实验中,控制金霉素初始浓度为0.019 mmol/L,通过改变过硫酸钠的投加量(0.09~4.85 mmol/L)考察其对金霉素降解的影响,结果如图 5所示.可以看出,随着过硫酸钠初始浓度由0.09 mmol/L增加到4.85 mmol/L时,在60 min时金霉素的去除率也由66.4%增加到99.7%,表明在一定范围内,增加过硫酸钠的投加量会提高金霉素的去除效果.
|
图 5 不同氧化剂投加量下UV/PS工艺对金霉素的去除率 Figure 5 CTC degradation rates for different PS dosages |
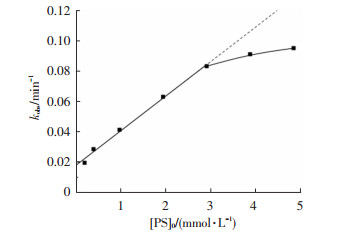
图 6表示了金霉素降解的表观速率常数同过硫酸钠投加量的关系.当过硫酸钠投加量为0.19~2.91 mmol/L时,金霉素降解速率与过硫酸钠投加量呈现较好的线性关系,但当过硫酸钠投加量高于2.91 mmol/L时,继续增加过硫酸盐的投加量,金霉素的降解速率仅会缓慢增加.这是由于在过硫酸钠低浓度时,随着过硫酸钠投加量的增加,溶液中活性自由基SO4-·也相应成比例增加,从而提高了金霉素的降解速率.但当过硫酸钠过量时,系统中过量的S2O82-又会成为SO4-·的清除剂(式(4)),并且过量SO4-·也会出现自淬灭现象(式(5)),使得系统中硫酸根自由基减少,其氧化效应减弱,导致有机底物降解速率减慢[23].Lin等[24]在UV/PS降解聚乙烯醇的研究中也有相同的结论,并发现了酸性条件下过硫酸盐的抑制作用越明显.
| $ {\rm{SO}}_{\rm{4}}^{\rm{-}} \cdot + {{\rm{S}}_{\rm{2}}}{\rm{O}}_{\rm{8}}^{{\rm{2-}}} \to {\rm{SO}}_{\rm{4}}^{{\rm{2-}}}{\rm{ + }}{{\rm{S}}_{\rm{2}}}{\rm{O}}_{\rm{8}}^{\rm{-}} \cdot, $ | (4) |
| $ {\rm{SO}}_{\rm{4}}^{\rm{-}} \cdot + {\rm{SO}}_{\rm{4}}^{\rm{-}} \cdot \to {{\rm{S}}_{\rm{2}}}{\rm{O}}_{\rm{8}}^{{\rm{2-}}} \cdot $ | (5) |
|
图 6 金霉素降解速率常数与氧化剂投加量的关系 Figure 6 Relationship between kobs with PS dosage |
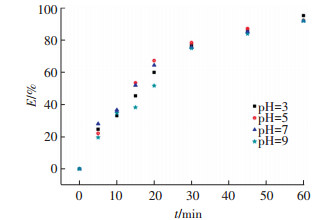
对于基于UV的高级氧化法,溶液的pH会对系统中活性自由基的生成和目标污染物的降解产生明显的影响.实验中控制过硫酸钠投加量0.5 mmol/L、金霉素初始浓度0.019 mmol/L,通过改变溶液的pH考察其对金霉素降解效果的影响.图 7表示了不同pH下金霉素去除率与反应时间的关系.可以看出,在酸性和碱性条件下金霉素的去除率均略高于中性条件下金霉素的去除率,但是反应60 min后金霉素去除率均在90%以上,表明在不同pH下UV/PS工艺对金霉素都有很好的降解效果.拟合所得的金霉素降解速率kobs及相关参数如表 2所示,其与去除率表现出相同的趋势,在3 < pH < 7范围内,随着pH的升高而降低至最小值(0. 041 1 min-1),之后在碱性条件下略微增加.这可能是由于在酸性条件下,系统中存在的H+会与过硫酸盐反应生成更多的硫酸根自由基(式(6)、(7))[24],加快了金霉素的降解.但是,在UV/PS反应系统中,不仅存在SO4-·,也会伴随着·OH的生成(式(8)).据Lee等[23]报道,在碱性条件下,随着pH的升高,溶液中OH-会促进SO4-·转化生成·OH(式(9))[25],当pH>7时,·OH成为了反应系统中主导的自由基.而·OH(E0=2.80 V)是氧化能力更强的活性自由基,一定程度上可以提高金霉素的降解速率.pH>9时,金霉素分子在反应溶液中已不稳定存在,可能已经转化为其差向异构体iso-CTC[26],故没有考察pH>9时金霉素的降解效率.
| $ {{\rm{S}}_{\rm{2}}}{\rm{O}}_{\rm{8}}^{{\rm{2-}}} + {{\rm{H}}^ + } \to {\rm{H}}{{\rm{S}}_{\rm{2}}}{\rm{O}}_{\rm{8}}^{\rm{-}}, $ | (6) |
| $ {\rm{H}}{{\rm{S}}_{\rm{2}}}{\rm{O}}_{\rm{8}}^{\rm{-}} \to {\rm{SO}}_{\rm{4}}^{\rm{-}} \cdot + {{\rm{H}}^ + }, $ | (7) |
| $ {\rm{SO}}_{\rm{4}}^{\rm{-}} \cdot + {{\rm{H}}_2}{\rm{O}} \to {\rm{HSO}}_{\rm{4}}^{{\rm{2-}}} + \cdot {\rm{OH, }} $ | (8) |
| $ {\rm{SO}}_{\rm{4}}^{\rm{-}} \cdot + {\rm{O}}{{\rm{H}}^-} \to {\rm{SO}}_{\rm{4}}^{{\rm{2-}}} + \cdot {\rm{OH}}. $ | (9) |
|
图 7 不同pH下UV/PS工艺对金霉素的去除率 Figure 7 CTC degradation rates for different pH values |
| 表 2 不同pH下金霉素的一级动力学参数 Table 2 Effect of pH on first-order kinetic parameters of CTC degradation |
在紫外激活过硫酸盐的过程中,系统中同时生成SO4-·和·OH两种自由基,共同参与有机污染物的氧化过程,见式(10)、(11) .通常,SO4-·主要参与电子转移反应,而·OH主要参与氢转移反应.为了鉴别UV/PS系统中主要存在的自由基,在反应原液中分别加入乙醇(EtOH)和叔丁醇(TBA),比较两种自由基掩蔽剂对金霉素降解效果的抑制作用.EtOH和TBA与两种自由基的反应速率不同:TBA与·OH的反应速率(3.8×108~7.6×108 L·mol-1·s-1)是其与SO4-·(k=4.0×105~9.1×105 L·mol-1·s-1)反应速率的418~1 900倍,而EtOH与·OH(1.2×109~2.9×109 L·mol-1·s-1)是其与SO4-·(1.6×107~7.7×107 L·mol-1·s-1)反应速率的16~175倍[27].采用准一级动力学曲线拟合投加TBA和EtOH时金霉素浓度随时间的变化规律,其结果如表 3所示.较空白实验,投加EtOH或TBA时金霉素的降解速率常数分别降低了92.3%或68.3%,EtOH表现出更明显的抑制作用,间接说明SO4-·是参与UV/PS氧化金霉素反应的主要活性自由基.
| $ {\rm{SO}}_{\rm{4}}^{\rm{-}} \cdot + {\rm{CTC}} \to {\rm{products}}, {k_{{\rm{SO}}_{\rm{4}}^{\rm{-}} \cdot }}, $ | (10) |
| $ {\rm{OH}} \cdot + {\rm{CTC}} \to {\rm{products}}, {k_{{\rm{OH}} \cdot }}. $ | (11) |
| 表 3 TBA和EtOH存在条件下金霉素的一级动力学参数 Table 3 First-order kinetic parameters of CTC degradation in the existence of TBA or EtOH |
为了计算金霉素与主要活性自由基SO4-·的二级动力学常数,选取苯甲酸(BA)为参照物质,在光照培养皿中同时加入摩尔浓度皆为0.019 mmol/L的苯甲酸和金霉素,过硫酸钠投加量为0.5 mmol/L,考察UV/PS工艺对两种有机污染物的去除效率,结果见图 8.其中,SO4-·与苯甲酸二级动力学常数kBA为1.2×109 L·mol-1·s-1[28],其与金霉素的二级动力学常数可利用SO4-·与两种有机物的反应动力学关系(式(12))间接求得.由图 8可得,kCTC/kBA=0.731,故能得到SO4-·与金霉素的反应速率为8.8×108 L·mol-1·s-1.Xie等[28]也采用相同方法,得到SO4-·与2-甲基异冰片和土臭素的反应速率分别为(4.6±0.6)×108、(7.6±0.6)×108 L·mol-1·s-1.
| $ ln\left({{c_{0, {\rm{CTC}}}}/{c_{t, {\rm{CTC}}}}} \right)=\frac{{{k_{{\rm{CTC}}}}}}{{{k_{{\rm{BA}}}}}}\ln \left({{c_{0, {\rm{BA}}}}/{c_{t, {\rm{BA}}}}} \right). $ | (12) |

|
图 8 金霉素与SO4-·反应速率的测定 Figure 8 Determination of reaction rate between CTC with SO4-· |
1) 单独UV、单独PS和UV/PS联用工艺对金霉素的降解均符合准一级反应动力学模型,并且UV工艺与PS工艺联用可大大提高金霉素的降解效果.
2) 底物初始浓度对金霉素的降解表现出明显的抑制作用.在过硫酸钠投加量为0.5 mmol/L时,随着金霉素初始浓度由0.005 mmol/L提高至0.019 mmol/L,其表观速率常数由0.075 4 min-1下降至0.025 1 min-1.
3) 过硫酸钠低浓度时(投加量< 2.91 mmol/L),金霉素降解的表观速率常数kobs随着过硫酸盐投加量的增加而线性升高;但当其投加量超过2.91 mmol/L时,kobs仅仅缓慢增加.
4) 溶液中pH对金霉素降解有一定影响.在酸性和碱性条件下金霉素的氧化反应相对较快,而在偏中性的条件下反应相对较慢.
5) UV/PS系统中参与金霉素氧化反应的主要活性自由基为SO4-·.金霉素初始浓度为0.019 mmol/L、过硫酸钠投加量为0.5 mmol/L时,SO4-·与金霉素的二级动力学常数为8.8×108 L·mol-1·s-1.
| [1] |
CHEE J C, MACKIE R I, KOIKE S, et al. Fate and transport of antibiotic residues and antibiotic resistance genes following land application of manure waste[J].
Journal of Environmental Quality,2009, 38 : 1086-1108.
( 0) 0)
|
| [2] |
YANG Jifeng, YING Guangguo, ZHAO Jianliang, et al. Spatial and seasonal distribution of selected antibiotics in surface waters of the Pearl Rivers, China[J].
Journal of Environmental Science and Health,2011, 46 (3) : 272-280.
( 0) 0)
|
| [3] |
AI Jia, HU Jianying, WU Xiaoqin, et al. Occurrence and source apportionment of sulfonamides and their metabolites in Liaodong Bay and the adjacent Liao River Basin, North China[J].
Environmental Toxicology and Chemistry,2011, 30 (6) : 1252-1260.
( 0) 0)
|
| [4] |
那广水, 陈彤, 张月梅, 等. 中国北方地区水体中四环素族抗生素残留现状分析[J].
中国环境监测,2009, 25 (6) : 1252-1260.
NA Guangshui, CHEN Tong, ZHANG Yuemei, et al. Analysis terracyclines antibiotics residues status in water of North China[J]. Environmental Monitoring in China,2009, 25 (6) : 1252-1260. (  0) 0)
|
| [5] |
尹春艳, 骆永明, 滕应, 等. 典型设施菜地土壤抗生素污染特征与积累规律研究[J].
环境科学,2012, 33 (8) : 2810-2816.
YIN Chunyan, LU Yongming, TENG Ying, et al. Pollution characteristics and accumulation of antibiotics in typical protected vegetable soils[J]. Environmental Science,2012, 33 (8) : 2810-2816. (  0) 0)
|
| [6] |
张慧敏, 章明奎, 顾国平. 浙北地区畜禽粪便和农田土壤中四环素类抗生素残留[J].
生态与农村环境学报,2008, 24 (3) : 69-73.
ZHANG Huimin, ZHANG Mingkui, GU Guoping. Residues of tetracyclines in livestock and poultry Manures and agricultural soils from north Zhejiang Province[J]. Journal of Ecology and Rural Environment,2008, 24 (3) : 69-73. (  0) 0)
|
| [7] |
王兵, 李娟, 莫正平, 等. 基于硫酸自由基的高级氧化技术研究及应用进展[J].
环境工程,2012, 30 (4) : 53-57.
WANG Bing, LI Juan, MO Zhengping, et al. Progress in advanced oxidation processes based on sulfate radical[J]. Environmental Engineering,2012, 30 (4) : 53-57. (  0) 0)
|
| [8] |
TSITONAKI A, SMETS B, BJERG P. The effects of heat-activated persulfate oxidation on soil microorganisms[J].
Water Research,2008, 42 (4/5) : 1013-1022.
( 0) 0)
|
| [9] |
JOHNSON R L, TRATNYEK P G, BERIENJSON R O. Persulfate persistence under thermal activation conditions[J].
Environmental Science & Technology,2008, 42 : 9350-9346.
( 0) 0)
|
| [10] |
杨世迎, 陈友媛, 胥慧, 等. 过硫酸盐活化高级氧化新技术[J].
化学进展,2008, 20 : 1433-1438.
YANG Shiying, CHEN youyuan, XU Hui, et al. A novel advanced oxidation technology based on activated persulfate[J]. Progress in Chemistry,2008, 20 : 1433-1438. (  0) 0)
|
| [11] |
GAO Yuqiong, GAO Naiyun, DENG Yang, et al. Ultraviolet (UV) light-activated persulfate oxidation of sulfamethazine in water[J].
Chemical Engineering Journal,2012, 195/196 : 248-253.
( 0) 0)
|
| [12] |
DENG Jing, SHAO Yisheng, GAO Naiyun, et al. Degradation of the antiepileptic drug carbamazepine upon different UV-based advanced oxidation processes in water[J].
Chemical Engineering Journal,2013, 222 : 150-158.
( 0) 0)
|
| [13] |
陈高, 赵玲, 董元华. 二氧化锰氧化降解金霉素的动力学研究[J].
环境科学,2009, 30 (9) : 2773-2778.
CHEN Gao, ZHAO Ling, DONG Yuanhua. Oxidative kinetics of chlortetracycline by manganese dioxide[J]. Environmental Science,2009, 30 (9) : 2773-2778. (  0) 0)
|
| [14] |
王辉, 姚宏, 田盛, 等. 不同环境条件下Fe3+对金霉素降解机制的影响[J].
北京工业大学学报,2013, 39 (6) : 1499-1505.
WANG Hui, YAO Hong, TIAN Sheng, et al. Effect of Fe3 + on the degradation mechanism of chlortetracycline under different environmental conditions[J]. Journal of Beijing University of Technology,2013, 39 (6) : 1499-1505. (  0) 0)
|
| [15] |
JIANG Lei, HU Xialin, YIN Daqiang, et al. Occurrence, distribution and seasonal variation of antibiotics in the Huangpu River, Shanghai, China[J].
Chemosphere,2011, 82 (S6) : 822-828.
( 0) 0)
|
| [16] |
罗义, 周启星. 抗生素抗性基因(ARGs)——一种新型环境污染物[J].
环境科学学报,2008, 28 (8) : 954-960.
LUO Yi, ZHOU Qixing. Antibiotic resistance genes(ARGs) as emerging pollutant[J]. Acta Scientiae Circumstantiae,2008, 28 (8) : 954-960. (  0) 0)
|
| [17] |
郭喜丰, 肖广全, 马丽莉, 等. 超声波降解四环素类抗生素废水[J].
环境工程学报,2014, 8 (4) : 1503-1509.
GUO Xifeng, XIAO Guangquan, MA Lili, et al. Ultrasonic degradation of tetracyclines in aqueous solution[J]. Chinese Journal of Environmental Engineering,2014, 8 (4) : 1503-1509. (  0) 0)
|
| [18] |
GAO Chen, ZHAO Ling, YUAN Huadong. Oxidative degradation kinetics and products of chlortetracycline by manganese dioxide[J].
Journal of Hazardous Materials,2011, 193 : 128-138.
( 0) 0)
|
| [19] |
DAGHRIR R, DROGUI P, KA I, et al. Photoelectrocatalytic degradation of chlortetracycline using Ti/TiO2 nanostructured electrodes deposited by means of a pulsed laser deposition process[J].
Journal of Hazardous Materials,2012, 199/200 : 15-24.
( 0) 0)
|
| [20] |
LOPES P J, SANCHEZ P M, GOMEZ P C, et al. Photodegradation of tetracyclines in aqueous solution by using UV and UV/H2O2 oxidation processes[J].
Journal of Chemical Technology and Biotechnology,2010, 85 (10) : 1325-1333.
( 0) 0)
|
| [21] |
BOLTON J R, LINDEN K G. Standardization of methods for fluence UV dose determination in bench-scale UV experiments[J].
Journal of Environmental Engineering,2003, 129 (3) : 209-215.
( 0) 0)
|
| [22] |
高乃云, 胡栩豪, 邓靖, 等. 紫外激活过硫酸盐降解水中卡马西平研究[J].
华中科技大学学报,2013, 41 (12) : 117-122.
GAO Naiyun, HU Xuhao, DENG Jing, et al. Study on UV-activated persulfate oxidation of carbamazepine in water[J]. Journal of Huazhong University of Science and Technology,2013, 41 (12) : 117-122. (  0) 0)
|
| [23] |
LEE Y C, LO S L, KUO J, et al. Persulfate oxidation of perfluorooctanoic acid under the temperatures of 20-40℃[J].
Chemical Engineering Journal,2012, 198/199 : 27-32.
( 0) 0)
|
| [24] |
LIN C C, LEE L T, HSU L J. Performance of UV/S2O82- process in degrading polyvinyl alcohol in aqueous solutions[J].
Journal of Photochemistry and Photobiology A: Chemistry,2013, 252 : 1-7.
( 0) 0)
|
| [25] |
TAN Chaoqun, GAO Naiyun, DENG Yang, et al. Heat-activated persulfate oxidation of diuron in water[J].
Chemical Engineering Journal,2012, 203 : 294-300.
( 0) 0)
|
| [26] |
SEBORG T, INGERSLEV F, HALLING B. Chemical stability of chlortetracycline and chlortetracycline degradation products and epimers in soil interstitial water[J].
Chemosphere,2004, 57 (10) : 1515-1524.
( 0) 0)
|
| [27] |
TAN Chaoqun, GAO Naiyun, ZHOU Shiqing, et al. Kinetic study of acetaminophen degradation by UV-based advanced oxidation processes[J].
Chemical Engineering Journal,2014, 253 : 229-236.
( 0) 0)
|
| [28] |
XIE Pengchao, MA Jun, LIU Wei, et al. Removal of 2-MIB and geosmin using UV/persulfate: contributions of hydroxyl and sulfate radicals[J].
Chemical Engineering Journal,2015, 69 : 223-233.
( 0) 0)
|
 2016, Vol. 48
2016, Vol. 48


