随着工业园区的发展和兴起,表面加工电镀工业园区的建设速度加快[1].哈尔滨金禹环保表面工业园区位于阿城西北部,规模为98.01 hm2.其中,污水处理厂占地面积17 679 m2,工程规模10 000 t/d.园区内表面加工企业对所产生的废水进行厂内处理,但园区内企业众多,生产工艺和产品复杂,园区污水处理厂不可避免地会长期受到重金属离子的干扰,并存在短期相对高浓度重金属负荷冲击的风险.因此,如何提高电镀工业园区污水生物处理工艺在重金属离子存在条件下的运行稳定性,是为数众多的表面加工电镀工业园区建设急需解决的问题.目前,针对含重金属废水的常见处理方法有化学沉淀法、离子交换法、电化学处理、膜处理技术、活性炭吸附等.化学沉淀法会产生大量密度较低的污泥,处理难度大[2]; 由于电极材料的性能难以满足工艺要求,电化学法处理效果不好,且存在能耗大、成本高、析氧和析氢等副反应多的问题[3]; 在水量大且重金属质量浓度相对较低的条件下,离子交换法、膜处理技术及活性炭吸附等处理方法费用昂贵[4].近年来,利用生物工艺处理含重金属废水受到关注.张晓辉[5]发现,驯化活性污泥处理含Cr6+和COD分别为15.6和115.3 mg/L的实际电镀废水时,Cr6+去除率可达98.2%,COD去除率可达74.3%.文献[6]考察酿酒酵母对重金属离子的去除能力时发现,其对Pb2+、Cu2+、Zn2+的吸附量可达300、20和30 mg/g左右[6].吴乾菁等[7]从电镀污泥和污水中获得了高效净化重金属的复合功能菌,投入中国人民解放军5701工厂使用,当进水Cr6+、Cu2+、Zn2+质量浓度分别为3~120、4~12、2~35 mg/L时,出水均可达标排放.生物工艺处理含重金属废水的主要原理是利用微生物进行吸附,这主要与其表面的去质子官能团有关,如羧基、氨基、羰基、羟基等[6, 8].目前认可度较高的生物吸附机理主要包括表面络合、静电吸附、离子交换和无机微沉淀等[9].革兰氏阴性菌的脂多糖和磷脂质可以给重金属离子提供结合点,革兰氏阳性菌表面的磷壁酸可以提供负电荷,通过静电引力吸附重金属离子[10-11].酵母菌细胞壁上的含氧官能团(如磷酸基、羧基等)可与金属离子螯合或配位[12].总之,生物工艺可实现快速而高效地去除废水中的重金属,且价格低廉,不造成二次污染,具有一定的应用前景.
本研究以常见的金属铜离子为去除目标,利用模拟电镀园区工业废水,从广州某电镀污水厂的活性污泥样品中筛选铜离子耐受菌种,并对筛选获得的铜耐受菌株对铜离子的吸附性能进行了研究,以期用于哈尔滨金禹环保表面工业园区污水处理厂含重金属废水的生物强化处理.
1 实验 1.1 菌种来源及培养基实验中使用的菌悬液来源于广州某电镀污水厂的活性污泥.用于筛选电镀废水中耐铜菌株的选择性固体培养基的配置参考电镀园区污水水质,主要污染物为重金属离子及光亮剂、表面活性剂、乳化剂等相对难生物降解的有机物,其配方为:糖精钠(光亮剂) 26.6 g/L、十二烷基苯磺酸钠(SDBS,表面活性剂) 26.6 g/L、辛基酚聚氧乙烯醚(乳化剂、表面活性剂) 12 g/L、乙醇36.6 g/L、液体石蜡16.7 g/L、NH4Cl 37.3 mg/L、KH2PO4 8.66 mg/L、CaCl2 0.1 g/L、MgSO4·7H2O 0.2 g/L、微量元素0.5 mL/L、Cu2+ 0~20 mg/L, 蒸馏水配制,pH=5,有机物质量浓度为200 mg/L,琼脂15 g/L.
微量元素配方:FeCl3·6H2O 3 g/L、MnCl2·4H2O 0.24 g/L、H3BO3 0.3 g/L、CuSO4·5H2O 0.03 g/L、ZnSO4·7H2O 0.24 g/L、NaMo·2H2O 0.03 g/L、KI 0.06 g/L、乙二胺四乙酸5 g/L,蒸馏水配制.
LB选择性液体培养基配方:蛋白胨10 g/L、酵母粉5 g/L、NaCl 10 g/L,Cu2+ 0~400 mg/L、蒸馏水配制,pH=5.
LB选择性固体体培养基配方:LB选择性液体培养基中加入琼脂(15 g/L).
1.2 菌种分离与鉴定取适量活性污泥,用无菌水制成菌悬液,倍比稀释,将10-5,10-6,10-73个浓度稀释液在含Cu2+质量浓度为0~20 mg/L的选择性固体培养基上涂布,每个浓度做3个平行样,于30℃的恒温培养箱中培养3 d.挑取单菌落在相应Cu2+质量浓度的选择性固体培养基上多次划线纯化.
经过多次纯化后,将单菌落接种于适量LB液体培养基中,30℃的恒温培养箱中培养24 h.经液氮研磨后,利用OMEGA试剂盒提取DNA,分别使用细菌引物(1492R和27F)、真菌引物(ITS1和ITS4),经PCR扩增后送往上海生工生物技术有限公司进行测序.
1.3 接种菌液制备将筛得的菌株用LB培养基富集培养,使其处于稳定期初期.取适量菌液,8 000 r/min,离心5 min,去上清液,0.1 mol/L NaCl溶液清洗3次,稀释至2OD600 nm,作为后期实验的接种菌液.
1.4 不同初始Cu2+质量浓度下菌株生长曲线的测定取3 mL接种菌液离心,适当稀释,各取50μL稀释后的菌液分别投加到350μL LB选择性液体培养基(Cu2+质量浓度梯度为0、50、100、150、200、250、300、350和400 mg/L)中,菌数量为107 UCF/mL.利用全自动生长曲线分析仪(Bioscreen)测定3 d内的生长曲线.
1.5 吸附时间、温度、pH及初始Cu2+质量浓度对菌种去除铜离子效能的影响每个影响因素均设置两组实验,实验组向NaCl溶液中投加筛选得到的耐铜功能菌,调节溶液含菌量为1.8OD600 nm左右,使微生物质量浓度为1~2 g/L,OD600 nm与微生物质量浓度对应关系见图 1.可以看出,R2均在0.99以上,有较高的拟合度.溶液pH为5,两组平行样.对照组不投加微生物,其余与实验组相同.为了确定吸附平衡时间,用CuSO4·5H2O调节溶液Cu2+质量浓度为10 mg/L,放于28℃、150 r/min恒温振荡培养箱中,每15 min取样一次,共培养2 h.为了确定温度对吸附效果的影响,调节溶液pH为5,Cu2+质量浓度为10 mg/L,分别于22、28、32、37℃的恒温振荡培养箱中,150 r/min条件下培养.为了确定pH对吸附效果的影响,利用0.1 mol/L NaOH溶液或0.1 mol/L HCl溶液,分别调节溶液pH为3~6,Cu2+质量浓度为10 mg/L,于28℃的恒温振荡培养箱中,吸附平衡后取样.为了确定Cu2+初始质量浓度对吸附效果的影响,调节溶液pH为6,Cu2+初始质量浓度分别为0、10、30、50、100、150和200 mg/L,放于28℃、150 r/min恒温振荡培养箱中,吸附平衡后取样.样品经4 000 r/min离心30 min后,取上清液,用ICP-AES测定Cu2+质量浓度.保留菌体,80℃过夜(12 h)烘干,称重.
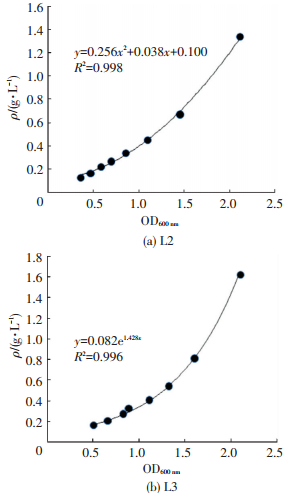
|
图 1 OD600 nm-微生物质量浓度关系 Figure 1 Relation between OD600 nm and biomass concentration |
实验共筛选到5株纯菌,其中,预实验效果好的两株菌分别被命名为L2和L3,后续研究以此两株菌为研究对象.分别提取L2和L3的DNA,经PCR扩增后送往上海生工生物技术有限公司测序.将返回的测序结果上传到NCBI进行比对,发现L2与Genbank中的肠杆菌属(Enterobacteria)的相似度达98%,L3与Genbank中的季也蒙毕赤酵母(Meyerozyma guilliermondii)的相似度达99%.将L2和L3的测序结果上传到Genbank,申请登录号分别为KU864992和KU864994.
2.2 铜离子的最小抑制质量浓度(MIC)处理含重金属的废水,考察不同重金属质量浓度对微生物生长情况的影响必不可少.由图 2(b)可以看出,在LB培养基中,Cu2+质量浓度低于300 mg/L时,L3生长明显; Cu2+质量浓度为300 mg/L时,L3有少许生长; Cu2+质量浓度高于300 mg/L时,几乎没有生长.将L3涂布于Cu2+质量浓度分别为250、300和350 mg/L的LB选择性固体培养基上,3个平行,30℃恒温条件下培养48 h,250 mg/L的培养基上有明显菌落长出,其余培养基上无菌落生长.故L3的铜离子最小抑制质量浓度为300 mg/L.结合平板涂布情况,由图 2(a)可以看出,L2的铜离子最小抑制质量浓度为200 mg/L, 低于L3.有研究发现,Ochrobactrum anthropi、Pseudomonas aeruginosa、Cupriavidus metalliduran和O.intermedium LBr在营养丰富的培养基中,铜离子最小抑制质量浓度分别为125 [13]、127 [14]、190 [15]和300 mg/L[16].可见,本实验筛得的L2和L3的铜离子耐受能力较强.结合选择性固体培养基平板涂布的情况,24~48 h内,在5 mg/L Cu2+平板上,L2和L3均有明显菌落生长.在10 mg/L Cu2+平板上可看到L2和L3有少许菌落生长.5 d后,L3在15 mg/L Cu2+平板上有少许菌落生长.由此可见,在两种培养基条件下,菌种的铜离子最小抑制质量浓度差别较大,生长情况明显不同.这可能是因为选择性固体培养基模拟实际电镀废水成分,含有辛基酚聚氧乙烯醚、十二烷基苯苯磺酸钠等表面活性剂,有一定微生物毒性,且相对难生物降解,影响了微生物的生长,从而降低了微生物对重金属铜的抗性.因此,生物吸附剂的研发一定要考虑实际废水的影响.

|
图 2 L2、L3在不同Cu2+质量浓度下的生长曲线 Figure 2 L2 and L3 growth curves after exposure to Cu2+ at different concentrations |
pH是影响溶液中重金属含量和吸附剂吸附能力的重要因素,其会影响吸附剂表面电荷、表面官能团质子化程度以及溶液中重金属离子的沉淀程度[17].实际电镀废水pH范围为1~8,其中,前处理废水、前处理浓液及混合废水等的pH相对较高[18-19].本文主要研究在pH为3~6内,L2和L3对Cu2+的吸附情况.由图 3可以看出,pH为3时,L2和L3对Cu2+的去除率最低.可能是因为在较低的pH(pH<4)下,H3O+和重金属离子竞争微生物表面的结合位点,导致微生物吸附去除重金属效能下降[20].pH为4~6时,铜离子的去除率明显升高,可能是因为pH高于微生物的等电点,微生物表面带负电,由于静电引力作用,重金属离子吸附率上升[21-22].当pH为6时,L2和L3对Cu2+的吸附去除率最高,分别为52.56%和56.77%.溶液中初始Cu2+质量浓度为10 mg/L,当pH大于6时开始产生沉淀,pH为7及以上时,生物对Cu2+的去除作用不明显,主要是因为沉淀作用导致溶液中Cu2+质量浓度降低, 故不加研究.
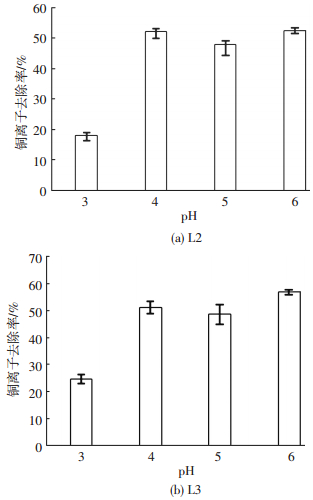
|
图 3 pH对L2和L3吸附去除Cu2+的影响 Figure 3 Effect of pH on the removal of Cu2+ by L2 and L3 |
温度是影响蛋白质活性的重要因素,与微生物的生长和新陈代谢紧密相关[23].Carpio等[8]的研究结果表明,肽链中的羧基、羟基、氨基等官能团向细胞壁提供负电荷,从而使微生物能够吸附去除Cu2+,且羧基和羟基是吸附去除Cu2+的主要官能团.因此,温度是影响菌株吸附去除重金属铜效能的重要因素.由图 4可以看出,温度对L2和L3吸附去除Cu2+效果影响相似.温度在22~28℃时,L2和L3对Cu2+的吸附去除率分别由47.97%和46.12%上升为52.26%和51.02%;温度在28~37℃时,去除率随温度升高而下降,37℃时,去除率下降至39.73%和38.04%.结果表明,当温度为22~32℃时,菌株对Cu2+的吸附去除率受温度影响不大.当温度高于32℃时,菌株对Cu2+的吸附去除率明显下降.由于北方地区温差较大,温度较低,本研究又考察了温度为10℃时,L2和L3对Cu2+的吸附去除率,分别为46.02%和43.24%.可见,在10~32℃的范围内,两菌株对Cu2+均有较高的吸附去除率,适于北方地区含重金属废水的处理.

|
图 4 温度对L2和L3吸附去除Cu2+的影响 Figure 4 Effect of temperature on the removal of Cu2+ by L2 and L3 |
吸附动力学和吸附等温线分析是反映微生物吸附能力的重要手段,可为后期大规模投用提供一定的依据.采用伪二级动力学模型描述L2和L3对Cu2+的吸附速率,该模型多被用于描述生物吸附动力学[24-25].模型如下:
| $ \frac{{d{q_t}}}{{dt}}=k{\left({{q_t}-{q_e}} \right)^2}. $ | (1) |
式中:qt为t时刻铜离子的吸附量(mg/g干细胞),qe为吸附平衡时铜离子的吸附量(mg/g干细胞),k为伪二级速率常数(g/(mg·min)).
| $ \frac{t}{{{q_t}}}=\frac{1}{{{v_0}}} + \frac{1}{{{q_e}}}t. $ | (2) |
式中:
| $ {q_t}=\frac{{{v_0}{q_e}t}}{{{q_e} + {v_0}t}}. $ | (3) |
根据式(2)得动力学参数(见表 1),可以看出,R2均在0.99以上,拟合度高.根据式(3)可知,当溶液中Cu2+为10 mg/L时,L2和L3对Cu2+的吸附速率,结果见图 5.可以看出,L2可在60 min内达到吸附平衡,L3可在30 min内达到吸附平衡,较L2速率快一倍.有研究发现,Lu等[24]筛选的Enterobactersp J1和Carpio等[8]研究的耐铜菌群吸附Cu2+的平衡时间为100 min,可见L2和L3吸附平衡时间短.
| 表 1 L2和L3吸附动力学参数 Table 1 Pseudo-second order kinetics of Cu2+ uptake by L2 and L3 |

|
图 5 L2和L3对Cu2+的吸附速率 Figure 5 Adsorption rate of L2 and L3 for Cu2+ |
为考察在最佳条件下L2和L3对Cu2+的吸附能力、最大吸附量及微生物上的Cu2+含量与溶液中Cu2+质量浓度之间的平衡关系,采用Langmuir等温线模型和Freundlich等温线模型分析实验数据.Langmuir等温线模型用于描述单分子层吸附、吸附剂表面能均匀的情况,模型如下
| $ \frac{{{\rho _e}}}{q}=\frac{{{\rho _e}}}{{{q_{\max }}}} + \frac{1}{{{K_L}{q_{\max }}}}. $ | (4) |
式中:q为t时刻的Cu2+吸附量(mg /g干细胞),qmax为理论上吸附平衡时的Cu2+吸附量(mg /g干细胞).ρe为吸附平衡时溶液的Cu2+质量浓度(mg/L),KL为朗格缪尔平衡常数.
| $ q=\frac{{{q_{\max }}{\rho _e}{K_L}}}{{1 + {K_L}{\rho _e}}}. $ | (5) |
根据式(4)得等温线参数(见表 2),可以看出,R2分别为0.979和0.934,拟合度较高.Freundlich等温线模型用于描述单一多层吸附、吸附剂表面能不均匀的情况,模型如下
| $ lg{\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} q=\lg {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {K_F} + \frac{1}{n}\lg {\rho _e}. $ | (6) |
式中KF为Freundlich吸附平衡常数,n为Freundlich常数,表明生物吸附强度.
| $ q={K_F}\rho _e^{\frac{1}{n}}. $ | (7) |
| 表 2 Langmuir等温线模型参数 |
根据式(6)得等温线参数(见表 3),可以看出,R2分别为0.969和0.940,拟合度较高.因此,两个等温线模型均可适用.根据式(5)和(7)可知,微生物上的Cu2+含量与溶液中Cu2+质量浓度之间的平衡关系(见图 6).理论上,L2最大吸附量为34.15 mg/g,低于L3的最大吸附量(45.68 mg/g).有研究发现,C. metallidurans CH34在稳定期时对Cu2+的最大吸附量为39.5 mg/L, 而灭活后和对数期时,吸附量均大于稳定期的吸附量[23].可见,微生物吸附效果还与生长周期有关.由表 2可以看出,相较于之前相关研究,L2和L3吸附效果不错.
| 表 3 Freundlich等温线模型参数 Table 3 Parameters of Freundlich models |
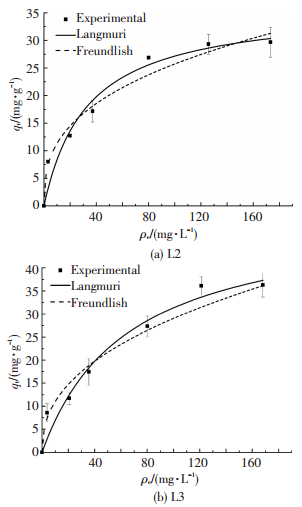
|
图 6 溶液中Cu2+平衡质量浓度与微生物对Cu2+吸附量的关系 Figure 6 Relation between Cu2+ equilibrium concentration in solution and the adsorption capacity for Cu2+ of L2 and L3 |
1) 从电镀废水的活性污泥中筛选到的两株菌分别命名为L2和L3.经鉴定,L2为肠杆菌属(Enterobacteria),相似度达98%,L3为季也蒙毕赤酵母(Meyerozyma guilliermondii),相似度达99%.将L2和L3的测序结果上传到Genbank,申请登录号分别为KU864992和KU864994.
2) 菌种对铜离子的最小抑制质量浓度与碳源及培养基的成分有关,在LB培养基中,营养充足,L2和L3的铜离子最小抑制质量浓度分别为200和300 mg/L.
3) L2和L3吸附Cu2+时,可在短时间内达到吸附平衡,平衡时间分别为60和30 min.考察pH、温度对两菌种吸附去除Cu2+的影响时发现,最佳pH和温度分别6和28℃,相应去除率分别为52.56%、56.77%和52.26%、51.02%.
4) 利用Langmuir和Freundlich等温线模型分析得知,在最佳pH和温度条件下,L2和L3的Cu2+最大吸附量分别为34.15和45.68 mg/g.
5) 综上,本研究得到的耐铜菌株具有快速、高效地去除废水中重金属的能力,有望用于哈尔滨金禹环保表面工业园区污水处理厂含重金属废水的生物强化处理.
| [1] |
杨明芬. 电镀工业园区废水集中处理技术探讨[J].
价值工程,2015 (3) : 306-307.
YANG Mingfen. On the centralized processing technology of waste water in electroplating industrial district[J]. Value Engineering,2015 (3) : 306-307. (  0) 0)
|
| [2] |
KONGSRICHAROERN N, POLPRASERT C. Electrochemical precipitation of chromium(Cr6+) from an electroplating wastewater[J].
Wat Sci Technol,1995, 31 : 109-117.
( 0) 0)
|
| [3] |
罗志勇, 张胜涛, 郑泽根, 等. 电化学法处理重金属废水的研究进展[J].
中国给水排水,2009, 25 (16) : 6-10.
LUO Zhiyong, ZHANG Shengtao, ZHENG Zegen, et al. Research progress in electrochemical methods for treatment of heavy metal waste water[J]. China Water and Wastewater,2009, 25 (16) : 6-10. (  0) 0)
|
| [4] |
VOLESKY B. Advances in biosorption of metals-selection of biomass types[J].
FEMS Microbiol Rev,1994, 14 : 291-302.
( 0) 0)
|
| [5] |
张晓晖.驯化活性污泥处理含铬(Ⅵ)废水的研究[D].南昌:江西理工大学, 2008.
ZHANG Xiaohui. Domesticated activated sludge treatment wastewater containing chromium (Ⅵ) [D]. Nanchang:Jiangxi University of Science and Technology, 2008. (  0) 0)
|
| [6] |
WANG J, CHEN C. Biosorbents for heavy metals removal and their future[J].
Biotechnology Advances,2009, 27 (2) : 195-226.
( 0) 0)
|
| [7] |
吴乾菁, 李昕, 李福德, 等. 微生物治理电镀废水的研究[J].
环境科学,1997 (5) : 47-50.
WU Qianjing, LI Xin, LI Fude, et al. Research of microorganism treating electroplating wastewater[J]. Chinese Journal of Enviromental Science,1997 (5) : 47-50. (  0) 0)
|
| [8] |
CARPIO I E M, MACHADO-SANTELLI G, SAKATA S K, et al. Copper removal using a heavy-metal resistant microbial consortium in a fixed-bed reactor[J].
Water Research,2014, 62 : 156-166.
( 0) 0)
|
| [9] |
邹水林.重金属铜耐受菌的筛选及吸附铜的研究[D].广州:华南理工大学, 2014.
ZOU Shuilin. Screening of copper resistant bacteria and analysis of its Cu2+ biosorption[D]. Guangzhou:South China University of Technology, 2014. (  0) 0)
|
| [10] |
WANG J, CHEN C. Biosorbents for heavy metals removal and their future[J].
Biotechnology Advances,2009, 27 (2) : 195-226.
( 0) 0)
|
| [11] |
OLAKF, ATARN, YAZICIOGˇLUD, 等. Biosorption of lead from aqueous solutions by bacillus strains possessing heavy-metal resistance[J].
Chemical Engineering Journal,2011, 173 (2) : 422-428.
( 0) 0)
|
| [12] |
FOMINA M, CHARNOCK J, BOWEN A D, et al. X-ray absorption spectroscopy (XAS) of toxic metal mineral transformations by fungi[J].
Environmental Microbiology,2007, 9 (2) : 308-21.
( 0) 0)
|
| [13] |
GUVEN O, TANSEL O, NUR C, et al. Heavy metal biosorption by biomass of Ochrobactrum anthropi producing exopolysaccharide in activated sludge[J].
Bioresource Technology,2003, 90 (1) : 71-74.
( 0) 0)
|
| [14] |
TEITZEL G M, PARSEK M R. Heavy metal resistance of biofilm and planktonic Pseudomonas aeruginosa[J].
Applied & Environmental Microbiology,2003, 69 (4) : 2313-2320.
( 0) 0)
|
| [15] |
MONCHY S, BENOTMANE M A, JANSSEN P, et al. Plasmids pMOL28 and pMOL30 of Cupriavidus metallidurans are specialized in the maximal viable response to heavy metals[J].
Journal of Bacteriology,2007, 189 (20) : 7417-7425.
( 0) 0)
|
| [16] |
FAN J, OKYAY T O, RODRIGUES D F. The synergism of temperature, pH and growth phases on heavy metal biosorption by two environmental isolates[J].
Journal of Hazardous Materials,2014, 279 : 236-243.
( 0) 0)
|
| [17] |
PETERS R W. Chelant extraction of heavy metals from contaminated soils[J].
Journal of Hazardous Materials,1999, 66 (1) : 151-210.
( 0) 0)
|
| [18] |
吴健良, 曾建新, 蓝俊宏, 等. Fenton-接触氧化联合工艺处理铁合金镀件电镀前处理废水[J].
环境工程学报,2014, 8 (11) : 4707-4714.
WU Jianliang, ZENG Jianxin, LAN Junhong, et al. Treatment of iron alloy electroplating pretreatment wastewater by Fenton-biological contact oxidation process[J]. Chinese Journal of Environmental Engineering,2014, 8 (11) : 4707-4714. (  0) 0)
|
| [19] |
刘定富, 葛丽颖. pH值调控对电镀废水处理的影响[J].
环保科技,2008 (1) : 8-10.
LIU Dingfu, GE Liying. Effect of pH value control on electroplating wastewater treatment[J]. Chinese Journal of Environmental Engineering,2008 (1) : 8-10. (  0) 0)
|
| [20] |
KARTHIKEYAN S, PALANIAPPAN P, SABHANAYAKAM S. Influence of pH and water hardness upon nickel accumulation in edible fish Cirrhinus mrigala[J].
Journal of Environmental Biology,2007, 28 (2) : 489.
( 0) 0)
|
| [21] |
ÇOLAKF, ATARN, YAZICIOĞLUD, 等. Biosorption of lead from aqueous solutions by Bacillus strains possessing heavy-metal resistance[J].
Chemical Engineering Journal,2011, 173 (2) : 422-428.
( 0) 0)
|
| [22] |
CHANG J S, LAW R, CHANG C C. Biosorption of lead, copper and cadmium by biomass of Pseudomonas aeruginosa PU21[J].
Water Research,1997, 31 (7) : 1651-1658.
( 0) 0)
|
| [23] |
FAN J, OKYAY T O, RODRIGUES D F. The synergism of temperature, pH and growth phases on heavy metal biosorption by two environmental isolates[J].
Journal of Hazardous Materials,2014, 279 : 236-243.
( 0) 0)
|
| [24] |
LU W B, SHI J J, WANG C H, et al. Biosorption of lead, copper and cadmium by an indigenous isolate Enterobacter sp. J1 possessing high heavy-metal resistance[J].
Journal of Hazardous Materials,2006, 134 (1) : 80-86.
( 0) 0)
|
| [25] |
CARPIO I E M, SANTOS C M, WEI X, et al. Toxicity of a polymer-graphene oxide composite against bacterial planktonic cells, biofilms, and mammalian cells[J].
Nanoscale,2012, 4 (15) : 4746-4756.
( 0) 0)
|
| [26] |
NAKAJIMA A, UEDA Y. Relationship between copper biosorption and microbial inhibition of hydroxyl radical formation in a copper(II)-hydrogen peroxide system[J].
World Journal of Microbiology & Biotechnology,2008, 24 (8) : 1253-1257.
( 0) 0)
|
| [27] |
CHANG J S, LAW R, CHANG C C. Biosorption of lead, copper and cadmium by biomass of Pseudomonas aeruginosa PU21[J].
Water Research,1997, 31 (7) : 1651-1658.
( 0) 0)
|
| [28] |
MOHAMAD O A, HATAB S R, LIU Z, et al. Biosorption and bioaccumulation of Cu2+ from aqueous solution using living M. amorphae isolated from mine tailings[J].
Mine Water & the Environment,2012, 31 (4) : 312-319.
( 0) 0)
|
 2016, Vol. 48
2016, Vol. 48


