二苯甲酮(Benzophenone,BP)是由一个羰基连接两个苯环形成的化合物,是紫外吸收剂的中间体,其衍生物广泛应用于多种产品和制剂中.2-羟基-4-甲氧基二苯甲酮(BP-3)、4-羟基二苯甲酮(4-HBP)、2, 4-二羟基二苯甲酮(BP-1)、2, 2′, 4, 4′-四羟基二苯甲酮(BP-2)、2, 4-二羟基-4-甲氧基二苯甲酮(BP-8)等是常见的BP型紫外吸收剂,其苯环上的羟基氢可与相邻的羰基氧形成螯合环,经紫外线照射后螯合环打开,化合物由不稳定的高能态转变为低能的稳定态,过程中释放能量,从而使有害的紫外光变为低能、无害的热能[1-2].BP型紫外吸收剂具有吸收率高、热稳定性好、兼容性强等优点,广泛应用于防晒类制剂[3-7]、油漆、涂料、染料[8-9]、食品塑料包装[10-11]等产品中,用以紫外防护、防止涂料染料褪色以及塑料产品的聚合或降解等.BP型紫外吸收剂具有内分泌干扰作用,进入人体后可与相应的激素受体相结合,扰乱人体内的激素水平,从而影响人体生殖健康[12-15].人们可通过呼吸、饮食和皮肤接触等途径摄入BP型紫外吸收剂.目前,国外BP型紫外吸收剂的人体监测研究主要集中在北美和欧洲等发达国家[16-20].中国对于BP型紫外吸收剂的人体监测研究相对较少.已有研究显示,BP-3、4-HBP、BP-1、BP-2和BP-8等紫外吸收剂已在我国居民尿液中广泛检出,表明我国居民对于此类紫外吸收剂的暴露比较普遍[21-22].
BP型紫外吸收剂在油漆、涂料、染料等产品中应用比较广泛[8-9],添加到此类产品中的BP型紫外吸收剂并不与材料中的高分子基质形成稳定的化学键,容易挥发到环境中并经呼吸或皮肤接触等途径进入人体,油漆工人长期从事油漆涂料的粉刷工作,大大增加了此类物质在体内的暴露风险.BP-3具有吸收率高、热稳定性好、价格低廉等优点,是目前应用最广泛的BP型紫外吸收剂.BP-3具有多种内分泌干扰效应,可影响人体生殖发育健康,BP-3进入人体后还可代谢产生4-HBP、BP-1、BP-2和BP-8等代谢产物.研究表明,BP-1和BP-2等紫外吸收剂在人体内具有比BP-3更强的毒性效应[21-22].为了了解油漆工人体内BP型紫外吸收剂的污染水平,本研究于2013年1—4月,在黑龙江省哈尔滨市采集10个油漆工人的尿液样品,同时采集10个普通人群的尿液样品作为对照,分析尿液样品中BP-3、4-HBP、BP-1、BP-2和BP-8的污染特征,并对油漆工人体内BP型紫外吸收剂的暴露风险进行了评价.测定人体尿液中BP型紫外吸收剂的浓度水平,对于评价环境中此类物质的污染水平、人体对BP型紫外吸收剂的代谢状况,以及了解体内BP型紫外吸收剂的含量与某些疾病之间的关系具有指导意义.同时,开展职业暴露人群体内BP型紫外吸收剂的监测工作能够揭示此类物质在日常生活环境中潜在的污染来源,为减少和控制BP型紫外吸收剂对于职业暴露人群的危害提供参考依据,保障相应职业工作人员的健康安全,并对在日常生活中有效地规避此类暴露风险具有重要的理论和实践意义.
1 实验 1.1 尿液样品的采集与保存2013年1—4月,以黑龙江省哈尔滨市油漆工人和普通人群和为研究对象,分别采集了10个油漆工人尿液样品和10个普通人群的尿液样品,采样人群年龄为13~60岁,油漆工人从业年限为5~25 a,尿液样品详细信息见表 1.每个尿液样品采集8~10 mL,均匀混合后转移至10 mL离心管中,密封,-20℃避光保存.
| 表 1 哈尔滨市油漆工人和普通人群尿液样品信息 Table 1 Information of urine samples in painters and general population in Harbin |
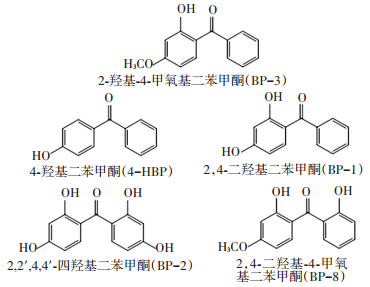
结合国内外的研究现状,共选择5种BP型紫外吸收剂为目标物,即BP-3、4-HBP、BP-1、BP-2、BP-8,详细信息如图 1和表 2所示.
|
图 1 BP型紫外吸收剂的分子结构 Figure 1 Molecular structures of BP-type UV filters |
| 表 2 BP型紫外吸收剂的名称、缩写、相对分子质量和CAS号 Table 2 Name, abbreviation, molecular weight and CAS number of BP-type UV filters |
尿液样品中BP型紫外吸收剂的前处理和仪器分析方法见文献[23].概述如下:1)样品酶解.将冰冻保存的尿液样品于室温下静置解冻至常温状态,涡旋混合30 s,取0.5 mL尿液样品于15 mL聚丙烯(PP)离心管中,加入200μL醋酸氨缓冲溶液,50μL 2 mL/L的β-葡萄糖醛酸酶以及100μL 500 mg/L的4-甲基伞形内酯,加入20 ng的13C12-BP-3内标以及0.5 mL超纯水,37℃水域过夜.2)液液萃取.向酶解后的尿液样品中加入3 mL乙酸乙酯,振荡1 h,4 500g离心10 min,移取上清液.此步骤重复两次,合并上清液,向混合上清液(约9 mL)中加入1 mL超纯水,4 500g离心10 min,取上清液,利用高纯氮气将上清液缓慢浓缩至几乎干燥,加入0.5 mL甲醇,涡旋混合10 s后转移至1 mL棕色样品瓶中,密封,低温保存,待仪器分析.
采用安捷伦1100高效液相色谱串联AB SCIEX API 2000三重四极杆质谱仪对BP型紫外吸收剂进行检测,色谱柱为Betasil C18型柱(100 mm×2.1 mm×5μm),保护柱为Betasil C18型柱(20 mm×2.1 mm×5μm).流动相A为甲醇,流动相B为甲醇-水溶液(10:90,体积比;醋酸铵调节pH,醋酸铵在甲醇水溶液中的浓度为0.15%),流速为300μL/min,流动相梯度为:0.0~4.5 min,80% B;4.5~6.0 min,30% B;6.0~15.0 min,5% B;15.0~25.0 min,5% B;25.5 min,80% B;25.5~30 min,80% B.进样体积10μL,载气为高纯氮气,进样口温度为450℃,负离子模式,离子喷雾电压为-4 700 V.BP-3、4-HBP、BP-1、BP-2、BP-8以及13C12-BP-3的定性、定量离子分别为227>211、197>92、243>93、245>91、243>93、233>217,BP-3和13C12-BP-3的轰击电能为-30 eV,4-HBP、BP-1、BP-2和BP-8的轰击电能为-40 eV.
1.3 质量控制和质量保证在样品处理过程中,同时进行2个空白实验和2个基质加标实验,处理方法与尿液样品相同,用以检测方法的回收率和基质干扰.空白样品中有BP-3和4-HBP的检出质量浓度分别为0.20和0.05μg/L,BP-1、BP-2和BP-8均未检出,数据均已扣除空白值.为检测样品处理过程中的基质影响和回收率,所有样品在处理前均加入13C12-BP-3内标,回收率为(86±17)%,所有数据均经过回收率校正.BP-3、4-HBP、BP-1、BP-2和BP-8的最低定量限(LOQ)范围为0.02~0.06μg/L.
2 结果与讨论 2.1 BP型紫外吸收剂的浓度水平5种BP型紫外吸收剂的检出率和浓度水平(肌酐校正:μg/g肌酐; 未经肌酐校正:μg/L)如表 3所示.由于实验所用尿液样品不是晨尿样品,分析过程中以肌酐校正后的浓度水平为准.BP-3、BP-2和BP-8在所有尿液中均有检出,是广泛存在于哈尔滨市居民尿液中的BP型紫外吸收剂.BP-1在普通人群和油漆工人尿液中的检出率均不足50%,说明BP-1不是哈尔滨市居民尿液中主要的紫外吸收剂.4-HBP在所有油漆工人尿液中均有检出,但在普通人群尿液中的检出率仅为50%,说明油漆工人对于4-HBP的暴露更广泛.
| 表 3 油漆工人和普通人群尿液样品中5种BP型紫外吸收剂的浓度水平 Table 3 Concentrations of BP-type UV filters in urine samples of painters and general population |
油漆工人尿液中5种BP型紫外吸收剂的总浓度(∑5 BPs)范围为0.24~8.66μg/g(1.75~13.68μg/L),普通人群尿液中BP型紫外吸收剂的总浓度范围为0.22~0.82μg/g(1.06~3.06μg/L),油漆工人尿液中BP型紫外吸收剂总浓度的几何平均值(1.36μg/g)是普通人群(0.43μg/g)的3倍,且油漆工人尿液中BP型紫外吸收剂的最高浓度比普通人群高一个数量级,说明油漆工人对于BP型紫外吸收剂的暴露程度高于普通人群,且BP型紫外吸收剂浓度较高的尿液样品主要为油漆工人尿液样品.
哈尔滨市油漆工人尿液中BP-3的几何平均浓度为0.11μg/g(0.28μg/L),与普通人群尿液中BP-3的几何平均浓度(0.08μg/g或0.29μg/L)基本相同,说明油漆工人不是BP-3的高风险暴露人群.哈尔滨市普通人群和油漆工人尿液中BP-3的浓度水平与南京市普通居民尿液中BP-3的浓度水平(0.11μg/L)基本相同[24],但低于天津(0.22μg/g)、上海(0.15μg/g)和齐齐哈尔(0.25μg/g)市普通居民尿液中BP-3的浓度水平[25].4-HBP和BP-1在油漆工人和普通人群尿液样品中的浓度均相对较低,说明4-HBP和BP-1不是哈尔滨市居民尿液中主要的BP型紫外吸收剂.
BP-2和BP-8是哈尔滨市油漆工人和普通人群尿液中浓度相对较高的BP型紫外吸收剂,哈尔滨市普通人群尿液中BP-2的几何平均浓度为0.09μg/g(0.34μg/L),低于上海市成年居民尿液中BP-2的浓度(0.79μg/L)[25].油漆工人尿液中BP-2的几何平均浓度(0.33μg/g)是普通人群的3倍,最高浓度(1.13μg/g)约为普通人群尿液中BP-2最高浓度(0.25μg/g)的5倍.哈尔滨市普通人群尿液中BP-8的几何平均浓度为0.16μg/g(0.59μg/L),高于上海市成年居民尿液中BP-2的浓度(0.18μg/L)[25].油漆工人尿液中BP-8的几何平均浓度(0.49μg/g)是普通人群的3倍,最高浓度(7.03μg/g)约为普通人群尿液中BP-8最高浓度(0.55μg/g)的13倍.油漆工人尿液中BP-2和BP-8的浓度显著高于普通人群,说明油漆工人接触了大量的BP-2和BP-8,即油漆涂料等材料与BP-2和BP-8在人体内的暴露程度有关,可显著增加人体内BP-2和BP-8的浓度水平.
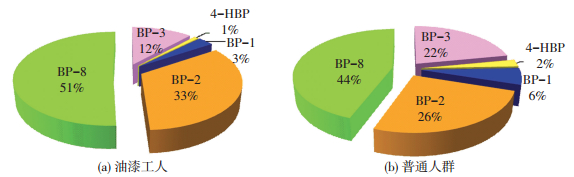
2.2 BP型紫外吸收剂的的组成特征为了了解各种BP型紫外吸收剂在哈尔滨市油漆工人和普通人群尿液中的分布情况,分析了油漆工人和普通人群尿液中BP型紫外吸收剂的组成特征(图 2).结果显示,BP-8是普通人群尿液中最主要的紫外吸收剂,占总浓度的44%,BP-3和BP-2分别占总浓度的22%、26%,4-HBP和BP-1仅占总浓度的8%.在油漆工人尿液中,BP-8和BP-2占BP型紫外吸收剂总浓度的比例均大于普通人群,分别为51%和33%,BP-3、4-HBP和BP-2的比例相对较小,共占总浓度的16%.油漆工人尿液中BP型紫外吸收剂的组成与普通人群不同,说明油漆工人接触的BP型紫外吸收剂的种类与普通人群存在差异,油漆工人主要通过呼吸和皮肤接触暴露于油漆涂料等产品释放出的BP型紫外吸收剂,其工作环境中的各类产品即为该人群尿液中BP型紫外吸收剂的主要来源,油漆工人尿液中BP-8和BP-2的组分相对较高,说明油漆工人的工作环境中BP-8和BP-2的组份相对较高.
|
图 2 哈尔滨市普通人群和油漆工人尿液中BP型紫外吸收剂的组成特征 Figure 2 Composition profiles of BP-type UV filters in urines of painters and general population in Harbin |
为了了解油漆工人和普通人群尿液中各种BP型紫外吸收剂的来源,对哈尔滨市油漆工人和普通人群尿液中BP-3、4-HBP、BP-1、BP-2和BP-8的浓度进行相关性分析,结果如表 4所示.由于普通人群和油漆工人尿液中4-HBP的检出率均低于50%,普通人群尿液中BP-1的检出率也低于50%,对于普通人群尿液中的4-HBP和BP-1,以及油漆工人尿液中的4-HBP不进行详细讨论.
| 表 4 油漆工人和普通人群尿液样品中BP型紫外吸收剂的相关性分析 Table 4 Correlation analysis of concentrations of BP-type UV filters in urines of painters and general population |
哈尔滨市普通人群尿液中BP-3和BP-2、BP-3和BP-8的浓度具有显著和极显著的相关性,BP-2和BP-8的浓度之间无显著相关性.研究表明,生物体内的BP-1、4-HBP、BP-2和BP-8既可由BP-3代谢产生[25-28],也可作为紫外吸收剂的母体单独添加到各类产品中[29].哈尔滨市普通人群尿液中BP-3和BP-2、BP-3和BP-8的浓度之间相关性显著,说明BP-3和BP-2、BP-3和BP-8具有相同或相似的来源,但BP-2和BP-8的浓度之间相关性不显著,说明BP-2和BP-8的来源不同,既不是主要由BP-3代谢而来,而是分别与BP-3具有相同或相似的来源.
油漆工人尿液中BP-3、4-HBP和BP-2的浓度彼此之间相关性显著,说明油漆工人尿液中BP-3、4-HBP和BP-2具有相同或相似的来源,即4-HBP和BP-2可能是由BP-3代谢而来,或BP-3、4-HBP、BP-2来源于同一种或一类产品中.BP-2和BP-8是油漆工人尿液中浓度较高的BP型紫外吸收剂,但BP-2和BP-8的浓度之间相关性不显著,说明油漆工人尿液中BP-2和BP-8的来源不同.BP-8和BP-3浓度之间也无显著相关性,说明BP-8不是由BP-3代谢而来,而是与BP-2和BP-3分别来源于不同的油漆、涂料、染料等产品中.4-HBP与BP-8的浓度之间具有显著相关性,说明4-HBP和BP-8可能来源于同一种或一类产品中.
2.4 健康风险评价健康风险评价是用于描述和评估某一个体未来发生某种特定疾病或由于某种特定疾病而导致死亡的可能性的一种方法或工具,通常,利用健康风险评价模型可以计算或估计有害物质给人体带来的风险.哈尔滨市油漆工人和普通人群尿液中BP型紫外吸收剂的日排泄量(daily excretion,DE)由公式(1)[22]计算:
| $ {I_{DE}}=cV \times \frac{1}{W}. $ | (1) |
式中:c为尿液中BP型紫外吸收剂的浓度;V为人体尿液的日排尿量,成年人尿液日排泄量为1.7 L/d[30];W为体质量.
哈尔滨市油漆工人和普通人群尿液中BP型紫外吸收剂的日排泄量如表 5所示.油漆工人尿液中5种BP型紫外吸收剂日排泄量的几何平均值、50分位(P50)和95分位(P95)分别为86.54、71.96和274.30 ng/(kg·d),高于普通人群尿液中5种BP型紫外吸收剂日排泄量的几何平均值(45.01)、P95(44.57)和P95(71.78 ng/(kg·d)),并且油漆工人尿液中日排泄量的P95是普通人群的4倍以上(下文采用日排泄量的几何平均值和P95进行比较分析).油漆工人尿液中BP-3、4-HBP和BP-1日排泄量的几何平均值分别为7.19、0.55和1.88 ng/(kg·d),略低于普通人群(8.46、0.94和2.19 ng/(kg·d)),但油漆工人尿液中BP-3、4-HBP和BP-1的P95日排泄量均高于普通人群,说明BP-3、4-HBP和BP-1的高暴露量人群主要存在于油漆工人群体中.BP-2和BP-8是哈尔滨市普通人群和油漆工人尿液中暴露量相对较高的BP型紫外吸收剂,油漆工人尿液中BP-2和BP-8日排泄量的几何平均值约为普通人群的2倍,而P95日排泄量是普通人群的3倍以上,说明油漆工人对于BP-2和BP-8的暴露程度普遍较高.综上,5种BP型紫外吸收剂的高暴露人群均为油漆工人,说明油漆工人的工作环境与BP型紫外吸收剂的暴露有关,长期接触油漆、涂料等粉刷材料可增加BP-3、4-HBP、BP-1、BP-2和BP-8在人体内的暴露量.
| 表 5 哈尔滨市油漆工人和普通人群尿液中PAEs的日排泄量 Table 5 Daily excretions of PAEs in urines of painters and general population in Harbinng·(kg·d)-1 |
由于BP-3、4-HBP、BP-1、BP-2和BP-8在人体内的代谢过程尚不清晰,缺乏相应的摄入与排泄比例关系,本文中计算的哈尔滨市油漆工人尿液中BP型紫外吸收剂的日排泄量低于实际日暴露量.哈尔滨市油漆工人尿液中BP型紫外吸收剂的总暴露量明显高于普通人群,说明油漆涂料的粉刷行业是BP型紫外吸收剂的高风险暴露职业.BP型紫外吸收剂是外源性内分泌干扰物,可对人体生殖健康产生不利影响,BP-3是使用较为广泛的BP型紫外吸收剂,因此,国内外关于BP型紫外吸收剂的研究主要集中在BP-3人体暴露.但是,动物实验表明,BP-1、4-HBP和BP-2在机体内的雌激素活性高于BP-3[31-32],而BP-2是哈尔滨市油漆工人暴露程度较高的BP型紫外吸收剂,因此,此类物质在油漆工人体内的暴露量应引起注意.此外,油漆工人因其工作性质,长期暴露于油漆、涂料等粉刷材料中,对BP型紫外吸收剂的暴露属于持续暴露,即体内的P型紫外吸收剂始终保持着相对较高的浓度水平,因此,应加强对于油漆工人体内BP型紫外吸收剂暴露水平的重视.
3 结论1) 哈尔滨市油漆工人对于BP型紫外吸收剂的暴露非常普遍,BP-3、BP-1、BP-2和BP-8的浓度高于普通人群,BP-2和BP-8是油漆工人尿液中主要的BP型紫外吸收剂.
2) 油漆工人尿液中BP-3、4-HBP、BP-2具有相同的来源,4-HBP和BP-8也具有相同的来源,但是BP-2和BP-8的来源不同.
3) 油漆工人尿液中BP-2和BP-8的日排泄量显著高于普通人群,长期接触油漆、涂料、染料等粉刷材料可增加人体内BP型紫外吸收剂的暴露量.
| [1] |
ROSARIO R, MONIKA M, ROLF A, et al. Photostability and phytotoxicity of selected sunscreen agents and their degradation mixtures in water[J].
Analytical & Bioanalytical Chemistry,2009, 395 (5) : 1513-1524.
( 0) 0)
|
| [2] |
PABLO G F, MARINA B F, ALBA O, et al. Evaluation of fungal-and photo-degradation as potential treatments for the removal of sunscreens BP3 and BP1[J].
Science of the Total Environment,2012, 427/428 (12) : 355-363.
( 0) 0)
|
| [3] |
GONZALEZ H, FARBROT A, LARK O, et al. Percutaneous absorption of the sunscreen benzophenone-3 after repeated whole-body applications, with and without ultraviolet irradiation[J].
Br J Dermatol,2006, 154 (2) : 337-340.
( 0) 0)
|
| [4] |
SUZUKI T, KITAMURA S R, SUGIHARA K, et al. Estrogenic and antiandrogenic activities of 17 benzophenone derivatives used as UV stabilizers and sunscreens[J].
Toxicology & Applied Pharmacology,2005, 203 (1) : 9-17.
( 0) 0)
|
| [5] |
LIAO C Y, KANNAN K. Widespread occurrence of benzophenone-type UV light filters in personal care products from China and the United States: an assessment of human exposure[J].
Environmental Science & Technology,2014, 48 (7) .
( 0) 0)
|
| [6] |
KUNNISUE T, WU Q, TANABE S, et al. Analysis of five benzophenone-type UV filters in human urine by liquid chromatography-tandem mass spectrometry[J].
Analytical Methods,2010, 2 (6) : 707-713.
( 0) 0)
|
| [7] |
National Library of Medicine.
Household products database[M]. Bethesda, MD: National Institutes of Health, 2011 .
( 0) 0)
|
| [8] |
韦万兴, 袁天佑, 曹家兴. 2, 4-二羟基二苯甲酮的合成[J].
广西化工,1999 (3) : 1-2.
WEI Wanxing, YUAN Tianyou, CAO Jiaxing. Synthesis of 2, 4 Dihydroxybenzophenone[J]. Guangxi Chemical Industry,1999 (3) : 1-2. (  0) 0)
|
| [9] |
刘忠泽. 二苯甲酮系列产品的合成及应用[J].
精细化工中间体,2002, 32 (2) : 7-8.
LIU Zhongze. Synthesis and application of Benzophenone derivants[J]. Fine Chemical Intermediats,2002, 32 (2) : 7-8. (  0) 0)
|
| [10] |
Environmental Working Group. EWG's skin deep cosmetic database[Z]. Available at: http://www.ewg.org/skindeep/, 2013.
( 0) 0)
|
| [11] |
SHAATH N A. Encyclopedia of UV absorbers for sunscreen products[J].
Cosmetics & Toiletries,1987, 102 : 21-39.
( 0) 0)
|
| [12] |
GOMEZ E, PILLON A, FENET H, et al. Estrogenic activity of cosmetic components in reporter cell lines: parabens, UV screens, and musks[J].
Journal of Toxicology & Environmental Health Part A Current Issues,2005, 68 (4) : 239-251.
( 0) 0)
|
| [13] |
KUNZ P Y, FENT K. Multiple hormonal activities of UV filters and comparison of in vivo and in vitro estrogenic activity of ethyl-4-aminobenzoate in fish[J].
Aquatic Toxicology,2006, 79 (4) : 305-324.
( 0) 0)
|
| [14] |
MOROHOSHI K, YAMAMOTO H, KAMATA R, et al. Estrogenic activity of 37 components of commercial sunscreen lotions evaluated by in vitro assays[J].
Toxicology in Vitro,2005, 19 (4) : 457-469.
( 0) 0)
|
| [15] |
KIM S, CHOI K. Occurrences, toxicities, and ecological risks of benzophenone-3, a common component of organic sunscreen products: a mini-review[J].
Environment International,2014, 70 .
( 0) 0)
|
| [16] |
CALAFAT A M, WONG L Y, YE X Y, et al. Concentrations of the sunscreen agent benzophenone-3 in residents of the United States: national health and nutrition examination survey 2003—2004[J].
Environmental Health Perspective,2008, 116 : 893-897.
( 0) 0)
|
| [17] |
FREDERIKSEN H, NIELSEN J K S, MORCK T A, et al. Urinary excretion of phthalate metabolites, phenols and parabens in rural and urban Danish mother-child pairs[J].
International Journal of Hygiene and Environmental Health,2013, 216 : 772-783.
( 0) 0)
|
| [18] |
LIDIA C, FEMNANDEZ M F, SABRINA L, et al. Urinary concentrations of phthalates and phenols in a population of Spanish pregnant women and children[J].
Environment International,2011, 37 (5) : 858-866.
( 0) 0)
|
| [19] |
PHILIPPAT C, MORTAMAIS M, CHEVRIER C, et al. Exposure to phthalates and phenols during pregnancy and offspring size at birth[J].
Environmental Health Perspective,2012, 120 : 464-470.
( 0) 0)
|
| [20] |
DEWALQUE L, PIRARD C, DUBOIS N, et al. Simultaneous determination of some phthalate metabolites, parabens and benzophenone-3 in urine by ultra high pressure liquid chromatography tandem mass spectrometry[J].
Journal of Chromatography B,2014, 949 : 37-47.
( 0) 0)
|
| [21] |
WANG L, KANNAN K. Characteristic profiles of benzonphenone-3 and its derivatives in urine of children and adults from the United States and China[J].
Environmental Science & Technology,2013, 47 (21) : 12532-12538.
( 0) 0)
|
| [22] |
GAO C J, LIU L Y, MA W L, et al. Benzonphenone-type UV filters in urine of Chinese young adults:concentration, source and exposure[J].
Environmental Pollution,2015, 203 : 1-6.
( 0) 0)
|
| [23] |
ASIMAKOPOULOS A G, WANG L, THOMAIDIS N S, et al. A multi-class bioanalytical methodology for the determination of bisphenol A diglycidyl ethers, p-hydroxybenzoic acid esters, benzophenone-type ultraviolet filters, triclosan, and triclocarban in human urine by liquid chromatography-tandem mass spectrometry[J].
Journal of Chromatography A,2014, 1324 (1) : 141-148.
( 0) 0)
|
| [24] |
CHEN M J, ZHU P F, XU B, et al. Determination of nine environmental phenols in urine by ultra-high-performance liquid chromatography-tandem mass spectrometry[J].
Journal of Analytical Toxicology,2012, 36 : 608-615.
( 0) 0)
|
| [25] |
WANG L, KANNAN K. Characteristic profiles of benzonphenone-3 and its derivatives in urine of children and adults from the United States and China[J].
Environmental Science & Technology,2013, 47 : 12532-12538.
( 0) 0)
|
| [26] |
CHUKWUEMEKA S O, MOHAMED S A R, MARVIN A F. Disposition of benzophenone-3 after dermal administration in male rats[J].
Toxicology Letters,1994, 73 (2) : 113-122.
( 0) 0)
|
| [27] |
FELIX T, HALL B J, BRODBELT J S. Determination of benzophenone-3 and metabolites in water and human urine by solid-phase microextraction and quadrupole ion trap GC-MS[J].
Analytica Chimica Acta,1998, 371 : 195-203.
( 0) 0)
|
| [28] |
OKEREKE C S, KADRY A M, ABDELRAHMAN M S, et al. Metabolism of benzophenone-3 in rats[J].
Drug Metabolism & Disposition,1993, 21 (5) : 788-791.
( 0) 0)
|
| [29] |
KUNISUE T, WU Q, TANABE S, et al. Analysis of five benzophenone-type UV filters in human urine by liquid chromatographytandem mass spectrometry[J].
Analytical Methods,2010, 2 : 707-713.
( 0) 0)
|
| [30] |
PERUCCA J, BOUBY N, VALEIX P, et al. Sex difference in urine concentration across differing ages, sodium intake, and level of kidney disease[J].
American Journal of Physiology-Regulatory Integrative and Comparative Physiology,2007, 292 : R700-R705.
( 0) 0)
|
| [31] |
KAWAMURA Y, OGAWA Y, NISHMURA T, et al. Estrogenic activities of UV stabilizers used in food contact plastics and benzophenone derivatives tested by the yeast two-hybrid assay[J].
Journal of Health Science,2003, 49 : 205-12.
( 0) 0)
|
| [32] |
KAWAMURA Y, MUTSUGA M, KATO T, et al. Estrogenic and anti-androgenic activities of benzophenones in human estrogen and androgen receptor mediated mammalian reporter gene assays[J].
Journal of Health Science,2005, 51 : 48-54.
( 0) 0)
|
 2016, Vol. 48
2016, Vol. 48


