2. 三峡库区生态环境教育部重点实验室(重庆大学), 重庆4000455 ;
3. 重庆市环境工程评估中心, 重庆401121
2. Key Laboratory of Three Gorges Reservoir Area's Ecology and Environment Ministry of Education (Chongqing University), Chongqing 400045, China ;
3. Appraisal Center for Environment & Engineering of Chongqing, Chongqing 401121, China
近年来, 采用电化学技术处理含氨氮废水已引起广泛关注[1-4].电化学处理具有操控简单、占地少、反应条件温和、不会或很少产生二次污染, 可以同时除去废水中多种难生物降解或有毒有害物质等诸多优点, 而且对高、低浓度氨氮污水均有较好的处理效果[5-7].现有研究中, 一般多采用高氯离子浓度的电解质体系, 通过在阳极的析氯作用衍生成大量“活性氯物质”将氨氮氧化.但该体系常会产生过量的余氯, 当水中存在有机物时, 会形成多种消毒副产物[8], 因而存在潜在的二次污染.为此, 有学者采用无氯离子的(NH4)2SO4电解质体系, 但研究结果显示对氨氮的去除率较低[9-10].三维电极法是20世纪60年代发展的一种新型电化学技术.三维电极通过在传统二维电极极板间充填粒子电极材料作为复性电极, 增加体系的面体比、传质强度和吸附能力, 获得较二维电极更高的电流效率和污染物的去除率[11-13].文献[5-6]对比了二维和三维电极对氨氮废水的处理, 证实三维电极可以达到更高的氨氮降解效果和电流效率, 不过该研究仍在有氯离子电解质体系下进行.目前,在无氯离子存在下采用三维电极处理氨氮废水还鲜有报道.此外, 对于电化学氧化氨氮的机理, 在有氯离子体系中, 一般认为是阳极产生含氯氧化剂的间接氧化作用占主导, 而直接氧化或羟基自由基(·OH)作用较小[14]; 而在无氯离子体系中, 有学者发现电化学处理后氮氧化物生成量较小, 认为氨氮去除以在阳极上直接氧化为N2为主, 羟基自由基的间接氧化起的作用较小[9]; 但另有学者报道氧化过程形成较多氮氧化物[15].同时, 对于氨氮气态转化途径的探讨多通过反应前后水中含氮物质变化进行推测.由此可见, 在无氯离子体系中氨氮的电化学氧化机理并未完全清楚, 且缺乏从系统中各相产物角度剖析氨氮转化机理.为此, 本文基于无氯离子电解质体系中构建三维电极, 从影响条件和气-液-固相产物变化角度分析其对水中氨氮的去除特性以及氨氮的转化途径, 以期为高效和绿色的氨氮处理技术发展提供理论依据.
1 实验 1.1 生物炭三维电极反应器反应器为一有机玻璃制备的矩形反应槽(15.5 cm×8 cm×8 cm), 如图 1所示; 阳极采用热氧化法制备Ti/IrO2-Ta2O5网状电极(15.5 cm×5 cm), 并采用同等尺寸的不锈钢网作阴极, 极板间距为1.0 cm; 极板间填充粒子电极材料为生物炭, 用松木限氧升温热解法制备(终温700℃, 粒径10~20目), 粒子电极填充质量浓度为5 g/L; 用(NH4)2SO4配制质量浓度为100 mg/L的氨氮溶液, 以18 mmol/L Na2SO4形成无氯离子的电解质体系.
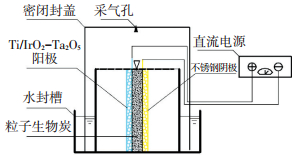
|
图 1 生物炭三维电极反应器 Figure 1 Schematic of biochar three-dimensional electrode reactor |
采用序批式实验, 在反应器中加入设定质量浓度的氨氮溶液后, 通电调节稳压直流电源输出电流值以控制电流密度(电流密度为单位浸没阴阳极正对极板面积上加载电流值)至25 mA/cm2时开始计时, 反应结束后立刻测定溶液中残留NH4+质量浓度, 以计算氨氮的去除率和去除量.
1.2.2 氨氮去除影响因素研究采用0.1 mol/L H2SO4和0.1 mol/L NaOH调节溶液初始pH,以及向溶液中添加18 mmol/L NaNO2和KNO3, 分别研究pH和共存氮氧离子对氨氮去除的影响.
1.2.3 氨氮转化途径研究对反应器进行加盖水封密闭处理并设置采气孔(图 1).在不同时间点对反应系统进行采样测定液相各种含氮化合物质量浓度; 采用解吸方法测定粒子电极材料对含氮化合物吸附量; 用注射器从采气孔抽取反应气体, 装入气体采样袋(E-switch单阀1 L铝箔采样袋)以分析反应过程中气相成分变化.
1.2.4 生物炭对含氮化合物的吸附1) 未加电场时生物炭对氨氮吸附.将0.15 g生物炭与30 mL氨氮溶液(质量浓度为100 mg/L)加入到50 mL具塞乙烯离心管中, 置于25℃恒温振荡器中振荡一定时间后, 在5 000 r/min转速下离心, 取上清液测定氨氮质量浓度计算被吸附的氨氮质量浓度.
2) 加电场后的生物炭对氨氮吸附.在加电场反应一定时间后, 取出生物炭粒子电极, 用滤纸过滤后于105℃烘干, 置于0.1 mol/L NaOH溶液振荡24 h ((24±1)℃, 200 r/min)解吸, 混合液过0.45μm滤膜, 测定滤液中含氮化合物质量浓度, 以计算反应中生物炭通过吸附作用去除的含氮化合物量.
1.3 指标测试水中NH4+、NO2-、NO3-和TN质量浓度按标准方法[16]分别采用纳氏试剂分光光度法、紫外分光光度法、N-(1-萘基)-乙二胺光度法、碱性过硫酸钾消解紫外分光光度法(T6 UV-VIS光度计, 北京普析, 中国)测定; 溶液pH使用pHS-3C酸度计测定.各气体组分的体积分数采用岛津GC2014C气相色谱仪分析, 并配置TCD热导检测器.每次实验重复两次, 测定结果取平均值.
2 结果与讨论 2.1 生物炭三维电极对氨氮去除性能分别考察了生物炭三维电极反应器在未加和施加电场下氨氮的去除率.从图 2可看出, 当反应3 h时, 反应器对水中氨氮去除率为3.82%, 吸附24 h时对氨氮的去除率为3.76%, 相差不大, 表明生物炭电极材料对氨氮的单纯吸附量较小.而加电场后, 反应3 h时反应器对溶液中氨氮的去除率达45.72%, 且随着反应时间延长, 去除率持续上升.对比分析可以认为, 电极材料单纯吸附作用对氨氮去除影响不大, 因此,反应器对氨氮去除主要是基于电化学反应过程.本文构建的三维电极反应器对氨氮去除率与文献[9]采用二维电极获得的23.5%去除率相比, 提高近1倍, 表明在无氯离子存在体系中, 三维电极对氨氮的去除有显著提升作用.
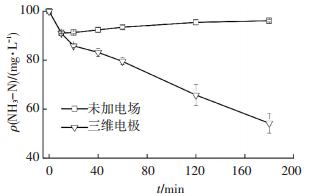
|
图 2 三维电极反应器与静态吸附中氨氮去除过程对比 Figure 2 Comparison of ammonia removal adsorption in three-dimensional electrode reactor and biochar |
反应动力学可推测反应过程的主要机制, 常用零级、一级和二级反应动力学来描述电化学法去除氨氮的过程[17].
零级反应动力学方程
| $ {\rho _t}={\rho _0}-{k_0}t, $ | (1) |
一级反应动力学方程
| $ ln\left({{\rho _0}/{\rho _t}} \right)={k_1}t + A, $ | (2) |
二级反应动力学方程
| $ d{\rho _t}/dt={k_2}{\left({{\rho _0}/{\rho _t}} \right)^2}. $ | (3) |
式中:ρ0和ρt为反应初始和t时刻物质的质量浓度, mg/L; t为反应时间, min; k0为零级反应速率常数, mg·L-1·min-1; k1为一级反应速率常数, min-1; k2为二级反应速率常数, L·g-1·min-1; A为常数, mg/L.
将图 2中三维电极降解氨氮的数据代入式(1)~(3), 得到的拟合参数见表 1.可以看出,三维电极反应器对氨氮的电化学氧化过程更符合一级动力学方程.
| 表 1 动力学拟合参数 Table 1 Fitting kinetic parameters |
氨氮初始质量浓度为100 mg/L, 改变溶液初始pH, 反应器对水中氨氮的去除效果见图 3.相同反应时间下, 溶液中氨氮去除率随初始pH增加而显著升高.如反应3 h时, 初始pH=3.05的氨氮去除率为22.86%, 而初始pH=11.09条件下氨氮去除率则达65.19%.此外, 溶液初始pH上升, 氨氮转化反应速率也显著增大, 表明溶液中OH-对氨氮转化有重要影响.在酸性溶液中氨氮以NH4+存在且抑制OH-生成, 而碱性环境中氨氮多以NH3·H2O形态赋存, NH3和OH-的同时氧化有利于中间产物NH2OH(羟胺)的生成[18], 并存在进一步氧化途径[19]:
| $ \begin{array}{c} {\rm{N}}{{\rm{H}}_3}\left({{\rm{ads}}} \right) + {\rm{O}}{{\rm{H}}^-} \to {\rm{N}}{{\rm{H}}_2}{\rm{OH, }}\\ {\rm{N}}{{\rm{H}}_2}{\rm{OH}} + {{\rm{O}}_2} \to {\rm{N}}{{\rm{O}}_3}, {{\rm{N}}_2}. \end{array} $ |
所以,OH-是反应器中氨氮氧化的必要反应物,这与反应过程中溶液的pH变化相对应.实验中测得溶液初始pH<9.01体系中, 反应结束时溶液pH均降至3.0左右; 在溶液初始pH=11.09体系中, 反应结束时pH最终降至8.0左右, 表明三维电极去除氨氮为一个消耗碱度的化学反应过程.
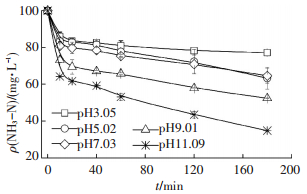
|
图 3 不同pH条件下氨氮溶液随时间的变化 Figure 3 Changes of ammonia in solution at different pH |
一般而言, NH4+氧化可以形成NO2-或NO3-.本研究通过在初始溶液中分别添加不同种类氮氧化物, 探究电化学反应过程中的中间产物和终产物.如图 4所示, NO2-和NO3-共存条件下反应器对氨氮去除率有所下降, 反应3 h后的氨氮去除率分别为34.56%和32.47%, 显著低于未添加时的45.72%, 其中NO3-对氨氮去除率影响略大于NO2-.
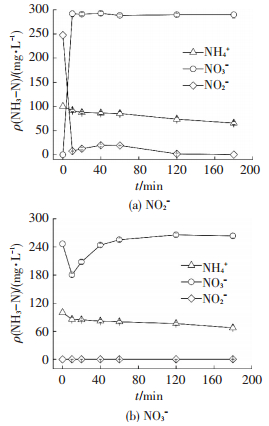
|
图 4 NO2-与NO3-共存溶液中氮形态随时间的变化 Figure 4 Changes of nitrogen forms in solution under different oxynitride ions NO2- and NO3- |
由图 4(a)可看出, 当初始溶液中加入NO2-时, 随着反应进行, 溶液中NO3-质量浓度迅速上升, 而NO2-质量浓度迅速减至零.由此可见, 三维电极反应器在氨氮去除过程中有新的NO3-生成和积累, 以及NO2-的转化和消除.推测电化学氧化氨氮终产物可能为NO3-.值得注意的是, 反应10 min后溶液中NO3-质量浓度波动很小, 在后期甚至有微微降低, 而此时无论是NH4+质量浓度还是NO2-质量浓度仍呈下降趋势, 表明有一部分氮被转移到气相或固相(生物炭)中.类似的现象在图 4(b)中也可观察到, 当初始溶液中加入NO3-时, 随着反应进行, 溶液中NO3-质量浓度先迅速下降, 然后逐渐上升至一个稳定值, 反应过程中未测定出NO2-, 表明三维电极反应器不会生成或积累NO2-.反应2 h后, 溶液中NH4+质量浓度仍持续下降, 但NO2-和NO3-质量浓度几乎没有变化, 这表明存在氮的反应体系外转移.
图 4(b)中硝酸盐氮的质量浓度在前20 min迅速下降, 随后缓慢回升, 这可能与生物炭电极对液体中硝酸盐氮的吸附有关.表 2为生物炭对氨氮、硝酸盐氮及亚硝酸盐氮共同存在时的饱和吸附情况.
| 表 2 生物炭对不同氮盐的饱和吸附量 mg·g-1 Table 2 Saturated adsorption amount of biochar for different oxynitride |
显然, 生物炭对硝酸盐氮存在一定的吸附, 这就使得溶液中硝酸盐迅速下降, 而随着氨氮被氧化为硝酸盐氮后, 反应体系中的硝酸盐质量浓度逐渐回升.
2.3 三维电极对氨氮去除机理 2.3.1 电化学反应体系中产物变化通过构建生物炭三维电极反应器密闭系统, 分析了反应体系中液-气-固三相中产物的生消变化.由图 5(a)可以看出, 溶液中无NO2--N生成, NH3-N最终转化为NO3--N (质量浓度由0 mg/L增加到12.49 mg/L), 该结果与文献[15]报道一致.同时, 总氮质量浓度随反应时间不断减小(由100 mg/L降至73.76 mg/L).因此, 三维电极体系中NH3-N最终产物为NO3--N与含氮气相产物.为进一步确定含氮气态产物性质, 测定了反应体系中气相成分随时间变化(图 5(b)).可以看出,除N2外, 气体中未检测到其他形式的含氮气态产物如NH3, NO, N2O等, 可以排除体系可能存在的氨吹脱作用.
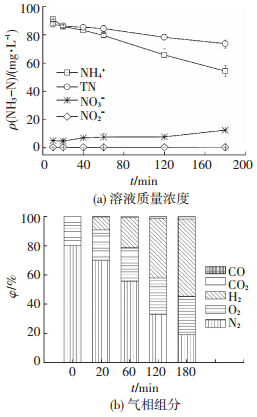
|
图 5 生物炭三维电极反应器中溶液质量浓度及气相组分随时间变化 Figure 5 Changes of component in liquid phase and gaseous phase in biochar three-dimensional electrode reactor |
由于反应过程中在极板上发生电解, 产生大量氧气和氢气, 使得反应体系中氢气(体积分数由0%增至52.98%)与氧气(体积分数由19.9%增至26.13%)增加导致氮气组分比例相对减小.但结合上文结果可以确定, 氨氮最终转化为氮气和硝酸盐.
2.3.2 氨氮转化反应途径在三维电极反应体系中, 氨氮的转化途径可能涉及两个方面:一部分NH4+被直接氧化成N2, 另一部分则通过生成的·OH间接氧化作用转化为NO3-.因为电极析氧作用可以为NH4+在体系中的电化学氧化提供条件,同时, 由于生物炭表面芳香性官能团可催化氧气向羟基自由基转化, 从而间接创造强烈的氧化环境[20-21], 反应过程如下:
| $ \begin{array}{c} 2{{\rm{H}}_2}{\rm{O}}-2{{\rm{e}}^-} \to 2 \bullet {\rm{OH}} + 2{{\rm{H}}^ + }, \\ {{\rm{O}}_2} + 2{{\rm{H}}^ + } + 2{{\rm{e}}^-} \to 2{\rm{O}}{{\rm{H}}^-} \to {{\rm{H}}_2}{{\rm{O}}_2} \to 2 \bullet {\rm{OH}}. \end{array} $ |
水中氨氮则可经过以下不同氧化反应过程转化为稳定产物[19]:
| $ \begin{array}{c} {\rm{N}}{{\rm{H}}_3}\left({{\rm{ads}}} \right) + {\rm{O}}{{\rm{H}}^-}-{{\rm{e}}^-} \to {\rm{N}}{{\rm{H}}_2}\left({{\rm{ads}}} \right) + {{\rm{H}}_2}{\rm{O, }}\\ {\rm{N}}{{\rm{H}}_2}\left({{\rm{ads}}} \right) + {\rm{O}}{{\rm{H}}^-}-{{\rm{e}}^-} \to {\rm{NH}}\left({{\rm{ads}}} \right) + {{\rm{H}}_2}{\rm{O, }}\\ {\rm{2N}}{{\rm{H}}_x}\left({{\rm{ads}}} \right) + 2x{\rm{O}}{{\rm{H}}^-}-2x{{\rm{e}}^-} \to 1{{\rm{N}}_2} \uparrow + 2x{{\rm{H}}_2}{\rm{O, }}\\ {\rm{N}}{{\rm{H}}_2}\left({{\rm{ads}}} \right) + {\rm{O}}{{\rm{H}}^-}-{{\rm{e}}^-} \to {\rm{N}}{{\rm{H}}_2}{\rm{OH, }}\\ {\rm{N}}{{\rm{H}}_2}{\rm{OH + 2O}}{{\rm{H}}^-}-{{\rm{e}}^-} \to {\rm{N}}{{\rm{O}}_2}^-+ {{\rm{H}}_2}{\rm{O}}, \\ {\rm{N}}{{\rm{O}}_2}{\rm{ + 2O}}{{\rm{H}}^-}-{{\rm{e}}^-} \to {\rm{N}}{{\rm{O}}_3}^-+ {{\rm{H}}_2}{\rm{O}}{\rm{.}} \end{array} $ |
此外, 取反应3 h后的固相, 即粒子电极(生物炭)进行解吸, 生物炭对NH4+和NO3-的吸附容量很小(分别为32.45和21.02μg/g).这进一步证实在三维电极反应器中, NH4+主要通过电催化氧化作用去除.在通电条件下生物炭作为粒子电极携带表面电荷而极性增强, 可与污染物发生短暂的结合, 从而缩短污染物传质距离, 进而增加污染物转化能力.相比单纯的吸附过程, 加载电场条件可创造更多活性结合位点和电催化反应场所.反应机理见图 6.
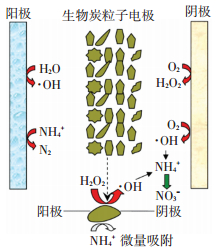
|
图 6 生物炭三维电极降解氨氮机理 Figure 6 Mechanism of ammonia removal by biochar three-dimensional electrode reactor |
对生物炭三维电极反应器系统中气-液-固相产物进行物料衡算, 可初步推断其主要化学反应过程为
| $ {\text{2}}{{\text{H}}_2}{\text{O}}\xrightarrow{{电解}}2{{\text{H}}_2} + {{\text{O}}_2}, $ | (4) |
| $ {{\text{O}}_2} + 2{{\text{H}}_2}{\text{O}} \to 4{\text{O}}{{\text{H}}^-}-4{{\text{e}}^-}, $ | (5) |
| $ 2{\text{N}}{{\text{H}}_3}\left({{\text{ads}}} \right) + 6{\text{O}}{{\text{H}}^-} \to {{\text{N}}_2}{\text{ + 6}}{{\text{H}}_2}{\text{O + 6}}{{\text{e}}^-}, $ | (6) |
| $ {\text{N}}{{\text{H}}_3}\left({{\text{ads}}} \right) + 9{\text{O}}{{\text{H}}^-} \to {\text{N}}{{\text{O}}_3}^-{\text{ + 6}}{{\text{H}}_2}{\text{O + 8}}{{\text{e}}^-}. $ | (7) |
根据气体组分监测分析, 气相组分满足V(H2):V(O2)=9:1, 而由水电解反应式(4)进行气相组分衡算, 可知电解产生的氧气被消耗于反应式(5)产生OH-(羟基自由基)强氧化剂; 溶液中氮形态变化, 根据电子转移守恒与物料守恒核算得知, 生物炭三维电极反应器中氮转化满足反应式(6)和(7), 故最终产物满足n(NO3--N):n(N2)=1:1.因此, 直接氧化与间接氧化作用均是三维电极对无氯氨氮去除主要途径.
3 结论1) 三维电极反应器能短时高效地去除水中氨氮, 在3 h内氨氮去除率可达45.72%, 高于电极材料单纯吸附的去除率3.82%, 去除过程符合一级动力学模型.
2) 提高溶液pH对氨氮去除率有显著促进, 表明三维电极处理氨氮主要是消耗OH-的化学反应过程.
3) 三维电极系统对水中NH4+的转化包括直接氧化和电化学反应产生·OH的间接氧化作用, 终产物分别为N2与NO3-, 且生成量满足n(NO3--N):n(N2)=1:1.
| [1] |
DENG Yang, ENGLEHARDT J D. Electrochemical oxidation for landfill leachate treatment[J].
Waste Management,2007, 27 (3) : 380-388.
( 0) 0)
|
| [2] |
HANSPETER Z, CRISTINA F, EBERHARD M, et al. Direct electrochemical oxidation of ammonia on graphite as a treatment option for stored source-separated urine[J].
Water Research,2015, 69 (1) : 284-294.
( 0) 0)
|
| [3] |
WANG Jianbing, YANG Chunli, DUAN Xuejiao, et al. Electrochemical oxidation of the effluent from coking wastewater treatment plants using Ti/RuO2-IrO2 electrode[J].
Applied Mechanics and Materials,2014, 587 : 587-589-629-635.
( 0) 0)
|
| [4] |
TOSHIAKI M, SHOHEI S, YU K, et al. In situ attenuated total reflection infrared spectroscopy on electrochemical ammonia oxidation over Pt electrode in alkaline aqueous solutions[J].
Langmuir,2015, 31 (42) : 11717-23.
( 0) 0)
|
| [5] |
杨慧敏, 何绪文, 何咏. 电化学氧化法处理微污染水中的氮[J].
环境化学,2010, 29 (3) : 491-495.
YANG Huimin, HE Xuwen, HE Yong. Removal of ammonia from micro-polluted water by electrochemical oxidation process[J]. Environmental Chemical,2010, 29 (3) : 491-495. (  0) 0)
|
| [6] |
丁晶, 舒欣, 赵庆良. 电化学氧化法处理氨氮废水的影响因素[J].
浙江大学学报,2013, 47 (5) : 889-895.
DING Jing, SHU Xin, ZHAO Qingliang. Influencing factors on ammonia removal by electrochemical oxidation treatment[J]. Journal of Zhejiang University,2013, 47 (5) : 889-895. (  0) 0)
|
| [7] |
MORAES P B, BERTAZZOLI R. Electrodegradation of landfill leachate in a flow electrochemical reactor[J].
Chemosphere,2005, 58 (1) : 41-46.
( 0) 0)
|
| [8] |
HRUDEY S E. Chlorination disinfection by-products, public health risk tradeoffs and me[J].
Water Research,2009, 43 (8) : 2057-2092.
( 0) 0)
|
| [9] |
褚衍洋, 杨波, 李玲玲, 等. 氨氮在两种电解质体系下的电化学氧化[J].
高校化学工程学报,2010, 24 (1) : 71-76.
CHU Yanyang, YANG Bo, LI Lingling, et al. Electrochemical oxidation of ammonia nitrogen in two aqueous electrolytes[J]. Journal of Chemical Engineering of Chinese Universities,2010, 24 (1) : 71-76. (  0) 0)
|
| [10] |
KIM K W, KIM Y J, KIM I T, et al. The electrolytic decomposition mechanism of ammonia to nitrogen at an IrO2 anode[J].
Electrochimica Acta,2005, 50 (22) : 4356-4364.
( 0) 0)
|
| [11] |
WEI Lingyong, Guo Shaohui, YAN Guangxu, et al. Electrochemical pretreatment of heavy oil refinery wastewater using a three-dimensional electrode reactor[J].
Electrochimica Acta,2010, 55 (28) : 8615-8620.
( 0) 0)
|
| [12] |
ZHAO Huazhang, SUN Yan, XU Lina, et al. Removal of acid orange 7 in simulated wastewater using a three-dimensional electrode reactor: removal mechanisms and dye degradation pathway[J].
Chemosphere,2010, 78 (1) : 46-51.
( 0) 0)
|
| [13] |
YAN Long, MA Hongzhu, WANG Bo, et al. Electrochemical treatment of petroleum refinery wastewater with three-dimensional multi-phase electrode[J].
Desalination,2011, 276 .
( 0) 0)
|
| [14] |
ISRAILIDES C J, VLYSSIDES A G, MOURAFETI V N, et al. Olive oil wastewater treatment with the use of an electrolysis system[J].
Bioresource Technology,1997, 61 (2) : 163-170.
( 0) 0)
|
| [15] |
KATSUHITO Y, SHIGERU Y, YUICHIRO S, et al. Basic study of electrochemical treatment of ammonium nitrogen-containing wastewater using Boron-doped diamond anode[J].
SEI Technical Review,2007, 65 : 71-73.
( 0) 0)
|
| [16] |
国家环境保护总局.
水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 2002 : 258 -279.
The State Environmental Protection Administration. Water and wastewater monitoring analysis method[M]. Beijing: China Environmental Science Press, 2002 : 258 -279. (  0) 0)
|
| [17] |
王程远, 胡翔, 李毅, 等. 电化学氧化法处理高质量浓度氨氮废水的研究[J].
工业用水与废水,2008, 39 (3) : 54-54.
WANG Chengyuang, HU Xiang, LI Yi, et al. Treatment of wastewater containing high concentration ammonia-natrogen by eletrochemichal oxidation process[J]. Industrial Water and Wastewater,2008, 39 (3) : 54-54. (  0) 0)
|
| [18] |
ENDO K, KATAYAMA Y, MIURA T. A rotating disk electrode study on the ammonia oxidation[J].
Electrochimica Acta,2005, 50 (11) : 2181-2185.
( 0) 0)
|
| [19] |
NIGEL J, BUNCE N J, DORIN B. Mechanism of electrochemical oxidation of ammonia[J].
Electrochimica Acta,2011, 56 (24) : 8085-8093.
( 0) 0)
|
| [20] |
WU Zucheng, CONG Yanqing, ZHOU Minghua, et al. P-nitrophenol abatement by the combination of electrocatalysis and activated carbon[J].
Chemical Engineering Journal,2005, 106 (1) : 83-90.
( 0) 0)
|
| [21] |
NAVALON S, DHAKSHINAMOOTHY A, ALVARO M, et al. Heterogeneous fenton catalysts based on activated carbon and related materials[J].
Cheminform,2012, 43 (14) : 1712-1730.
( 0) 0)
|
 2016, Vol. 48
2016, Vol. 48


