尖晶石型LiMn1.5Ni0.5O4由于理论克容量和放电平台电压较高,而成为锂离子电池正极材料中最具应用前景的材料之一[1].目前,制备LiMn1.5Ni0.5O4的方法主要有水热法、溶胶凝胶法、高温固相法以及液相共沉淀法等.高温固相法成本低廉、合成方法较简单,但制备的样品颗粒大,均匀性较差,电化学性能较差.溶胶凝胶法和水热法制备的样品一般颗粒细小,分布均匀,但合成原料一般采用有机试剂,成本较高,故难以实际应用.共沉淀法的反应过程比较容易控制,一般先制得Ni-Mn氢氧化物共沉淀,再配锂盐煅烧,最后得到产物.所制样品颗粒一般较细小且均匀,电化学性能较优[2].锂离子在正负极材料中的脱出和嵌入是锂离子电池充放电过程中发生的主要电极反应.因此,评价电极材料电化学性能的一个重要方面就是锂离子嵌脱动力学[3].表征锂离子嵌脱动力学的测试方法较多:PSCA(电位阶跃法)、CV(循环伏安法)、CPR(电流脉冲驰豫法)、EIS(电化学阻抗谱法)等[4].作为研究电极过程动力学的电化学阻抗技术具有对电化学体系扰动小且扫描频率范围广的特点,并且可根据阻抗谱图(Nyquist图)明确区分不同频率范围内影响电化学过程的控制步骤[5],已广泛应用于对各类电极体系的研究.本文采用水热辅助共沉淀法制备了LiMn1.5Ni0.5O4材料,并主要以EIS(电化学阻抗谱法)详细研究了其锂离子嵌脱动力学的影响.
1 实验 1.1 LiMn1.5Ni0.5O4正极材料的制备将NiSO4·6H2O和MnSO4·H2O按照化学计量比溶解在1∶2的乙醇和去离子水中为溶液1,将NH4HCO3按化学计量比溶解在去离子水中为溶液2,磁力搅拌溶液1、2直至固体全部溶解,然后将溶液2缓慢倒入溶液1,磁力搅拌30 min.将溶液倒入反应釜中,将反应釜放在200℃的干燥箱中反应10 h.经过离心处理得到前驱体,向前驱体中加入计算量的碳酸锂和适量的酒精,球磨6 h,经过干燥箱干燥处理得到粉末混合物.然后在马弗炉中500℃低温烧结4 h,经过研磨到预烧产物,并在800℃高温烧结12 h,最后在600℃保温6 h得到目标产物.
1.2 实验电池的组装按质量比为8∶1∶1分别称取LiNi0.5Mn1.5O4活性材料、乙炔黑和PVDF;用1-甲基-2-吡咯烷酮溶剂是混合物混合均匀,磁力搅拌3 h;然后将混合后的浆料均匀的涂覆在铝箔上;随后在真空状态下于105℃烘干,并用手动冲片机冲成直径为10 mm的圆形极片;将冲好的圆形极片用粉末压片机在4 MPa压力下压实得到用来组装模拟电池的正极极片.采用Li金属为负极,美国Cegard 2300为隔膜,1 mol·L-1的LiPF6/EC-DMC-DEC(体积比为1∶1∶1)为电解液,在充满高纯氩气的手套箱中进行实验电池组装.
1.3 测试方法采用日本岛津公司的XRD-6100型X射线衍射仪对所制备的正极样品进行XRD分析.采用日立公司SU8010型扫描电镜(SEM)观察样品的颗粒和晶粒大小、形状和分布.采用美国阿美特克公司的PARSTAT 4000型电化学工作站测试电化学阻抗谱,正弦波信号振幅为5 mV,扫描频率范围为0.01~105 Hz.正极活性物质为工作电极,参比电极和辅助电极同为Li金属.
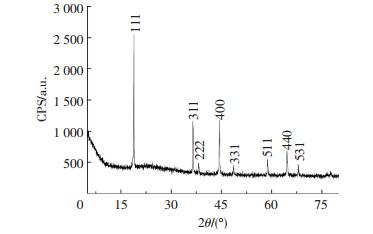
2 结果与讨论图 1为LiMn1.5Ni0.5O4材料的XRD谱图.由图 1可以看出,LiMn1.5Ni0.5O4材料在2θ为19.1°、36.8°、38.5°、44.5°、48.8°、58.9°、64.8°、68.1°、76.6°、77.6°处的衍射峰应分别归属于尖晶石LiNi0.5Mn1.5O4的(111)、(311)、(222)、(400)、(331)、(511)、(440)、(531)、(533)、(620)晶面的衍射峰.据文献报道[6],在700°C高温煅烧下合成的LiMn1.5Ni0.5O4材料会发生歧化反应而失氧,在晶面400和440侧面会出现Li1-xNixO杂质峰,该物质为化学惰性,它的存在会降低材料的容量,应该越少越好.
|
图 1 LiMn1.5Ni0.5O4材料的XRD图 Figure 1 XRD pattern of LiMn1.5Ni0.5O4 material |
从图 1中可以看出,在晶面400和440两个晶面侧面基本没有杂质峰,这说明材料在合成过程中的失氧非常少,这主要是因为材料在制备过程中增加了600℃低温退火,这个过程使得材料在结晶反应中氧元素得到了补充,Li1-xNixO杂质消失,提高了材料的性能.
图 2为LiMn1.5Ni0.5O4材料的的SEM图.从图 2中可以看出,所合成的样品成规则的球形,表面有微孔,有利于电解液与活性物质的接触.球形粒子堆积时,粒子间空隙较小,粉体堆积密度较高.因此,提高材料堆积密度和体积比容量的有效途径之一就是正极材料粉体颗粒的球形化[7].

|
图 2 LiMn1.5Ni0.5O4材料的的SEM图 Figure 2 SEM image of LiMn1.5Ni0.5O4 material |
图 3为尖晶石LiNi0.5Mn1.5O4正极材料在开路电势(OCV)时和经过20次循环后的Nyquist图,用于拟合的等效电路图如图 3的插图所示.图 3中Z′为实部阻抗,Z″为虚部阻抗.从图 3可看出,所有样品的阻抗谱图都是由高频区半圆、中频区半圆、低频区斜线3部分组成.而未进行循环时的两个半圆非常不明显,这是因为在OCV时,锂离子未发生嵌脱所致.高频的半圆代表了电池电极、活性材料颗粒以及电解液的欧姆电阻Rs,电解液的欧姆电阻(Rs)与锂离子和电子通过电解液、多孔隔膜、导线、活性材料颗粒等输运有关[8];中频段的半圆来源于电化学反应的电荷转移电阻Rct,其半径越小,表示电解质/氧化物电极界面的电荷传输阻抗越小;低频段斜线代表Li+的Warbug阻抗[9-10].此外,Rf 、Cf分别为Li+通过电极表面SEI层的阻抗和容抗,而Cdl为恒相位角元件(与双电层电容相关).

|
图 3 LiNi0.5Mn1.5O4循环前后的Nyquist图及其拟合等效电路图 Figure 3 Nyquist plots of LiMn1.5Ni0.5O4 before and after cycling and equivalent circuit used to fit the EIS |
从图 3中可以看出,经过20次循环后,LiMn1.5Ni0.5O4材料的电荷转移电阻明显增大,这可能是由于在循环过程中正极材料中过渡金属溶解所致.锂离子扩散系数(DLi)可计算为[11]:
| $ \begin{array}{*{20}{l}} {{Z_{{\rm{re}}}}={R_{{\rm{ct}}}} + {R_{\rm{s}}} + \sigma {\omega ^{-\frac{1}{2}}}, }\\ {{D_{{\rm{Li}}}}=\frac{{{R^2}{T^2}}}{{2{A^2}{n^4}{F^4}c_{{\rm{Li}}}^2{\sigma ^{{2^ \cdot }}}}}} \end{array} $ |
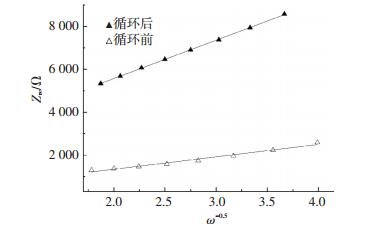
式中:R为气体常数(8.314 J·mol-1·K-1);T为绝对温度(293.15 K);A为表面积;F为法拉第常数;n为氧化过程中每个分子转移的电子数;ω为角频率;cLi为锂离子的浓度, mol/L;σ为与Zre(实部阻抗)有关的Warburg系数.Zre-ω-1/2关系图如图 4所示.
|
图 4 循环前后的LiNi0.5Mn1.5O4材料在低频区的Zre-ω-1/2关系 Figure 4 Graph of Zre plotted against ω-1/2 at low-frequency region of LiMn1.5Ni0.5O4 before and after cycling |
通过式(2)计算得到,循环前后的LiNi0.5Mn1.5O4正极材料的锂离子扩散系数分别为7.89×10-17 cm2·s-1和8.28×10-18 cm2·s-1,扩散系数明显下降.HF与LiNi0.5Mn1.5O4 将会发生如下反应[12]:
| $ \begin{array}{l} 4HF + 2LiN{i_{0.5}}M{n_{1.5}}{O_4} \to \\ 3N{i_{0.5}}M{n_{0.75}}{O_2} + 0.25Ni{F_2} + 0.75Mn{F_2} + 2LiF + 2{H_2}o. \end{array} $ |
因此,LiNi0.5Mn1.5O4溶解产生的NiF2、LiF及MnF2会沉积在活性物质表面,阻碍了锂离子的迁移,导致电荷转移电阻增大,锂离子扩散系数减小,进而电子电导率和离子电导率下降.
为了进一步揭示LiNi0.5Mn1.5O4正极材料的锂离子嵌锂动力学,图 5给出了LiNi0.5Mn1.5O4正极材料在不同温度下的电化学阻抗谱图,拟合电路图如图 3中的插图所示.表 1给出了EIS谱的一些拟合结果.锂离子扩散系数(DLi)计算,Zre-ω-1/2关系图如图 6所示.计算的锂离子扩散系数如表 1所示.

|
注:彩图见电子版(http://hit.alljournals.cn)(2016年第8期) 图 5 LiMn1.5Ni0.5O4在不同温度下的Nyquist图 Figure 5 Nyquist plots of LiMn1.5Ni0.5O4 at different temperatures |
| 表 1 不同温度下测试的LiNi0.5Mn1.5O4的EIS谱的部分拟合结果及计算的锂离子扩散系数 Table 1 Partial fitting results of EIS and lithium-ion diffusion coefficients of LiMn1.5Ni0.5O4 measured at different temperatures |

|
注:彩图见电子版(http://hit.alljournals.cn)(2016年第8期) 图 6 不同温度下LiMn1.5Ni0.5O4在低频区的Zre-ω-1/2关系 Figure 6 Graph of Zre plotted against ω-1/2 at low-frequency region of LiMn1.5Ni0.5O4 at different temperatures |
从表 1可以看出,随着温度的升高,LiNi0.5Mn1.5O4材料具有更大的SEI (solid electrolyte interphase)膜层阻抗Rf.根据SEI模型及原理,SEI膜层阻抗与SEI膜的电导率ρ有如下关系[13]
| $ {R_f}=\frac{{\rho l}}{S}. $ |
式中:S为电极表面积,l为SEI膜层厚度.假设LiNi0.5Mn1.5O4在温度升高过程中ρ、S变化较小且可忽略,则说明温度升高后,SEI膜的厚度也增大.这可能是因为温度升高后LiNi0.5Mn1.5O4材料的溶解速度加快,从而导致SEI膜的厚度增大,因此这也是LiNi0.5Mn1.5O4材料高温性能差的原因.由于溶液电阻Rs 随温度变化的幅度很小,因此在电池循环过程中,欧姆电阻可被视为一个可以忽略的区域[14].这是由于在电池的储存过程中,电解液的锂离子的浓度基本不随存储温度的变化而变化,且电极材料中锂离子并不影响电解液的电导率[15].相对于20℃测试的结果(图 3循环前的阻抗谱图为20℃测试的结果),电荷转移电阻Rct明显增大和锂离子扩散系数明显减小,温度升高至30℃后,Rct明显减小,DLi明显增大.这可能是因为温度较低时,没有锂离子嵌入过程,SEI膜的形成导致LiNi0.5Mn1.5O4材料的电子电导率的下降,因此具有较大的电荷转移电阻和较小的锂离子扩散系数.随着温度的升高,电解液逐渐进入LiNi0.5Mn1.5O4的晶格,可能会导致材料自放电的加剧,进而导致少量锂离子嵌入,进而降低了电荷转移电阻并增大了锂离子扩散系数.但随着温度升高,电荷转移电阻逐步增大,Li+扩散系数也逐渐减小,这可能是由于温度升高后,SEI膜的厚度增大,从而导致了电荷转移电阻的增大,锂离子扩散系数减小.此外,高温下碳酸酯体系的电解液稳定性较差,含有LiPF6电解质盐和EC、DMC溶剂的电解液,在高温下会一系列的复杂热分解反应.此外,DMC与LiPF6 的分解产物PF5 同样发生了系列化学反应,释放大量反应热与气体[16-17],并导致SEI膜在逐渐增厚,从而进一步增大了电荷转移电阻Rct,降低了锂离子扩散系数.
3 结论1)采用水热辅助共沉淀法成功制备了尖晶石型LiNi0.5Mn1.5O4正极材料.所合成的LiNi0.5Mn1.5O4成规则的球形,表面有微孔,粒径分布窄,有利于电解液的与活性物质的接触.
2)在循环过程中,LiNi0.5Mn1.5O4溶解产生的氟化物会沉积在活性物质表面,阻碍了锂离子的迁移,导致电荷转移电阻增大,锂离子扩散系数减小,进而电子电导率和离子电导率下降.温度升高后LiNi0.5Mn1.5O4材料的溶解速度加快,
3)从而导致SEI膜的厚度增大.在电池存储过程中,电解液的锂离子的浓度几乎不随存储温度变化而变化,电极材料中锂离子的浓度并不影响电解液的电导率.但是,电荷转移电阻逐渐增大,锂离子扩散系数逐渐减小.
| [1] |
邓海福, 聂平, 申来法, 等. 锂离子电池用高电位正极材料LiNi0.5Mn1.5O4[J].
化学进展,2014, 26 (6) : 939-949.
DOI: 10.7536/PC131160 DENG Haifu, NIE Ping, SHEN Laifa, et al. High voltage spinel-structured LiNi0.5Mn1.5O4 as cathode materials for Li-ion batteries[J]. Progress in Chemistry,2014, 26 (6) : 939-949. DOI: 10.7536/PC131160 (  0) 0)
|
| [2] |
SANTHANAM R, RAMBABU B. Research progress in high voltage spinel LiNi0.5Mn1.5O4 material[J].
Journal of Power Sources,2010, 195 (17) : 5442-5451.
DOI: 10.1016/j.jpowsour.2010.03.067 ( 0) 0)
|
| [3] |
伊廷锋, 朱彦荣, 沈浩宇, 等. Mn2+掺杂对LiFePO4正极材料结构、性能及嵌锂动力学的影响[J].
哈尔滨工业大学学报,2013, 45 (7) : 121-125.
DOI: 10.11918/j.issn.0367-6234.2013.07.022 YI Tingfeng, ZHU Yanrong, SHEN Haoyu, et al. Effects of Mn2+ doping on structure, performance and kinetic of lithium-ion insertion of LiFePO4 positive-electrode material[J]. Journal of Harbin Institute of Technology,2013, 45 (7) : 121-125. DOI: 10.11918/j.issn.0367-6234.2013.07.022 (  0) 0)
|
| [4] |
丁燕怀, 张平, 高德淑. 测定Li+扩散系数的几种电化学方法[J].
电源技术,2007, 31 (9) : 741-744.
DING Yanhuai, ZHANG Ping, GAO Deshu. Several electrochemical methods for measurement of chemical diffusion coefficient of lithium-ion[J]. Chinese Journal of Power Sources,2007, 31 (9) : 741-744. (  0) 0)
|
| [5] |
朱彦荣, 伊廷锋, 岳彩波, 等. LiAl0.05Mn1.95O4正极材料锂离子嵌脱动力学研究[J].
哈尔滨工业大学学报,2009, 41 (3) : 165-168.
ZHU Yanrong, YI Tingfeng, YUE Caibo, et al. Kinetics of lithium ion insertion-extraction forLiAl0.05Mn1.95O4 cathodev material[J]. Journal of Harbin Institute of Technology,2009, 41 (3) : 165-168. (  0) 0)
|
| [6] |
HOWELING A, GLATTHAAR S, NOTZEL D, et al. Evidence of loss of active lithium in titanium-doped LiNi0.5Mn1.5O4/graphite cells[J].
Journal of Power Sources,2015, 274 : 1267-1275.
DOI: 10.1016/j.jpowsour.2014.10.199 ( 0) 0)
|
| [7] |
应皆荣, 高剑, 姜长印, 等. 控制结晶法制备球形锂离子电池正极材料的研究进展[J].
无机材料学报,2006, 21 (2) : 291-297.
DOI: 10.3321/j.issn:1000-324X.2006.02.005 YING Jirong, GAO Jian, JIANG Changyin, et al. Research and development of preparing spherical cathode materials for lithium ion batteries by controlled crystallization method[J]. Journal of Inorganic Materials,2006, 21 (2) : 291-297. DOI: 10.3321/j.issn:1000-324X.2006.02.005 (  0) 0)
|
| [8] |
庄全超, 徐守冬, 邱祥云, 等. 锂离子电池的电化学阻抗谱分析[J].
化学进展,2010, 22 (6) : 1044-1057.
ZHUANG Quanchao, XU Shoudong, QIU Xiangyun, et al. Diagnosis ofelectrochemical impedance spectroscopy in lithium ion batteries[J]. Progress in Chemistry,2010, 22 (6) : 1044-1057. (  0) 0)
|
| [9] |
WANG G G, ZHAN J Q, CAO C N, et al. Physical properties and electrochemical performance of LiMn2O4 cathode materials prepared by a precipitation method[J].
Journal of Solid State Electrochemistry,2005, 9 (7) : 524-530.
DOI: 10.1007/s10008-004-0607-9 ( 0) 0)
|
| [10] |
CUI Wenyu, AN Maozhong, YANG Peixia, et al. Vinylene carbonate additive for EMITFSI-based electrolyte for Li/LiFePO4 batteries[J].
Journal of Harbin Institute of Technology (New Series),2011, 18 (5) : 44-48.
( 0) 0)
|
| [11] |
CHOU S L, WANG J Z, LIU H K, et al. Rapid synthesis of Li4Ti5O12 microspheres as anode materials and its binder effect for lithium-ion battery[J].
Journal of Physical Chemistry C,2011, 115 (32) : 16220-16227.
DOI: 10.1021/jp2039256 ( 0) 0)
|
| [12] |
GAO Xuanwen, DENG Yuanfu, WEXLER D, et al. Improving the electrochemical performance of the LiNi0.5Mn1.5O4 spinel by polypyrrole coating as a cathode material for the lithium-ion battery[J].
Journal of Materials Chemistry A,2015, 3 (1) : 404-411.
DOI: 10.1039/C4TA04018J ( 0) 0)
|
| [13] |
JAFTA C J, OZOEMENA K I, MATHE M K, et al. Synthesis, characterisation and electrochemical intercalation kinetics of nanostructured aluminium-doped Li[Li0.2Mn0.54Ni0.13Co0.13]O2 cathode material for lithium ion battery[J].
Electrochimica Acta,2012, 85 : 411-422.
DOI: 10.1016/j.electacta.2012.08.074 ( 0) 0)
|
| [14] |
FEY G T K, LU C Z, KUMAR T P. Preparation and electrochemical properties of high-voltage cathode materials, LiMyNi0.5-yMn1.5O4 (M=Fe, Cu, Al, Mg; y=0-0.4)[J].
Journal of Power Sources,2003, 115 (2) : 332-345.
DOI: 10.1016/S0378-7753(03)00010-7 ( 0) 0)
|
| [15] |
朱彦荣, 夏继才, 伊廷锋, 等. 温度对LiMn2O4 正极材料嵌锂动力学的影响[J].
电池工业,2010, 15 (4) : 202-204.
DOI: 10.3969/j.issn.1008-7923.2010.04.003 ZHU Yanrong, XIA Jicai, YI Tingfeng, et al. Effect of temperature on kinetics of lithium ion insertion for Li-ion battery positive electrode material[J]. Chinese Battery Industry,2010, 15 (4) : 202-204. DOI: 10.3969/j.issn.1008-7923.2010.04.003 (  0) 0)
|
| [16] |
胡传跃, 李新海, 郭军, 等. 高温下锂离子电池电解液与电极的反应[J].
中国有色金属学报,2007, 17 (4) : 629-635.
DOI: 10.3321/j.issn:1004-0609.2007.04.022 HU Chuanyue, LI Xinhai, GUO Jun, et al. Reactions between electrolyte and electrode of lithium ion batteries at elevated temperature[J]. The Chinese Journal of Nonferrous Metals,2007, 17 (4) : 629-635. DOI: 10.3321/j.issn:1004-0609.2007.04.022 (  0) 0)
|
| [17] |
尹成果, 马玉林, 程新群. 锂离子电池高温电解液[J].
化学进展,2013, 25 (1) : 54-59.
DOI: 10.7536/PC120630 YIN Chengguo, MA Yulin, CHENG Xinqun, et al. Elevated-temperature electrolytes for li-ion batteries[J]. Progress in Chemistry,2013, 25 (1) : 54-59. DOI: 10.7536/PC120630 (  0) 0)
|
 2016, Vol. 48
2016, Vol. 48


