2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨 150090;
3. 绿色化工技术重点实验室(哈尔滨理工大学),哈尔滨 150040;
4. 哈尔滨工业大学 科学与工业技术研究院,哈尔滨 150090;
5. 山东建筑大学 市政与环境工程学院,济南 250101
2. State Key Laboratory of Urban Water Resource and Environment (Harbin Institute of Technology), Harbin 150090, China;
3. Key Laboratory of Green Chemical Engineering and Technology of College of Heilongjiang Province (Harbin University of Science and Technology), Harbin 150040, China;
4. School of Science and Industrial Technology, Harbin Institute of Technology, Harbin 150090, China;
5. School of Municipal and Environmental Engineering, Shandong Jianzhu University, Jinan 250101, China
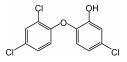
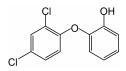
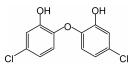
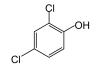
三氯生(TCS)是羟二乙醚的氯化衍生物质,其化学名称为2, 4, 4-三氯-2-羟基-二苯醚,近几十年来广泛用于护理用品(如肥皂、牙膏、护肤品等)、医疗防腐剂和杀菌剂、日用产品(如鞋袜、塑料厨具、家用洗涤剂等),越来越多的TCS在环境样品甚至是母乳中被检测出来,美国30个洲有80多条河流中检测出TCS[1-2].TCS的辛醇-水分配系数(log Kow)和有机碳-水分配系数(log Koc)分别为4.8和4.0,这表明TCS容易被生物体细胞吸收,而且其对人类乳腺癌细胞产生雌激素和雄激素效应,甚至导致人体正常干细胞的DNA断裂损伤[2-3].因此,TCS对人体健康有着不容忽视的危害性,针对水体中TCS去除技术的研究非常必要.
近年来,基于羟基自由基(HO ·)的高级氧化工艺被广泛应用到水处理工艺中.HO ·具有较高的氧化还原电位(E0=2.73 V vs NHE),能够使有机物化学键断裂甚至矿化,从而达到去除有机物的目的[4-5].紫外(UV, 254 nm)催化H2O2已被证明能够有效地产生HO ·并且已经在水厂得到应用,目前针对UV/H2O2降解TCS的研究尚少见报道.本文主要研究H2O2投加量、TCS浓度和天然有机物浓度(NOM)对TCS降解动力学的影响,并利用动力学模型进行模拟,利用液相-质谱联用仪(LC-MS/MS)对UV/H2O2降解TCS的产物进行分析测定,推测其反应机理.
1 实验 1.1 试剂三氯生、N, N-二乙基-对苯二胺(DPD)、过氧化氢酶(POD)、腐殖酸(NOM)均为ACS级,购自Sigma公司;过氧化氢(H2O2, 质量分数35%)、磷酸一氢钠、磷酸二氢钠为分析纯级,购自国药集团化学试剂有限公司;甲醇、乙腈为色谱纯;其余试剂均为分析纯,试剂与反应液均用去离子水配置(Milli-pore, 18 MΩ·cm).
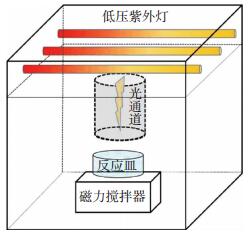
1.2 仪器设备紫外装置包括光源、反应容器和磁力搅拌器(图 1).光源采用低压紫外汞灯(GPH212T5L/4,Heraeus,254 nm);紫外光通过圆形管道垂直摄入反应皿中,光强为0.8×10-7 Einstein · L-1 · s-1,反应皿容量为100 mL,光程为4 cm.
|
图 1 紫外辐射装置 Figure 1 Experimental device used for the UV photolysis |
TCS利用液相色谱(HPLC, Waters 2695)进行检测,色谱柱为symmol/Letry C18 (4.6×150 mmol/L, 5 μm, Waters),检测器型号为Waters 2998,流动相采用甲醇和1‰乙酸(60:40),流速为1.0 mL/min,进样体积为100 μL,检测波长为230 nm.采用DPD/POD方法检测H2O2浓度[6],采用pH检测器(UB-7, Denver)检测溶液pH,采用TOC检测仪(Multi 3100 N/C,Shimadzu)检测总有机碳(TOC).
TCS的氧化产物利用Agilent 1260高效液相色谱进行检测.色谱柱为Agilent Poroshell 120 EC C18 (4.6×150 mmol/L, 5 μm),流动相为乙腈(A)和超纯水(B),流速为0.2 mL/min,流动相梯度为A在35 min内由10%增加到90%,并保持35 min,然后在0.1 min内降至10%,并保持10 min.进样体积为10 μL.离子源为电喷雾负离子模式(ESI-),利用母离子扫描模式进行检测,离子源电压和温度分别为-4 500 V和500 ℃,氮气流速为50 mL/min,扫描范围为50~500 u,扫描速度为1 000 u/s,去簇电压和入口电压分别为-70和-10 V,碰撞电压为-20~-100 V.
1.4 实验方法配置100 mL含有一定浓度的TCS和H2O2的溶液放置到紫外装置内,通过紫外遮光板起始和终止反应,每次取样1 mL,用10 μL 0.5 mol/L的抗坏血酸终止氧化剂,立即用液相色谱进行检测.
1.5 模型介绍研究模型基于稳态动力学假设[7],包括:TCS的降解是由于HO ·和紫外的直接光解作用;在反应时间内H2O2的浓度变化可忽略;HO ·生成速率与消耗速率相当.
TCS在UV/H2O2体系中浓度随时间的变化可以表示为
| $ {\left. {\frac{{{\rm{ - d[TCS]}}}}{{{\rm{d}}t}}} \right|_{t = 0}} = {r_{{\rm{uv,TCS}}}} + {k_{{\rm{HO\cdot,TCS}}}}{[{\rm{HO\cdot]}}_{{\rm{ss}}}}{{\rm{[TCS}}]_0}. $ | (1) |
式中:[TCS]0为TCS初始浓度,ruv, TCS为紫外直接光解速率,kHO ·, TCS为TCS和HO ·反应的二级速率常数,[HO ·]ss为HO ·的稳态浓度.
ruv, TCS可由式(2)~(4)进行计算:
| $ {k_{{\rm{uv,TCS}}}} = {\varphi _{{\rm{TCS}}}}{I_0}{f_{{\rm{TCS}}}}(1 - {{\rm{e}}^{ - {A_0}}}), $ | (2) |
| $ \begin{array}{l} {A_0} = {\rm{ }}2.303b({\varepsilon _{{\rm{TCS}}}}{\left[ {{\rm{TCS}}} \right]_0} + {\varepsilon _{{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}}}{[{{\rm{H}}_{\rm{2}}}{{\rm{O}}_2}]_0} + \\ \;\;\;\;\;\;\;\;{\varepsilon _{{\rm{NOM}}}}{[{\rm{NOM}}]_0}){\rm{ }}, \end{array} $ | (3) |
| $ {f_{{\rm{TCS}}}} = \frac{{2.303b{\varepsilon _{{\rm{TCS}}}}{{[{\rm{TCS}}]}_0}}}{{{A_0}}}. $ | (4) |
式中:φTCS为TCS的量子产率0.34 mol·Einstein-1[8],I0为光照强度0.8×10-7 Einstein·L-1·s-1,fTCS为TCS的紫外吸收比例,b为紫外光路长度4 cm,εTCS、εH2O2和εNOM分别为TCS、H2O2和NOM在紫外254 nm波长下的摩尔吸光系数,分别为1 795 L · mol-1 · cm-1[8]、18 L · mol-1 · cm-1[7]和0.11 L · mg-1 · cm-1.
体系中[HO ·]ss可由式(5)~(8)计算得
| $ {\left[ {HO\cdot} \right]_{{\rm{ss}}}} = \frac{{{r_{{\rm{HO\cdot}}}}}}{{\sum {{k_{{\rm{HO\cdot,S}}}}} {{[{\rm{S}}]}_0}}}. $ | (5) |
式中:rHO ·为HO ·的生成速率,ΣkHO·, S[S]0为水体中自由基捕获剂浓度与其反应二级速率常数乘积的加和.
| $ {r_{{\rm{HO\cdot}}}} = {\varphi _{{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}}}{I_0}{f_{{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}}}(1 - {{\rm{e}}^{ - {A_0}}}), $ | (6) |
| $ {f_{{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}}} = \frac{{2.303b{\varepsilon _{{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}}}{{[{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}]}_0}}}{{{A_0}}}, $ | (7) |
| $ \begin{array}{l} \sum {{k_{{\rm{HO\cdot,S}}}}} {[{\rm{S}}]_0} = {k_{{\rm{HO\cdot,TCS}}}}{[{\rm{TCS}}]_0} + {k_{{\rm{HO\cdot,}}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}}}{\left[ {{{\rm{H}}_{\rm{2}}}{{\rm{O}}_2}} \right]_0} + \\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{k_{{\rm{HO\cdot,NOM}}}}{\left[ {{\rm{NOM}}} \right]_0} + {k_{{\rm{HO\cdot,}}{{\rm{H}}_{\rm{2}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}^ - }}[{{\rm{H}}_{\rm{2}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}^ - ] + \\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{k_{{\rm{HO\cdot,HP}}{{\rm{O}}_{\rm{4}}}^{{\rm{2 - }}}}}[{\rm{HP}}{{\rm{O}}_{\rm{4}}}^{2 - }]. \end{array} $ | (8) |
式中:φH2O2为过氧化氢的量子产率(0.5 mol·Einstein-1)[7],fH2O2为过H2O2的紫外吸收比例.
通过上述式中得到的kuv, TCS和[HO ·]ss,利用式(1)可以得到TCS的表观一级降解速率.模型中所用的速率常数见表 1.
| 表 1 UV/H2O2降解三氯生主要反应 Table 1 Principal reactions of TCS degradation by UV/H2O2 process |
由图 2可知,紫外直接光解TCS的表观速率为4.06×10-4 s-1,投加H2O2能够显著增加TCS的降解效率.当H2O2投加量为1 mmol/L时,TCS降解的表观速率增加到2.51×10-3 s-1,但是H2O2投加量大于1 mmol/L时,TCS的降解表观速率会随着H2O2投加量的增加而降低,例如当H2O2投加量为5 mmol/L时,TCS降解的表观速率降为1.91×10-3 s-1.模型结果表明,当H2O2投加量小于1 mmol/L时,HO ·氧化TCS的一级表观速率与H2O2投加量成正相关,这主要是由于H2O2投加量的增加能够显著提高体系中HO ·的稳态浓度.紫外直接光解TCS的速率随着H2O2的增加而降低,这是由于H2O2对光能的竞争作用.此外模拟结果显示,当H2O2投加量大于1 mmol/L时,HO ·对TCS的降解贡献也随H2O2的增加而降低,这主要是由于HO ·与H2O2反应的二级速率常数高达2.7×107 L·mol-1·s-1[9],因此,H2O2投加量大时其对HO ·的捕获作用更强.
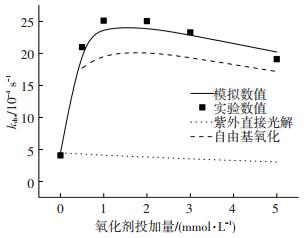
|
实验条件:[TCS]=1 μmol/L,pH=7,I0=0.8×10-7 Einstein·L-1·s-1 图 2 H2O2投加量对三氯生降解效率的影响 Figure 2 Impacts of H2O2 dosages on the degradation efficiency of TCS |
由图 3可知,TCS浓度的增加会降低其在UV/H2O2体系中的降解速率,当TCS的浓度由1 μmol/L增加到5 μmol/L时,TCS降解的表观速率由2.51×10-3 s-1降到1.59×10-3 s-1.模拟计算结果显示,TCS初始浓度的增加对与其紫外直接照射的速率影响不大,但其浓度的增加使得体系中HO ·被更多地消耗导致HO ·的稳态浓度降低,从而降低了TCS的降解速率.如当TCS的浓度由1 μmol/L增加到5 μmol/L时,式(8)得到的自由基捕获能力(ΣkHO ·, S[S]0)由32 751增加到54 351,而式(5)得到的HO ·稳态浓度由3.702×10-13降到2.161×10-13 mol/L.
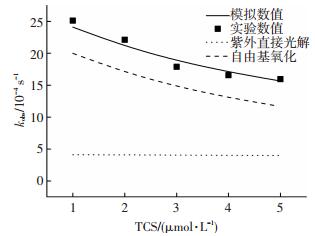
|
实验条件:[H2O2]=1 mmol/L,pH=7,I0=0.8×10-7 Einstein·L-1·s-1 图 3 三氯生浓度对其降解效率的影响 Figure 3 Impacts of TCS concentration on the degradation efficiency of TCS |
水体中天然腐殖酸(NOM)的存在是影响高级氧化技术氧化效率的关键因素.由图 4可知,NOM对UV/H2O2降解TCS的抑制作用较显著.当NOM投加量由0.1 mg·L-1增加到2 mg·L-1时,TCS降解的表观速率由2.418×10-3 s-1迅速降到0.706×10-3 s-1.模拟结果显示, 随着NOM质量浓度的增加,TCS在UV/H2O2体系中的直接光解作用逐渐降低,其光解速率由0.392×10-3 s-1降到0.181×10-3 s-1,而且HO ·对TCS的降解效率也大大被抑制.这主要是由于NOM本身具有一定的吸收紫外的能力,该实验中所用NOM的摩尔吸光系数为0.11 L · mg-1 · cm-1,从而NOM的投加使得催化H2O2和直接光解TCS的光子数减少;另一方面,NOM捕获HO ·的二级反应速率常数为1.4×104 L ·mg-1 · s-1[10],因此,水中NOM的存在降低了该体系中HO ·的稳态浓度,体系中没有NOM时,通过模拟得到的HO ·的稳态浓度为3.702×10-13 mol/L,当NOM质量浓度为2 mg·L-1时,通过模拟得到的HO ·的稳态浓度减少为0.880×10-13 mol/L.
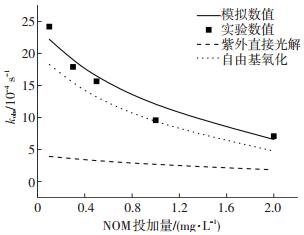
|
实验条件:[TCS]=1 μmol/L, [H2O2]=1 mmol/L,pH=7, I0=0.8×10-7 Einstein·L-1·s-1 图 4 NOM质量浓度对三氯生降解效率的影响 Figure 4 Impacts of NOM concentration on the degradation efficiency of TCS |
图 5为水体pH对UV/H2O2氧化体系降解TCS的影响.可以看出,当pH由5增加到8时,TCS的降解速率有少许降低,由2.466×10-3 s-1降到2.239×10-3 s-1.由于H2O2的pKa为11.62,在pH5~8范围内,H2O2的形态浓度保持不变,此外体系中离子强度的变化不会影响HO ·对TCS的降解[12],因此,理论上TCS的降解在pH 5~8范围内应该不受pH影响.而本研究中TCS的降解速率在pH5~8范围内随pH增加而降低的原因可能是体系中H2PO4-和HPO42-的浓度变化.由表 1中编号8和9可知,HO ·与H2PO4-和HPO42-反应的二级速率常数分别为2.0×104和1.5×105 L·mol-1·s-1,当pH由5增加到8时,体系中HPO42-的浓度由3.131×10-5 mol/L增加到4.315×10-3 mol/L,从而体系中背景成份对HO ·的捕获增加.但是当水体pH增加到9时,TCS的降解速率突然增加到2.691×10-3 s-1.这主要是由于TCS的pKa为8.21,当pH为9时TCS以去质子化形势存在,而其摩尔吸光系数和光量子产率变为4 590 L·mol-1·cm-1和0.25 mol·Einstein-1,HO ·与其反应的二级速率常数也增加到1.0×1010 L·mol-1·s-1.模拟结果也显示当pH为9时,紫外直接光解和HO ·氧化TCS的表观速率分别为7.630×10-4和3.206×10-3 s-1, 而pH为5时,其仅为4.110×10-4和2.015×10-3 s-1.
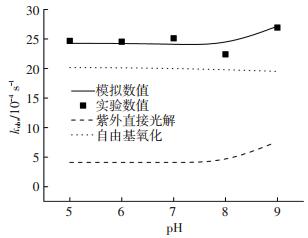
|
实验条件:[TCS]=1 μmol/L, [H2O2]=1 mmol/L,I0=0.8×10-7 Einstein·L-1·s-1 图 5 pH对三氯生降解效率的影响 Figure 5 Impacts of pH on the degradation efficiency of TCS |
利用三重四级杆串联线性离子阱液相质谱联用仪(LC-MS/MS)对UV/H2O2氧化降解TCS产物进行分析,采用母离子扫描模式(PIS approach)进行检测[11],质谱图如图 6所示.
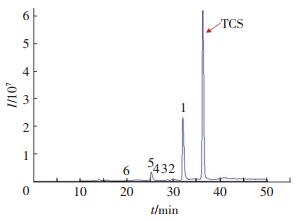
|
实验条件:[TCS]=10 μmol/L, [H2O2]=3 mmol/L,I0=0.8×10-7 Einstein·L-1·s-1 图 6 LC-MS/MS测定UV/H2O2降解TCS色谱图 Figure 6 HPLC/ESI-QqQMS PIS chromatogram of a sample containing TCS treated by UV/H2O2 |
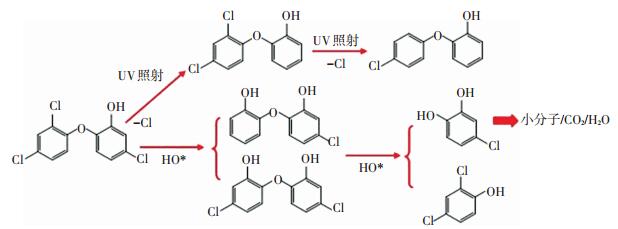
结合保留时间、产物的质荷比、子离子数等信息推测TCS和6个产物(图 6,1~6)的结构式,结果如表 2所示.研究结果表明,UV/H2O2氧化降解TCS的一系列反应主要包括脱氯反应和羟基化反应,推测TCS在UV/H2O2体系中的降解反应路径为图 7.可以看出,UV/H2O2能够氧化TCS脱氯产生小分子物质,并有效地去除其毒性.
| 表 2 UV/H2O2降解TCS的氧化产物 Table 2 Detection of oxidation products of TCS treated by UV/H2O2 |
|
图 7 UV/H2O2降解TCS反应路径 Figure 7 Proposed reaction pathway of TCS decay by UV/H2O2 process |
1) 相对于紫外直接作用,UV/H2O2能够更有效地降解TCS,利用动力学模型可以对TCS在该氧化体系中降解的表观速率进行模拟.H2O2投加量的增加能够促进TCS的降解,但是当H2O2投加量大于1 mmol/L时,由于H2O2对HO ·的捕获作用增强,继续增加H2O2投加量反而会使TCS的降解效率降低.
2) 水中TCS浓度的增加会使得氧化体系中HO ·的稳态浓度降低,而NOM的存在一方面因为其遮光作用降低了TCS的直接光解效率,另一方面由于NOM对HO ·的竞争作用,其对TCS的降解有较强的抑制作用.
3) TCS去质子化后在UV/H2O2体系中的降解效率会显著提高.UV/H2O2能够通过直接光解和HO ·的氧化使TCS发生脱氯反应和羟基化反应,从而能够有效地降低TCS毒性.
| [1] |
徐海丽, 林毅, 孙倩, 等. 三氯生的生态效应及其在环境中的迁移转化[J].
生态毒理学报, 2012, 7 (3) : 225-233.
XU Haili, LIN Yi, SUN Qian, et al. Ecological effects of triclosan and its transport and transformation in the environment[J]. Asian Journal of Ecotoxicology, 2012, 7 (3) : 225-233. |
| [2] |
李林朋, 马慧敏, 胡俊杰, 等. 三氯生和三氯卡班对人体肝细胞DNA损伤的研究[J].
生态环境学报, 2010 (12) : 2897-2901.
LI Linpeng, MA Huimin, HU Junjie, et al. The genotoxicity of triclosan and triclocarban in human hepatocyte L02 cell[J]. Ecology and Environmental Sciences, 2010 (12) : 2897-2901. |
| [3] |
唐丽, 孙秀发, 张军. 三氯生对大鼠脂肪代谢的影响[J].
中国药理学与毒理学杂志, 2002 (1) : 70-74.
TANG Li, SUN Xiufa, ZHANG Jun. Effects of triclosan on fat metabolism in rats[J]. Chinese Journal of Pharmacology and Toxicology, 2002 (1) : 70-74. |
| [4] | CHEN X, RICHARD J, LIU Y, et al. Ozonation products of triclosan in advanced wastewater treatment[J]. Water Research, 2012, 46 (7) : 2247-2256. DOI: 10.1016/j.watres.2012.01.039 |
| [5] |
陈忠良.三氯生光降解产物分析[D].无锡:江南大学, 2008.
CHEN Zhongliang. Analysis of the photodegradation products of triclosan[D]. Wuxi: Jiang Nan University, 2008. |
| [6] | BADER H S V H J. Photometric method for the determination of low concentrations of hydrogen peroxide by the peroxidase catalyzed oxidation of N, N-diethyl-p-phenylenediamine (DPD)[J]. Water Research, 1988, 22 (9) : 1109-1115. DOI: 10.1016/0043-1354(88)90005-X |
| [7] | CRITTENDEN J C, HU S, HAND D W, et al. A kinetic model for H2O2/UV process in a completely mixed batch reactor[J]. Water Research, 1999, 33 (10) : 2315-2328. DOI: 10.1016/S0043-1354(98)00448-5 |
| [8] | CARLSON J C, STEFAN M I, PARNIS J M, et al. Direct UV photolysis of selected pharmaceuticals, personal care products and endocrine disruptors in aqueous solution[J]. Water Research, 2015, 84 : 350-361. DOI: 10.1016/j.watres.2015.04.013 |
| [9] | BUXTON G V, GREENSTOCK C L, HELMAN W P, et al. Critical Review of rate constants for reactions of hydrated electrons chemical kinetic data base for combustion chemistry. Part 3: Propane[J]. Journal of Physical and Chemical Reference Data, 1988, 17 (2) : 513. DOI: 10.1063/1.555805 |
| [10] | LUTZE H V, BIRCHER S, RAPP I, et al. Degradation of chlorotriazine pesticides by sulfate radicals and the influence of organic matter[J]. Environmental Science & Technology, 2015, 49 (3) : 1673-1680. |
| [11] | LUO C, JIANG J, MA J, et al. Oxidation of the odorous compound 2, 4, 6-trichloroanisole by UV activated persulfate: Kinetics, products, and pathways[J]. Water Research, 2016, 96 : 12-21. DOI: 10.1016/j.watres.2016.03.039 |
| [12] | ZHANG T, CHEN Y, WANG Y, et al. Efficient peroxydisulfate activation process not relying on sulfate radical generation for water pollutant degradation[J]. Environmental Science & Technology, 2014, 48 (10) : 5868-5875. |
 2017, Vol. 49
2017, Vol. 49