2. 哈尔滨工业大学 市政环境工程学院,哈尔滨 150090
2. School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China
丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)可以广泛地与植物形成共生关系,甚至在有机污染物污染的地方[1-3],并且丛枝菌根真菌可以有效地提高植物对营养物质的吸收,缓解污染物对植物的毒性[4-5].阿特拉津,又名莠去津,是一种在农、林业上广泛应用的三嗪类除草剂[6-7].由于阿特拉津使用时间长,具有土壤淋溶性,可以随地表径流进入水体,并且浸渗入地下水.作为一种潜在的人类致癌物质和内分泌干扰物质,阿特拉津在环境中的残留引起重视[7-8],亟需其污染修复方法的研发[9-10].
植物修复作为一种经济适用的原位修复技术,在有机污染物修复方面具有巨大的应用潜力[11-12].水生植物修复在水生环境除草剂污染修复上也有一定的应用[13-14].美人蕉是一种广泛应用于人工湿地中的水生植物,具有优良的脱氮除磷效能和景观适宜性,经丛枝菌根真菌接种的美人蕉在外源性污染物的植物修复领域也有一定的应用[15].高质量浓度的除草剂会对水生植物造成伤害,从而影响植物修复的效率和植物修复系统的稳定性[16].利用丛枝菌根真菌的菌根修复技术能针对性地克服微生物修复及植物修复有机污染物的不足,综合利用微生物、植物、菌根真菌及其相互作用的根际和菌(丝)围环境,可以显著地影响阿特拉津的植物提取与转运,并且影响阿特拉津在土壤中的消散与降解[17-18].前期研究结果表明,丛枝菌根真菌可以与美人蕉形成良好的共生关系,并且提高了水体中阿特拉津植物修复的去除率[19].本研究在前期工作的基础上,延长美人蕉-丛枝菌根真菌共生体系对阿特拉津降解的时间,追踪不同时间段阿特拉津的降解率,考察丛枝菌根真菌对阿特拉津降解速率和半衰期的影响,为菌根技术在阿特拉津污染修复领域的应用提供理论指导作用.
1 试验 1.1 试验材料试验于2014年5月-8月在哈尔滨工业大学城市水资源与水环境国家重点实验室面源污染防治与生态修复综合试验区进行.
供试植物:黄花美人蕉(Canna indica L. var. flava Roxb.),购于河北省安新县永信水生植物种植专业合作社,选取株高15 cm长势一致的幼苗,所用幼苗裸根培养于土壤中.
供试菌剂:丛枝菌根真菌菌剂摩西球囊霉(Funnelliformis mosseae),由黑龙江大学生命学院宋福强教授提供,此菌种保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No. 3012,以白三叶草为宿主植物,土壤、沙子、蛭石以体积比2:5:3混合作为基质进行扩繁,获得内含侵染植物根段、菌丝及孢子体的根际土作为接种菌剂,每克菌剂中含有20~25个摩西球囊霉孢子.
供试化学药品:试验用除草剂阿特拉津纯品(BR,纯度97%)购于上海一基实业有限公司,高效液相色谱分析标准品(HPLC,纯度99.0%)购于美国Sigma公司.
1.2 试验设计 1.2.1 菌根植物的培养试验采用盆栽,所用小盆直径为110 mm,高度为100 mm,采用蛭石作为植物培养基质,每个小盆中装有蛭石60 g,所用蛭石经121 ℃下高温高压蒸汽灭菌2 h,每天灭菌1次,重复3 d,以保证去除其中原本含有的丛枝菌根真菌等微生物.
试验设置不接菌的对照组(CK)和接菌的菌根组(FM)两种处理,其中对照组每盆添加经灭菌处理的丛枝菌根真菌菌剂12 g,菌根组每盆接种丛枝菌根真菌菌剂12 g.每盆中栽种一棵美人蕉幼苗,培养过程中以4倍稀释的霍格兰营养液浇灌植物,每2 d浇水1次.将所有的试验盆随机摆放在温室中,培养30 d.
1.2.2 不同处理的美人蕉对阿特拉津的降解试验将培养30 d的对照组和菌根组两组植物分别进行阿特拉津的降解试验.阿特拉津设置0,0.1,0.5,1,3,5,10,15 mg·L-1 8种不同的质量浓度,其中质量浓度0 mg·L-1为空白对照.用4倍稀释的霍格兰营养液配置相应质量浓度的阿特拉津溶液,每组3盆植物放置于装有5 L阿特拉津溶液的大盆中,所用大盆直径为300 mm,高度为145 mm,小盆放入后大盆的液面略没过小盆,每2 d补充4倍稀释的霍格兰营养液至5 L,每个质量浓度设置3组重复.降解试验为期35 d,每7 d取样一次测定水中残留的阿特拉津质量浓度,试验结束时取样测定植物株高、根长和生物量等指标.
1.3 测定方法 1.3.1 植物根系AMF侵染率的测定侵染率测定样品采样时间为接种菌剂30 d后,剪取1 cm长的根段,用酸性品红溶液染色法,于10倍显微镜下观察菌根发育状况.随机观察120条根段,采用十字交叉法计算根系菌根侵染率[20].在阿特拉津的降解试验期间,每7 d各质量浓度下的3株植物分别取部分根系,测定取样时间下各质量浓度的平均根系侵染率.
1.3.2 植物生长指标的测定株高,采用刻度软尺测量.根长,采用刻度软尺测量.生物量,将美人蕉分为地上和地下两部分,分别取部分样品放入电热恒温鼓风干燥箱内,105 ℃杀青5 min后,于70 ℃烘干24 h至恒质量,通过含水率的计算得到地上和地下部分生物量.
1.3.3 菌根效应的计算菌根效应通过菌根依赖性指数(relative mycorrhizal dependency index, IMD)计算,菌根依赖性指数计算公式[21]为
| $ {I_{{\rm{MD}}}}\left( \% \right) = ({X_{{\rm{AMF}}}} - {X_{{\rm{non - AMF}}}})/{X_{{\rm{AMF}}}} \times 100. $ |
式中:XAMF为菌根植物的生长指标,包括株高、根长和生物量;Xnon-AMF为对照组植物的生长指标,包括株高、根长和生物量.
1.3.4 水中阿特拉津质量浓度的测定从盆中取得含有阿特拉津的水样,经0.22 μm过滤后,采用高效液相色谱进行阿特拉津质量浓度测定[22].液相色谱测定的条件为:流动相为乙腈/水(体积比为6:4),流速1.0 mL·min-1,检测波长为紫外220 nm, 采用C18-BDS色谱柱(5 μm, 25×0.46 cm),柱温30 ℃.
1.3.5 水中阿特拉津残留量的拟合方法本试验中水中阿特拉津的动态降解符合一级化学反应动力学方程式ln ρ=-Kt+ln ρ0,其变形公式为ρ=ρ0e-Kt.将此公式应用于实验结果可得
| $ \rho = {k_0}{\rho _0}{{\rm{e}}^ - }^{Kt}. $ |
式中:ρ0为阿特拉津的初始质量浓度;ρ为施药后间隔t时间的阿特拉津残留量;K为消解速率常数;k0为初始质量浓度修正系数;t为施加阿特拉津后的天数.根据试验中植物对阿特拉津的降解特性,在进行方程式拟合时,低质量浓度情况下(0.1,0.5,1,3 mg·L-1),t的范围为7~35 d;高质量浓度情况下(5,10,15 mg·L-1),t的范围为14~35 d.
1.4 数据统计分析采用SPSS17.0统计软件处理实验数据,Duncan单因素方差分析比较各处理之间的差异显著性(p < 0.05为差异显著;p < 0.01为差异极显著).
2 结果与讨论 2.1 AMF对美人蕉根系的侵染丛枝菌根真菌与植物建立的共生关系的程度可以通过AMF侵染率的高低来评价.在接种菌剂30 d后,植物根系的菌根侵染达到稳定期.分别测定了对照组和菌根组的美人蕉根系菌根侵染率,由于对所用培养基质蛭石进行了灭菌处理,对照组没有菌根检出,而菌根组的菌根侵染率为(22.1±4.6)%.在进行阿特拉津降解期间,测定了菌根组不同取样时间的各质量浓度平均菌根侵染率,如图 1所示,菌根侵染率在阿特拉津施加下无明显的变化.结果表明,本试验中采用的摩西球囊霉菌剂可以与美人蕉根系形成稳定的共生关系,并且这种共生关系不受阿特拉津施加的影响.
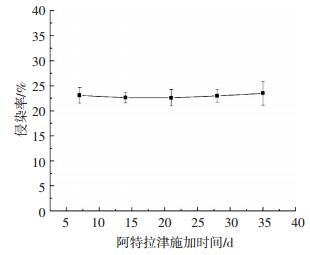
|
图 1 施加阿特拉津后的根系菌根侵染率 Figure 1 Colonization rates of root after exposure to atrazine |
阿特拉津作为一种除草剂,危害植物正常的生长,而丛枝菌根真菌具有促进植物生长和提高植物对胁迫环境适应性的能力,可以缓解阿特拉津对植物的伤害,促进植物的生长.
对不同阿特拉津质量浓度下植物的生长指标进行测定,结果如图 2、3所示.由图 2可以看出,阿特拉津的施加抑制了美人蕉的株高和根长的生长,并且随着阿特拉津质量浓度的增加,其对株高和根长抑制作用更明显.接种丛枝菌根真菌缓解了阿特拉津对美人蕉生长的抑制效应,在不同阿特拉津质量浓度下提高了2.8%~32.3%的株高和4%~30.4%的根长,并且在阿特拉津质量浓度大于0.5 mg·L-1时缓解作用显著(p < 0.05).在5 mg·L-1时,与对照组相比,菌根组显著增加了32.3%的株高和30.4%的根长,说明在阿特拉津质量浓度为5 mg·L-1时,丛枝菌根真菌的作用最明显.
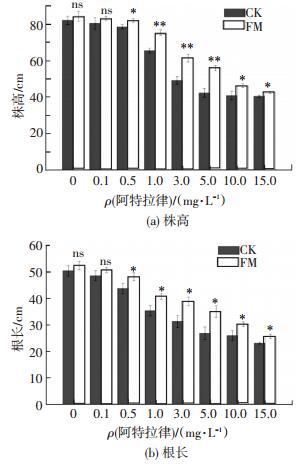
|
CK:对照组;FM:菌根组;*:p < 0.05;**:p < 0.01;ns:p > 0.05 图 2 美人蕉在不同阿特拉津质量浓度下的株高和根长 Figure 2 Shoot height and root length of Canna after exposure to different concentration of atrazine |
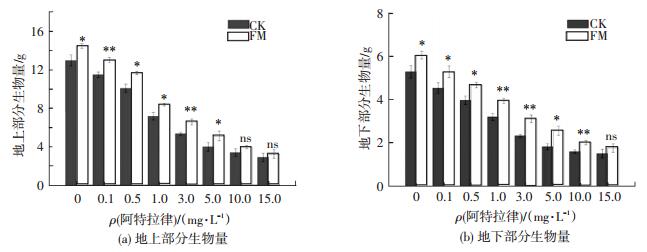
|
CK:对照组;FM:菌根组;*:p < 0.05;**:p < 0.01;ns:p > 0.05 图 3 美人蕉在不同阿特拉津质量浓度下的生物量 Figure 3 Above-and underground biomass of Canna after exposure to different concentration of atrazine |
由图 3可以看出,施加阿特拉津降低了美人蕉的地上和地下部分生物量,随着阿特拉津质量浓度的增加,美人蕉的生物量急剧减少.接种丛枝菌根真菌缓解了阿特拉津对美人蕉生物量的抑制作用,显著缓解了美人蕉生物量的减少.在不同的阿特拉津质量浓度下,与对照组相比,菌根组显著提高了11.3%~28.2%的地上部分生物量和14.6%~40.1%的地下部分生物量,并且在阿特拉津质量浓度为5 mg·L-1时,菌根组提高了28.2%的地上部分生物量和40.1%的地下部分生物量(p < 0.05),此时丛枝菌根真菌的作用最大.结果表明,丛枝菌根真菌接种对生物量的保护作用与其对株高和根长的保护作用一致.
丛枝菌根真菌对美人蕉各生长指标的影响进一步通过菌根依赖性指数来分析.如图 4所示,各生长指标的菌根效应呈现相同的趋势,随着阿特拉津质量浓度的增加,菌根依赖性指数先增加后减少,在阿特拉津质量浓度为5 mg·L-1时,菌根依赖性指数达最大值.在阿特拉津质量浓度较小时,对植物的伤害有限,菌根效应发挥不到最大程度,随着阿特拉津对植物损害的增加,菌根效应也相应增加,当阿特拉津质量浓度超过5 mg·L-1,阿特拉津对植物的伤害过于严重,而菌根效应也开始下降.结果表明,美人蕉植株的各生长指标均存在较强的菌根效应,并且在阿特拉津质量浓度为5 mg·L-1时,菌根效应达最大值.
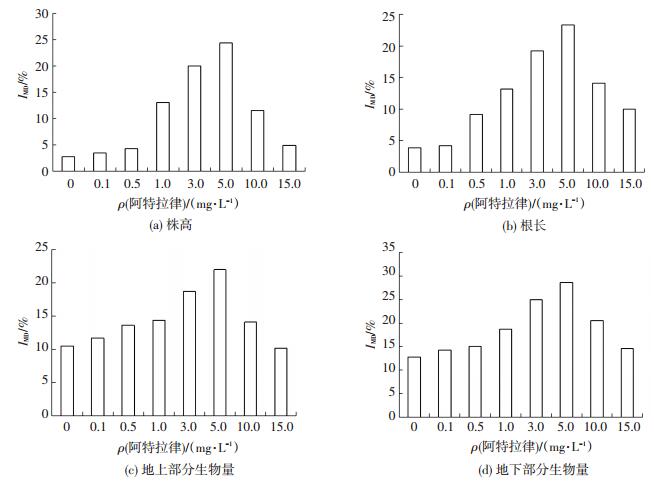
|
图 4 菌根组美人蕉各生长指标的菌根依赖性 Figure 4 IMD of growth and biomass of Canna after exposure to atrazine |
本试验中丛枝菌根真菌对生物量的影响与Huang等[18]得到的结果有差异,Huang发现在较低的阿特拉津质量浓度下,接种菌根增加了玉米根部的生物量而降低了玉米茎部的生物量.这种差异的原因很复杂,因为本试验与其所采用的丛枝菌根真菌、植物的种类和培养条件均不一样.值得说明的是本试验采用的黄花美人蕉具有位于地下的块状茎,其生物量属于地下部分生物量.Wu等报道的丛枝菌根真菌接种可以显著地提高在多环芳羟污染土壤中生长的玉米的茎、叶和根部的生物量[23],这与本试验中美人蕉生物量的菌根效应一致.本试验结果表明,接种丛枝菌根真菌可以促进美人蕉的生长,缓解阿特拉津对植物的伤害,这对植物修复在阿特拉津降解方面的应用具有重大的意义.
2.3 AMF对美人蕉植物修复阿特拉津的影响作为一种除草剂,阿特拉津对植物的毒害作用限制了植物修复在水体阿特拉津污染修复方面的应用.从前文可知,接种丛枝菌根真菌提高了美人蕉对阿特拉津的抗性,本部分通过研究美人蕉对阿特拉津的降解效能,分析接种丛枝菌根真菌对美人蕉植物修复水体中阿特拉津的影响.
本试验考察了不同质量浓度的阿特拉津在植物修复下的残留量,采用一级化学反应动力学方程拟合降解曲线,得到了降解方程,结果如图 5和表 1所示.结果表明,水体中阿特拉津污染的修复采用美人蕉植物修复是一种可行的有效方法.在阿特拉津质量浓度不高于3 mg·L-1时,美人蕉植物修复阿特拉津效果稳定,阿特拉津的半衰期在12 d左右,但是当阿特拉津质量浓度高于3 mg·L-1时,阿特拉津的半衰期开始延长.然而在不同的阿特拉津质量浓度下,菌根组的降解速率均不同程度地大于对照组,半衰期均低于对照组.其中对照组在1 mg·L-1的质量浓度下,降解速率得最大值,而菌根组在3 mg·L-1的质量浓度下,降解速率得最大值.对照组在阿特拉津质量浓度超过3 mg·L-1时,半衰期开始大幅度延长,而菌根组在丛枝菌根真菌的作用下,半衰期增幅较小,大体上趋于稳定.结果表明,接种丛枝菌根真菌促进了植物对水体中阿特拉津的降解,缩短了水体中阿特拉津的半衰期.
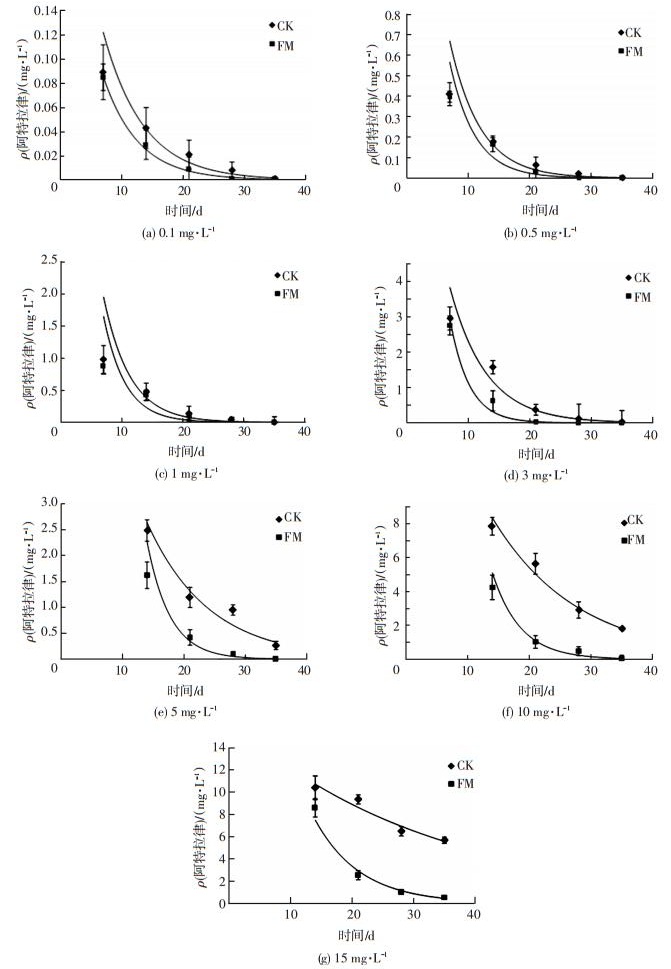
|
图 5 不同质量浓度阿特拉津的残留量随时间的变化 Figure 5 Changes over time in residue of different concentration of atrazine |
| 表 1 不同质量浓度的阿特拉津残留量随时间变化的拟合 Table 1 Fitting equation of changes over time in residue of different concentration of atrazine |
Wang等在阿特拉津对3种水生植物生长和生理影响的研究中考察了3种水生植物菖蒲(A.calamus)、千屈菜(L.salicaria)和水葱(S.tabernaemontani)对阿特拉津的降解效率[24],与本研究采用的阿特拉津溶液总体积均为5 L,采用的共同阿特拉津质量浓度为1 mg·L-1,在此质量浓度下,菖蒲、千屈菜和水葱对阿特拉津的降解速率均低于0.1 d-1,本试验中对照组美人蕉对阿特拉津的降解速率为0.231 d-1.两个研究的差异在于Wang等的研究中每5 L阿特拉津溶液中放置5棵株高15~20 cm的植物,而本研究中每5 L阿特拉津溶液中放置3棵美人蕉,施加阿特拉津时美人蕉的株高为20~25 cm,采用的植株略大,但是采用的植物数量少,两个研究中的阿特拉津降解速率具有可比性.结果表明,美人蕉对阿特拉津的降解速率高于菖蒲、千屈菜和水葱,美人蕉是植物修复水体中阿特拉津的理想选择.
在本研究中,接种丛枝菌根真菌提高了美人蕉植物修复阿特拉津的效率,降低了阿特拉津的半衰期.Wang等[25]在研究辛硫磷在胡萝卜、葱和土壤中残留量时发现,丛枝菌根真菌可以降低辛硫磷在土壤中的残留量,促进辛硫磷的降解.马放等[26]发现丛枝菌根真菌可以降低农药三环唑在土壤中的残留量,这与本试验的结果一致,表明丛枝菌根真菌的接种可以促进植物对有机污染物的消解和去除.丛枝菌根真菌在阿特拉津植物修复中的作用对于利用植物修复高浓度、高毒性的有机污染物具有重大意义,但其作用机理还需要进一步的研究.
3 结论1) 在接种丛枝菌根真菌30 d后,美人蕉根系的菌根侵染率达(22.1±4.6)%,进行阿特拉津施加期间,美人蕉根系的菌根侵染率无明显变化.表明本试验中采用的摩西球囊霉菌剂可以与美人蕉根系形成稳定的共生关系,并且这种共生关系对阿特拉津的污染具有一定的抗性.
2) 丛枝菌根真菌缓解了阿特拉津对美人蕉生长的抑制作用,提高了在阿特拉津胁迫下美人蕉的株高、根长和生物量.表明在阿特拉津胁迫下美人蕉植株的各生长指标均存在较强的菌根效应,并且在在阿特拉津质量浓度为5 mg·L-1时,菌根效应达最大值.
3) 在低质量浓度(≤3 mg·L-1)阿特拉津污染的情况下,美人蕉是一种高效的植物修复水生植物,接种丛枝菌根真菌可以显著地提高美人蕉对阿特拉津的降解速率,并且提高了美人蕉植物修复阿特拉津的质量浓度范围.表明接种丛枝菌根真菌的美人蕉是植物修复阿特拉津水体污染的理想选择.
| [1] | FRANCO-RAMIREZ A, FERRERA-CERRATO R, VARELA-FREGOSO L, et al. Arbuscular mycorrhizal fungi in chronically petroleum-contaminated soils in Mexico and the effects of petroleum hydrocarbons on spore germination[J]. J Basic Microbiol, 2007, 47 (5) : 378-383. DOI: 10.1002/(ISSN)1521-4028 |
| [2] | CAIRRNEY J W G, MEHARG A A. Influences of anthropogenic pollution on mycorrhizal fungal communities[J]. Environ Pollut, 1999, 106 (2) : 169-182. DOI: 10.1016/S0269-7491(99)00081-0 |
| [3] | CABELLO M N. Hydrocarbon pollution: Its effect on native arbuscular mycorrhizal fungi (AMF)[J]. FEMS Microbiol Ecol, 1997, 22 (3) : 233-236. DOI: 10.1111/j.1574-6941.1997.tb00375.x |
| [4] | MARSCHENER H. Role of root growth, arbuscular mycorrhiza, and root exudates for the efficiency in nutrient acquisition[J]. Field Crops Res, 1998, 56 (1/2) : 203-207. |
| [5] | BOLAN N S. A critical review on the role of mycorrhizal fungi in the uptake of phosphorus by plants[J]. Plant Soil, 1991, 134 (2) : 189-207. DOI: 10.1007/BF00012037 |
| [6] | GRAYMORE M, STAGNITTI F, ALLINSON G. Impacts of atrazine in aquatic ecosystems[J]. Environ Int, 2001, 26 (7/8) : 483-495. |
| [7] | CASA-RESINO DE LA I, VALDEHITA A, SOLER F, et al. Endocrine disruption caused by oral administration of atrazine in European quail (Coturnix coturnix coturnix)[J]. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2012, 156 (3/4) : 159-165. |
| [8] | CHEN C, YANG S, GUO Y, et al. Photolytic destruction of endocrine disruptor atrazine in aqueous solution under UV irradiation: Products and pathways[J]. J Hazard Mater, 2009, 172 (2/3) : 675-684. |
| [9] | PANDEY J, CHAUHAN A, JAIN R K. Integrative approaches for assessing the ecological sustainability of in situ bioremediation[J]. FEMS Microbiol Rev, 2009, 33 (2) : 324-375. DOI: 10.1111/j.1574-6976.2008.00133.x |
| [10] | OMOTAYO A E, ILORI M O, AMUND O O, et al. Establishment and characterization of atrazine degrading cultures from Nigerian agricultural soil using traditional and bio-sep bead enrichment techniques[J]. Applied Soil Ecology, 2011, 48 (1) : 63-70. DOI: 10.1016/j.apsoil.2011.01.006 |
| [11] | RANE N R, CHANDANSHIVE V V, KHANDARE R V, et al. Green remediation of textile dyes containing wastewater by Ipomoea hederifolia L[J]. RSC Advances, 2014, 4 (69) : 36623-36632. DOI: 10.1039/C4RA06840H |
| [12] | HUSSAIN S, SIDDIQUE T, ARSHAD M, et al. Bioremediation and phytoremediation of pesticides: Recent advances[J]. Crit Rev Environ Sci Technol, 2009, 39 (10) : 843-907. DOI: 10.1080/10643380801910090 |
| [13] | WEAVER M A, ZABLOTOWICZ R M, LOCKE M A. Laboratory assessment of atrazine and fluometuron degradation in soils from a constructed wetland[J]. Chemosphere, 2004, 57 (8) : 853-862. DOI: 10.1016/j.chemosphere.2004.08.013 |
| [14] | WANG Q H, ZHANG W, LI C, et al. Phytoremediation of atrazine by three emergent hydrophytes in a hydroponic system[J]. Water Sci Technol, 2012, 66 (6) : 1282-1288. DOI: 10.2166/wst.2012.320 |
| [15] | EL FAIZ A, DUPONNOIS R, WINTERTON P, et al. Effect of different amendments on growing of Canna Indica L. inoculated with AMF on mining substrate[J]. Int J Phytorem, 2015, 17 (5) : 503-513. DOI: 10.1080/15226514.2014.950408 |
| [16] | SONG Y, ZHU L S, XIE H, et al. Effects of atrazine on DNA damage and antioxidative enzymes in Vicia Faba[J]. Environ Toxicol Chem, 2009, 28 (5) : 1059-1062. DOI: 10.1897/08-285.1 |
| [17] | HUANG H, ZHANG S, WU N, et al. Influence of Glomus etunicatum/Zea mays mycorrhiza on atrazine degradation, soil phosphatase and dehydrogenase activities, and soil microbial community structure[J]. Soil Biol Biochem, 2009, 41 (4) : 726-734. DOI: 10.1016/j.soilbio.2009.01.009 |
| [18] | HUANG H, ZHANG S, SHAN X, et al. Effect of arbuscular mycorrhizal fungus (Glomus caledonium) on the accumulation and metabolism of atrazine in maize (Zea mays L.) and atrazine dissipation in soil L[J]. Environ Pollut, 2007, 146 (2) : 452-457. DOI: 10.1016/j.envpol.2006.07.001 |
| [19] | DONG J, WANG L, MA F, et al. The effect of Funnelliformis mosseae inoculation on the phytoremediation of atrazine by the aquatic plant Canna indica L. var. flava Roxb[J]. RSC Advances, 2016, 6 (27) : 22538-22549. DOI: 10.1039/C5RA23583A |
| [20] | GIOVANNETTI M, MOSSE B. An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots[J]. New Phytol, 1980, 84 (3) : 489-500. DOI: 10.1111/j.1469-8137.1980.tb04556.x |
| [21] | PLENCHETTE C, FORTIN J A, FURLAN V. Growth responses of several plant species to mycorrhizae in a soil of moderate P-fertility[J]. Plant Soil, 1983, 70 (2) : 199-209. DOI: 10.1007/BF02374780 |
| [22] | XU L J, CHU W, GRAHAM N. Atrazine degradation using chemical-free process of USUV: Analysis of the micro-heterogeneous environments and the degradation mechanisms[J]. J Hazard Mater, 2014, 275 : 166-174. DOI: 10.1016/j.jhazmat.2014.05.007 |
| [23] | WU F Y, YU X Z, WU S C, et al. Phenanthrene and pyrene uptake by arbuscular mycorrhizal maize and their dissipation in soil[J]. J Hazard Mater, 2011, 187 (1/2/3) : 341-347. |
| [24] | WANF Q, QUE X, ZHENG R, et al. Phytotoxicity assessment of atrazine on growth and physiology of three emergent plants[J]. Environ Sci Pollut Res Int, 2015, 22 (13) : 9646-9657. DOI: 10.1007/s11356-015-4104-8 |
| [25] | WANG F Y, TONG R J, SHI Z Y, et al. Inoculations with arbuscular mycorrhizal fungi increase vegetable yields and decrease phoxim concentrations in carrot and green onion and their soils[J]. PLoS One, 2011, 6 (2) : e16949. DOI: 10.1371/journal.pone.0016949 |
| [26] |
马放, 李哲, 王立, 等. 丛枝菌根真菌对农药三环唑的残留减量研究[J].
哈尔滨工业大学学报, 2013, 45 (4) : 58-63.
MA F, LI Z, WANG L, et al. Research of residue reduction of AMF to tricyclazole[J]. Journal of Harbin Institute of Technology, 2013, 45 (4) : 58-63. |
 2017, Vol. 49
2017, Vol. 49


