2. 长江水环境教育部重点实验室(同济大学),上海 200092;
3. 上海同济城市规划设计研究院,上海 200092;
4. 成都川力智能流体设备股份有限公司,成都 611500
2. Key Laboratory of Yangtze Aquatic Environment (Tongji University), Ministry of Education, Shanghai 200092, China;
3. Shanghai Tongji Urban Planning & Design Institute, Shanghai 200092, China;
4. Chengdu Chuanli Intelligence Fuild Equipment Co., Ltd., Chengdu 611500, China
饮用水安全问题关系到人类的生存与健康[1-2].尽管给水处理厂出水水质能满足《生活饮用水卫生标准》(GB 5749-2006)要求,但随着供水管网输送距离的增加,水中细菌总数、浑浊度等随之增加,从而导致管网水质的“二次污染”[3-4].管网中细菌的生长繁殖是造成管网水质降低的重要原因之一,其与营养物质质量浓度、消毒剂余量等因素相关[5].营养物质为细菌提供能源并合成细胞物质,其组成和比例决定了细菌的生长程度和种类[6].消毒剂可有效灭活并抑制细菌再生长,是保证供水管网水质安全的重要环节.有机碳为细菌生长的主要限制元素,生物可同化有机碳(assimilable organic carbon, AOC)和生物可降解溶解性有机碳(biodegradable dissolved organic carbon, BDOC)常作为饮用水生物稳定性评价指标[7-8].不加氯时, AOC < 10 μg/L乙酸碳;加氯时,AOC在50~100 μg/L时饮用水处于生物稳定[9-10].Dukan等[11]运用动态模型认为水中BDOC低于0.20~0.25 mg/L时,水质生物稳定性较高.近几年,国内外学者发现部分地区的饮用水中磷质量浓度较低,磷元素成为管网水中细菌再生长的主要限制因子[12-13].当生物可利用磷(microbially available phosphorus, MAP)质量浓度在1~3 μg/L时,磷会限制细菌的生长[14].往往同一水样中多种营养物质同时具有限制因子的作用[15].因此,在探讨单一营养物质基础上,有必要研究多种营养物质对细菌再生长的作用.Sathasivan等[16]提出了以细菌再生长潜力(bacterial regrowth potential, BRP)作为评价生物稳定性的指标,此方法以水样本身的土著混合细菌为接种菌种,对接种后水样进行培养,以最终的细菌数量(CFU/mL)表示水样中各类营养物质和环境条件支持细菌再生长的潜力.叶林等[17]认为BRP与BDOC具有较好的相关性,可作为中国一般给水厂生物稳定性评价的参考指标.本文以BRP为研究方法,结合配水实验,探讨碳、氮、磷3种营养物质以及自由氯对BRP的影响,以期为保障供水系统水质生物稳定性提供理论参考.
1 实验 1.1 水样本实验为超纯水配水小试实验,为避免水样受其他营养物质不足的干扰,在水中投加过量无机营养组分,其种类、质量浓度见表 1.各实验中碳、氮、磷元素以NaAc、KNO3和KH2PO4的形式进行添加,NaAc、KNO3和KH2PO4充足时添加量分别为5 667、10 110、1 320 μg/L[16].
| 表 1 测定BRP需要添加的营养物质质量浓度 Table 1 Addition of nutrients concentration for BRP experiment |
配置含氯水时,除投加上述营养物质外,另外添加自由氯.实验采用次氯酸钠溶液,自由氯质量浓度用DPD比色法确定.检测仪器采用PCⅡ型单参数水质分析仪.
1.2 BRP实验方法 1.2.1 实验材料的准备为避免外部污染引起的实验误差,玻璃器皿在使用前需经过洗涤剂浸泡12 h;自来水、去离子水先后冲洗;稀盐酸溶液浸泡12 h;自来水、去离子水先后冲洗;121 ℃高压蒸汽灭菌20 min的处理步骤后,烘干待用.
1.2.2 接种液的准备取某水库水源水为接种用原液,8个月内对该水源水检测的基本水质参数见表 2.原水经2 μm微孔滤膜过滤去除杂质微粒后,加入具塞磨口锥形瓶中,20 ℃避光培养5 d得接种液.
| 表 2 接种用原水基本水质参数 Table 2 Water quality indexes of raw water |
每个样品取100 mL水样进行实验,按接种液与水样的体积比为1:100,即向100 mL水样中加入1 mL接种液,摇匀后,20 ℃避光培养5 d.
1.2.4 结果表征采用异养菌平板计数法(heterotrophic plate counting, HPC)对培养后的水样进行细菌计数,采用R2A培养基[18],20 ℃培养7 d计数结果即BRP的检测值,以CFU/mL表示.
1.3 分析方法本文中营养物质支持细菌的再生长能力采用该营养物质的产率系数表征,产率系数分析计算采用软件Origin 9.1里Analysis选项中的linear fitting功能.p < 0.05时认为数据相关性显著.
2 结果与讨论 2.1 营养物质对BRP的影响 2.1.1 单一碳、氮、磷质量浓度变化对BRP的影响图 1(a)、(b)、(c)为添加充足其他营养物质后,碳、氮、磷质量浓度分别对水样BRP的影响.碳质量浓度为250 μg /L是促进细菌生长的临界值,当碳质量浓度 < 250 μg/L时,水样的BRP随着碳质量浓度的升高而增大,碳支持土著细菌再生长的的产率系数为2.35×106 CFU/μg (R2=0.99, p < 0.05).氮质量浓度 < 7 μg/L时,BRP随着氮质量浓度增大的趋势较为明显,氮对土著细菌再生长的产率系数为9.76×107CFU/μg (R2=0.91, p < 0.05),氮质量浓度>7 μg/L时,BRP随氮质量浓度增加变化不明显,即7 μg/L的氮质量浓度是促进细菌生长的临界值.磷质量浓度为3 μg/L是促进细菌生长的临界值,磷质量浓度 < 3 μg/L时,BRP随着磷质量浓度增大的趋势较为明显,磷对土著细菌再生长的产率系数为1.76×108CFU/μg (R2=0.91, p < 0.05).

|
图 1 BRP与水中碳、氮、磷质量浓度的关系 Figure 1 Relationship of BRP and carbon, nitrogen and phosphorus concentration |
微生物对各种营养物质的摄取是按照一定的比例进行的,McCarty曾提出过细菌化学实验式C60H87O23N12P[19];本实验中,土著细菌生长所需的C:N:P为250:7:3,即100:2.8:1.2.Van der Kooij等[7]提出对于微生物生长,最适宜的C:N:P为100:10:1.Sang等[20]提出原水土著细菌再生长的C:P为100:1.6.本实验C:N:P与前人结果相比,氮的比例偏低、磷的比例相近,可能是因为本实验采用的碳和磷是微生物易于利用的乙酸碳和正磷酸盐,而氮是硝态氮,而水体中部分微生物,如硝化细菌以氨氮为底物,不能直接利用硝态氮[21],氨化细菌以有机氮为氮源,无法利用水中无机氮[22].另外,不同细菌组成对营养元素的利用程度不同,导致可利用的营养元素比例存在差异.
研究报道表明,1 μg /L碳可支持103~104 cells/mL的细菌生长[6],即碳的产率系数为106~107 cells/μg,本实验碳的产率系数2.35×106 CFU/μg在该报道的范围内.此外,还应注意的是,本实验中磷的产率系数为1.76×108CFU/μg,分别是碳、氮产率系数的74.9倍和1.8倍,说明磷对细菌生长极为重要.水源水中的磷质量浓度本身就处于较低水平,常规制水工艺对磷的去除非常有效,去除率可达90%以上[23-24],而对AOC的去除效果却并不显著[25],这样就可能形成出厂水中磷元素相对缺乏的状况,使之成为管网水中细菌再生长的限制因子.因此,应对磷在管网水生物稳定性中所起的限制作用予以特别关注.
2.1.2 碳、氮、磷质量浓度共同变化对BRP的影响1) 碳、磷质量浓度共同变化对BRP的影响.图 2为添加充足其他营养物质后,碳、磷质量浓度共同变化对BRP的影响.图 2(a)中,磷质量浓度在1 μg/L以下时,增加碳质量浓度对BRP的影响较小,水中细菌的生长主要受磷的影响;磷质量浓度为1~3 μg/L时,碳、磷质量浓度共同控制细菌的生长;磷质量浓度>3 μg/L时,增加磷质量浓度BRP无明显变化,此时细菌生长主要受碳质量浓度的限制.图 2(b)中,磷质量浓度为0.5 μg/L时,磷质量浓度过低,BRP值维持在1×105CFU/mL以下,细菌难以生长;磷质量浓度为1.0和1.5 μg/L,碳质量浓度 < 50 μg/L时以及磷质量浓度为2.0 μg/L、碳质量浓度 < 100 μg/L时,碳、磷两种营养物质共同控制细菌的生长,任何一种营养物质的质量浓度增加均能有效提高细菌生长的数量;碳质量浓度>100 μg/L时,水中细菌生长的主要营养限制因子为磷.
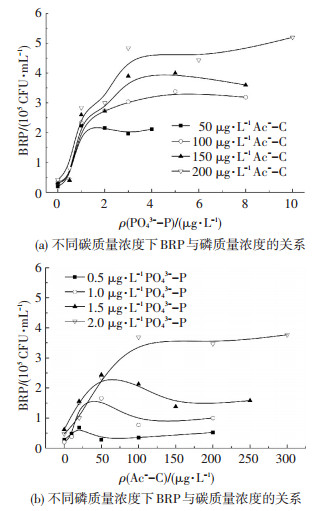
|
图 2 BRP与碳、磷质量浓度的关系 Figure 2 Relationship of BRP and carbon and phosphorus concentration |
表 3、4为BRP达到稳定时,分别对应图 2(a)、(b)的磷、碳的产率系数.可以看出,随着碳(磷)质量浓度的增加,BRP达到稳定时磷(碳)的产率系数基本呈上升趋势,且低于碳(磷)充足时磷(碳)的产率系数,表明碳(磷)质量浓度不足时,会降低磷(碳)支持细菌再生长的潜力.此外,磷质量浓度为0.5 μg/L时,碳的产率系数经线性拟合计算为负值,磷质量浓度为1.0及1.5 μg/L时,碳的产率系数线性拟合相关性较差,说明体系中磷质量浓度过低会严重影响微生物对碳的吸收利用.
| 表 3 碳质量浓度变化时磷支持细菌再生长的产率系数 Table 3 Yield values for heterotrophic bacteria of phosphorus when carbon concentration changes |
| 表 4 磷质量浓度变化时碳支持细菌再生长的产率系数 Table 4 Yield values for heterotrophic bacteria of carbon when phosphorus concentration changes |
2) 碳、氮质量浓度共同变化对BRP的影响.图 3为添加充足其他营养物质后,碳、氮质量浓度共同变化对BRP的影响.可以看出,碳、氮元素均可能影响细菌生长繁殖的水平.水样中的氮质量浓度 < 4.5 μg/L、碳质量浓度 < 100 μg/L时,由于营养条件不能满足细菌细胞合成和代谢的基本需求,两种营养元素质量浓度的增加均能提高细菌生长的数量;氮质量浓度 < 4.5 μg/L、碳质量浓度>100 μg/L时,碳质量浓度对BRP的影响较小,氮质量浓度控制着细菌的生长能力;氮质量浓度在4.5~7 μg/L、碳质量浓度 < 200 μg/L时,BRP重新受到碳、氮质量浓度的共同影响;氮质量浓度高于7 μg/L、碳元素质量浓度 < 200 μg/L时,BRP主要受碳质量浓度的影响,碳元素的质量浓度越高,BRP值越大.
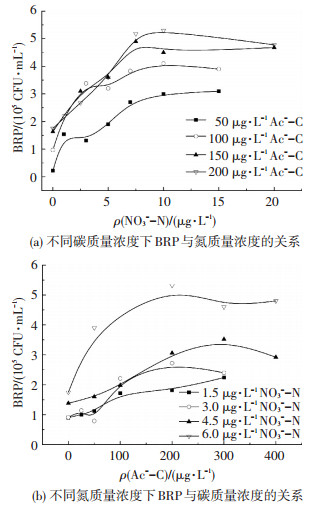
|
图 3 BRP与碳、氮质量浓度的关系 Figure 3 Relationship of BRP and carbon and nitrogen concentration |
表 5、6为BRP达到稳定值时,分别对应图 3(a)、(b)氮、碳的产率系数.可以看出,随着碳(氮)质量浓度增加,BRP达稳定值时氮(碳)的产率系数呈上升趋势,且低于碳(氮)充足时的产率系数,表明碳(氮)质量浓度不足时,会降低氮(碳)支持细菌再生长的潜力.
| 表 5 碳质量浓度变化时氮支持细菌再生长的产率系数 Table 5 Yield values for heterotrophic bacteria of nitrogen with different carbon concentration |
| 表 6 氮质量浓度变化时碳支持细菌再生长的产率系数 Table 6 Yield values for heterotrophic bacteria of carbon with different nitrogen concentration |
3) 氮、磷质量浓度共同变化对BRP的影响.图 4为添加充足其他营养物质后,氮、磷质量浓度共同变化对BRP的影响.可以看出,磷质量浓度 < 0.5 μg/L时,添加其他任何营养物质均无法有效促进细菌的生长,表明过低的磷质量浓度无法满足细菌基本的新陈代谢;磷质量浓度在1~3 μg/L、氮质量浓度在4.5~10 μg/L时,BRP随其中任意一种营养元素质量浓度的升高而增大,此时细菌生长所需的营养物质不断得到补充,BRP的增大效果较明显;磷质量浓度>3 μg/L时,增加磷质量浓度对BRP的提高较小,细菌生长主要受氮质量浓度的限制,6.0 μg/L氮质量浓度时BRP值达最大,氮质量浓度>10 μg/L时,增加氮质量浓度对BRP的提高较小,细菌生长主要受磷的限制.
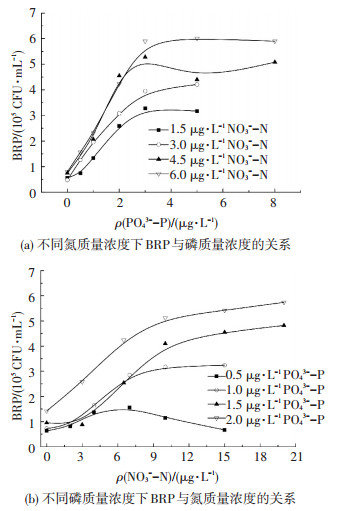
|
图 4 BRP与氮、磷质量浓度的关系 Figure 4 Relationship of BRP and nitrogen and phosphorus concentration |
表 7、8为BRP达到稳定值时,分别对应图 4(a)、(b)磷、氮的产率系数.可以看出,随着氮(磷)质量浓度增加,BRP达到稳定值时磷(氮)的产率系数呈上升趋势,且低于氮(磷)充足时的产率系数,表明氮(磷)质量浓度不足时,会降低磷(氮)支持细菌再生长的潜力.
| 表 7 氮质量浓度变化时磷支持细菌再生长的产率系数 Table 7 Yield values for heterotrophic bacteria of phosphorus with different nitrogen concentration |
| 表 8 磷质量浓度变化时,氮支持细菌再生长的产率系数 Table 8 Yield values for heterotrophic bacteria of nitrogen with different phosphorus concentration |
4) 两种营养物质共同对BRP限制作用.本实验中,当两种营养物质共同限制时,一种营养物质的质量浓度低于细菌生长需求时,会导致另一种营养物质支持细菌再生长能力的下降,表现在另一种营养物质的产率系数低于其在营养物质充足环境中的产率系数,且随着营养物质浓度的增加而升高.国内已有学者开展过两种营养物质共同对细菌再生长限制作用的实验.文献[26]表明,当碳质量浓度分别为50、100和200 μg/L时,磷对悬浮菌再生长的产率系数分别为5.6×108、8.8×108和2.0×109 CFU/μg,产率系数随碳质量浓度的增加而上升,与本实验结论相似.文献[27]表明,以碳100 μg/L、氮50 μg/L、磷5 μg/L作为基础水平,微生物再生长的碳、氮、磷的限值分别为100、20和2 μg/L,碳、氮、磷的产率系数分别为8.37×105,3.19×106和3.59×107CFU/μg,与本实验结果相比均偏低,可能是因为其所采取的其他营养物质的基础质量浓度对细菌生长不足,影响细菌对所研究营养物质的利用水平.
另外,值得注意的是,图 2(b)和图 4(b)中,磷质量浓度为0.5 μg/L时,增加其他任何营养物质的质量浓度均无法有效促进细菌的生长,BRP值维持在1×105CFU/mL以下,表明磷质量浓度低于0.5 μg/L可有效控制细菌的再生长.姜登岭[26]认为,实际管网中磷质量浓度低于0.7 μg/L并尽量减小管网水力停留时间,水样可实现生物稳定.
综上,对于各种营养物质均较贫乏的给水管网环境,应当对细菌生长所必需的各种营养元素质量浓度进行检测,综合分析找出水中细菌生长的限制因子,为提高管网水生物稳定性提供支持.
2.2 氯与营养物质的共同作用对BRP的影响图 5为含氯水中BRP与碳、氮、磷质量浓度的关系.在含氯水环境中,细菌对营养元素的利用受到了限制.加氯量为0.05 mg/L时,水中细菌的生长规律与无氯环境中相似,细菌再生长能力随营养物质质量浓度的增加而提高.随着加氯量的增加,细菌繁殖受到的抑制趋势逐渐增强,BRP呈下降趋势,加氯量≥0.50 mg/L时,各体系中BRP均保持在500 CFU/mL以下,即水中大部分细菌被灭活,增加各种营养物质的质量浓度并不能促进细菌增长,微生物再生长风险较低.Gillespie等[5]利用流式细胞仪监测供水管网中总细胞质量浓度和完整细胞质量浓度时发现,在氯化消毒系统中,当自由氯质量浓度高于0.5 mg/L时,管网中完整细胞质量浓度的比例大幅减少.加氯量≥0.50 mg/L时,本实验结果满足美国环保局二级推荐标准设定的HPC < 500 CFU/mL要求[28],细菌生长得到有效控制.
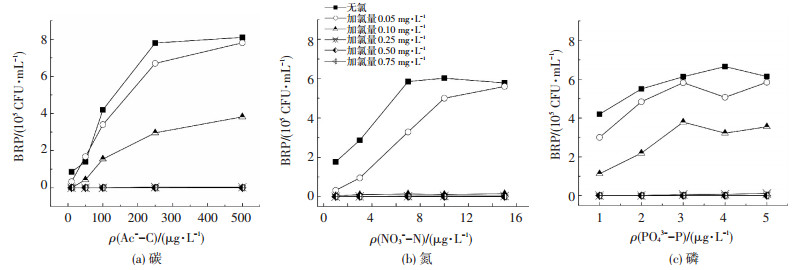
|
图 5 含氯水中BRP与碳、氮、磷元素质量浓度的关系 Figure 5 Relationship between BRP and carbon, nitrogen, phosphorus concentration, respectively with different chlorine residuals |
1) 单一营养物质质量浓度不足时,水源细菌生长的碳、氮、磷营养物质质量浓度的临界值分别为250、7和3 μg/L.碳、氮、磷对BRP的产率系数分别为2.35×106、9.76×107和1.76×108 CFU/μg.细菌生长所需C:N:P为100:2.8:1.2.
2) 水体中的其他营养物质足量,对于碳、氮、磷3种营养物质,当其中两种营养物质质量浓度不足时,相对质量浓度较低的营养物质为BRP主要限制因子,不仅会引起水体BRP的下降,还可导致其他营养物质支持细菌再生长能力的下降.磷质量浓度为0.5 μg/L时,增加其他任何营养物质的质量浓度均无法有效促进细菌的生长,即管网水中磷质随加氯量增加,BRP呈降低趋势;加氯量≥0. 50 mg/L时,细菌生长得到有效控制.
| [1] | ASHBOLT N J. Microbial contamination of drinking water and human health from community water systems[J]. Current Environmental Health Reports, 2015, 2 (1) : 95-106. DOI: 10.1007/s40572-014-0037-5 |
| [2] | WOLYNIAK D, ELIZABETH A. Impact of biofilm and other environmental factors on the fate and transport of Cryptosporidium oocysts[D]. Bethlehem: Lehigh University, 2011. |
| [3] |
王华然, 尹静. 饮用水生物稳定性研究进展[J].
环境与健康杂志, 2009, 26 (4) : 367-370.
WANG Huaran, YIN Jing. Advances on biological stability of drinking water[J]. Journal of Environment and Health, 2009, 26 (4) : 367-370. |
| [4] | LU Pinpin, CHEN Chao, WANG Qingfeng, et al. Phylogenetic diversity of microbial communities in real drinking water distribution systems[J]. Biotechnology and Bioprocess Engineering, 2013, 18 (1) : 119-124. DOI: 10.1007/s12257-012-0230-z |
| [5] | GILLESPIE S, LIPPHAUS P, GREEN J, et al. Assessing microbiological water quality in drinking water distribution systems with disinfectant residual using flow cytometry[J]. Water Research, 2014, 65 (15) : 224-234. |
| [6] | PREST E I, HAMMES F, LOOSDRECHT VAN M C M, et al. Biological stability of drinking water: Controlling factors, methods, and challenges[J]. Frontiers in Microbiology, 2016, 7 (45) : 1-24. |
| [7] | KOOIJ VAN DER D, VISSER A, HIJNEN W. Determining the concentration of easily assimilable organic carbon in drinking water[J]. Journal (American Water Works Association), 1982, 74 (10) : 540-545. |
| [8] | SERVAIS P, BILLEN G, HASCOËT M. Determination of the biodegradable fraction of dissolved organic matter in waters[J]. Water Research, 1987, 21 (4) : 445-450. DOI: 10.1016/0043-1354(87)90192-8 |
| [9] | KOOIJ VAN DER D. Assimilable organic carbon as an indicator of bacterial regrowth[J]. Journal (American Water Works Association), 1992, 84 (2) : 57-65. |
| [10] | LECHEVALLIER M W, WELCH N J, SMITH D B. Full-scale studies of factors related to coliform regrowth in drinking water[J]. Applied and Environmental Microbiology, 1996, 62 (7) : 2201-2211. |
| [11] | DUKAN S, LEVI Y, PIRIOU P, et al. Dynamic modelling of bacterial growth in drinking water networks[J]. Water Research, 1996, 30 (9) : 1991-2002. DOI: 10.1016/0043-1354(96)00021-8 |
| [12] | MIETTINEN I T, VARTIAINEN T, MARTIKAINEN P J. Phosphorus and bacterial growth in drinking water[J]. Applied and Environmental Microbiology, 1997, 63 (8) : 3242-3245. |
| [13] |
桑军强, 张锡辉, 周浩晖, 等. 总磷作为饮用水生物稳定性控制指标的研究[J].
水科学进展, 2003, 14 (6) : 720-724.
SANG Junqiang, ZHANG Xihui, ZHOU Haohui, et al. Study on total phosphorus as an indicator of drinking water biostability[J]. Advances in Water Science, 2003, 14 (6) : 720-724. |
| [14] | SATHASIVAN A, OHGAKI S, YAMAMOTO K, et al. Role of inorganic phosphorus in controlling regrowth in water distribution system[J]. Water Science and Technology, 1997, 35 (8) : 37-44. DOI: 10.1016/S0273-1223(97)00149-2 |
| [15] | LEHTOLA M J, MIETTINEN I T, VARTIAINEN T, et al. Changes in content of microbially available phosphorus, assimilable organic carbon and microbial growth potential during drinking water treatment processes[J]. Water Research, 2002, 36 (15) : 3681-3690. DOI: 10.1016/S0043-1354(02)00100-8 |
| [16] | SATHASIVAN A, OHGAKI S. Application of new bacterial regrowth potential method for water distribution system-a clear evidence of phosphorus limitation[J]. Water Research, 1999, 33 (1) : 137-144. DOI: 10.1016/S0043-1354(98)00158-4 |
| [17] |
叶林, 于鑫, 施旭, 等. 用细菌生长潜力(BGP)评价饮用水生物稳定性[J].
给水排水, 2008, 33 (11) : 146-149.
YE Lin, YU Xin, SHI Xu, et al. Evaluation of drinking water biostability using bacterial growth potential (BGP)[J]. Water & Wastewater Engineering, 2008, 33 (11) : 146-149. |
| [18] | REASONER D J, GELDREICH E E. A new medium for the enumeration and subculture of bacteria from potable water[J]. Applied and Environmental Microbiology, 1985, 49 (1) : 1-7. |
| [19] |
顾夏声.
废水生物处理数学模式[M]. 2版. 北京: 清华大学出版社, 1993 .
GU Xiasheng. Mathematical model of biological treatment of wastewater[M]. 2nd ed. Beijing: Tsinghua University Press, 1993 . |
| [20] | SANG Junqiang, ZHANG Xihui, LI Lingzhi, et al. Improvement of organics removal by bio-ceramic filtration of raw water with addition of phosphorus[J]. Water Research, 2003, 37 (19) : 4711-4718. DOI: 10.1016/S0043-1354(03)00429-9 |
| [21] |
孙寓姣, 赵轩, 王蕾, 等. 沣河水系脱氮微生物群落结构研究[J].
生态环境学报, 2014, 23 (9) : 1451-1456.
SUN Yujiao, ZHAO Xuan, WANG Lei, et al. Study on the microorganisms of nitrogen cycle in Fenghe river[J]. Ecology and Environmental Sciences, 2014, 23 (9) : 1451-1456. |
| [22] |
郭端强, 方改霞, 段敬霞, 等. 河南省白龟山水库下游水体氨化细菌分离鉴定及其降解有机氮条件[J].
微生物学通报, 2014, 41 (2) : 236-242.
GUO Duanqiang, FANG Gaixia, DUAN Jingxia, et al. Isolation and identification of ammonifying bacteria in the downstream waters of Baiguishan Reservior in Henan Province and conditions of degrading organic nitrogen[J]. Microbiology China, 2014, 41 (2) : 236-242. |
| [23] | NISHIJIMA W, SHOTO E, OKADA M. Improvement of biodegradation of organic substance by addition of phosphorus in biological activated carbon[J]. Water Science and Technology, 1997, 36 (12) : 251-257. DOI: 10.1016/S0273-1223(97)00721-X |
| [24] |
桑军强, 李灵芝, 王占生. 饮用水净化工艺中磷的去除研究[J].
中国环境科学, 2003, 23 (2) : 78-80.
SANG Junqiang, LI Lingzhi, WANG Zhansheng. Studies on the removal of phosphorus in drinking water purificationtechnology[J]. China Environmental Science, 2003, 23 (2) : 78-80. |
| [25] |
张领国, 张克峰, 李梅, 等. 饮用水水质生物稳定性研究进展[J].
净水技术, 2013, 32 (6) : 1-5.
ZHANG Linguo, ZHANG Kefeng, LI Mei, et al. Advances in research of biological stability for drinking water quality[J]. Water Purification Technology, 2013, 32 (6) : 1-5. |
| [26] |
姜登岭.营养基质对管网水悬浮菌再生长的影响研究[D].北京:清华大学, 2004.
JIANG Denglin.Effects of nutrients bacteria regrowth on suspended in water distribution drinking systems[D]. Beijing: Tsinghua University, 2004. http://www.oalib.com/references/18256611 |
| [27] |
廖一鸣.上海市城市供水系统微生物再生机理及其控制技术研究[D].上海:上海交通大学, 2013.
LIAO Yiming. Study on the mechanism of microbial regrowth andrestriction technique in Shanghai drinking water supply system[D].Shanghai: Shanghai Jiaotong University, 2013. |
| [28] | USEPA (US Environmental Protection Agency). 40 CFR Parts 141 and 142. Drinking water; National Primary drinking water regulation; Filtration, disinfection; turbidity, Giardia lamblia, viruses, Legionella, and heterotrophic bacteria; Final Rule[S]. Federal Register, 1989. |
 2017, Vol. 49
2017, Vol. 49


