2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学), 哈尔滨 150090
2. State Key Laboratory of Urban Water Resource and Environment(Harbin Institute of Technology), Harbin 150090, China
与传统硝化反硝化工艺相比,同步亚硝化-厌氧氨氧化与反硝化工艺(simultaneous partial nitrification, anaerobic ammonium oxidation and denitrification,SNAD)(反应式如下)
| $ \begin{align} &\begin{array}{*{35}{l}} \text{NH}_{\text{4}}^{\text{+}}\text{+0}\text{.85}{{\text{O}}_{\text{2}}}\text{+HCO}_{3}^{-}\text{+0}\text{.023}{{\text{C}}_{\text{6}}}{{\text{H}}_{\text{12}}}{{\text{O}}_{\text{6}}}\to \\ \text{0}\text{.495}{{\text{N}}_{\text{2}}}\text{+1}\text{.138C}{{\text{O}}_{\text{2}}}\text{+2}\text{.643}{{\text{H}}_{\text{2}}}\text{O} \\ \end{array} \\ & \\ \end{align} $ |
具有能源消耗量低、污泥产量低、无需外加碳源等优点,还可以在同一个反应器内实现同步脱氮除碳功能.但是由于SNAD工艺中厌氧氨氧化菌(AnAOB)的倍增时间较长[1],能够实现污泥有效持留的颗粒污泥成为SNAD工艺的主要研究形式,SNAD颗粒污泥工艺的研究主要集中于SBR内[2-5],借助于SBR独特的操控方式,可以通过控制容积交换率(volumetric exchange rate,VER)、沉淀时间等实现对沉降性能不好的絮状污泥的淘洗.其中,VER不仅影响着絮状污泥的淘洗强度,还影响着进水稀释程度以及反应器中微生物与基质的接触反应时间等,因此, VER对于污泥的颗粒化进程、反应器理化环境的稳定性以及反应器的处理效果都有重要影响.
很多研究表明,较高的VER所形成的高水力选择压有利于提高污泥胞外聚合物(extracellular polymeric substances,EPS)含量,从而促进好氧颗粒污泥的颗粒化进程[6-9].Haydée De Clippeleir等研究了VER对于全程自养脱氮(completely autotrophic nitrogen removal over nitrite,CANON)颗粒污泥启动的影响,结果却表明较低的VER可以形成较为稳定的理化环境,同时基质质量浓度、代谢产物、水流剪切力等的波动也较小,有利于CANON颗粒污泥的形成[10];较高的VER会增加污泥的流失程度,而无益于促进CANON污泥的颗粒化进程[11-12].SNAD颗粒污泥既有别于由异养菌组成的好氧颗粒污泥,又有别于由自养菌组成的CANON颗粒污泥,因此, VER对于SNAD颗粒污泥形成过程的影响机理尚不明确.VER作为SBR反应器重要运行控制参数,研究其对于SNAD颗粒污泥形成的影响将有助于进一步明晰SNAD污泥颗粒化机理, 从而为其工程应用提供理论指导.
本文采用2个不同容积交换率(37.5%和75%)的SBR(R1和R2), 研究容积交换率对SNAD污泥颗粒化过程中粒径变化、污泥质量浓度变化、微生物活性变化、反应器去除效果及稳定性等方面的影响.
1 实验 1.1 实验装置实验采用两个SBR(如图 1),反应器由有机玻璃精加工而成,有效容积5.4 L,高100 cm,内径9 cm.底部安装直径为7 cm的微孔曝气环,使用气泵和气体流量计联合控制曝气量.反应器内部安装有搅拌机,转速为150 r·min-1.反应器通过水浴控制在(30±1) ℃.pH、DO、温度通过在线测定仪监测.容积交换率为SBR排水量与有效容积之比,可以通过控制排水口高度实现R1和R2的容积交换率分别为37.5%和75%.
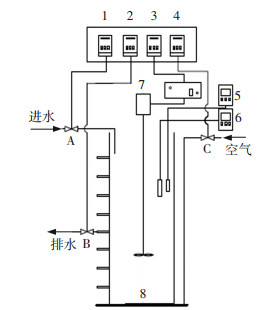
|
1、2、3、4分别为进水、排水、搅拌、曝气时序控制器,5、6分别为pH、DO测定仪,7为机械搅拌机,8为微孔曝气环,A、B、C分别为控制进水、排水、曝气的电磁阀. 图 1 试验装置示意 Figure 1 Schematic diagram of the experimental equipment |
接种污泥为少量稳定运行的SNAD污泥与CANON生物膜组成的混合污泥.整个实验过程以某大学生活小区化粪池出水为原水(水质见表 1).反应器采用间歇运行模式,每周期包括进水(3 min)、反应(R1和R2的反应时间根据各自周期实验结果确定)、沉淀(10 min)、排水(2 min)4个部分.每周期结束后,洗泥3次以去除上一周期反应结束残留的物质.
| 表 1 原水水质 Table 1 Wastewater characteristics |
NH4+-N:纳氏试剂分光光度法;NO2--N:N-(1-萘基)-乙二胺分光光度法;NO3--N:紫外分光光度法;COD:5B-3B型COD测定仪;粒径:Mastersize2000型激光粒度仪测定;MLSS:重量法;TIC:非色散红外吸收TOC测定仪;DO、pH、t:WTW在线测定仪.脱氮途径计算时依据模型[2, 13]假定:1) 硝化过程氧化的NH4+-N全部转化为NO2--N;2) 厌氧氨氧化过程消耗的ρ(NH4+-N):ρ(NO2--N)=1:1.32,同时每消耗1 mg·L-1 NH4+-N生成0.26 mg·L-1 NO3--N,生成的NO3--N可用于反硝化; 3) 反硝化过程每消耗1 mg·L-1 NO3--N需要消耗2.86 mg·L-1的COD.涉及的计算公式如下:
| $ \begin{align} &{{\rho }_{总氮}}\left( \text{TN} \right)\text{=}\rho \left( \text{NH}_{4}^{+}\text{-N} \right)\text{+}\rho \left( \text{NO}_{2}^{-}\text{-N} \right)\text{+} \\ &\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \rho \text{(NO}_{3}^{-}\text{-N), }\left( \text{mg/L} \right) \\ \end{align} $ | (1) |
总氮去除量
| $ \text{ }\!\!\Delta\!\!\text{ }\rho \left( \text{TN} \right)\text{=}{{\rho }_{\text{inf}}}\left( \text{TN} \right)\text{-}{{\rho }_{\text{eff}}}\left( \text{TN} \right)\text{, }\left( \text{mg/L} \right) $ | (2) |
反硝化途径氮去除量
| $ \begin{align} &{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{1}}}\text{=}{{\rho }_{\text{inf}}}\text{(NO}_{3}^{-}\text{-N)-}{{\rho }_{\text{eff}}}\text{(NO}_{3}^{-}\text{-N)+0}\text{.11 }\!\!\times\!\!\text{ } \\ &\ \ \ \ \ \ \ \ \text{ }\!\![\!\!\text{ }{{\rho }_{\text{inf}}}\text{(NH}_{4}^{+}\text{-N)+}{{\rho }_{\text{inf}}}\text{(NO}_{2}^{-}\text{-N)-}{{\rho }_{\text{eff}}}\text{(NH}_{4}^{+}\text{-N)-} \\ &\ \ \ \ \ \ \ {{\rho }_{\text{eff}}}\text{(NO}_{2}^{-}\text{-N) }\!\!]\!\!\text{, }\left( \text{mg/L} \right) \\ \end{align} $ | (3) |
厌氧氨氧化途径氮去除量
| $ {{\text{ }\!\!\Delta\!\!\text{ }}_{\text{2}}}\text{= }\!\!\Delta\!\!\text{ }\rho \left( \text{TN} \right)\text{-}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{1}}}\text{, }\left( \text{mg/L} \right) $ | (4) |
总氮去除速率
| $ {R_{{\rm{NR}}}}{\rm{ = }}\frac{{{\rm{24 }} \times {\rm{ }}\Delta {\rm{ }}\rho \left( {{\rm{TN}}} \right)}}{{{\rm{1 000 }} \times {\rm{ HRT}}}}{\rm{,}}\left( {\frac{{\rm{g}}}{{{\rm{L }} \cdot {\rm{ d}}}}} \right) $ | (5) |
总氮去除率
| $ {{R}_{\text{N}}}\text{=}\frac{{{\rho }_{\text{inf}}}\left( \text{TN} \right)\text{-}{{\rho }_{\text{eff}}}\left( \text{TN} \right)}{{{\rho }_{\text{inf}}}\left( \text{TN} \right)}\text{.} $ | (6) |
单位MLVSS好氧氨氧化活性RAO=
| $ \frac{{{\rm{24 }} \times {\rm{ }}[{\rm{ (}}{\rho _{{\rm{inf}}}}{\rm{(NH}}_4^ + {\rm{ - N) - }}{\rho _{{\rm{eff}}}}{\rm{(NH}}_4^ + {\rm{ - N) - }}\Delta {{\rm{ }}_{\rm{2}}}{\rm{/2}}{\rm{.04 }}]{\rm{ }}}}{{{\rm{1 000 }} \times {\rm{ HRT }} \times {\rm{ }}{\rho _{{\rm{MLVSS}}}}}}{\rm{, }}\left( {\frac{{\rm{g}}}{{{\rm{g }} \cdot {\rm{ d}}}}} \right) $ | (7) |
厌氧氨氧化活性
| $ {R_{{\rm{AN}}}}{\rm{ = }}\frac{{{\rm{24 }} \times {\rm{ }}\Delta {{\rm{ }}_{\rm{2}}}{\rm{/2}}{\rm{.04}}}}{{{\rm{1 000 }} \times {\rm{ HRT }} \times {\rm{ }}\rho {{\rm{ }}_{{\rm{MLVSS}}}}}}{\rm{, }}\left( {\frac{{\rm{g}}}{{{\rm{g }} \cdot {\rm{ d}}}}} \right) $ | (8) |
特征比
| $ \gamma {\rm{ = }}\frac{{{\rho _{{\rm{inf }}{\rm{ }}}}\left( {{\rm{TN}}} \right){\rm{-}}{\rho _{{\rm{eff }}{\rm{ }}}}\left( {{\rm{TN}}} \right)}}{{{\rho _{{\rm{eff }}{\rm{ }}}}{\rm{(NO}}_3^ - {\rm{ - N) - }}{\rho _{{\rm{inf }}{\rm{ }}}}{\rm{(NO}}_3^ - {\rm{ - N)}}}}{\rm{.}} $ | (9) |
式中:ρinf (NH4+-N)、ρinf (NO2--N)、ρinf (NO3--N)分别表示进水氨氮、亚硝酸盐氮和硝酸盐氮质量浓度;ρeff (NH4+-N)、ρeff (NO2--N)、ρeff (NO3--N)分别表示出水氨氮、亚硝酸盐氮和硝酸盐氮质量浓度,mg·L-1;HRT为水力停留时间,h;由于原水中有机氮含量较低,式(1) 中的总氮采用总无机氮来表示.
2 结果与讨论 2.1 VER对SNAD污泥颗粒化过程的影响由图 2可知,R1和R2接种污泥质量浓度约为2.1 g·L-1,粒径约为200 μm.在颗粒化初期,R1经过8 d粒径快速增长至240 μm,而R2的粒径快速增长至276 μm.R1和R2在初期都实现了较快的粒径增长,原因在于接种初期粒径较小的絮状污泥在水力筛分作用下被淘洗出反应器,造成平均粒径向较大粒径方向移动(粒度分布见表 2);R2在初期的粒径增长幅度大于R1,原因在于R2的VER较高,产生的水力筛分作用更大,絮状污泥被淘洗的程度更强,由此也造成了R2更加严重的污泥流失(图 2)(第8天时,R1和R2的污泥质量浓度分别降为1.98和1.68 g·L-1).R1和R2分别经过36和54 d后,颗粒粒径增长至400 μm以上,认为SNAD颗粒污泥工艺启动成功[14-15].与此同时,R1的污泥质量浓度经颗粒化初期的下降之后缓慢升高至2.03 g·L-1,表明污泥已经适应了R1内较低的水力筛分作用,污泥得以在R1内有效持留并增殖;而R2的污泥质量浓度持续下降至1.41 g·L-1,表明污泥的增殖速度难以弥补R2内较高VER所造成的污泥流失,同时污泥流失较多也不利于大颗粒的形成.与R2相比,具有较低VER的R1所产生的类似于连续流的稳定物理化学环境及较低的水力筛分作用,即较低的理化压力和较小的水力选择压[11-12],使得倍增时间较长,对环境变化极为敏感的自养菌得以在较为稳定的环境内实现有效富集,并利用自养菌较强的自凝聚性抵抗水力条件的波动[16];而R2由于VER较大,致使理化条件变化较大,较大的水力选择压使得粒径较小的絮状污泥难以在反应器内持留,污泥质量浓度的持续降低使得粒径的增长受限.
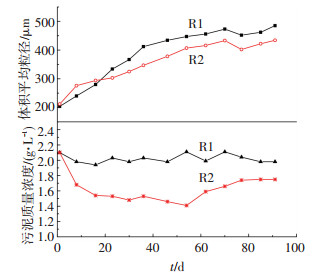
|
图 2 颗粒形成前后污泥质量浓度与粒径的变化 Figure 2 Variations of sludge concentration and particle size before and after the formation of granular |
| 表 2 各阶段粒度分布 Table 2 Distribution of biomass fractions at various stages |
以往对于好氧颗粒污泥的研究认为:较高的VER是好氧颗粒污泥形成的关键因素[9],这是因为对于生长速率较快的异养菌,其颗粒化的关键在于促进异养菌的凝聚作用,利用较高VER所形成的水力选择压可以提高污泥EPS含量,从而提高污泥疏水性能,降低细胞表面自由能,继而促进好氧颗粒污泥的形成[6, 8].但是Haydée De Clippeleir等通过控制不同实验阶段的VER研究其对自养的CANON颗粒污泥形成的影响,结果在较高VER阶段无CANON颗粒形成,而在较低VER阶段才实现了CANON颗粒污泥的成功启动[10];Thomas Schaubroeck等的研究结果同样表明, 较低的VER所产生的稳定环境有利于促进CANON颗粒的形成以及脱氮性能的提升[12].与好氧颗粒污泥不同,CANON颗粒污泥内的好氧氨氧化菌(AOB)和厌氧氨氧化菌(AnAOB)本身具有较高的胞外聚合物含量[16-20],较高的EPS含量使得自养菌更易于发生细胞凝聚而形成颗粒.研究表明, 自养菌高度的凝聚性不仅意味着细胞数量的增加,细胞间的信息交换和合作也都将加强,继而增强细胞的代谢和活性,EPS对于细胞凝聚的促进作用将增加基因表达的稳健性,同时增强自养菌对于客观环境变化的容忍性[16].因此, 制约CANON颗粒污泥形成的关键在于自养菌极慢的生长速率,而实现CANON污泥快速颗粒化的关键在于实现污泥的有效持留.
对于由异养菌和自养菌共同组成的SNAD颗粒污泥,以上两个方面都会对颗粒化过程产生影响.在本实验中,采用较低VER的操作模式可以大幅缩短SNAD颗粒污泥工艺的启动时间,同时在启动过程中可以有效避免污泥质量浓度的大量流失.由此表明, 实现污泥的有效持留比较高的水力选择压对SNAD颗粒污泥的形成更加重要.
2.2 VER对SNAD污泥颗粒化过程中去除效果的影响R1和R2的进水基质相同,只是由于各自的VER不同导致R1和R2在周期初始时的基质质量浓度不同(如图 3所示).R1和R2在实验开始后均表现出一定的脱氮除碳效果,原因在于接种污泥中含少量已经培养成熟的SNAD颗粒污泥,这部分污泥得以迅速适应各反应器内的环境.在颗粒形成阶段,与R2相比,R1的出水中总是存在较多的亚氮( < 5 mg·L-1),原因在于较低的VER使得R1内存在较多粒径较小的絮状污泥(表 2),研究表明异养菌以及AOB主要生长在小絮体内[21],因此, 絮状污泥的存在有利于去除进水中的COD、降低反应器内的溶解氧(DO), 从而避免较高COD和DO对AnAOB活性的抑制,同时有利于为AnAOB提供足够的基质亚氮, 从而避免基质匮乏对于AnAOB活性的限制.相关研究表明, 亚硝化阶段是整个脱氮过程的限制步骤[22-25],而絮状污泥的存在将有利于促进亚硝化性能, 从而提高SNAD颗粒污泥反应器的去除效果.

|
图 3 颗粒形成前后进出水水质变化 Figure 3 Variations of water quality before and after the formation of granular |
R1经过36 d实现了颗粒化,同时总氮去除速率由0.112 g·L-1·d-1升高至0.259 g·L-1·d-1;R2经54 d才实现颗粒化,总氮去除速率由0.117 g·L-1·d-1升高至0.217 g·L-1·d-1(如图 4).研究表明,较高的反应器去除效果是颗粒形成的重要前提,以往培养颗粒污泥的反应器几乎都是在去除速率达到一定程度后才有颗粒的出现[10, 15, 26],因此, 提高反应器去除效果对于颗粒污泥的快速培养至关重要.颗粒形成后,继续运行至第91天时,R1总氮去除速率升高至0.356 g·L-1·d-1,COD去除速率升高至0.397 g·L-1·d-1,出水总氮平均值为13.41 mg·L-1;R2的总氮去除速率升高至0.248 g·L-1·d-1,COD去除速率升高至0.341 g·L-1·d-1,出水总氮平均值为20.02 mg·L-1.在整个实验阶段,R1和R2的去除能力均不断提升,但是R1的总氮去除速率的增长率高于R2且出水总氮较低,除了大量絮状污泥的存在促进了R1的亚硝化性能以及COD降解能力外,较小的VER也使得R1的污泥流失程度小于R2,较高的污泥质量浓度也是R1去除能力较高的重要原因[2].
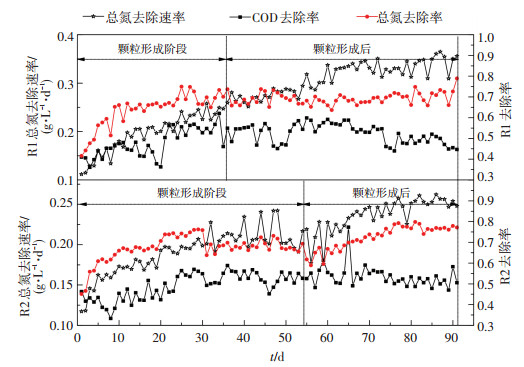
|
图 4 颗粒形成前后反应器去除效果变化 Figure 4 Variations of removal performance before and after the formation of granular |
R1和R2各自在第90天时周期内的运行效果如图 5所示.R1在0~45 min内,COD被大量去除,反应器内的DO在0.2 mg·L-1以下,与此同时氮化合物质量浓度少量降低.研究表明, 较高的COD对于AOB和AnAOB有抑制作用[27-28],还会引起DO的波动从而限制亚硝化效果[29-30],因此,在反应初期主要进行COD的降解,而亚硝化和厌氧氨氧化过程受到抑制.45 min以后,氨氮质量浓度迅速降低,亚氮和硝氮质量浓度则升高至1.9和3.74 mg·L-1(占出水总氮的31%),最终总氮去除率为72%,其中通过厌氧氨氧化途径脱氮的比例为67.4%,通过反硝化途径脱氮的比例为4.7%.R2内基质和DO的变化趋势与R1相似,不同之处在于R2周期开始时的COD和氨氮质量浓度较高,因此, COD对于亚硝化和厌氧氨氧化过程的抑制作用持续时间也较长;同时R2内高DO阶段所持续的时间也较长(如图 4),研究认为DO质量浓度高于0.5 mg·L-1时,亚硝酸盐氧化菌(NOB)的增殖速率将超过AOB[29],同时AnAOB的活性也将受到抑制,R2反应周期内DO在0.5 mg·L-1以下与0.5 mg·L-1以上的时间比例为90 min:230 min(内插法求得),R2内DO高于0.5 mg·L-1的时间较长,将导致R2内NOB不断增殖,由此造成出水硝氮的不断增加,出水中硝氮质量浓度达到9.4 mg·L-1(占出水总氮的59%).而R1的周期内DO在0.5 mg·L-1以下与0.5 mg·L-1以上的时间比例为65 min:85 min,DO处于0.5 mg·L-1以上的时间较短将有利于抑制NOB的活性同时促进厌氧氨氧化菌的活性.而R1内由于有大量絮状污泥的存在,其亚硝化性能受到DO降低的影响较小.

|
图 5 典型周期的运行效果对比 Figure 5 Comparison of performance in representative batch test |
实验期间R1和R2内好氧氨氧化菌活性(RAO)、厌氧氨氧化菌活性(RAN)以及特征比(Δρ(TN)/Δρ(NO3-))变化如图 6所示.颗粒形成前后,R1和R2内RAO和RAN均不断增加,表明微生物不断适应反应器内的环境条件;但是R1内的RAO和RAN始终高于R2,第90天时,R1内RAO和RAN分别为0.113 0和0.080 9 g·g-1·d-1,而R2内RAO和RAN分别为0.093 6和0.070 5 g·g-1·d-1,相关研究也表明, 较低的VER有利于形成稳定的理化环境,同时基质质量浓度、代谢产物、水流剪切力等的波动较小,其所形成的接近于连续流的稳定环境有利于微生物活性的提升[10, 12],R1内的RAO和RAN较高也是其实现较高总氮去除速率的重要原因.特征比(Δρ(TN)/Δρ(NO3-))可以有效揭示反应器内的NOB是否大量增殖[13, 31],实验期间R1的特征比一直在20附近波动,平均值为19.2;而R2的特征比呈下降趋势,由21.7下降至实验结束时的7.1.由此表明,较低容积交换率所形成的较低的溶解氧波动有利于抑制NOB的增殖.实现较高的RAO和RAN的同时有效抑制NOB的增殖是实现SNAD工艺稳定高效运行的前提,也是实现SNAD污泥快速颗粒化的重要因素.
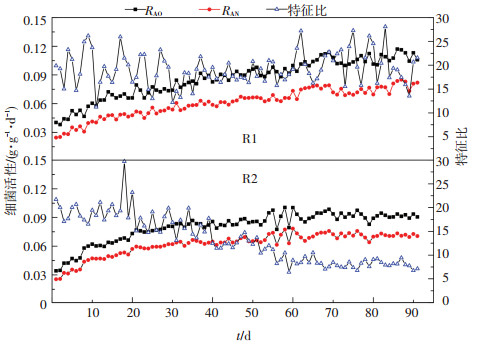
|
图 6 颗粒形成前后微生物活性的变化 Figure 6 Variations of microbial activity before and after the formation of granular |
SNAD工艺稳定运行的关键在于在同一个反应器内实现异养好氧菌、AOB、AnAOB、NOB以及异养反硝化菌(HB)等多种细菌的协同代谢.协同代谢的关键在于有效抑制NOB活性的同时促进AOB和AnAOB的活性.类似于R2出水硝氮增加是困扰SNAD工艺稳定运行的普遍问题,众多SNAD反应器均是由于NOB的过度繁殖而导致亚硝化过程向全程硝化方向转变,厌氧氨氧化菌脱氮途径比例由于基质亚氮的匮乏而不断降低,而反硝化脱氮途径不断升高,继而导致同步亚硝化-厌氧氨氧化与反硝化工艺向全程硝化-反硝化工艺转变[32-35].因此,通过控制较低的VER来营造类似于连续流的稳定环境,避免过高COD对于AOB、AnAOB活性的抑制以及过高DO导致NOB的大量增殖,从而实现NOB活性的有效抑制以及较高的RAO和RAN,将有助于实现SNAD颗粒污泥的高效稳定运行.
3 结论1) R1采用37.5%的容积交换率经过36 d即实现了SNAD污泥的颗粒化,比采用75%的容积交换率的R2快1/3,其污泥流失程度也小于R2,表明较低的容积交换率可以加速SNAD污泥的颗粒化进程.
2) R1的总氮去除速率为0.356 g·L-1·d-1,出水总氮平均值为13.41 mg·L-1;R2的总氮去除速率为0.248 g·L-1·d-1,出水总氮平均值为20.02 mg·L-1,表明较低的容积交换率有利于提高反应器的去除效果.
3) R1内RAO和RAN分别为0.113 0和0.080 9 g·g-1·d-1,而R2内RAO和RAN分别为0.093 6和0.070 5 g·g-1·d-1;实验期间R1内特征比平均值为19.2,而R2内的特征比由21.7下降至7.1.由此表明,较低容积交换率有利于促进AOB和AnAOB的活性,同时实现NOB的有效抑制,有利于实现SNAD的高效稳定运行.
| [1] |
STROUS M, HEIJNEN J J, KUENEN J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J].
Appl Microbiol Biotechnol, 1998, 50: 589-596.
DOI: 10.1007/s002530051340 |
| [2] |
李冬, 苏庆岭, 梁瑜海, 等. CANON颗粒污泥高效脱氮及处理生活污水实验研究[J].
哈尔滨工业大学学报, 2015, 47(8): 79-86.
LI Dong, SU Qingling, LIANG Yuhai, et al. Efficient nitrogen removal from domestic wastewater by CANON granular sludge[J]. Journal of Harbin Institute of Technology, 2015, 47(8): 79-86. DOI: 10.11918/j.issn.0367-6234.2015.08.016 |
| [3] |
LANGONE M, YAN J, HAAIJER S C M, et al. Coexistence of nitrifying, anammox and denitrifying bacteria in a sequencing batch reactor[J].
Evolutionary and Genomic Microbiology, 2014, 5(2): 1-12.
|
| [4] |
LOTTI T, KLEEREBEZEM R, HU Z, et al. Pilot-scale evaluation of anammox-based mainstream nitrogen removal from municipal wastewater[J].
Environmental Technology, 2014, 36(9): 1167-1177.
|
| [5] |
郑照明, 李泽兵, 刘常敬, 等. 城市生活污水SNAD工艺的启动研究[J].
中国环境科学, 2015, 35(4): 1072-1081.
ZHENG Zhaoming, LI Zebing, LIU Changjing, et al. The study of SNAD process start-up on domestic wastewater[J]. China Environmental Science, 2015, 35(4): 1072-1081. |
| [6] |
LIU Yu, WANG Zhiwu, TAY J. A unified theory for upscaling aerobic granular sludge sequencing batch reactors[J].
Biotechnology Advances, 2005, 23(5): 335-344.
DOI: 10.1016/j.biotechadv.2005.04.001 |
| [7] |
LIU Yu, TAY J. Fast formation of aerobic granules by combining strong hydraulic selection pressure with overstressed organic loading rate[J].
Water Research, 2015, 80: 256-266.
DOI: 10.1016/j.watres.2015.05.015 |
| [8] |
LIU Yu, WANG Zhiwu, QIN Lei, et al. Selection pressure-driven aerobic granulation in a sequencing batch reactor[J].
Applied Microbiology and Biotechnology, 2005, 67(1): 26-32.
|
| [9] |
WANG Zhiwu, LIU Yu, TAY J. The role of SBR mixed liquor volume exchange ratio in aerobic granulation[J].
Chemosphere, 2006, 62(5): 767-771.
DOI: 10.1016/j.chemosphere.2005.04.081 |
| [10] |
CLIPPELEIR DE H, VLAEMINCK S E, CARBALLA M, et al. A low volumetric exchange ratio allows high autotrophic nitrogen removal in a sequencing batch reactor[J].
Bioresource Technology, 2009, 100(21): 5010-5015.
DOI: 10.1016/j.biortech.2009.05.031 |
| [11] |
VLAEMINCK S E, CLOETENS L F F M, CARBALLA N B, et al. Granular biomass capable of partial nitritation and anammox[J].
Water Science and Technology, 2009, 58(5): 1113-1120.
|
| [12] |
SCHAUBROECK T, BAGCHI S, CLIPPELEIR DE H, et al. Successful hydraulic strategies to start up OLAND sequencing batch reactors at lab scale[J].
Microbial Biotechnology, 2012, 5(3): 403-414.
|
| [13] |
李冬, 杨卓, 梁瑜海, 等. 耦合反硝化的CANON生物滤池脱氮研究[J].
中国环境科学, 2014, 34(6): 1448-1456.
LI Dong, YANG Zhuo, LIANG Yuhai, et al. Nitrogen removal performance by CANON biological filtration with denitrification[J]. China Environmental Science, 2014, 34(6): 1448-1456. |
| [14] |
杨麟. 好氧颗粒污泥快速培养及其去除生物营养物特性的研究[D]. 长沙: 湖南大学, 2008.
YANG Qi.Research on rapid cultivation of aerobic granular sludge and its characteristics in biological nutrient removal[D]. Changsha: Hunan University, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10532-2008081555.htm |
| [15] |
李冬, 苏庆岭, 梁瑜海, 等. 机械搅拌对CANON污泥快速颗粒化的影响[J].
中国环境科学, 2015, 35(1): 72-79.
LI Dong, SU Qingling, LIANG Yuhai, et al. Influence of mechanical stirring on the rapid granulation of CANON sludge[J]. China Environmental Science, 2015, 35(1): 72-79. |
| [16] |
HOU Xiaolin, LIU Sitong, ZHANG Zuotao. Role of extracellular polymeric substance in determining the high aggregation ability of anammox sludge[J].
Water Research, 2015, 75: 51-62.
|
| [17] |
LI Yuan, HUANG Zhenxing, RUAN Wenquan, et al. ANAMMOX performance, granulation, and microbial response under COD disturbance[J].
Journal of Chemical Technology & Biotechnology, 2015, 90(1): 139-148.
|
| [18] |
NI Shouqing, SUN Na, YANG Houling, et al. Distribution of extracellular polymeric substances in anammox granules and their important roles during anammox granulation[J].
Biochemical Engineering Journal, 2015, 101: 126-133.
DOI: 10.1016/j.bej.2015.05.014 |
| [19] |
TANG Chongjian, ZHENG Ping, WANG Caihua, et al. Performance of high-loaded ANAMMOX UASB reactors containing granular sludge[J].
Water Research, 2011, 45(1): 135-144.
DOI: 10.1016/j.watres.2010.08.018 |
| [20] |
NI Bingjie, RUSCALLEDA M, SMETS B F. Evaluation on the microbial interactions of anaerobic ammonium oxidizers and heterotrophs in Anammox biofilm[J].
Water Research, 2012, 46(15): 4645-4652.
DOI: 10.1016/j.watres.2012.06.016 |
| [21] |
MÓNICA F, JOSE RAMÓN V, ANUSKA M, et al. Is the CANON reactor an alternative for nitrogen removal from pre-treated swine slurry[J].
Biochemical Engineering Journal, 2012, 65: 23-29.
DOI: 10.1016/j.bej.2012.03.008 |
| [22] |
VÁZQUEZ-PADÍN J, FERNÁDEZ I, FIGUEROA M, et al. Applications of Anammox based processes to treat anaerobic digester supernatant at room temperature[J].
Bioresource Technology, 2009, 100(12): 2988-2994.
DOI: 10.1016/j.biortech.2009.01.028 |
| [23] |
AHN Y, CHOI H. Autotrophic nitrogen removal from sludge digester liquids in upflow sludge bed reactor with external aeration[J].
Process Biochemistry, 2006, 41(9): 1945-1950.
DOI: 10.1016/j.procbio.2006.04.006 |
| [24] |
SLIEKERS A O, THIRD K A, ABMA W, et al. CANON and Anammox in a gas-lift reactor[J].
FEMS Microbiology Letters, 2003, 218(2): 339-344.
DOI: 10.1016/S0378-1097(02)01177-1 |
| [25] |
SLIEKERS A O, DERWORT N, GOMEZ J L C, et al. Completely autotrophic nitrogen removal over nitrite in one single reactor[J].
Water Research, 2002, 36(10): 2475-2482.
DOI: 10.1016/S0043-1354(01)00476-6 |
| [26] |
INNEREBNERA G, INSAMA H, FRANKE-WHITTLEA I H, et al. Identification of anammox bacteria in a full-scale deammonification plant making use of anaerobic ammonia oxidation[J].
Systematic and Applied Microbiology, 2007, 30: 408-412.
DOI: 10.1016/j.syapm.2007.02.001 |
| [27] |
ZHANG Xiaojing, ZHANG Hongzhong, YE Changming, et al. Effect of COD/N ratio on nitrogen removal and microbial communities of CANON process in membrane bioreactors[J].
Bioresource Technology, 2015, 189: 302-308.
DOI: 10.1016/j.biortech.2015.04.006 |
| [28] |
ZHANG Zhaoji, LI Yuanyuan, CHEN Shaohua, et al. Simultaneous nitrogen and carbon removal from swine digester liquor by the Canon process and denitrification[J].
Bioresource Technology, 2012, 114: 84-89.
DOI: 10.1016/j.biortech.2012.03.006 |
| [29] |
HULLE VAN S W H, VANDEWEYER H J P, MEESSCHAERT B D, et al. Engineering aspects and practical application of autotrophic nitrogen removal from nitrogen rich streams[J].
Chemical Engineering Journal, 2010, 162(1): 1-20.
|
| [30] |
VÁZQUEZ-PADÍN J, MOSQUERA-CORRAL A, CAMPOS J L, et al. Microbial community distribution and activity dynamics of granular biomass in a CANON reactor[J].
Water Research, 2010, 44(15): 4359-4370.
DOI: 10.1016/j.watres.2010.05.041 |
| [31] |
LIANG Yuhai, LI Dong, ZHANG Xiaojing, et al. Nitrogen removal and microbial characteristics in CANON biofilters fed with different ammonia levels[J].
Bioresource Technology, 2014, 171: 168-174.
DOI: 10.1016/j.biortech.2014.08.072 |
| [32] |
JOSS A, DERLON N, CYPRIEN C, et al. Combined nitritation-anammox: Advances in understanding process stability[J].
Environmental Science & Technology, 2011, 45(22): 9735-9742.
|
| [33] |
CHO S, FUJⅡ N, LEE T, et al. Development of a simultaneous partial nitrification and anaerobic ammonia oxidation process in a single reactor[J].
Bioresource Technology, 2011, 102(2): 652-659.
DOI: 10.1016/j.biortech.2010.08.031 |
| [34] |
LAN C, KUMAR M, WANG C, et al. Development of simultaneous partial nitrification, anammox and denitrification (SNAD) process in a sequential batch reactor[J].
Bioresource Technology, 2011, 102(9): 5514-5519.
DOI: 10.1016/j.biortech.2010.11.024 |
| [35] |
DAVEREY A, SU S, HUANG Y, et al. Nitrogen removal from opto-electronic wastewater using the simultaneous partial nitrification, anaerobic ammonium oxidation and denitrification (SNAD) process in sequencing batch reactor[J].
Bioresource Technology, 2012, 113: 225-231.
DOI: 10.1016/j.biortech.2011.12.004 |
 2017, Vol. 49
2017, Vol. 49


