含氮生活污水不加处理就排放会导致水体的富营养化,目前, 城市生活污水处理厂常采用生物法去除其中的氮[1].传统的生物脱氮技术包括好氧硝化和缺氧反硝化两个过程,其中硝化过程中氨氮首先被氨氧化菌(AOB)氧化成亚硝态氮,再由亚硝态氮氧化菌(NOB)氧化成为硝态氮,而对于反硝化菌来说,无论是亚硝态氮还是硝态氮都可以作为最终电子受体完成向气态氮还原的过程[2].将硝化过程控制在亚硝化阶段的短程生物脱氮技术不仅节约了40%的碳源和25%的曝气量,而且提高了硝化和反硝化效率,缩短了反应时间[3].基于短程生物脱氮的显著优点,如何实现稳定的短程硝化成为了污水处理方向的研究热点[4-5].实现短程生物脱氮的关键是将硝化控制在亚硝化阶段,即抑制系统中亚硝态氮氧化菌(NOB)的活性[6].目前实现途径主要有控制温度[7]、pH[8]、DO[9]、游离氨(FA)[10]和游离亚硝酸(FNA)质量浓度[11-12]以及缩短污泥龄[6]和调整运行方式[13]等.
近来,有研究报道腐殖酸(HA)对硝化过程中亚硝酸积累有明显的促进作用[14-15].腐殖酸是大分子聚合物,化学结构复杂,带有羧基、酚基、酮基等活性基团[16],其相对分子质量为102~106,主要包括富里酸、黄腐酸和黑腐酸.腐殖酸(HA)普遍存在于自然环境中,Wilen等[17]在研究活性污泥主要化学成分时发现腐殖酸是除蛋白质之外所占比重最大的高分子化合物;佟娟等[18]在剩余污泥碱性发酵液中也发现了腐殖酸的存在,并且李欢等[19]研究了采用碱破解方法提取污泥中腐殖酸的方法.因此,基于已有的研究报道,可以利用污泥发酵液中的腐殖酸实现短程生物脱氮.张邵园等[15]在生物膜反应器中发现HA对NOB的抑制作用要高于AOB,从而通过控制腐殖酸的负荷在7 d左右的时间内出现并维持了亚硝酸积累;陈银广等[14]通过是否投加腐殖酸(HA)的批次试验表明了腐殖酸的投加在1 h内会引起更多的亚硝酸积累.然而,已有的研究关于接种污泥本身是否具有短程硝化效果以及HA对硝化菌(NOB)的抑制范围并没有明确的说明.因此,本实验通过接种不同类型污泥并分别投加不同质量浓度的HA,探究了HA是否依然能实现生物短程硝化.
1 试验 1.1 试验水质及污泥来源试验用水均为配水,构成如下:NH4Cl(20 mg/L)、NaNO2(20 mg/L),KH2PO4(40 mg/L),MgSO4·7H2O(20 mg/L),CaCl2·2H2O(10 mg/L),ZnSO4·7H2O(0.12 mg/L),H3BO3(0.15 mg/L),CuSO4·5H2O(0.03 mg/L),KI(0.18 mg/L),MnCl2·4H2O(0.12 mg/L),CoCl2·6H2O(0.15 mg/L),EDTA(10 mg/L),FeCl3·6H2O(1.5 mg/L).试验所用接种污泥分别取自:硝化活性遭到破坏的A2O反应器好氧段污泥,硝化活性较低,表示为Sc1;稳定运行的A2O反应器好氧段污泥,具有良好的全程硝化效果,表示为Sc2; 某以实际生活污水为处理对象的中试SBR反应器,具有较好的短程硝化效果,表示为Sp.试验所用腐殖酸购买于天津市光复精细化工研究所.
1.2 试验装置及运行运用人工配水进行了不同质量浓度的HA预处理不同类型活性污泥的试验.第一组试验为探究HA对硝化性能不好的污泥(Sc1)的影响.试验前将活性污泥用蒸馏水淘洗3遍,并用人工配水定容到有效容积为5 L的反应瓶内,此时混合液悬浮固体质量浓度(MLSS)约为2 000 mg/L.挥发性悬浮固体质量浓度(MLVSS)约为1 600 mg/L,然后将混合液均分为5份,分别放入有效容积为1.5 L的抽滤瓶内,编号为1~5,内有转子和pH及DO探头,采用磁力搅拌器调节转速.为测定活性污泥的起始硝化活性,直接加入氯化铵贮备液和亚硝酸钠贮备液,使混合液的初始NH4+-N质量浓度和NO2--N质量浓度为15~20 mg/L,然后曝气3 h.此外,用3 mol/L的盐酸溶液和2 mol/L的氢氧化钠溶液调节初始pH为7.5~8.0,维持DO在5 mg/L左右,排除pH和溶解氧在硝化过程中的影响.1号反应器设为空白试验,2~5号反应器分别投加0、80、160、240 mg/L (对应于0、50、100、150 mg/g MLVSS)的HA进行预处理,时间为24 h.反应时每隔15 min取样分析NH4+-N、NO3--N、NO2--N的变化.按上述方法分别使用硝化活性好的污泥(Sc2)和短程硝化效果良好的污泥(Sp)同时进行第2组和第3组试验.
1.3 分析项目与方法 1.3.1 常规项目检测方法NH4+-N、NO3--N、NO2--N由LACHAT Quikchem8500型流动注射仪测定(Lachat Instrument,Milwaukee,Wiscosin);MLSS及MLVSS采用重量法检测;pH、DO和温度采用WTW、Multi340i型便携式多功能pH/DO测定仪监测.
1.3.2 非常规项目检测方法腐殖酸(HA)的测定采用修正的Folin-Lowry法.采用腐殖酸作为标准物,将20 g Na2CO3和4 g NaOH溶于1 L蒸馏水得到试剂A,取1 mL样品,加入0.4 mL试剂A,迅速混合并将混合液在室温下静置10 min,加入Folin-酚试剂,迅速混合后静置30 min,溶液呈淡蓝色,使用分光光度计在波长为735 nm处测定吸光度值.
1.4 计算方法 1.4.1 氨氮氧化率(RAO)的计算方法| $ {R_{{\rm{AO}}}}{\rm{ = }}\frac{{{\rho _{\rm{始}}}{\rm{(N}}{{\rm{H}}_{\rm{4}}}^{\rm{ + }} - {\rm{N) - }}{\rho _{\rm{末}}}{\rm{(N}}{{\rm{H}}_{\rm{4}}}^{\rm{ + }} - {\rm{N)}}}}{{{\rho _{\rm{始}}}{\rm{(N}}{{\rm{H}}_{\rm{4}}}^{\rm{ + }} - {\rm{N)}}}}{\rm{ \times 100\% }}{\rm{.}} $ | (1) |
式中:ρ(NH4+-N)始为曝气开始时氨氮质量浓度,ρ末(NH4+-N)为曝气结束时氨氮质量浓度.
1.4.2 硝态氮积累率(RNA)的计算方法| $ {R_{{\rm{NA}}}}{\rm{ = }}\frac{{{\rho _{\rm{末}}}{\rm{(NO}}_3^ - - {\rm{N)}}}}{{{\rho _{\rm{末}}}{\rm{(NO}}_2^ - - {\rm{N) + }}{\rho _{\rm{末}}}{\rm{(NO}}_3^ - - {\rm{N)}}}}{\rm{ \times 100\% }}{\rm{.}} $ | (2) |
式中:ρ末(NO3--N)为曝气结束时硝态氮质量浓度,ρ末(NO2--N)为曝气结束时亚硝态氮质量浓度.
1.4.3 反应速率的计算方法1) 比氨氧化速率(RSAO)计算公式
| $ {R_{{\rm{SAO}}}}{\rm{ = }}\frac{{{\rm{(}}{\rho _{\rm{始}}}{\rm{(NH}}_4^ + - {\rm{N) - }}{\rho _{\rm{末}}}{\rm{(NH}}_4^ + - {\rm{N)) \times 1}}\;{\rm{440}}}}{{\rho \left( {{\rm{MLVSS}}} \right){\rm{ \times }}{{t}_{\rm{N}}}}}{\rm{.}} $ | (3) |
式中:ρ始(NH4+-N)为曝气开始时氨氮质量浓度(mg/L), ρ末(NH4+-N)为曝气结束时氨氮质量浓度(mg/L),ρ(MLVSS)为污泥质量浓度(mg/L),tN为曝气反应时间(min),1 440即60×24,将曝气反应时间(min)换算成以天(d)为单位.
2) 比硝态氮积累速率计算公式
| $ {R_{{\rm{SNaP}}}}{\rm{ = }}\frac{{{\rm{(}}{\rho _{\rm{末}}}{\rm{(NO}}_3^ - - {\rm{N) - }}{\rho _{\rm{始}}}{\rm{(NO}}_3^ - - {\rm{N)) \times 1}}\;{\rm{440}}}}{{\rho \left( {{\rm{MLVSS}}} \right){\rm{ \times }}{t_{\rm{N}}}}}{\rm{.}} $ | (4) |
式中:ρ末(NO3--N)为曝气结束时硝态氮质量浓度(mg/L),ρ始(NO3--N)为曝气开始时硝态氮质量浓度(mg/L).
2 结果与讨论 2.1 HA对Sc1硝化性能的影响图 1为Sc1污泥在不同HA质量浓度下的氨氮(NH4+-N),亚硝态氮(NO2--N)和硝态氮(NO3--N)变化.可以看出,Sc1系统接种的污泥硝化性能较差,在提供足够溶解氧和底物的条件下进行曝气3 h,NH4+-N和NO2--N几乎没有减少,表明氨氧化细菌(AOB)和亚硝态氮氧化细菌(NOB)的活性都较差.而经过HA预处理24 h后的污泥,在相同控制条件下,随着HA质量浓度的升高,NH4+-N的质量浓度没有发生明显变化,但NO2--N质量浓度呈现骤降趋势,伴随着NO3--N质量浓度出现同等程度的上升趋势.文献[14]报道投加70.8 mg/g MLVSS的HA在曝气1 h内出现了80%以上的NO2--N积累,HA的含量越高,NO2--N积累率也越高.但是在本实验中分别投加50、100、150 mg/g MLVSS(80、160、240 mg/L)的HA后NO2--N质量浓度都为0,显然没有出现NO2--N积累的现象.表明HA的投加促进了NO2--N向NO3--N的转化,这意味着对于Sc1系统,NOB的活性没有被抑制,反而被提高了.
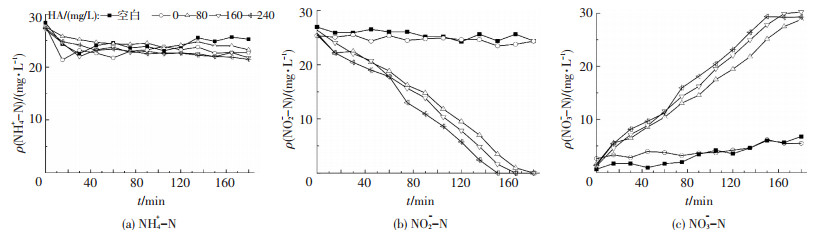
|
图 1 不同HA质量浓度下Sc1污泥NH4+-N,NO2--N,NO3--N的变化 Figure 1 Changes of NH4+-N, NO2--N, NO3--N at different HA concentrations of sludge Sc1 |
为进一步分析HA对活性污泥硝化性能的影响,考察了Sc1系统曝气结束时的氨氮氧化率(RAO)、比氨氧化速率(RSAO)、硝态氮积累率(RNA)以及比硝态氮积累速率(RSNaP)的变化规律(图 2).试验组1投加的是未经过任何处理的活性污泥,作为接种污泥,原始活性污泥的RAO和RSAO分别为11.02%和0.028 9 g/(gVSS·d),AOB的活性较差;2~5号反应器分别添加0、80、160、240 mg/L的HA经过24 h的预处理后,RAO依次为25.33%、13.87%、19.81%、21.96%,RSAO依次为0.034 6、0.029 0、0.033 8、0.037 8 g/(gVSS·d),AOB的活性依旧维持较低水平,而污泥的RNA从44.72%(0 mg/L HA)增长到55.28%(80 mg/L HA)、59.98%(160 mg/L HA)、78.82%(240 mg/L HA),对应的RSNaP也从0.050 6 g/(gVSS·d)增长到0.159 1、0.156 9、0.159 4 g/(gVSS·d).这也表明了HA的投加提高了NOB的活性,同时对AOB的活性没有产生影响.
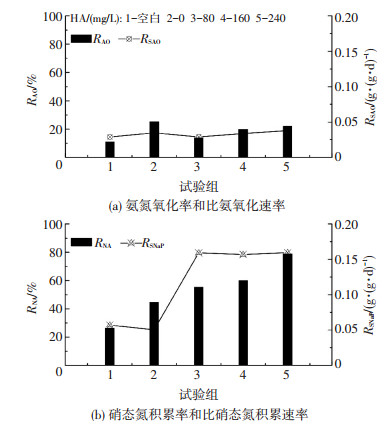
|
图 2 不同HA质量浓度下Sc1反应速率的变化 Figure 2 Changes of reaction rate at different HA concentrations of sludge Sc1 |
Sc2取自于运行稳定的A2O反应器好氧段污泥.该污泥经过3 h的曝气后,出水NH4+-N、NO2--N和NO3--N的质量浓度分别为6.94、0、35 mg/L(图 3),RAO为66.81%,并且RNA达到100%(图 4).可见Sc2中的AOB、NOB活性均较高.Sc2经过不同质量浓度的HA预处理24 h后出水NH4+-N质量浓度分别为13.37(0 mg/L HA)、11.76(80 mg/L HA)、12.24(160 mg/L HA)、11.91 mg/L(240 mg/L HA),而各组的NO2--N依然全部转化为NO3--N,并未出现亚硝积累.文献[15]报道在生物膜硝化反应系统中当进水HA单位TOC负荷在0.03~0.05 kg/(h·m3)时反应器内亚硝积累能达到57%以上,主要原因是HA对AOB和NOB都有抑制作用,但是NOB对HA抑制的敏感程度要高于AOB,从而通过控制HA的质量浓度可以实现亚硝积累.然而本试验中HA的投加也并未抑制NOB的活性,该污泥的硝化类型依旧为稳定的全程硝化,但与Sc1污泥相比,HA的投加也并没有进一步提高NOB的活性.
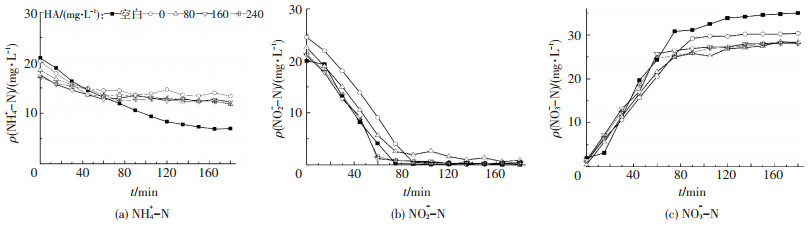
|
图 3 不同HA质量浓度下Sc2污泥NH4+-N,NO2--N,NO3--N的变化 Figure 3 Changes of NH4+-N, NO2--N, NO3--N at different HA concentrations of sludge Sc2 |
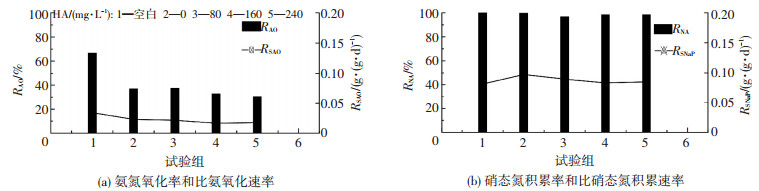
|
图 4 不同HA质量浓度下Sc2污泥反应速率的变化 Figure 4 Changes of reaction rate at different HA concentrations of sludge Sc2 |
图 5为不同HA质量浓度下Sp污泥NH4+-N、NO2--N、NO3--N的变化.接种原始污泥的反应器3 h内NH4+-N几乎全部转化为NO2--N,而显然几乎没有NO3--N的生成.因为Sp污泥取自稳定运行的短程硝化反应器,该污泥在长期实时控制的作用下,AOB相比NOB已成为明显的优势菌群,或者已实现从系统中淘汰[20],所以,即使底物存在NO2--N,从NO2--N到NO3--N依旧不会进行.这也说明HA的投加并没有改变短程Sp污泥的菌群结构,依然进行短程硝化.
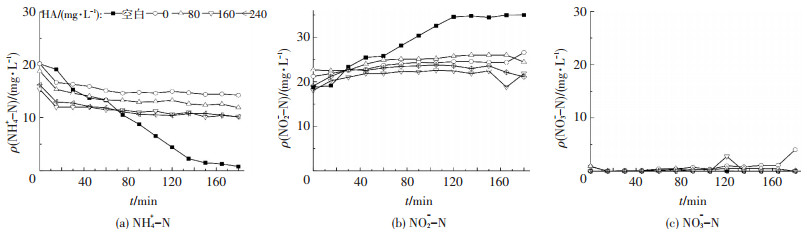
|
图 5 不同HA质量浓度下Sp污泥NH4+-N,NO2--N,NO3--N的变化 Figure 5 Changes of NH4+-N, NO2--N, NO3--N at different HA concentrations of sludge Sp |
综上,通过接种不同类型的污泥投加不同质量浓度的HA,并没有实现生物短程硝化,反而提高了硝化活性不好的污泥中NOB的活性.原因可能是腐殖酸本身均有复杂稳定的化学结构,同时含有大量丰富的活性功能团,如羟基、酚羟基、醌基等,能提高将亚硝酸盐氧化为硝酸盐的亚硝酸盐氧化还原酶(NXR)的活性,而对于将氨氮转化为亚硝酸盐的氨单加氧酶(AMO)和羟胺氧还酶(HAO)没有影响.这与之前张邵园[15]、陈银广[14]等的研究结果有所不同.鉴于已有研究和本研究都是基于HA对硝化菌活性的短期影响,至于利用HA长期驯化的硝化污泥是否具有短程硝化特性,还需进一步的研究.
3 结论1) 对于硝化活性不好的污泥Sc1,HA的投加可以提高其NOB的活性,当HA的质量浓度在80 mg/L(50 mg/g MLVSS)时, RSNaP就从0.050 6 g/(gVSS·d)增长到0.159 1 g/(gVSS·d),同时不会对AOB的活性产生影响,RSAO基本没有改变.
2) 对于硝化活性良好的污泥Sc2,HA的投加不会再进一步提高AOB和NOB的活性,同时不会有抑制作用产生.
3) 对于短程硝化效果良好的污泥Sp,HA的投加不会破坏其短程效果,由于NOB较少,基本上不会有NO3--N的积累.
| [1] |
CONLEY D J. Ecology.Controlling eutrophication: Nitrogen and phosphorus[J].
Science, 2009, 323(5917): 1014-1015.
DOI: 10.1126/science.1167755 |
| [2] |
TURK O, MAVINIC D S. Preliminary assessment of a shortcut in nitrogen removal from wastewater[J].
Can J Civil Eng, 1986, 13: 600-605.
DOI: 10.1139/l86-094 |
| [3] |
GU Shengbo, WANG Shuying, YANG Qing, et al. Start up partial nitrification at low temperature with a real-time control strategy based on blower frequency and pH[J].
Bioresource Technology, 2012, 112: 34-41.
DOI: 10.1016/j.biortech.2011.12.028 |
| [4] |
YANG Qing, PENG Yongzhen, LIU Xiuhong, et al. Nitrogen removal via nitrite from municipal wastewater at low temperatures using real-time control to optimize nitrifying communities[J].
Environmental Science & Technology, 2007, 41(23): 8159-8164.
|
| [5] |
FUX C, BOEHLER M, HUBER P, et al. Biological treatment of ammonium-rich wastewater by partial nitritation and subsequent anaerobic ammonium oxidation (anammox) in a pilot plant[J].
Journal of Biotechnology, 2002, 99(3): 295-306.
DOI: 10.1016/S0168-1656(02)00220-1 |
| [6] |
GE Shijian, WANG Shuying, YANG Xiong, et al. Detection of nitrifiers and evaluation of partial nitrification for wastewater treatment: A review[J].
Chemosphere, 2015, 140: 85-98.
DOI: 10.1016/j.chemosphere.2015.02.004 |
| [7] |
HELLINGA C, SCHELLEN A, MULDER J W, et al. The SHARON process: An innovative method for nitrogen removal from ammonium-rich waste water[J].
Water Science & Technology, 1998, 37(9): 135-142.
|
| [8] |
VILLAVERDE S, GARCIAENCINA P A, FDZPOLANCO F. Influence of pH over nitrifying biofilm activity in submerged biofilters[J].
Water Research, 1997, 31(5): 1180-1186.
DOI: 10.1016/S0043-1354(96)00376-4 |
| [9] |
BLACKBURNE R, YUAN Zhiguo, KELLER J. Partial nitrification to nitrite using low dissolved oxygen concentration as the main selection factor[J].
Biodegradation, 2008, 19(2): 303-312.
DOI: 10.1007/s10532-007-9136-4 |
| [10] |
ZHOU Yan, OEHMEN A, LIM M, et al. The role of nitrite and free nitrous acid (FNA) in wastewater treatment plants[J].
Water Research, 2011, 45(15): 4672-4682.
DOI: 10.1016/j.watres.2011.06.025 |
| [11] |
PARK S, BAE W, RITTMANN B E. Operational boundaries for nitrite accumulation in nitrification based on minimum/maximum substrate concentrations that include effects of oxygen limitation, pH, and free ammonia and free nitrous acid inhibition[J].
Environmental Science & Technology, 2010, 44(1): 335-342.
|
| [12] |
TORA J A, LAFUENTE J, BAEZA J A, et al. Combined effect of inorganic carbon limitation and inhibition by free ammonia and free nitrous acid on ammonia oxidizing bacteria[J].
Bioresource Technology, 2010, 101(15): 6051-6058.
DOI: 10.1016/j.biortech.2010.03.005 |
| [13] |
POLLICE A, TANDOI V, LESTINGI C. Influence of aeration and sludge retention time on ammonium oxidation to nitrite and nitrate[J].
Water Research, 2002, 36(10): 2541-2546.
DOI: 10.1016/S0043-1354(01)00468-7 |
| [14] |
JI Zhouyin, CHEN Yinguang. Using sludge fermentation liquid to improve wastewater short-cut nitrification-denitrification and denitrifying phosphorus removal via nitrite[J].
Environmental Science & Technology, 2010, 44(23): 8957-8963.
|
| [15] |
ZHANG Shaoyuan, WANG Jusi, JIANG Zhaochun, et al. Nitrite accumulation in an attapulgas clay biofilm reactor by fulvic acids[J].
Bioresource Technology, 2000, 73(1): 91-93.
DOI: 10.1016/S0960-8524(99)00133-9 |
| [16] |
SCHRAMM K W, BEHECHTI A, BECK B, et al. Influence of an aquatic humic acid on the bioconcentration of selected compounds in Daphnia magna[J].
Ecotoxicology & Environmental Safety, 1998, 41(1): 73-76.
|
| [17] |
WILEN B M, JIN B, LANT P. The influence of key chemical constituents in activated sludge on surface and flocculating properties[J].
Water Research, 2003, 37(9): 2127-2139.
DOI: 10.1016/S0043-1354(02)00629-2 |
| [18] |
TONG Juan, CHEN Yingung. Recovery of nitrogen and phosphorus from alkaline fermentation liquid of waste activated sludge and application of the fermentation liquid to promote biological municipal wastewater treatment[J].
Water Research, 2009, 43(12): 2969-2976.
DOI: 10.1016/j.watres.2009.04.015 |
| [19] |
李欢, 金宜英, 聂永丰. 污水污泥中腐殖酸的提取和利用[J].
清华大学学报, 2009, 49(12): 1980-1983.
LI Huan, JIN Yiying, NIE Yongfeng. Extraction and utilization of humic acid in waste water and sludge[J]. Journal of Tsinghua University, 2009, 49(12): 1980-1983. DOI: 10.3321/j.issn:1000-0054.2009.12.017 |
| [20] |
杨庆. 基于实时控制的SBR工艺短程深度脱氮基础研究与中试[D]. 北京: 北京工业大学, 2009.
YANG Qing. Foundation and pilot-scale research on advanced nitrogen removal via nitrite in SBR based on real-time control[D]. Beijing: Beijing University of Technology, 2009" http://d.wanfangdata.com.cn/Thesis/Y1571163 |
 2017, Vol. 49
2017, Vol. 49


