2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学), 哈尔滨 150090;
3. 绿色化工技术重点实验室(哈尔滨理工大学), 哈尔滨 150040;
4. 哈尔滨工业大学科学与工业技术研究院, 哈尔滨 150090;
5. 山东建筑大学 市政与环境工程学院, 济南 250000
2. State Key Laboratory of Urban Water Resource and Environment (Harbin Institute of Technology), Harbin 150090, China;
3. Key Laboratory of Green Chemical Engineering and Technology of College of Heilongjiang Province (Harbin University of Science and Technology), Harbin 150040, China;
4. School of Science and Industrial Technology, Harbin Institute of Technology, Harbin 150090, China;
5. School of Municipal and Environmental Engineering, Shandong Jianzhu University, Jinan 250000, China
近年来,内分泌干扰物类物质在水体中越来越多地被检测出来,其生物致癌致突变性引起广泛重视.六氟双酚A(BPAF)是一种具有极强危害性的内分泌干扰物,其分子结构与双酚A结构类似,结合人体内分泌α和β受体位置的能力比双酚A分别高20和50倍[1-2].此外,由于BPAF有较强的化学稳定性,在水体中的半衰期较长而很难被自然过程降解,因此,BPAF在地表水体中经常被检测出来,德国3/4的地表水和水库水中都检测出了BPAF[3-4].然而目前针对BPAF水处理工艺的研究还较少.
过一硫酸盐(PMS, HSO5-)是一种便于运输且绿色环保的氧化剂,其通过紫外(254 nm)催化后能够有效地产生HO·(E0=2.73 V vs NHE)和SO4-·(E0=2.6 V vs NHE) (式(1)),从而能够有效地对水体中的有机微污染物进行去除[5].
| $ \begin{array}{*{20}{c}} {{\rm{HS}}{{\rm{O}}_{\rm{5}}}^ - + {\rm{hv}} \to {\rm{HO}} \cdot {\rm{ + SO}}_4^ - .}\\ {\varepsilon = 14\;{\rm{L}} \cdot {\rm{mo}}{{\rm{l}}^{{\rm{ - 1}}}} \cdot {\rm{c}}{{\rm{m}}^{ - 1}}, \varphi = 0.52\;{\rm{mol}} \cdot {\rm{Einstei}}{{\rm{n}}^{{\rm{ - 1}}}}.} \end{array} $ | (1) |
式中ε和φ分别指PMS在紫外波长254 nm照射下的摩尔吸光系数和量子产率.Sharma等[6]利用紫外(1.26 μE·s-1)催化PMS降解双酚A,结果表明,当双酚A、PMS的浓度分别为220和660 μmol/L,双酚A降解的假一级速率为0.025 min-1.
高锰酸钾(KMnO4)作为常用的水处理预氧化剂,近些年在水处理中的应用越来越广泛,KMnO4本身能够选择性氧化降解烯烃类化合物和酚类化合物,主要是通过双键加成、脱氢反应和电子转移反应[7].江进[8]研究发现,KMnO4与双酚A的反应速率随pH的升高而增加,当pH=9时,其二级反应速率达870 L·mol-1·s-1.此外,高锰酸钾被还原至稳定价态如Mn(Ⅱ)和Mn(Ⅳ)的过程中会经历中间价态如Mn(Ⅲ)、Mn(Ⅴ)等形态化合物,这些中间价态锰也被证明有很强的氧化能力.庞素艳等[9]利用高锰酸钾降解三氯生,发现络合剂能够促进高锰酸钾降解三氯生,这主要是由于络合剂使中间态锰的稳定性增强,有效发挥了中间态锰的氧化能力.
UV/PMS和KMnO4氧化工艺都已经被证明能有效地去除水中有机微污染物,但是目前还没有对KMnO4耦合UV/PMS工艺降解有机物的报道.本文对比研究UV/PMS/KMnO4和UV/PMS工艺降解BPAF的效能.考察不同pH、PMS投加量、KMnO4浓度对两种工艺去除BPAF的影响,此外利用实际水体验证UV/PMS/KMnO4对BPAF去除的可行性,并对机理进行初步探索.
1 实验 1.1 实验试剂过一硫酸盐、高锰酸钾、六氟双酚A,叔丁醇和甲醇均为ACS级,购自美国西格玛公司;磷酸一氢钠、磷酸二氢钠均为分析纯级,购自国药集团化学试剂有限公司;其余所需试剂均为分析纯,试剂与反应液均用去离子水配置(Milli-pore, 18 MΩ·cm);实际水体分别取自松花江、淮河、湖水和地下水,实验时用0.45 μmol/L玻璃纤维滤膜过滤.
1.2 分析方法六氟双酚A利用液相色谱(HPLC, Waters 2695) 进行检测,色谱柱为symmetry C18 (4.6×150 mm, 5 μm particle size, Waters),光电二极管阵列检测器(Waters 2998),流动相采用甲醇和1‰乙酸(40:60),流速为1.0 mL·min-1,进样体积为100 μL,检测波长分别为270 nm.KMnO4浓度采用ABTS(2, 2’-联氮-双-(3-乙基苯并噻唑林-6-磺酸))方法进行测定[10].过一硫酸盐浓度采用碘量法进行检测[5].采用pH检测器(UB-7, Denver)检测溶液pH,TOC检测仪(Multi 3100 N/C,Shimadzu)检测总有机碳(TOC).
1.3 实验装置与步骤紫外装置中放置4支紫外灯(254 nm,GPH212T5L/4,10 W,贺利氏),采用平行光束照射反应皿中的反应液(100 mL),紫外灯到反应液表面距离为30 cm,辐射光强为1.291×10-7 Einstein·L-1·s-1.反应温度为(20±1) ℃,用1 mmol/L磷酸盐做缓冲,反应pH利用1 mol/L HClO4和1 mol/L NaOH进行调节,在不同时间点取1 mL待测液体用30 μL盐酸羟胺(10 mmol/L)终止反应.
2 结果与讨论 2.1 PMS与KMnO4投加量的影响由图 1可知,UV/PMS和UV/PMS/KMnO4两种体系中,随着PMS投加量的增加,BPAF的去除率也随着增加.当PMS投加量由0.2 mmol/L增加到1.5 mmol/L时,经过20 min后,UV/PMS体系中BPAF的去除率由11.3%增加到65.9%,UV/PMS/KMnO4体系中BPAF的去除率由18%增加到77%.这主要是由于随着PMS投加量的增加,体系中HO·和SO4-·的稳态浓度增加,从而大大增加了目标物去除的速率.在各PMS投加量下,KMnO4对UV/PMS降解BPAF都有明显的促进作用,例如当PMS投加量为1 mmol/L、KMnO4投加量为1.5 μmol/L时,UV/PMS/KMnO4体系比UV/PMS体系对BPAF的去除效率高16.7%.

|
实验条件:[KMnO4]=1.5 μmol·L-1, [BPAF]=10 μmol·L-1, IUV=1.291×10-7 Einstein·L-1·s-1,pH= 6.8,t=20 min 图 1 PMS投加量对UV/PMS和UV/PMS/KMnO4降解六氟双酚A的影响 Figure 1 Impacts of PMS dosages on the degradation efficiencies of BPAF in UV/PMS and UV/PMS/KMnO4 processes |
图 2表明了KMnO4投加量对UV/PMS/KMnO4氧化体系降解BPAF的影响.结果表明,在PMS投加量为1 mmol/L,当没有投加KMnO4时,BPAF的去除率为48.6%,当KMnO4投加量为1.5 μmol/L时,BPAF的去除率增加到66.8%.但是继续增加KMnO4投加量时,BPAF的去除率不再增大.

|
实验条件:[PMS]=1 mmol·L-1, [BPAF]=10 μmol·L-1, IUV=1.291×10-7 Einstein·L-1·s-1, pH= 6.8,t=20 min 图 2 KMnO4投加量对UV/PMS和UV/PMS/KMnO4降解六氟双酚A的影响 Figure 2 Impacts of KMnO4 dosages on the degradation efficiencies of BPAF in UV/PMS and UV/PMS/KMnO4 processes |
选取3.26、5.79、6.74和8.60 4个pH对UV/PMS和UV/PMS/KMnO4两种氧化体系降解BPAF的影响进行研究,结果如图 3所示.在偏中酸性条件下(pH 3~7),BPAF的去除率随着pH增加而降低,但是当pH=9时,BPAF的去除率达最高,其在UV/PMS和UV/PMS/KMnO4中的去除率分别为95.1%和97.4%.由于BPAF的pKa为9.2,在本实验条件下(pH=3.26~8.60) BPAF的形态不产生变化,推测pH的影响可能有以下几方面:1) 当pH < 7时,PMS的摩尔吸光系数为12.5~14 L·mol-1·cm-1,紫外催化PMS作用受pH影响不大[11];但是当偏中性条件时,PMS的自分解反应增强和SO4-·反应产生HO·,降低了体系的总氧化能力,导致BPAF的降解效率降低[12].周俊等[13]在研究UV/PMS降解硝基氯酚受pH影响时也发现了同样现象.2) 当pH > 8时,PMS的摩尔吸光系数随pH的增加而显著增加,例如当pH由8增加到12时,其由13.8 L·mol-1·cm-1增加到149.5 L·mol-1·cm-1[11],因此,当pH增加时,体系中自由基的稳态浓度会显著增加,从而大大增加了目标物的去除效率.

|
实验条件:[PMS]=1 mmol·L-1, [BPAF]=10 μmol·L-1, [KMnO4]=1.5 μmol·L-1, IUV=1.291×10-7 Einstein·L-1·s-1, t=20 min 图 3 pH对UV/PMS和UV/PMS/KMnO4降解六氟双酚A的影响 Figure 3 Impacts of solution pH on the degradation efficiencies of BPAF in UV/PMS and UV/PMS/Mn(Ⅶ) processes |
推测UV/PMS/KMnO4比UV/PMS去除BPAF效率高的原因可能有以下两点:KMnO4本身的氧化性增强了BPAF的去除效果;反应过程中产生的某些中间态锰能够有效促BPAF降解.
研究中同时进行空白实验,如单独KMnO4、单独PMS、单独UV等对BPAF进行氧化,结果如图 4所示,当pH为6.8时,只有UV/PMS和UV/PMS/KMnO4两种工艺能够有效地降解BPAF,而且UV/PMS/KMnO4降解效果更好.其他的氧化工艺条件下BPAF基本没有降解.结果表明,单独PMS、单独KMnO4、单独UV均不能氧化BPAF,因此,可以排除KMnO4本身对BPAF的氧化提高UV/PMS去除BPAF效率的可能性.

|
实验条件:[BPAF]=10 μmol·L-1, [PMS]=1 mmol·L-1, IUV=1.291×10-7 Einstein·L-1·s-1, pH=6.8, t=20 min 图 4 各氧化工艺对BPAF的降解效果 Figure 4 BPAF degradation in various oxidation processes |
采用甲醇和叔丁醇作为SO4-·和HO·的捕获实验,结果如图 5所示.甲醇基本上能够完全抑制UV/PMS对BPAF的降解,并没有完全抑制UV/PMS/KMnO4对BPAF的降解,这表明在对UV/PMS/KMnO4氧化BPAF的过程中有非自由基的氧化活性物种生成.因此,推测KMnO4的催化作用最有可能的原因是在紫外和PMS的共同作用下,体系中产生了中间价态锰,中间价态锰的引入能够有效增加BPAF的去除效率.
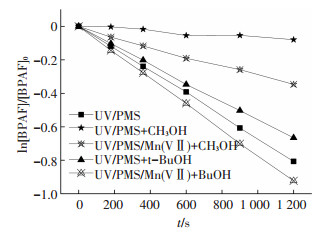
|
实验条件:[BPAF]=10 μmol·L-1, [PMS]=1 mmol·L-1, IUV=1.291×10-7 Einstein·L-1·s-1, pH=6.8, t=20 min 图 5 甲醇和叔丁醇对UV/PMS和UV/PMS/KMnO4降解BPAF的影响 Figure 5 Impacts of methanol and Tert-butyl-alcohol on the degradation efficiencies of BPAF in UV/PMS and UV/PMS/KMnO4 processes |
有研究报道了中间价态锰的催化氧化作用.江进[14]在研究中发现中间价态锰如3价锰(Mn(Ⅲ))和5价锰((Mn(Ⅴ))分别具有一电子和二电子氧化特性,它们具有很强的氧化能力,特别是对酚类化合物有较好的降解效果.庞素艳[15]在研究中也发现Mn(Ⅱ)和Mn(Ⅲ)能够有效地催化PMS氧化降解酚类化合物,而且Mn(Ⅲ)催化PMS氧化效能明显高于Mn(Ⅱ)催化PMS体系.因此,KMnO4对UV/PMS体系降解BPAF的促进作用可能是由于反应过程中产生的中间价态锰能够氧化BPAF或催化PMS促进了BPAF的降解.
2.4 实际水体实验配水实验结果表明,KMnO4能够有效地促进UV/PMS氧化降解BPAF,但是考察实际水体中KMnO4对UV/PMS去除BPAF作用的研究更有意义.实验所用实际水体分别为松花江水、淮河水、地下水和管网出水,实验水体水质如表 1所示.
| 表 1 实验所用实际水体水质 Table 1 Water quality of the actual water for test use |
图 6结果表明,在4种实际水体中,UV/PMS和UV/PMS/KMnO4工艺能够有效地去除水中的BPAF,这主要是由于氧化体系中产生的HO·和SO4-·选择性低,从而能够有效地进攻目标物,有研究表明在天然有机物存在的条件下,SO4-·比HO·能更有效地降解水体中的有机微污染物(如阿特拉津)[15].研究结果还表明,KMnO4对UV/PMS降解BPAF都有显著的促进作用,松花江水、淮河水、地下水和管网出水中BPAF的去除率分别增加了12.6%、14.4%、12.4%和14.1%,这表明在实际水体中,UV/PMS/KMnO4氧化体系仍然能够比UV/PMS氧化体系更有效地去除水体中的BPAF,这主要是由于中间价态锰的氧化能力不受水体中常见的氯离子、碳酸跟离子等的干扰,此外,水体中存在的天然有机物可能会利用其配位络合能力与反应过程中的中间价态锰形成络合物而更好地降解有机为污染物[16].
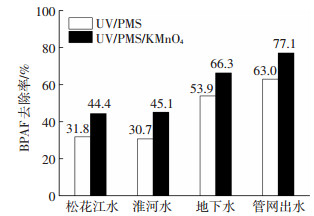
|
实验条件:[PMS]=1.5 mmol·L-1, [KMnO4]=3 μmol·L-1, [BPAF]=10 μmol·L-1, t=20 min 图 6 UV/PMS与UV/PMS/KMnO4降解实际水体中BPAF效率对比 Figure 6 Efficiencies comparison of BPAF degradation with UV/PMS and UV/PMS/KMnO4 processes in actual water |
1) PMS投加量的增加能够显著提高UV/PMS和UV/PMS/KMnO4对六氟双酚A的去除效率.
2) 在相同PMS投加量(1 mmol/L)条件下,投加少量的(0-1.5 μmol/L)KMnO4能够有效地促进六氟双酚A的降解,但是继续投加KMnO4,促进作用不明显.
3) 在实际水体中,UV/PMS/KMnO4氧化体系依然比UV/PMS氧化体系对六氟双酚A的降解效率高.
4) KMnO4对UV/PMS氧化BPAF的促进作用可能是由于高锰酸钾在紫外和PMS的共同作用下产生中间价态锰,中间价态锰能够氧化BPAF或催化PMS促进了BPAF的降解.
| [1] |
YANG Y, YIN J, YANG Y, et al. Determination of bisphenol AF (BPAF) in tissues, serum, urine and feces of orally dosed rats by ultra-high-pressure liquid chromatography-electrospray tandem mass spectrometry[J].
Journal of Chromatography B, 2012, 901: 93-97.
DOI: 10.1016/j.jchromb.2012.06.005 |
| [2] |
ZHANG L, LV J, XU T, et al. High efficiency removal and recovery of an endocrine disrupting compound-bisphenol AF from wastewaters[J].
Separation and Purification Technology, 2013, 116: 145-153.
DOI: 10.1016/j.seppur.2013.05.036 |
| [3] |
UMAR M, RODDICK F, FAN L, et al. Application of ozone for the removal of bisphenol A from water and wastewater:A review[J].
Chemosphere, 2013, 90(8): 2197-2207.
DOI: 10.1016/j.chemosphere.2012.09.090 |
| [4] |
LIU Y, ZHANG X, WU F. Photodegradation of bisphenol AF in montmorillonite dispersions: Kinetics and mechanism study[J].
Applied Clay Science, 2010, 49(3): 182-186.
DOI: 10.1016/j.clay.2010.05.002 |
| [5] |
LUO C W, MA J, JIANG J, et al. Simulation and comparative study on the oxidation kinetics of atrazine by UV/H2O2, UV/HSO5- and UV/S2O82-[J].
Water Research, 2015, 80: 99-108.
DOI: 10.1016/j.watres.2015.05.019 |
| [6] |
SHARMA J, MISHRA I M, DIONYSIOU D D, et al. Oxidative removal of Bisphenol A by UV-C/peroxymonosulfate (PMS): Kinetics, influence of co-existing chemicals and degradation pathway[J].
Chemical Engineering Journal, 2015, 276: 193-204.
DOI: 10.1016/j.cej.2015.04.021 |
| [7] |
WALDEMER R H, TRATNYEK P G. Kinetics of contaminant degradation by permanganate[J].
Environmental Science & Technology, 2006, 40(3): 1055-1061.
|
| [8] |
JIANG J, PANG S Y, MA J. Oxidation of triclosan by permanganate (Mn(Ⅶ)): Importance of ligands and in situ formed manganese oxides[J].
Environmental Science & Technology, 2009, 43(21): 8326-8331.
|
| [9] |
庞素艳, 王强, 鲁雪婷, 等. 中间价态锰强化KMnO4氧化降解三氯生[J].
哈尔滨工业大学学报, 2015, 47(2): 87-91.
PANG Suyan, WANG Qiang, LU Xueting, et al. Oxidative removal of triclosan by potassium permanganate enhanced with manganese intermediates[J]. Journal of Harbin Institute of Technology, 2015, 47(2): 87-91. DOI: 10.11918/j.issn.0367-6234.2015.02.016 |
| [10] |
JIANG J, PANG S Y, MA J. Role of ligands in permanganate oxidation of organics[J].
Environmental Science & Technology, 2010, 44(11): 4270-4275.
|
| [11] |
GUAN Y H, MA J, LI X, et al. Influence of pH on the formation of sulfate and hydroxyl radicals in the uv/peroxymonosulfate system[J].
Environmental Science & Technology, 2011, 45(21): 9308-9314.
|
| [12] |
HANCI T O, IMREN C, KABDASLI I, et al. Application of the UV C photo assisted peroxymonosulfate oxidation for the mineralization of dimethyl phthalate in aqueous solutions[J].
Photochemical & Photobiological Sciences, 2011, 10(3): 419-424.
|
| [13] |
周骏, 肖九花, 方长玲, 等. UV/PMS体系硝基氯酚降解动力学及机理研究[J].
中国环境科学, 2016(1): 66-73.
ZHOU Jun, XIAO Jiuhua, FANG Changling, et al. Degradation kinetics and mechanisms of chloronitrophenol in UV/PMS system[J]. China Environmental Science, 2016(1): 66-73. |
| [14] |
江进. 高价态锰、铁氧化降解水中典型有机物的特性与机理研究[D]. 哈尔滨: 哈尔滨工业大学, 2009.
JIANG Jin. Characteristics and mechanisms for oxidative degradation of typical organic compounds in aqueous solution by high valent manganese and iron species[D]. Harbin: Harbin Institute of Technology, 2009. http://d.wanfangdata.com.cn/Thesis/D269489 |
| [15] |
LUTZE H V, BIRCHER S, RAPP I, et al. Degradation of chlorotriazine pesticides by sulfate radicals and the influence of organic matter[J].
Environmental Science & Technology, 2015, 49(3): 1673-1680.
|
| [16] |
庞素艳. 铁锰催化H2O2、KHSO5、KMnO4氧化降解酚类化合物的效能与机理研究[D]. 哈尔滨: 哈尔滨工业大学, 2011.
PANG Suyan. Effectiveness and mechanism of the oxidation of phenolic compounds by hydrogen peroxide, peroxymonosulfate and permanganate catalyzed with iron and mangnese[D]. Harbin:Harbin Institute of Technology, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10213-1011279501.htm |
 2017, Vol. 49
2017, Vol. 49


