2. 北京德威佳业科技有限公司, 北京 100020;
3. 城市水资源与水环境国家重点实验室(哈尔滨工业大学), 哈尔滨 150090
2. Beijing Dewei Jiaye Science and Technology Co., Ltd., Beijing 100020, China;
3. State Key Laboratory of Urban Water Resource and Environment (Harbin Institute of Technology), Harbin 150090, China
以邻苯二甲酸二丁酯(DBP)为代表的环境雌激素类污染物分布广泛,难以被生物降解,易进入水环境中,并通过食物链等进入生物体内进行富集,对健康造成伤害[1-2].基于硫酸根自由基的高级氧化法因氧化力强、低能耗、二次污染小等优势,近年来受到众多学者的广泛研究[3-5].尖晶石铁氧体是一种不溶于水且具磁性的稳定化合物,对过硫酸盐(PMS)具有一定的活化作用[6].Lin等[7]研究了4种不同A位金属的尖晶石铁氧体催化过硫酸盐降解水中DBP的实验,得出CoFe2O4催化降解DBP效果最好且具有较强磁性.石墨烯具有较大的比表面积、良好的稳定性和吸附能力,与催化剂负载能够显著提高催化效能[8-9].伊玉等[10]制备出可磁性回收催化剂CoFe2O4/GO,并用于催化过硫酸盐降解酸性橙Ⅱ,水中COD去除率可达到90%以上.Luo等[11]制备ZnO/石墨稀用于光催化降解亚甲基蓝,降解效果约为纯ZnO的2.5倍.目前,将复合型石墨.烯催化剂用于催化氧化过硫酸盐去除水中污染物的研究较少.
本文采用共沉淀方法制得复合型GO/CoFe2O4催化剂,并用于催化PMS去除水中DBP,通过扫描和透射电镜、X射线衍射仪、X射线光电子能谱分析对GO/CoFe2O4性能进行了研究,考察了不同水质条件下GO/CoFe2O4催化PMS去除水中DBP的效果,提出了催化反应机理,并对催化剂的稳定性进行了研究.
1 实验 1.1 试剂和仪器硝酸钴(天津市巴斯夫化工有限公司),硝酸铁(天津市光复精细化工研究所),氢氧化钠(天津市大陆化学试剂厂),氧化石墨烯溶液(自制),过硫酸盐(PMS,Sigma Aldrich),邻苯二甲酸二丁酯(DBP,天津市复宇精细化工有限公司),乙醇(EtOH,天津市天力化学试剂有限公司),叔丁醇(TBA,天津市福晨化学试剂厂),去离子水.除过硫酸盐为优级纯外,其余均为分析纯.
S-4800型扫描电子显微镜(SEM,日本日立公司);JSM-2010型透射电子显微镜(TEM,日本电子株式会社);XSAM 800型X射线光电子能谱仪(XPS,英国岛津公司);D/max-TTR-Ⅲ系列X射线衍射仪(XRD,日本理学公司);1100型高效液相色谱仪(HPLC,美国安捷伦公司);DK-98-1型电热恒温水浴锅(天津泰斯特公司);DK-98-Ⅱ型电子万用炉(天津泰斯特公司);SHZ-D(Ⅲ)型真空抽滤机(巩义市予华仪器有限责任公司).
1.2 GO/CoFe2O4的制备量取75 mL氧化石墨烯溶液超声均匀待用,并配制4 mol/L NaOH溶液备用.称取0.01 mol硝酸钴和0.02 mol硝酸铁溶于25 mL水中,将石墨烯溶液与混合溶液置于三口瓶中,90 ℃水浴加热并机械搅拌均匀后缓慢滴入30 mL NaOH溶液,反应2 h,重复过滤洗涤至滤液呈中性,抽滤,将反应物放入烘箱内80 ℃烘干5 h,取出研磨,获得粉末状GO/CoFe2O4催化剂.
1.3 性能测试方法 1.3.1 物理性能表征将样品在80 ℃下烘干12 h,采用SEM和TEM在不同放大倍数下对催化剂的表面形貌进行表征.采用XPS分析判断样品中所含元素种类及价态.将样品研磨干燥后采用XRD对催化剂晶型进行表征.测试条件为:CuKα/石墨单色器,管电压30 kV,管电流150 mA,步进角度为0.1°,扫描速率为10(°)/min,扫描角度为10°~90°.
1.3.2 DBP分析方法采用HPLC对DBP进行检测,检测条件为:流动相中去离子水与甲醇的比例为1:4,进样量为80 μL,波长为280 nm,柱温为35 ℃,流量为1 mL/min,检测时长为6 min.DBP去除率
| $ E = \left( {1 - \rho /{\rho _0}} \right) \times 100\% . $ |
式中ρ0、ρ分别为零时刻和t时刻DBP的质量浓度(mg/L).
1.4 催化PMS及反复利用实验取500 mL浓度为2 μmol/L的DBP溶液于烧杯中,量取0.007 8 g PMS溶于DBP溶液中,则PMS浓度为20 μmol/L.采用NaOH调节溶液pH为中性,然后加入0.05 g GO/CoFe2O4,搅拌.每隔一定时间取样5 mL于比色管中,加入0.12 mmol/L的NaNO2作为淬灭剂,0.45 μm滤膜过滤,装于液相小瓶中待测.实验在自然光照下进行.分别改变温度、催化剂投量及DBP初始浓度,测定并计算GO/CoFe2O4/PMS体系中DBP去除率.反应完成后,溶液中催化剂采用磁铁收集分离,反复冲洗,80 ℃真空烘干回用.循环使用5次.
2 结果与分析 2.1 性能表征 2.1.1 催化剂形貌分析图 1为不同催化剂的TEM、SEM图.由图 1(a)可知,本实验制备的GO呈片状结构,由于在GO表面存在各种有机官能团破坏了π键,导致片层产生褶皱.由图 1(b)可知,CoFe2O4边界十分清晰.图 1(c)、(d)为不同放大倍数的复合GO/CoFe2O4,可见GO与CoFe2O4堆叠在一起,部分表面存在沉积,浅灰色区域为GO负载材料, 而暗点则对应着CoFe2O4颗粒的存在,在GO/CoFe2O4边缘可见GO片层边界清晰.在制备过程中,机械搅拌的作用没有使铁氧体脱落,说明该催化剂具有一定机械强度.图 1(e)中CoFe2O4呈颗粒状,形状大小不一,表面粗糙,粒径为10 μm左右.图 1(f)为复合了石墨烯的GO/CoFe2O4催化剂,仍呈颗粒状,表面凹凸不平,且存在孔隙,粒径变小至2 μm左右.复合催化剂是在原位化学反应状态下合成的,在复合反应过程中,钴铁氧体在片层石墨烯表面沉积形成,石墨烯表面的基团限制了钴铁氧体的生长,所以形成的复合催化剂粒径变小.

|
图 1 不同催化剂的TEM、SEM图 Figure 1 TEM, SEM charts of different catalysts |
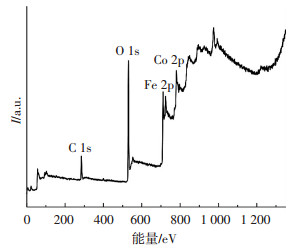
图 2为GO/CoFe2O4的XPS谱图,可知GO/CoFe2O4中含有C、Co、Fe和O元素,C 1s的特征峰出现在284.5 eV处,说明GO成功与CoFe2O4复合.O 1s峰位置出现在530.1 V处,Fe 2p的特征峰位在710.1 V处,表明催化剂中铁元素以+3价存在,Co 2p的特征峰出现在780.1 V处,Co元素以+2存在于催化剂中[12].
|
图 2 GO/CoFe2O4的XPS谱图 Figure 2 XPS pattern of GO/CoFe2O4 |
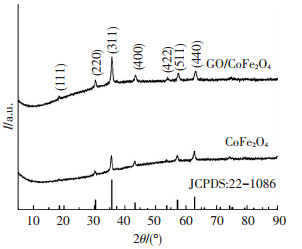
图 3为不同催化剂的XRD谱图,可知CoFe2O4和GO/CoFe2O4具有相似XRD晶型,并且样品的特征峰均与CoFe2O4的特征峰图谱(JCPDS:22-1086) 呈现出较好的匹配性,特征峰的位置分别在2θ=18.36°、30.30°、35.58°、43.20°、53.91°、57.15°和62.79° 7个位置,所对应的布拉格晶面为(111)、(222)、(311)、(400)、(422)、(511) 以及(440).其中三强峰的位置为30.30°(220)、35.58°(311) 和62.79°(440),所属空间群为Fd-3m(227),同时证明催化剂均属于尖晶石结构.与CoFe2O4衍射峰相比,GO/CoFe2O4形成的衍射峰强度更高,是由于铁氧体负载到GO表面,增加了CoFe2O4的结晶度[13].
|
图 3 不同催化剂的XRD谱图 Figure 3 XRD patterns of different catalysts |
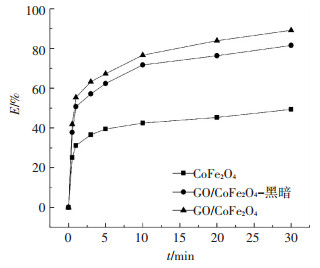
图 4为不同体系下催化PMS降解DBP效果曲线.在自然光照条件下,前5 min内两种催化剂催化PMS对DBP的降解速率非常快,随着反应的进行降解曲线逐渐趋于平稳,直至30 min时,降解反应基本完成.CoFe2O4催化PMS对DBP的去除率为49%,而GO/CoFe2O4对DBP去除率为89%,相比CoFe2O4提高40%.说明石墨烯的加入可能改变了CoFe2O4原有的表面结构,使其表面活性位点增多,与PMS接触几率增加,从而提高DBP的去除率.而黑暗条件下,GO/CoFe2O4催化PMS对DBP去除率为81%,相比自然光照条件下降低7%,可见自然光对催化降解体系影响不大.
|
图 4 不同体系下催化PMS降解DBP效果 Figure 4 Removal efficiency of DBP by catalysis of PMS in different systems |
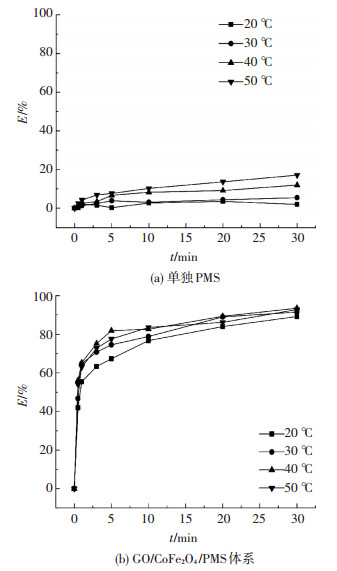
考虑在实际工程应用中,提高温度到60 ℃以上会大大增加运行成本,本实验研究的温度范围为20~50 ℃.图 5为不同温度条件下,不同体系DBP的去除效果曲线.随着温度的增加,DBP的去除率有小幅度增加,当系统温度达50 ℃时,单独PMS对DBP去除率为20%左右,可见在50 ℃以下,温度对PMS的活化作用并不明显.同样,在GO/CoFe2O4催化PMS体系中,DBP的去除率随着温度的增加而增大,且前3 min内降解速率非常快,反应进行5 min时DBP降解基本完成.20 ℃时,体系中DBP的去除率为89%.当系统温度达50 ℃时,DBP的去除率为93%,提高4%,相比单独PMS体系对DBP去除率提高了73%,说明GO/CoFe2O4活化PMS明显加快DBP的降解速率.综上,实际工程中以20 ℃为反应温度,可以减少运行成本,并能保证DBP的有效去除.
|
图 5 温度对单独PMS与GO/CoFe2O4/PMS体系降解DBP效果的影响 Figure 5 Effect of temperature on degradation of DBP in PMS alone and GO/CoFe2O4/PMS systems |
图 6为不同GO/CoFe2O4投量对DBP去除效果的影响曲线.可知当催化剂的投量为0.02 g/L时,GO/CoFe2O4/PMS氧化体系对DBP的去除率为51%,随着催化剂投量增加,对DBP的去除率也随之提高,当催化剂投量达0.1 g/L时,体系对DBP的去除率可提高到89%.这是由于在该催化氧化体系中,催化剂表面的活性点位对催化过程至关重要,催化剂投量的增加相当于增加了催化剂表面活性的点位数量,提高了PMS活化速率.继续提高催化剂投量使其达到0.2 g/L时,体系DBP去除率并没有增加.且当催化剂投量达0.4 g/L时,体系对DBP的去除率反而呈现下降的趋势为81%.催化剂一方面可以提供催化所需的活性点位,另一方面过多的催化剂可能淬灭体系中已经产生的羟基自由基和硫酸自由基,从而使得体系对DBP的降解效果受到影响.
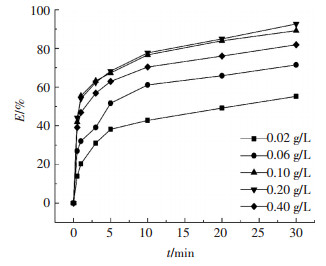
|
图 6 GO/CoFe2O4投量对DBP去除效果的影响 Figure 6 Effect of GO/CoFe2O4 dosage on the degradation of DBP |
图 7为DBP初始浓度对污染物去除效果的影响.可以看出,当DBP初始浓度分别为1、2、4 μmol/L时,GO/CoFe2O4/PMS氧化体系对DBP去除率分别为96%、89%、70%.当DBP浓度为1 μmol/L时,体系对DBP降解速率非常快,5 min基本完全降解,由于DBP浓度过小,体系中PMS浓度相对较高,使得降解反应迅速完成.而DBP浓度为2 μmol/L时,前3 min内DBP降解速率非常快,在10 min左右基本达到稳定,对体系中PMS充分利用.当DBP浓度为4 μmol/L时,体系中DBP的去除率明显降低,这可能是由于溶液中DBP浓度过大,一方面阻止了催化剂与PMS的接触机会,另一方面由于PMS相对浓度较低,产生的羟基自由基和硫酸根自由基等活性自由基有限,无法充分降解目标物.当DBP初始浓度为2 μmol/L时,GO/CoFe2O4/PMS体系对DBP去除效能最佳.
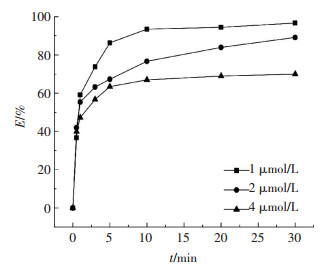
|
图 7 DBP初始浓度对DBP降解效果的影响 Figure 7 Effect of initial concentration of DBP on the degradation of DBP |
催化剂能够改变化学反应的速度,但其在反应过程前后的化学性质与其本身结构并不发生变化.GO/CoFe2O4有较强的磁性,在实验结束后,可用磁铁将其与溶液分离,并进行循环利用实验.图 8为GO/CoFe2O4经过5次循环使用后,在催化PMS体系中对DBP降解效果.可以看出,循环使用对该复合催化剂的催化效能没有明显的影响,催化体系仍保持较高的污染物降解性能.首次使用的GO/CoFe2O4/PMS体系对DBP的去除率为89%,重复5次试验后,对DBP的去除率为84%.DBP去除率的降低可能是由于GO/CoFe2O4在催化和回收洗涤过程中有少部分金属离子溶出或少部分催化剂随水流失导致其质量减少.
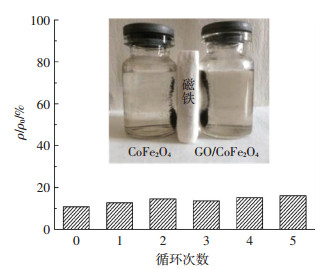
|
图 8 GO/CoFe2O4的循环利用实验 Figure 8 Degradation of DBP in recycling use of GO/CoFe2O4 |
为验证GO/CoFe2O4催化PMS去除DBP体系中自由基种类,进行自由基淬灭实验.由于叔丁醇(TBA)与硫酸根自由基(SO4-·)和羟基自由基(·OH)的反应速率常数分别为(4~9.1) 和(3.8~7.6)×109 L·mol-1·s-1,前者反应速率比后者小了约10 000倍,当反应液中同时含有两者自由基时,TBA会淬灭·OH反应,保留SO4-·.而乙醇(EtOH)与SO4-·和·OH的反应速率常数接近,所以EtOH可同时淬灭两者[14-15].图 9为GO/CoFe2O4催化PMS降解DBP体系中的自由基淬灭实验曲线,可见当体系中加入TBA时,30 min时DBP去除率从89%降到49%,说明在体系中存在一部分·OH被TBA捕获,从而影响降解效果.另一方面,当体系中加入EtOH时,DBP的去除率大幅下降,只有17%的DBP被降解,对比加入TBA的体系中DBP去除率,可说明体系中除了·OH还存在SO4-·,且·OH和SO4-·对降解DBP的贡献率分别为56%、44%.因此,当两者都被EtOH捕获时,自由基对于污染物降解效果大大降低.
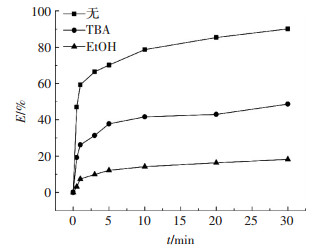
|
图 9 催化PMS降解DBP体系中的自由基淬灭实验 Figure 9 DBP degradation rate by activation of PMS with and without radical scavengers of TBA and EtOH |
图 10为GO/CoFe2O4催化PMS降解DBP反应机理图,催化剂吸附水分子在其表面,形成表面羟基(·OH).由于GO/CoFe2O4表面存在大量表面羟基点位,≡Co(Ⅱ)可与·OH相结合,与水中PMS反应,产生SO4-·和·OH,同时完成≡Co(Ⅱ)到≡Co(Ⅲ)的转变.生成的≡Co(Ⅲ)与PMS继续反应,进一步产生SO4-·和≡Co(Ⅱ),完成一个循环过程达到催化效果[16].相似地,对于铁元素也有类似的反应机理.几个反应同时进行,伴随着催化剂的再生,直到PMS消耗完全并产生大量SO4-·和·OH.由于SO4-·大量分布在水中,在SO4-·与目标物反应的同时,也会对周围的H2O进行夺H作用,进而生成·OH,体系中的SO4-·和·OH共同作用将DBP降解.由于石墨烯的加入改善了GO/CoFe2O4催化剂形貌及微观结构,相比CoFe2O4,比表面积增大,表面羟基浓度提高,从而可以增强GO/CoFe2O4的催化性能.
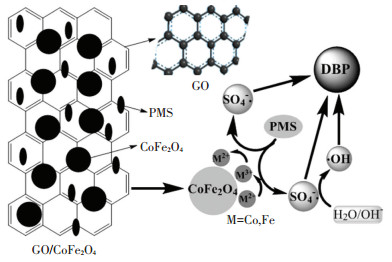
|
图 10 GO/CoFe2O4催化PMS降解DBP反应机理 Figure 10 Mechanism of DBP degradation by catalysis of PMS on GO/CoFe2O4 |
1) 制备的复合型GO/CoFe2O4催化剂呈颗粒状,表面粗糙,尖晶石结构,平均粒径为2 μm,该催化剂中存在Fe、Co、O和C元素,GO成功与CoFe2O4复合.
2) 室温下,DBP初始浓度为2 μmol/L、催化剂投量为0.1 g/L、PMS浓度为20 μmol/L、pH为7时,GO/CoFe2O4催化PMS对DBP的去除率可达89%,具有较好的催化效能.重复使用5次后,其催化效果仅降低5%,该催化剂具有良好的重复使用性.
3) 在GO/CoFe2O4/PMS体系中,由于电子转移作用,使得Co(Ⅱ)/Co(Ⅲ)与Fe(Ⅱ)/Fe(Ⅲ)相互转换,进而催化PMS产生大量的SO4-·,同时SO4-·可对H2O产生夺H作用,生成·OH,体系中共存两种自由基对DBP进行降解.
| [1] |
CIRILLO T, FASANO E, ESPOSITO F, et al. Di(2-ethylhexyl)phthalate (DEHP) anddinbutylphthalate (DBP) exposure through diet in hospital patients[J].
Food and Chemical Toxicology, 2012, 51(1): 434-438.
|
| [2] |
GULTEKIN I, INCE N H. Synthetic endocrine disruptors in the environment and water remediation by advanced oxidation processes[J].
Journal of Environmental Management, 2007, 85(4): 816-832.
DOI: 10.1016/j.jenvman.2007.07.020 |
| [3] |
李丽, 刘占孟, 聂发挥. 过硫酸盐活化高级氧化技术在污水处理中的应用[J].
华东交通大学学报, 2014, 6(6): 114-118.
LI Li, LIU Zhanmeng, NIE Fahui. Application of advanced oxidation technology by activation peroxymonosulfate in wastewater treatment process[J]. Journal of East China Jiaotong University, 2014, 6(6): 114-118. DOI: 10.16749/j.cnki.jecjtu.2014.06.005 |
| [4] |
DO S H, JO J H, JO Y H, et al. Application of aperoxymonosulfate/cobalt (PMS/Co(Ⅱ)) system to treat diesel-contaminated soil[J].
Chemosphere, 2009, 77(8): 1127-1131.
DOI: 10.1016/j.Chemosphere.2009.08.061 |
| [5] |
SHI Penghui, DAI Xianfeng, ZHENG Hongai, et al. Synergistic catalysis of Co3O4 and graphene oxide on Co3O4/GO catalysts for degradation of Orange Ⅱ in water by advanced oxidation technology based on sulfate radicals[J].
Chemical Engineering Journal, 2014, 240(11): 264-270.
DOI: 10.1016/j.cej.2013.11.089 |
| [6] |
仙晓宁, 孙建安. CoFe2O4纳米颗粒的制备及其磁学性能[J].
有色金属文摘, 2015, 5: 114-115.
XIAN Xiaoning, SUN Jian'an. Preparation and magnetic properties of CoFe2O4 nanoparticles[J]. Nonferrous Metals Abstract, 2015, 5: 114-115. |
| [7] |
REN Yueming, LIN Lingqiang, MA Jun, et al. Sulfate radicals induced from peroxymono-sulfate by magnetic ferrospinel MFe2O4(M=Co, Cu, Mn, and Zn) as heterogeneous catalysts in the water[J].
Applied Catalysis B: Environmental, 2015, 165: 572-578.
DOI: 10.1016/j.apcatb.2014.10.051 |
| [8] |
ZOU Yuqin, KAN Jin, WANG Yong. Fe2O3-graphene rice-on-sheet nanocomposite for high and fast lithium ion storage[J].
The Journal of Physical Chemistry C, 2011, 115(42): 20747-20753.
DOI: 10.1021/jp206876t |
| [9] |
ZHU Xianjun, ZHU Yanwu, MURALI S, et al. Nanostructured reduced graphene oxide/Fe2O3 composite as a high-performance anode material for lithium ion batteries[J].
ACS Nano, 2011, 5(4): 3333-3338.
DOI: 10.1021/nn200493r |
| [10] |
伊玉. 可回收磁性材料CoFe2O4/GO催化PMS降解染料废水的性能研究[D]. 上海: 东华大学, 2014.
YIN Yu. The research on the degradation of dye wasterwater using PMS actication by magnetically sparable CoFe2O4 immobilized on Go[D]. Shanghai: Donghua University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10255-1014212863.htm |
| [11] |
LUO Qiuping, YU Xiaoyun, LEI Bingxin, et al. Reduced graphene oxide-hierarchical ZnO hollow sphere composites with enhanced photocurrent and photocatalytic activity[J].
The Journal of Physical Chemistry C, 2012, 116(14): 8111-8117.
DOI: 10.1021/jp2113329 |
| [12] |
KONDOH H, TOYOSHIMA R, MONYA Y, et al. In situ analysis of catalytically activePd surfaces for CO oxidation with near ambient pressure XPS[J].
Catalysis Today, 2016, 260: 14-20.
DOI: 10.1016/j.cattod.2015.05.016 |
| [13] |
MENG Na, PRIESTLEY R C E, ZHANG Yanqiu, et al. The effect of reduction degree of GO nanosheets on microstructure and performance of PVDF/GO hybrid membranes[J].
Journal of Membrane Science, 2016, 501: 169-178.
DOI: 10.1016/j.memsci.2015.12.004 |
| [14] |
袁瑞霞. 基于自由基反应的高盐染料废水降解动力学及有机卤代物(AOX)生成机制研究[D]. 上海: 东华大学, 2012.
YUAN Ruixia. Free radicals based degradation kinetics and AOX formation mechanisms in the treatment of high salinity dye wastewater[D]. Shanghai: Donghua University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10255-1013162577.htm |
| [15] |
GUAN Yinghong, MA Jun, LI Xuchun, et al. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfate system[J].
Environ Sci Technol, 2011, 45(21): 9308-9314.
DOI: 10.1021/es2017363 |
| [16] |
LI Xuning, WANG Zhaohui, ZHANG Bo, et al. FexCo3-xO4 nanocages derived from nanos-cale metal-organic frameworks for removal of bisphenol A by activation of peroxymonosulfate[J].
Applied Catalysis B: Environmental, 2016, 181: 788-799.
DOI: 10.1016/j.apcatb.2015.08.050 |
 2017, Vol. 49
2017, Vol. 49


