2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学), 哈尔滨 150090
2. State Key Laboratory of Urban Water Resource and Environment (Harbin Institute of Technology), Harbin 150090, China
近年来,由于石油炼制、农药、化工等行业的迅速发展,导致每年产生大量的含硫含氮有机废水[1].其中,石油行业产生的废水中所含有机物多为酚类化合物,由于其具有毒性、致癌性和难降解性等特点[2],导致此类废水的处理更加棘手,对周围环境和人体健康均造成很大的危害[3-5].反硝化脱硫(denitrifying sulfide removal, DSR)工艺能够在自养、异养菌的协同作用下,以废水中硝酸盐为电子受体,硫化物、有机物为电子供体,最终生成N2、CO2、S0等,实现废水中碳氮硫的同步去除[6-10].此工艺运行成本低、无二次污染,且可回收单质硫,在含硫含氮废水处理领域具有良好的应用前景[11].目前,国内外关于反硝化脱硫工艺的研究大多以一种易降解的乙酸、葡萄糖等为碳源[12-14],尚未见不同碳源对反硝化脱硫工艺影响的报道,使得该技术的应用受到一定限制.
为此,针对碳源对反硝化同步脱硫工艺影响报道不足的现象,构建UASB反应器,考察两种不同碳源(乙酸钠和苯酚)对反硝化脱硫工艺碳氮硫去除效果及单质硫累积的影响,在此基础上,通过批次试验进一步探究碳氮硫降解及转化规律,以期对含硫含氮有机废水的处理提供理论和技术参考.
1 实验 1.1 实验仪器连续流实验采用UASB反应器[15](如图 1),内径5 cm,高80 cm,有效容积1.57 L.实验采用蠕动泵从反应器底部进水,出水部分回流,回流比控制为10:1,反应器采用水浴加热,温度控制在(30±1) ℃.

|
1—进水箱; 2—进水蠕动泵; 3—UASB反应区; 4—温控计; 5—回流蠕动泵; 6—吸收瓶; 7—湿式气体流量计; 8—出水计量水箱; A—进水管; B—气体收集器 图 1 UASB反应器示意 Figure 1 Schematic diagram of upflow anaerobic sludge blanket reactor |
接种污泥取自中海油(青岛)重质油加工工程技术研究中心污水处理工艺曝气池,静置后去掉上清液.污泥初始MLSS为11.1 g·L-1,MLVSS为4.9 g·L-1,接种量为1 L,混合污泥投入密闭的反应器后静置24 h.
1.3 实验方法 1.3.1 反硝化脱硫工艺的运行实验同时启动两个UASB反应器#1和#2(其中#1以乙酸钠为碳源,#2以苯酚为碳源),均进行连续流实验.试验采用人工配水方式,各反应器进水溶液基质及指标控制见表 1.其中进水中的硫化物和硝酸盐分别通过投加化学试剂Na2S·9H2O和KNO3提供,NaHCO3和K2HPO4分别作为无机碳源和磷源.试验过程中控制反应器温度为(30±1) ℃,模拟废水pH为7.5±0.2.
| 表 1 各反应器进水基质 Table 1 Influent substrate of each reactor |
从1.3.1运行稳定后的#1和#2连续流实验的反应器中各取一定量的污泥,经沉淀静止后,将上层液体倒掉,再将污泥用清水多次冲洗后备用.实验分为A、B两组,均在120 mL厌氧瓶中进行.A组注入#1反应器污泥20 mL,#1进水基质80 mL;B组注入#2污泥20 mL,#2阶段Ⅰ进水基质80 mL,并调节各瓶pH至7.5左右,同时充入氮气5 min以保持厌氧环境,随后恒温振荡器中进行培养,控制转速100 r/min,温度为30 ℃.实验全程采用针管定时取水,水样取出后立即测试,最大程度地避免与氧接触.
1.4 分析方法水样检测前需经0.45 μm滤膜过滤,以防其他物质产生干扰.采用紫外分光光度法(HJ/T 346—2007) 测定NO3--N;乙二胺分光光度法(GB 7493—87) 测定NO2--N;铬酸钡分光光度法(HJ/T 342—2007) 测定SO42-;亚甲基蓝分光光度法(GB/T 16489—1996) 测定S2-;4-氨基安替比林分光光度法(HJ 503—2009) 测定苯酚;离子色谱法测定Ac-;采用硫平衡推算法计算单质硫产率[16];标准重量法测定MLSS和MLVSS;采用高通量宏基因组学技术分析微生物群落;PHS-25型pH计直接测定pH.
2 结果与讨论 2.1 乙酸钠条件下反硝化脱硫工艺运行效能以乙酸钠为碳源时,#1反应器在运行过程(硫氮比为5:2) 中S2-、NO3--N、Ac--C变化及其转化规律如图 2所示.可以看出,在第Ⅰ阶段(HRT为10 h)#1反应器刚启动时,NO3--N、S2-和Ac--C的去除率便达到91%、94%和77%,说明接种污泥对进水基质有良好的适应性,但此时S0积累率仅为25%.连续运行11 d后,反应器中有少量白色固体出现,NO3--N、S2-和Ac--C去除率分别达到97%、99%和100%,S0积累率稳定在45%左右,反应器N、S、C的去除效能达203.7、475.2和186 g/(m3·d).此时污泥MLVSS为2.1 g·L-1,SVI值为160 mL/g.通过高通量测序得出反应器中主要的异养反硝化菌属为Thauera、Thermomonas和Arenimonas,分别占41.24%、26.42%和10.24%,自养反硝化菌属为Thiobacillus,占3.24%.出水NO2--N质量浓度整体较低,保持在2 mg/L以下,在第4天出现最高值10 mg/L,是因为NO3--N被快速还原成中间产物NO2--N,但NO2--N的还原速率提升稍有滞后,导致出水有少量NO2--N积累.
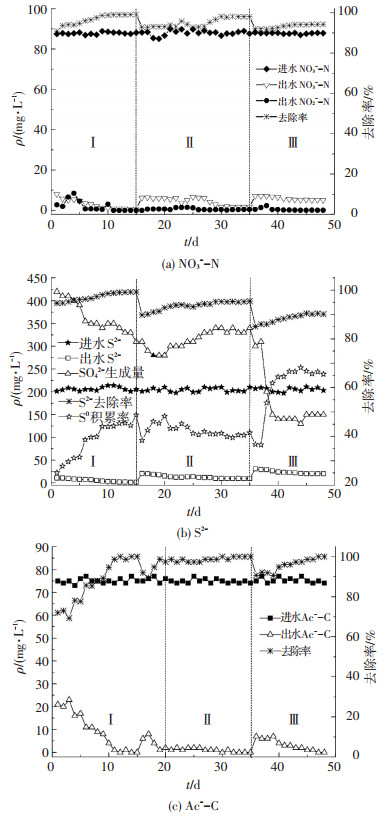
|
图 2 乙酸钠为碳源时S2-、NO3--N、Ac--C的去除 Figure 2 Removal efficiency of NO3--N, S2-, Ac--C using sodium acetate as carbon resource |
进入第Ⅱ阶段(HRT降至5 h),微生物开始显示出不适应性,NO3--N和S2-去除率分别降低至92%和90%,连续运行15 d后,NO3--N、S2-和Ac--C去除率分别稳定在98%、95%和98%左右,S0积累率约为41%,此阶段反应器N、S、C的去除效能可达411.6、912和364.56 g/(m3·d).污泥质量浓度增高,同时有明显的颗粒污泥生成,测得污泥MLVSS为2.6 g·L-1,SVI值为100 mL/g.异养反硝化菌属Thauera、Thermomonas和Arenimonas数量均略微降低,分别降至39.24%、22.50%和9.32%,自养反硝化菌属Thiobacillus数量变化不大,占2.35%.
第Ⅲ阶段(HRT降至2.5 h),NO3--N、S2-和Ac--C的出水质量浓度都出现了先增高后降低的现象,稳定后NO3--N、S2-和Ac--C去除率分别达93%、90%和99%,此时反应器N、S、C的去除效能为781.2、1 728和736.56 g/(m3·d).污泥质量浓度和沉降性均显著增加,有大量的颗粒污泥产生并沉降在反应器底部,此时测得污泥MLVSS为3.2 g·L-1,SVI值为60 mL/g.在此阶段,异养菌属Thauera、Thermomonas、Arenimonas数量继续下降,分别降至30.65%、7.75%和9.58%,同时SB-1_norank异养反硝化菌属出现,占9.03%,自养反硝化菌属Thiobacillus数量略微上升,达3.10%.S0积累率增高至65%左右,是因为水力负荷的增加使得微生物群落结构发生改变,进而导致S0→S042-的氧化速率降低,硫酸盐生成量减少,S0质量浓度增高.
2.2 苯酚条件下反硝化脱硫工艺运行效能以苯酚为碳源时,#2反应器在运行过程中S2-、NO3--N、C6H5O--C变化及其转化规律如图 3所示.可以看出,第Ⅰ阶段(硫氮比为2:3)#2反应器刚启动时,NO3--N、S2-和C6H5O--C的去除率分别达82%、90%和83%,此后三者的去除率均出现先下降后升高的现象,说明接种污泥对以苯酚为碳源的进水基质产生了不适性,系统稳定后NO3--N、S2-和C6H5O--C去除率分别达78%、97%和96%,出水NO2--N质量浓度保持在1 mg/L以下,反应器N、S、C的去除效能达280.8、232.8和172.8 g/(m3·d).污泥MLVSS值为2.3 g·L-1,SVI值为150 mL/g,此阶段监测到的异养反硝化菌属有Bacillus、Thauera和Pseudomonas,分别占0.24%、0.35%和0.12%,自养反硝化菌属为Sulfurovum,占0.34%.实验过程中硫化物全部转化为硫酸盐,未出现S0积累,与乙酸钠为碳源时结果相差较大.

|
图 3 苯酚为碳源时S2-、NO3--N、C6H5O--C的去除 Figure 3 Removal efficiency of NO3--N, S2-, C6H5O--C using phenol as carbon source |
第Ⅱ阶段(进水碳氮硫基质同时倍增),NO3--N、S2-和C6H5O--C的出水质量浓度均出现先增高后降低的现象,随着微生物对进水基质逐渐适应,NO3--N、S2-的去除率也分别恢复至73%和95%,但C6H5O--C去除率降低明显,仅为80%,实验过程仍没有S0积累,此阶段反应器N、S、C的去除效能达525.6、456和288 g/(m3·d).污泥SVI值为90 mL/g,沉降性能显著增高,部分污泥沉降在反应器底部,污泥质量浓度也略微上升,MLVSS值升至2.9 g·L-1,异养反硝化菌属Bacillus、Thauera和Pseudomonas数量均有所上升,分别达0.34%、0.92%和2.68%,自养反硝化菌属Thiobacillus、Azoarcus出现,分别占0.32%和0.19%,而Sulfurovum菌属则完全消失.可以看出此阶段由于水力负荷的增加使得反硝化脱硫工艺中NO3--N、S2-和C6H5O--C的去除率下降,因此,为保持较高的碳氮硫去除率,应适当增加水力停留时间(HRT)或降低进水基质质量浓度.
进入第Ⅲ阶段(硫氮比为2:1),实验全程仍未出现S0积累,NO3--N、S2和C6H5O--C去除率刚开始仅为40%、70%和33%,NO2--N质量浓度也出现瞬时积累现象.11 d后各指标基本稳定,NO3--N、S2-和C6H5O--C去除率分别恢复至67%、85%和50%,反应器N、S、C的去除效能达160.8、408和180 g/(m3·d).此阶段污泥质量浓度继续增加,沉降性能则变化不大,测得污泥MLVSS值为3.3 g·L-1,SVI值为88 mL/g.异养反硝化菌属Thauera、Pseudomonas则分别下降至0.32%和0.29%,而Bacillus菌属数量则上升至6.62%;自养反硝化菌属Thiobacillus、Azoarcus分别占0.76%、0.21%.可以看出,在硫氮比为2:1时,碳氮硫去除率较硫氮比为2:3时均下降明显,是因为在硫氮比为2:1时,NO3--N质量浓度相对过低,使得DSR工艺中电子受体不足,进而导致硫化物和苯酚去除效果变差,因此, 控制适当的硫氮比有利于保持较高的碳氮硫去除率.
2.3 批次试验中碳氮硫降解及转化规律由图 4可以看出,A组中NO3--N、S2-、Ac--C质量浓度几乎同步降低,分别在25、7和15 h后处于稳定状态.其中S2-去除速率最高;NO3--N去除速率呈先快后慢的趋势,在前10 h内即去除了80%;而SO42--S质量浓度在前15 h上升较慢,15~20 h期间则迅速上升,20 h后基本不再变化,和NO2--N的消失几乎处于同步状态.此时S0积累率约在50%左右.在Ac--C去除完毕时,S0开始迅速反应生成硫酸盐.因此,乙酸钠为碳源时,S2-、Ac--C、S0的氧化速率为:qS2- > qAcetate > qS0.当有Ac--C和S0同时存在时,Ac--C优先被氧化,S0就被积累下来.
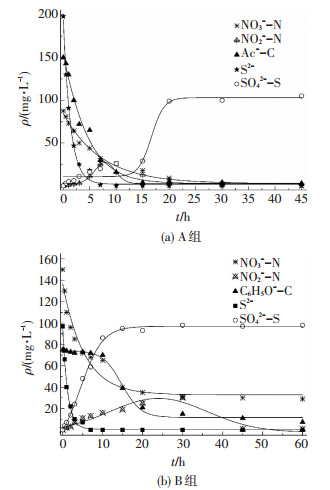
|
图 4 批次试验中NO3--N、NO2--N、C、S2-、SO42--S质量浓度变化 Figure 4 Concentrations of NO3--N, NO2--N, C, S2-, SO42--S in batch cultivation experiment |
B组中NO3--N、S2-反应趋势与A组基本相同,NO2--N质量浓度同样呈现先增高后降低的趋势,在30 h时达最高值32 mg/L,45 h后消失;但苯酚的去除出现了滞后期,在前10 h内几乎没变化,10 h后才开始降低;SO42--S质量浓度在前10 h内则迅速上升,10 h后基本不再变化,此时S0积累率为零.可以看出,在S0完全转化为硫酸盐后,苯酚才开始被氧化.因此,苯酚为碳源时,S2-、苯酚、S0的氧化速率为:qS2- > qS0 > qPhenol.在S0和苯酚同时存在时,S0先被氧化,苯酚的去除存在滞后期,从而使得硫化物的氧化产物不能够停留在单质硫阶段,全部转化为硫酸盐.
3 结论1) 乙酸钠为碳源时,HRT为2.5~10 h,NO3--N、S2-和Ac--C去除率保持在93%、90%和99%以上,单质硫积累率稳定在41%以上;而苯酚为碳源时,HRT为10 h,NO3--N、S2-和C6H5O--C去除率分别达到67%、85%和50%,但硫化物均转化为硫酸盐,出水无单质硫累积.由此可知,在乙酸钠或苯酚为碳源条件下,反硝化脱硫工艺均能实现碳氮硫的同步去除,但乙酸钠为碳源时,碳氮硫去除效率较高,且存在单质硫积累.
2) 乙酸钠为碳源时,S2-氧化速率(qS2-) > 乙酸盐氧化速率(qAcetate) > S0的氧化速率(qS0),导致乙酸盐和单质硫同时存在时,乙酸盐优先被氧化,单质硫则被保留下来;而苯酚为碳源时,S2-氧化速率(qS2-) > S0的氧化速率(qS0) > 苯酚氧化速率(qPhenol),使得苯酚和单质硫同时存在时,单质硫优先被氧化为硫酸盐,苯酚的氧化则滞后.因此, 在乙酸钠和苯酚分别为碳源时,DSR工艺中硫化物的氧化产物会有所差异.
| [1] |
OLMOS A, OLGUIN P, FAJARDO C, et al. Physicochemical characterization of spent caustic from the OXIMER process and sour waters from Mexican oil refineries[J].
Energy & Fuels, 2004, 18(2): 302-304.
|
| [2] |
EL-SHEEKH M M, GHARIEB M M, ABOU-EL-SOUOD G W. Biodegradation of phenolic and polycyclic aromatic compounds by some algae and cyanobacteria[J].
Journal of Bioremediation & Biodegradation, 2012, 3(1): 1-9.
|
| [3] |
CHEN Chuan, REN Nanqi, WANG Aijie, et al. Simultaneous biological removal of sulfur, nitrogen and carbon using EGSB reactor[J].
Applied Microbiology & Biotechnology, 2008, 78(6): 1057-1063.
|
| [4] |
SARTI A, POZZI E, CHINALIA F A, et al. Microbial processes and bacterial populations associated to anaerobic treatment of sulfate-rich wastewater[J].
Process Biochemistry, 2010, 45(2): 164-170.
DOI: 10.1016/j.procbio.2009.09.002 |
| [5] |
DAMIANOVIC M H R Z, FORESTI E. Dynamics of sulfidogenesis associated to methanogenesis in horizontal-flow anaerobic immobilized biomass reactor[J].
Process Biochemistry, 2009, 44(9): 1050-1054.
DOI: 10.1016/j.procbio.2009.04.027 |
| [6] |
CHEN Chuan, WANG Aijie, REN Nanqi, et al. Enhancing denitrifying sulfide removal with functional strains under micro-aerobic condition[J].
Process Biochemistry, 2010, 45(6): 1007-1010.
DOI: 10.1016/j.procbio.2010.02.013 |
| [7] |
CHEN Chuan, WANG Aijie, REN Nanqi, et al. Optimal process pattern for simultaneous sulfur, nitrogen and carbon removal[J].
Water Science & Technology A Journal of the International Association on Water Pollution Research, 2009, 136(4): 833-837.
|
| [8] |
REYES-AVILA J, RAZO-FLORES E, GOMEZ J. Simultaneous biological removal of nitrogen, carbon and sulfur by denitrification[J].
Water Research, 2004, 38(14): 3313-3321.
|
| [9] |
KIM E W, BAE J H. Alkalinity requirements and the possibility of simultaneous heterotrophic denitrification during sulfur-utilizing autotrophic denitrification[J].
Water Science & Technology, 2000, 42(3): 233-238.
|
| [10] |
FURUMAI H, TAGUI H, FUJITA K. Effects of pH and alkalinity on sulfur-denitrification in a biological granular filter[J].
Water Science & Technology, 1996, 34(1): 355-362.
|
| [11] |
WONG B T, LEE D J. Denitrifying sulfide removal and carbon methanogenesis in a mesophilic, methanogenic culture[J].
Bioresource Technology, 2011, 102(12): 6673-6679.
DOI: 10.1016/j.biortech.2011.03.097 |
| [12] |
FERN NDEZ-NAVA Y, MARA N E, SOONS J, et al. Denitrification of high nitrate concentration wastewater using alternative carbon sources[J].
Journal of Hazardous Materials, 2009, 173(1): 682-688.
|
| [13] |
PENG Yongzhen, MA Yong, WANG Shuying. Denitrification potential enhancement by addition of external carbon sources in a pre-denitrification process[J].
Journal of Environmental Sciences, 2007, 19(3): 284-289.
DOI: 10.1016/S1001-0742(07)60046-1 |
| [14] |
HAMLIN H J, MICHAELS J T, BEAULATON C M, et al. Comparing denitrification rates and carbon sources in commercial scale upflow denitrification biological filters in aquaculture[J].
Aquacultural Engineering, 2008, 38(2): 79-92.
DOI: 10.1016/j.aquaeng.2007.11.003 |
| [15] |
LIU Chunshuang, ZHAO Dongfeng, MA Wenjuan, et al. Denitrifying sulfide removal process on high-salinity wastewaters[J].
Applied Microbiology & Biotechnology, 2015, 99(15): 1-6.
|
| [16] |
LEE D J, WONG B T. Denitrifying sulfide removal by enriched microbial consortium: Kinetic diagram[J].
Bioresource Technology, 2014, 164(7): 386-393.
|
 2017, Vol. 49
2017, Vol. 49


