2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学), 哈尔滨 150090;
3. 哈尔滨工业大学 生命科学与技术学院, 哈尔滨 150080
2. State Key Laboratory of Urban Water Resource and Environment(Harbin Institute of Technology), Harbin 150090, China;
3. School of Life Science and Technology, Harbin Institute of Technology, Harbin 150080, China
微生物电化学系统(microbial electrochemical systems, MESs)是以电化学活性细菌为催化剂将有机物中的化学能直接转化为电能的装置,将有机物分解代谢的同时,能够以电能、清洁能源(氢气)或生成有用代谢副产物等方式回收能量[1].MESs与其他技术相耦合衍生出多种具有不同功能的系统,包括微生物电解池(microbial electrolysis cell, MEC)、微生物脱盐电池(microbial desalination cell, MDC)及微生物光电池(microbial photoelectrochemical solar cell, MPC)等[2].由于具有适用温度范围广、污泥产量低等优点,MESs在废水生物处理、生物质能源开发和利用等方面受到广泛关注.
尽管已有报道证明电化学活性菌可以利用多种有机物,但大多数MESs在处理含发酵类底物及中高浓度废水时都表现出产电性能下降、出水水质差等缺点,这些因素是限制MESs在实际废水处理中大规模应用的重要瓶颈[3].鉴于厌氧消化系统在处理高浓度有机废水方面的显著优势,将其与MESs有效地结合,为推进MESs面向实际废水处理应用开辟了途径.目前已有多种厌氧反应器被有效地整合于MESs中,包括升流式厌氧污泥床(UASB)、厌氧流化床(AFB)及厌氧折流板反应器(ABR)等,这些整合系统在处理蔗糖配水、酒精蒸馏废水及玉米秸秆产乙醇工艺洗液废水时表现出较好的水处理效果及电化学性能[4-6].连续搅拌釜式反应器(continuous stirred tank reactor, CSTR)因具有传质性好、反应速率快及操作稳定等优点而成为应用较为广泛的反应器之一[7].在两相厌氧发酵技术中,CSTR常被作为产酸相装置,并表现出水解酸化效率高、生物量大的特点[8].CSTR可与多种形式的MESs整合,并表现出不同的功能.将MDC浸没于CSTR中构建浸没式MDC,可以显著降低CSTR中氨氮浓度,从而缓解高氨氮对厌氧消化过程的抑制作用[9].另外,将MEC串联于CSTR之后,通过二者的耦合发挥各自的优点,可以有效提高整合系统的氢气回收率,达到梯级产氢的目的[10].然而,这些整合系统多使用铂碳作为阴极催化剂,大量使用阴阳离子交换膜作为分隔材料,极大地增加了整合系统的构建成本、提高了系统构型的复杂程度且不利于系统的稳定运行,因此,限制了其在实际废水处理中的应用.
本研究将CSTR与MES整合,构建了一体式连续搅拌微生物电化学系统(continuous stirred microbial electrochemical reactor, CSMER).考察运行方式、水力停留时间、进水COD浓度对系统性能的影响;同时平行运行一连续搅拌釜式反应器(continuous stirred tank reactor, CSTR),考察微生物电化学反应与厌氧消化过程的协同作用对整合系统底物去除效果和运行稳定性的影响.并采用高通量测序对CSMER内微生物群落结构进行分析,考察其在整合系统电能输出及水处理效能方面的作用.
1 实验 1.1 连续搅拌微生物电化学系统(CSMER)连续搅拌微生物电化学系统(continuous stirred microbial electrochemical reactor, CSMER)由有机玻璃制成,其底端为圆柱状的全混流搅拌区(CMZ)(内径175 mm×高94 mm),顶端为长方体的微生物电化学区(MEZ)(长125 mm×宽175 mm×高175 mm),有效容积为4 L(图 1)[11].该系统以三相分离器作为固体、液体及气体的分离装置.MEZ分别以碳纤维刷(12支,刷直径40 mm,长100 mm)和不锈钢网辊压阴极(4片,长55 mm×宽105 mm)作为阳极和阴极材料[12].12支碳纤维刷固定于MEZ顶端,4片辊压阴极分别位于MEZ的4个面,其中每3支碳纤维刷和一片辊压阴极构成一个独立的微生物燃料电池,并以10 Ω外阻连接,则整个MEZ由4个相同且独立的微生物燃料电池组成,但4个电池共用来自CMZ的电解液.同时平行运行一个连续搅拌釜式反应器(continuous stirred tank reactor, CSTR),其构型及有效容积与CSMER相同,但无微生物电化学区,对比两个系统的性能差异.

|
图 1 连续搅拌微生物电化学系统构型 Figure 1 Schematic diagram of CSMER |
接种污泥(1 L)取自本实验室长期运行的处理纤维素废水的CSTR,经蔗糖配水在厌氧条件下驯养15 d后接种.试验采用模拟废水,成分为0.9 g·L-1蔗糖、0.13 g·L-1KCl、3.32 g·L-1NaH2PO4·2H2O、10.32 g·L-1Na2HPO4·12 H2O、微量金属溶液(12.5 mL·L-1)和维他命溶液(5 mL·L-1)[13-14].
系统在连续流条件下启动(HRT为24 h, COD为1 000 mg·L-1),待获得稳定电压输出后,考察运行方式(连续流与间歇流)、水力停留时间(HRT为18、12及6 h)和进水COD浓度(COD为2 000、4 000及6 000 mg·L-1)对系统产电及水处理效能的影响,确定其最优的运行参数.并分析系统内微生物群落结构的空间分布,考察其对系统效能的影响.
1.3 测试项目与方法电压输出由PISO-813系列数据采集卡(泓格科技)完成,每间隔30 min保存一次数据.极化曲线及功率密度曲线采用单周期变电阻法测量,在每一个外阻下稳定1 h后记录相应的即时输出电压值.利用交流阻抗法测量系统的内阻,有效电路为R(QR)(QR),利用ZSimpWin3.10软件拟合[15].COD的测试采用重铬酸钾滴定法[16].气体组分通过装有热导检测器(TCD)的气相色谱(Agilent GC 7890A, 美国)分析,气体体积采用湿式气体流量计(LML-1, 中国)测量.高通量焦磷酸测序由上海生工公司通过美国Roche 454 GS-FLX Titanium测序系统完成[17].
2 结果与分析 2.1 运行方式对系统性能的影响CSMER以连续流运行方式启动,HRT为24 h,通过逐级降低外阻的方式驯化阳极产电菌.经过500 h的驯化,最终在10 Ω外阻下获得稳定的电流输出,4个电池的平均电流密度输出分别为(3.21±0.11)、(3.06±0.07)、(2.98±0.12) 和(3.13±0.05) A·m-2(图 2(a)).改为间歇流后,系统经过两个周期的运行,输出电流达到稳定状态,各个周期的平均峰值电流密度输出为(2.66±0.03)、(2.65±0.07)、(2.58±0.08)、(2.58±0.07) A·m-2(图 2(a)).

|
图 2 不同运行方式下的电流输出及Nyquist曲线 Figure 2 Electricity generation and Nyquist plot of CSMER under continuous and batch feeding modes |
连续流运行条件下,4个电池的总内阻分别为15.28、16.98、26.63及16.58 Ω(图 2(b)).由于4个电池构型相同且共用同一电解液,其欧姆内阻基本一致,分别为5.17、5.12、6.09及5.02 Ω.电池3的电荷转移内阻较高(16.32 Ω),导致其总内阻高于其他3个电池.原因可能是系统的出水口安装在电池3阴极的正前方,氧气通过出水口扩散进入系统内部,导致电池3阴极周围的溶解氧浓度明显高于其他3片电极,促使其附近好氧菌快速繁殖并附着于阴极催化层表面,堵塞了催化层孔结构,导致电子在电极上的传质阻力增加,从而增大了电池3的电荷转移内阻[18].较连续流相比,间歇流运行条件下系统各电池的内阻分别增大至32.46、33.85、38.66及32.27 Ω.其中欧姆内阻基本不变,但电荷转移内阻及扩散内阻均有所增加(图 2(c)).可能是连续流状态下,溶液处于流动状态,存在对流、湍流等作用,有利于质子在溶液中的扩散,从而为阴极氧还原反应提供足够的质子,提高了氧还原反应速率,强化了电极催化反应的驱动力,因此,降低了电荷转移内阻及扩散内阻,提高了其产电性能[19].而间歇流条件下,用于阴极氧还原反应的质子仅依靠电解液的缓冲作用提供,从而限制了氧还原反应速率.另外,在间歇流运行条件下,电池3的电荷转移内阻(17.93 Ω)与其他3个电池差别不大(17.97、18.91及18.12 Ω),原因可能是经过近1 000 h的运行,4片阴极上生物膜的附着-脱落过程均已经达到各自平衡状态,其生物量及生物膜厚度基本一致,对阴极催化层的影响程度无明显差别[20],因此,间歇流条件下4个电池总内阻的差别不如连续流条件下的差异明显.
2.2 水力停留时间对系统性能的影响改变进水流速,考察不同水力停留时间(HRT为18、12及6 h)下系统的性能.当HRT由18 h下降到12 h时,4个电池的平均电流密度输出由(3.39±0.02) A·m-2提高到(4.03±0.05) A·m-2.但继续降低HRT至6 h时,平均输出电流密度下降至(2.58±0.05) A·m-2,且电流输出的波动明显增大(图 3(a)).
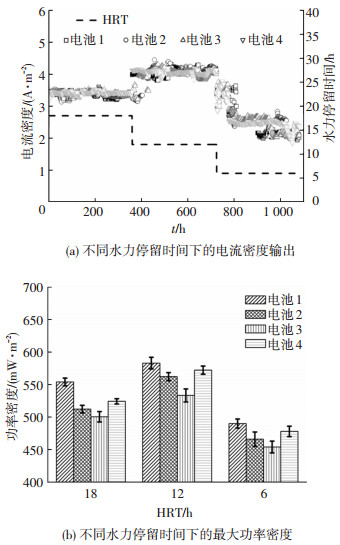
|
图 3 不同水力停留时间下CSMER的产电性能 Figure 3 Electricity production of CSMER at different hydraulic retention time |
在HRT由18 h下降到6 h的过程中,4个电池的最大功率密度均呈现先升高后下降的趋势,在HRT为12 h时,均达到最大值,分别为(583±9)、(562±7)、(533±10) 和(572±6) mW·m-2(图 3(b)).当HRT下降到6 h时,4个电池的最大功率密度分别降低了15.9%、17.1%、14.9%及16.5%.因此,从稳定电流值及最大功率密度输出值考虑,HRT为12 h有利于系统的电能输出.
2.3 进水COD浓度对系统性能的影响在HRT为12 h条件下,逐渐提高进水COD浓度,增大系统的有机负荷(4、8、12 kg·m-3·d-1),考察系统的电能输出及水处理效果.随着有机负荷的增加,系统的电流输出无明显变化,其平均电流密度输出分别为(4.05±0.02)、(4.02±0.07) 及(3.71±0.05) A·m-2(图 4).在有机负荷为4~12 kg·m-3·d-1内,系统的COD去除率随进水负荷的增加而增加,当进水负荷提高到12 kg·m-3·d-1时,COD去除率达到最大值(87.1±1.1)%.一般厌氧消化系统的处理负荷在5~25 kg·m-3·d-1内,因此,该系统已达到厌氧系统的处理水平[21].在一定范围内,进水负荷的提高并没有影响系统的产电性能,说明系统的抗负荷冲击能力较强.原因可能是反应器底端的全混流搅拌区(CMZ)的微生物群落结构复杂,能够分解进水中的大部分有机物,从而使进入到顶端微生物电化学区(MEZ)的有机物浓度基本保持不变,不影响系统的产电性能.研究表明,在处理含发酵类底物及成分复杂的中高浓度有机废水时,各类微生物种群之间的协同作用对于提高微生物电化学系统(MESs)的污染物去除效果和产电性能具有重要作用.尤其是发酵菌群与产电菌群之间的协同及互养作用,对于产电菌群利用复杂底物进行产电至关重要.在以餐厨垃圾渗滤液为底物的MESs中,阳极的优势菌属为Geobacter (37.7%)和Bacteroides (34.7%),另外包括少量的Veillonella、Enterococcus、Eubacterium、Spirochaeta及Fusobacterium.其中Bacteroides及其他发酵菌群的作用主要是水解复杂有机物,为Geobacter提供底物,进行产电[22].在利用剩余污泥产氢的双室MESs中,其阳极也发现了各类产酸发酵细菌,包括Paludibacter、Petrimonas、Oscillibacter及Anaerovorax等.这些发酵细菌的主要作用是将不同种类的糖和胺类物质发酵为有机酸,然后有机酸再被产电菌利用进行产电[10].

|
图 4 不同有机负荷下CSMER的电流密度输出 Figure 4 Electricity generation of CSMER at different organic loading rate |
在试验过程中,同时平行运行了一个CSTR,考察两个系统效能的差异.每次提高进水有机负荷后,两个系统的出水COD浓度均在4~6 d内即可达到稳定水平,表明二者的稳定性较好.另外,在有机负荷由4提高至12 kg·m-3·d-1的过程中,CSMER的COD去除率由82.3%提高至87.1%,且CSTR的去除率也始终保持在53.3%左右.当进水有机物负荷为12 kg·m-3·d-1时,CSTR的COD去除率及甲烷产率分别为(53.9 ±2.1)%和(0.43±0.09) L·L-1·d-1.较CSTR相比,CSMER的COD去除率及甲烷产率分别提高了61.6%及244.2%.另外,CSTR中氢气产率为(0.43±0.11) L·L-1·d-1,而CSMER中并没有检测到氢气的产生.结果表明,CSMER中存在产甲烷菌,以产甲烷为主,而根据CSTR中丁酸/乙酸的比值(1.7),该系统以产氢发酵为主,主要存在产酸发酵细菌[23].导致两个系统中微生物群落结构存在差异的原因是CSMER中CMZ与MEZ在空间上的分离,进水中的大分子有机物首先在CMZ被水解酸化为小分子的挥发酸,沿着水力方向大部分挥发酸进入到MEZ供产电菌利用进行产电,挥发酸的不断移除缓解了其对CMZ产甲烷菌群的抑制作用,从而有利于该区域产甲烷菌的生长.除考察了系统的运行效能外,还对两个系统的构建成本进行分析.由于CSMER采用单室结构,且以价格低廉的辊压电极作为阴极,在很大程度上降低了系统构建成本,因此,用于制备阴阳极材料的成本仅占系统总造价的11.3%.相比CSTR,其构建成本仅提高12.8%.
2.4 微生物群落多样性分析 2.4.1 细菌多样性分析对两个系统不同区域的微生物群落进行454高通量测序,考察其微生物群落的多样性.将高通量测序序列与数据库比较后在门水平上进行分类(图 5).CSMERAnode与其他群落有明显差异,表现为Proteobacteria的比重最高(36.4%),而其他5个群落均表现Firmicutes(44.3%~50.6%)含量最高.

|
图 5 细菌焦磷酸测序序列在门水平上的分类 Figure 5 Taxonomic classification of bacterial pyrosequences at the phylum level |
属水平上的分类结果表明,CSMERCMZ中占据优势的细菌种属为Clostridium(10.0%)、Acidaminococcus(11.7%)及Lactococcus(10.8%)(表 1).
| 表 1 细菌焦磷酸测序序列在属水平上的分类 Table 1 Taxonomic classification of bacterial pyrosequences at the genus level |
其中Clostridium是一种典型的水解发酵菌,能够将淀粉、纤维素、蔗糖等大分子有机物降解为小分子的挥发酸,如乙酸、丙酸等[24].且Lactococcus也是厌氧系统处理糖蜜废水中优势菌属之一[25].而CSMERAnode群落中最具优势的细菌种属为产电菌Geobacter (14.5%),其次为Longilinea(7.1%)、Enterobacter(6.1%)及Pleomorphomonas(6.0%),与CSMERCMZ 具有明显差异.在CSMERCathode群落中占据优势的细菌种属为Lactococcus(13.9%)、Longilinea(11.6%)、Acidaminococcus(11.2%)、Clostridium(9.0%)及Verrucomicrobium(8.0%),大部分为CSMERCMZ及CSMERCathode中的优势菌属,可能是由于CMZ中的絮状活性污泥及阳极上的生物膜沿着水力方向附着于阴极表面导致的.但CSMERCathode中Verrucomicrobium的丰度明显高于CSMERCMZ(0%)和CSMERAnode(1.8%),而该类菌属常被发现于水生和土壤环境或城市垃圾渗滤液中[26],在CSMERCathode中存在大量Verrucomicrobium可能和阴极区复杂的溶解氧浓度梯度有关,使这种特殊的微生物选择性地富集到阴极表面.CSTRBottom和CSTRUp微生物群落基本相似,其优势菌属为Lactococcus(18.9%、19.1%)、Longilinea(6.3%、7.5%)及Acidaminococcus(5.5%、6.3%).在CSTR中没有发现Geobacter存在,而CSMER中Clostridium等水解酸化菌群与产电菌Geobacter的协同作用可能是其水处理效果及甲烷产率高于CSTR的原因.
根据Fast UniFrac的分析结果,通过weighted PCoA分析对群落结构进行比较(图 6),可以更加直观地看出群落之间的进化距离.主成分1和主成分2分别解释了42%和32%的信息变量,CSTRBottom和CSTRUp与启动污泥(Sludge)聚到了一起,说明这3个群落具有较高的相似性.而CSMERCMZ和CSMERAnode群落之间存在较大差异.以上结果说明,在CSMER中,由于电流的存在,某些特殊的微生物(产电菌)选择性地富集到了CSMER的阳极上,而两区的协同作用又对CMZ的微生物群落结构产生较大影响.
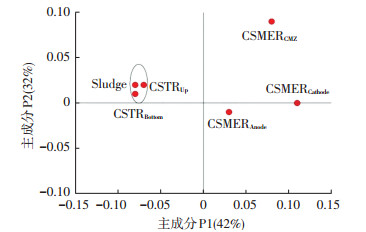
|
图 6 CSMER及CSTR中微生物群落结构基于Fast UniFrac的weighted PCoA分析 Figure 6 Weighted principal coordinate analysis (PCoA) of the CSMER and CSTR microbial community structures based on Fast UniFrac |
对样本中的古生菌进行了454高通量测序,各样本在纲水平上的分类基本相似,均主要含有Methanomicrobia和Methanobacteria,以及较低丰度的Thermoplasmata(图 7(a)).科水平上的分类结果表明CSMERCMZ中利用乙酸产甲烷菌(Methanosaetaceae和Methanosarcinaceae)及利用氢气产甲烷菌(Methanospirillaceae和Methanobacteriaceae)的丰度分别为52.2%和47.1% (图 7(b)).而CSTRBottom和CSTRUp中利用乙酸产甲烷菌的丰度菌约为80%左右,说明CSMER中产甲烷菌的多样性高于CSTR.CSTR中相对简单的产甲烷菌群落结构减少了有机物的降解途径,从而导致其有机物去除率低于CSMER.
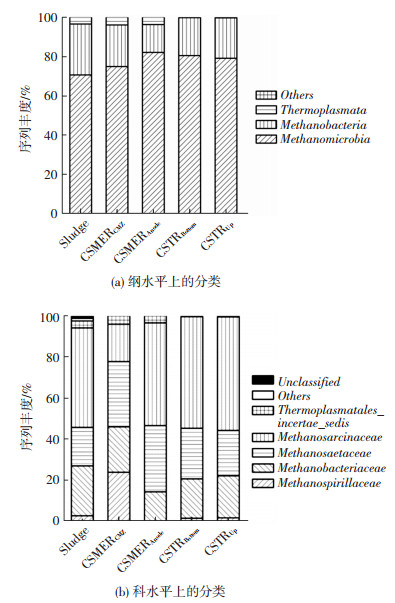
|
图 7 古生菌焦磷酸测序分析 Figure 7 Taxonomic classification of archaeal pyrosequences |
1) 连续搅拌微生物电化学系统(CSMER)在连续流运行方式下获得的平均电流输出高于间歇流,原因是连续流条件下存在对流、湍流等作用,有利于质子在溶液中的扩散,从而为阴极氧还原反应提供足够的质子,提高了氧还原反应速率,因此,提高了其产电性能.
2) CSMER的4个电池在HRT为12 h时获得了最大功率密输出,分别为(583±9), (562±7), (533±10) 和(572±6) mW·m-2, 当进水负荷提高到12 kg·m-3·d-1时,系统的电能输出无明显变化,COD去除率为(87.1±1.1)%,是对照的连续搅拌釜式反应器(CSTR)的1.6倍,而微生物电化学反应与厌氧消化过程的协同作用,可能是CSMER底物去除效果优于CSTR的主要原因.
3) CSMER底端的全混流搅拌区以Clostridium、Acidaminococcus及Lactococcus等水解发酵菌群为优势细菌菌属;顶端的微生物电化学区以产电菌Geobacter占优势.CSMER中相对复杂的细菌菌落导致其产甲烷菌的多样性高于CSTR,从而增加了该系统有机物的降解途径,提高其有机物去除率.
| [1] |
LOGAN B E, RABAEY K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies[J].
Science, 2012, 337(6095): 686-690.
DOI: 10.1126/science.1217412 |
| [2] |
WANG Heming, REN Zhiyong. A comprehensive review of microbial electrochemical systems as a platform technology[J].
Biotechnology Advances, 2013, 31(8): 1796-1807.
DOI: 10.1016/j.biotechadv.2013.10.001 |
| [3] |
LI Wenwei, YU Hanqing, HE Zhen. Towards sustainable wastewater treatment by using microbial fuel cells-centered technologies[J].
Energy & Environmental Science, 2014, 7(3): 911-924.
|
| [4] |
HE Zhen, MINTEER S D, ANGENENT L T. Electricity generation from artificial wastewater using an upflow microbial fuel cell[J].
Environmental Science & Technology, 2005, 39(14): 5262-5267.
|
| [5] |
HUANG Jiansheng, YANG Ping, GUO Yong, et al. Electricity generation during wastewater treatment: An approach using an AFB-MFC for alcohol distillery wastewater[J].
Desalination, 2011, 276(1/2/3): 373-378.
|
| [6] |
FENG Yujie, LI He, WANG Xin, et al. Continuous electricity generation by a graphite granule baffled air-cathode microbial fuel cell[J].
Bioresource Technology, 2010, 101(2): 632-638.
DOI: 10.1016/j.biortech.2009.08.046 |
| [7] |
CHENG Xiyu, LI Qian, LIU Chunzhao. Coproduction of hydrogen and methane via anaerobic fermentation of cornstalk waste in continuous stirred tank reactor integrated with up-flow anaerobic sludge bed[J].
Bioresource Technology, 2012, 114: 327-333.
DOI: 10.1016/j.biortech.2012.03.038 |
| [8] |
郑国臣. CSTR和ABR处理有机废水产氢产甲烷特征与效能[D]. 哈尔滨: 哈尔滨工业大学, 2010.
ZHENG Guochen. Performance and efficient of CSTR and ABR for hydrogen and methane production by organic wastewater fermentation[D]. Harbin:Harbin Institute of Technology, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10213-1011278952.htm |
| [9] |
ZHANG Yifeng, ANGELIDAKI I. Submersible microbial desalination cell for simultaneous ammonia recovery and electricity production from anaerobic reactors containing high levels of ammonia[J].
Bioresource Technology, 2015, 177: 233-239.
DOI: 10.1016/j.biortech.2014.11.079 |
| [10] |
路璐. 生物质微生物电解池强化产氢及阳极群落结构环境响应[D]. 哈尔滨: 哈尔滨工业大学, 2012.
LU Lu. Enhanced hydrogen production from biomass in microbial electrolysis cells and the environmental responses of anodophilic community structures[D]. Harbin:Harbin Institute of Technology, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10213-1013035368.htm |
| [11] |
WANG Haiman, QU Youpeng, LI Da, et al. Evaluation of an integrated continuous stirred microbial electrochemical reactor: Wastewater treatment, energy recovery and microbial community[J].
Bioresource Technology, 2015, 195: 89-95.
DOI: 10.1016/j.biortech.2015.06.039 |
| [12] |
DONG Heng, YU Hongbin, WANG Xin, et al. A novel structure of scalable air-cathode without Nafion and Pt by rolling activated carbon and PTFE as catalyst layer in microbial fuel cells[J].
Water Research, 2012, 46(17): 5777-5787.
DOI: 10.1016/j.watres.2012.08.005 |
| [13] |
LOVELY D R, PHILLIPS E J P. Novel mode of microbial energy metabolism: Organic carbon oxidation coupled to dissimilatory reduction of iron or manganese[J].
Applied and Environmental Microbiology, 1988, 54(6): 1472-1480.
|
| [14] |
ANGELIDAKI I, SANDERS W. Assessment of the anaerobic biodegradability of macropollutants[J].
Reviews in Environmental Science & Bio/Technology, 2004, 3(2): 117-129.
|
| [15] |
LI Da, QU Youpeng, LIU Jia, et al. Using ammonium bicarbonate as pore former in activated carbon catalyst layer to enhance performance of air cathode microbial fuel cell[J].
Journal of Power Sources, 2014, 272: 909-914.
DOI: 10.1016/j.jpowsour.2014.09.053 |
| [16] |
佟海龙, 黄力群, 何燕, 等. 以不同底物和苯胺为燃料的微生物燃料电池的产电特性[J].
环境工程学报, 2016, 10(1): 480-484.
TONG Hailong, HUANG Liqun, HE Yan, et al. Power generation of microbial fuel cell from aniline and different substrates[J]. Chinese Journal of Environmental Engineering, 2016, 10(1): 480-484. DOI: 10.12030/j.cjee.20160179 |
| [17] |
唐霁旭, 王志伟, 马金星, 等. 454高通量焦磷酸测序法鉴定膜生物反应器膜污染优势菌种[J].
微生物学通报, 2014, 41(2): 391-398.
TANG Jixu, WANG Zhiwei, MA Jinxing, et al. Identifying predominant strains causing membrane biofouling by using 454 high-throughputpyrosequencing[J]. Microbiology China, 2014, 41(2): 391-398. |
| [18] |
ZHANG Fang, PANT D, LOGAN B E. Long-term performance of activated carbon air cathodes with different diffusion layer porosities in microbial fuel cells[J].
Biosensors & Bioelectronics, 2011, 30(1): 49-55.
|
| [19] |
DU Fangzhou, XIE Beizhen, DONG Wenbo, et al. Continuous flowing membraneless microbial fuel cells with separated electrode chambers[J].
Bioresource Technology, 2011, 102(19): 8914-8920.
DOI: 10.1016/j.biortech.2011.07.056 |
| [20] |
LIN Hongjun, ZHANG Meijia, WANG Fangyuan, et al. A critical review of extracellular polymeric substances (EPSs) in membrane bioreactors: Characteristics, roles in membrane fouling and control strategies[J].
Journal of Membrane Science, 2014, 460: 110-125.
DOI: 10.1016/j.memsci.2014.02.034 |
| [21] |
MOON H, CHANG I S, KIM B H. Continuous electricity production from artificial wastewater using a mediator-less microbial fuel cell[J].
Bioresource Technology, 2006, 97(4): 621-627.
DOI: 10.1016/j.biortech.2005.03.027 |
| [22] |
JIA Jianna, TANG Yu, LIU Bingfeng, et al. Electricity generation from food wastes and microbial community structure in microbial fuel cells[J].
Bioresource Technology, 2013, 144: 94-99.
DOI: 10.1016/j.biortech.2013.06.072 |
| [23] |
LIN Chiuyue, CHENG Chaohui. Fermentative hydrogen production from xylose using anaerobic mixed microflora[J].
International Journal of Hydrogen Energy, 2006, 31(7): 832-840.
DOI: 10.1016/j.ijhydene.2005.08.010 |
| [24] |
WANGY H, LIS L, CHENI C, et al. A study of the process control and hydrolytic characteristics in a thermophilic hydrogen fermentor fed with starch-rich kitchen waste by using molecular-biological methods and amylase assay[J].
International Journal of Hydrogen Energy, 2010, 35(23): 13004-13012.
DOI: 10.1016/j.ijhydene.2010.04.065 |
| [25] |
KIM T G, YUN J, CHO K S. The close relation between Lactococcus and Methanosaeta is a keystone for stable methane production from molasses wastewater in a UASB reactor[J].
Applied Microbiology and Biotechnology, 2015, 99(19): 8271-8283.
DOI: 10.1007/s00253-015-6725-8 |
| [26] |
WANGNER M, HORN M. The Planctomycetes, Verrucomicrobia, Chlamydiae and sister phyla comprise a superphylum with biotechnological and medical relevance[J].
Current Opinion in Biotechnology, 2006, 17(3): 241-249.
DOI: 10.1016/j.copbio.2006.05.005 |
 2017, Vol. 49
2017, Vol. 49


