2. 北京电子科技职业学院 生物工程学院, 北京 100176
2. School of Biological Engineering, Beijing Polytechnic, Beijing 100176, China
随着管网的多年运行,沿管道内壁会逐渐形成生长环[1-2].生长环是管道内沉淀物、锈蚀物、黏垢、生物膜等构成的混合体[3-5].生长环表层的黏稠状薄膜即为生物膜.自来水在管网输送的过程中与生物膜直接接触,且可在管网中停留数小时乃至数天,若受到二次污染,将导致用户端水质恶化,因此,供水管网内生物膜对水质的影响备受关注,对此的研究也愈来愈多.而对于管网内生物膜与余氯衰减交互作用的研究较少.本文通过动态模拟试验,研究了余氯对生物膜形成的影响及生物膜作用下的余氯衰减规律.本研究成果对供水管网氯消毒的控制、氯衰减模型的建立及水质安全保障具有重要的指导意义[6-8].
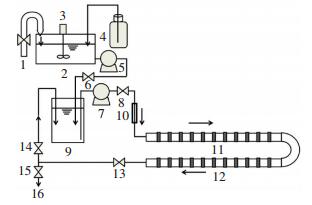
1 实验 1.1 实验装置采用的供水管网模拟装置及各部分构造如图 1所示.根据目前管网材质的调研结果,选择铸铁、PE、不锈钢作为研究管材,分别制作各研究管材的挂片.铸铁管材挂片为长12 cm,宽2.5 cm,厚0.9 cm的矩形,由DN50的新管道加工而成;PE管材挂片长10 cm,由外径32 mm、壁厚3 mm的新管道加工而成;不锈钢管材挂片长12.5 mm,由外径20 mm、壁厚1 mm的新管道加工而成,挂片制作方式如图 2所示.模拟管网总长5 m,挂片置于辅助管段内,辅助管段采用医用PVC管.
|
1—自来水; 2—高位水箱; 3—搅拌装置; 4—消毒剂投加装置; 5、7—水泵; 6、8、13、14、15—阀门; 9—低位水箱; 10—流量计; 11、12—管段生物膜反应器; 16—排水口 图 1 管道模拟系统示意 Figure 1 Schematic diagram of pipelines |

|
图 2 试验管段实物 Figure 2 Experimental pipes |
实验采用市政管网的自来水,水质状况如表 1所示.高位水箱材质为304不锈钢,容积为1.2 m3,低位水箱材质为PVC,容积为30 L,水在高位水箱内与消毒剂混合稳定,由高位水箱进入低位水箱后,在水泵的作用下在模拟管网及低位水箱内循环.流速的测定采用容积法,可通过调节阀门改变流速.
| 表 1 进水水质 Table 1 Water quality of experimental water |
为了便于实验运行和比较,共制作了图 1所示的12套实验装置,实验在12套装置内平行进行,各装置管材及投氯量如表 2所示.从水厂的投氯量角度考虑选择1 mg/L, 从耐氯菌的特性研究考虑选择3,4 mg/L两个质量浓度.实验装置于8月初开始运行.
| 表 2 各装置管材及投氯量 Table 2 Pipe material and chlorine dosage in each equipment |
采用异养菌平板计数法(HPC),具体步骤如下:
1) 样品采集.取下实验装置中的一段实验管段,用灭菌的去离子水冲洗后放入装有无菌蒸馏水的广口瓶中,将广口瓶置于超声波振荡器中,功率设置为80 W振荡2 min,间歇2 min,如此重复5次;2) 样品稀释.利用倍比稀释法将水样稀释到需要的质量浓度;3) 接种.取上述稀释菌液0.5 mL接种到准备好的培养皿中,用涂棒将水样均匀涂于培养皿表面,并用封口膜封住平板,每个稀释度3个平行样;4) 培养.于25 ℃恒温倒置培养5~7 d;5) 计数.待菌落数目稳定后对菌落数目进行计数,据此计算水样中异养菌数目.
1.2.2 进出水其他水质测定方法试验中温度、浊度、pH、电导率、TOC、总铁等常规指标均按国家标准方法测定[9],余氯的测定方法采用DPD(N, N-二甲基-1, 4-二苯胺)比色法.
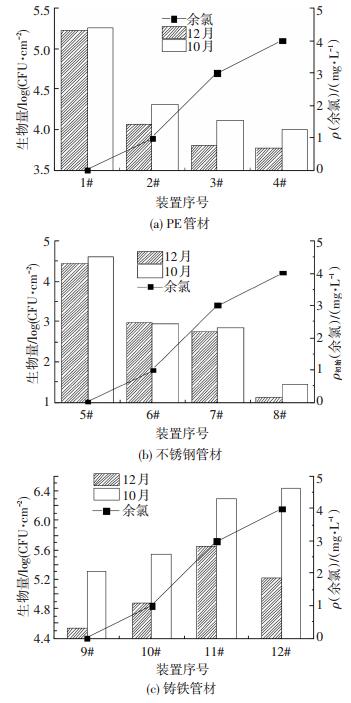
2 结果与讨论 2.1 供水管网内余氯对生物膜生长的影响实验装置先行运行约60 d,此时管壁内生物膜生物量已经稳定,于10月和12月对各装置取样并测定,12月水温约18 ℃,10月水温约26 ℃,图 3分别为1~4号(PE)、5~8号(不锈钢)和9-12号(铸铁)装置管壁生物膜生物量随余氯质量浓度的变化.可以看出,PE、不锈钢、铸铁管材内管壁生物膜细菌密度的对数值分别在3.8~5.3、1.1~4.6、4.5~6.4内,即细菌密度分别为6.0×103~1.81×105、13~4.01×104、3.4×104~2.78×106 cell/cm2.
|
图 3 余氯质量浓度与管壁生物膜生物量的关系 Figure 3 Relation between chlorine concentration and biofilm biomass |
由图 3(a)、(b)可知,PE和不锈钢管内,随着余氯质量浓度的升高,生物量均逐渐降低,二者呈负相关关系.其中,PE管内,10月份和12月份的相关系数分别为0.82和0.71.不锈钢管内,10月份和12月份的相关系数分别为0.85和0.82,生物量受余氯质量浓度影响均较大.也可以看出,温度升高,生物量增大,余氯的衰减也增大.但在PE管中,余氯质量浓度为0和4 mg/L的装置内细菌密度的波动较小,仅相差10倍,而不锈钢管内的变化幅度较大,相差1 000倍以上.
值得注意的是,图 3(c)中,与另外两种管材不同,铸铁管内壁生物膜生物量随余氯质量浓度的升高反而升高,与余氯质量浓度呈正相关关系,10月份和12月份的相关系数分别为0.69和0.96.但是细菌密度波动较小.这是由于铸铁管材容易腐蚀,形成的锈蚀物可增加比表面积,为微生物提供更多安全的栖息地,保护其生长.而PE管材很难被腐蚀,内壁光滑平整,不锈钢管材更是如此.因此,余氯的作用也更明显,更有利于微生物的灭活,管内卫生状况也更好.此外,生物膜培养阶段为高氯环境,使得微生物逐渐形成耐氯性,当加大投氯量时,在管壁内生长的微生物逐渐减少,无耐氯能力的细菌被灭活,这就使存活的微生物能够获得更多的养分和栖息地.
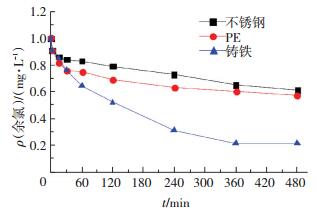
2.2 供水管网内生物膜对氯衰减的影响 2.2.1 管壁生物膜作用下余氯衰减动力学研究以下述条件培养的生物膜作为研究对象:铸铁管材,余氯质量浓度为3 mg/L,流速为0.6 m/s,温度为15 ℃.待生物膜稳定后,投加1 mg/L的氯,并逐时测定余氯质量浓度,得到衰减曲线如图 4所示.可以看出,在生物膜的作用下,余氯的衰减分为快速消耗阶段(0~30 min)和稳定消耗阶段(30 min之后),此现象与氯衰减规律一致[10-11].原因可能是:反应初期,主体水中的余氯与生物膜直接接触并发生氧化还原反应,同时,在水流的冲刷作用下,部分生物膜由管壁脱离进入水中,增大了与余氯接触的机会,反应速率随之增大.生物膜表面易于与氯发生反应的物质随反应的进行逐渐被消耗尽,余氯需要向生物膜内部扩散才能进一步与生物膜发生反应.因此,消耗速度逐渐减慢,进入稳定消耗阶段.

|
生物膜+反应器:管网中总的余氯衰减情况;反应器:去除实验管段后余氯的衰减情况;生物膜余氯衰减曲线=余氯初始质量浓度-(反应器余氯衰减曲线-生物膜反应器余氯衰减曲线) 图 4 生物膜存在条件下的余氯衰减曲线 Figure 4 Chlorine decay with the existence of biofilm |
决定余氯衰减速率的因素为余氯向生物膜内部的扩散速率和余氯与生物膜表明物质之间的反应速率,而后者更快,因此,后者决定了余氯衰减速率.
由图 4可知,稳定消耗阶段,余氯质量浓度与反应时间呈较好的线性关系,因此,该阶段的余氯衰减可由零级反应表征.由图 4还可见,生物膜余氯衰减曲线位于反应器余氯衰减曲线下方,这说明与主体水相比,管壁对余氯衰减的影响要大得多.这是由于生物膜中聚集了大量的有机物质,远多于主体水中的量,且随着微生物的生长,不断分泌胞外物质,使得生物膜不断增厚,死亡的微生物也可与氯发生反应[12].这也是余氯衰减模型的建立要考虑管壁衰减的原因.
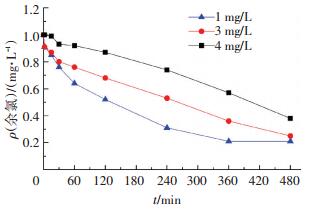
2.2.2 生物膜与余氯反应的影响因素分析1) 管材的影响.将1 mg/L余氯质量浓度下培养的生物膜作为研究对象.待生物膜稳定后,投加1 mg/L的氯,并逐时测定余氯质量浓度,得到余氯衰减曲线,如图 5所示,余氯衰减情况如表 3所示.本研究中的余氯消耗系数是指余氯衰减一级模型中的系数k(ρ=ρ0×e-kt),k值的确定是通过Excel软件,对余氯质量浓度和时间拟合得到.
|
投氯量为1 mg/L 图 5 不同管材培养的生物膜作用下余氯衰减曲线 Figure 5 Chlorine decay with the existence of biofilm developed in different pipe materials |
| 表 3 不同管材生物膜生物量及余氯衰减情况 Table 3 Biofilm biomass and chlorine decay coefficient in different pipe materials |
由图 5和表 3可知,在快速消耗阶段,PE、铸铁管内生物膜作用下的氯衰减状况基本一致,氯消耗量及余氯衰减系数均大于不锈钢管.在稳定消耗阶段,铸铁管内余氯消耗速率明显大于PE、不锈钢管材,是后者的3~4倍,PE、不锈钢管壁内生物膜对余氯衰减速率的影响非常接近.可见,在3种管材培养的生物膜中,铸铁管的影响最大,PE管第二,不锈钢管影响最小.这也是由于铸铁管易腐蚀,可为微生物提供庇护所,而PE和不锈钢管不易腐蚀,内壁光滑,这与Van der Kooij等的研究结论一致[13].
2) 生物多样性的影响.由研究知,铸铁管内的余氯质量浓度对生物膜多样性及细菌种类影响较大[14-15],因此,在1、3和4 mg/L余氯质量浓度下培养生物膜并作为研究对象,考察生物多样性对余氯衰减的影响.待生物膜稳定后,投加1 mg/L的氯,保持实验条件为:流速0.6 m/s,温度15 ℃,并逐时测定余氯质量浓度,得到余氯衰减曲线(如图 6所示),余氯衰减情况如表 4所示.
|
图 6 生物膜作用下余氯衰减曲线(铸铁) Figure 6 Chlorine decay with the existence of biofilm developed in different chlorine concentration (cast iron) |
| 表 4 不同余氯质量浓度下培养的生物膜生物量以及余氯衰减情况(铸铁) Table 4 Biofilm biomass and chlorine decay coefficient with the existence of biofilm developed in different chlorine concentration (cast iron) |
由图 6、表 4可知,在快速消耗阶段,随着余氯质量浓度的增加,余氯的衰减量不断减少;在稳定消耗阶段,随着余氯质量浓度的增加,余氯的衰减系数变化不大.说明生物多样性对余氯衰减速率影响不大,上述现象可用生物进化理论解释.在生物膜的培养过程中,微生物已经适应了高氯质量浓度,具备了一定的抗氯性,能够抵抗余氯的灭活作用,且随着培养环境余氯质量浓度的提高,这种抗氯性愈加显著.也有学者得到类似的结论[3, 16-17].
3) 生物膜生物量的影响.以0、1、3、4 mg/L余氯质量浓度下、PE和不锈钢管内培养生物膜作为研究对象,考察生物量对余氯衰减的影响.待生物膜稳定后,投加1 mg/L的氯,并逐时测定余氯质量浓度,得到余氯衰减曲线如图 7所示.由表 5、图 7可知,在稳定消耗阶段,随着余氯质量浓度的升高,PE管内余氯衰减系数不断减小,投氯量为0和4 mg/L时余氯衰减系数相差6倍.不锈钢管内余氯衰减系数更为接近.
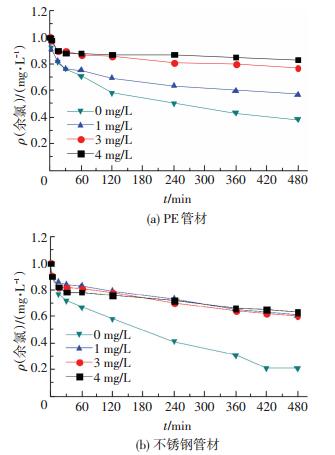
|
图 7 4种余氯条件下培养的生物膜影响下余氯衰减曲线 Figure 7 Chlorine decay with the existence of biofilm developed in different chlorine concentration |
| 表 5 不同余氯质量浓度下培养的生物膜生物量以及余氯衰减情况 Table 5 Biofilm biomass and chlorine decay coefficient with the existence of biofilm developed in different chlorine concentration (PE, stainless steel) |
PE、不锈钢管内余氯衰减系数与生物膜生物量的关系如图 8所示.可以看出,两种管材内,相关性系数都较高,表明二者的正相关关系较显著.这是由于微生物在生长过程中不断分泌胞外物质用以保护自身免受外界影响,同时黏附水中有机物,因此,生物膜中生物量的多少从某种程度上反映了水中有机物的数量,这些物质均可与余氯发生反应,因此,生物膜的生物量与余氯衰减之间必然存在紧密联系.也有学者得到类似结论[18-20].
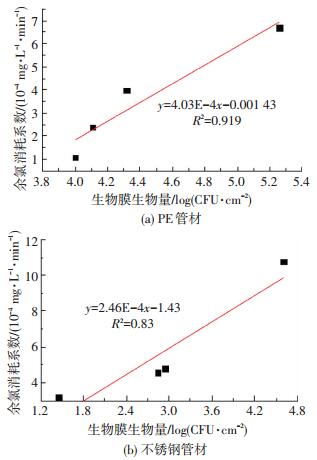
|
图 8 生物膜生物量与余氯消耗系数的关系 Figure 8 Relation between biofilm biomass and chlorine decay coefficient |
4) 流速的影响.以1 mg/L余氯质量浓度下、不锈钢管内培养生物膜并作为研究对象.分别测定流速为0.4和0.6 m/s时余氯的衰减情况,得到余氯衰减曲线(如图 9所示).快速衰减阶段,与0.4 m/s相比,流速为0.6 m/s时余氯衰减较大;稳定消耗阶段,与0.4 m/s相比,流速为0.6 m/s时余氯衰减速率较大.这可从流体力学的角度解释:一方面,流速增大,水流对生物膜的冲刷作用增大,将有更多的生物膜脱离管壁进入主体水,增加了反应的几率;另一方面,流速增大,管内壁黏性底层变薄,氧和余氯通过该层的扩散补给更容易,因此,促进了反应的进行,增加了氯的消耗.
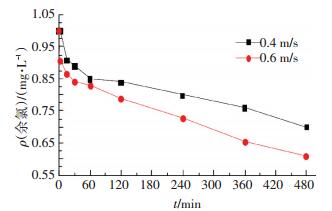
|
图 9 生物膜作用下流速对氯衰减的影响 Figure 9 Influence of velocity on chlorine decay with the existence of biofilm |
5) 初始氯质量浓度的影响.以1 mg/L余氯质量浓度下、PE管内培养生物膜作为研究对象.分别测定初始氯质量浓度为1、2 mg/L时余氯的衰减情况(如图 10所示).在快速消耗阶段,投氯量为1 mg/L时,余氯质量浓度降低了24%,投氯量为2 mg/L时,余氯质量浓度降低了13%;在稳定消耗阶段,与1 mg/L相比,投氯量为2 mg/L时,余氯衰减速率系数更大,是前者的9倍.可见,增加投氯量在初期并不能引起余氯消耗的加快,因为这段时间内增加余氯消耗量的主要因素是有机物质的量,而在后期,余氯衰减速率更快,因为增大投氯量使得生物膜与主体水中余氯质量浓度的差值增大,扩散速度增大.
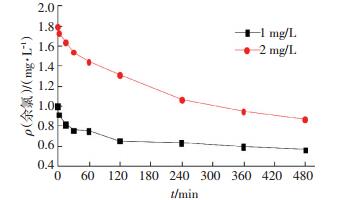
|
图 10 生物膜作用下初始氯质量浓度对余氯衰减的影响 Figure 10 Influence of chlorine dosage on chlorine decay with the existence of biofilm |
1) PE和不锈钢管内,随着余氯质量浓度的升高,生物量均逐渐降低,而铸铁管内生物膜生物量随着余氯质量浓度的升高反而升高.
2) 在生物膜作用下,余氯衰减分为快速消耗阶段(0~30 min)和稳定消耗阶段(30 min之后);在3种管材培养的生物膜中,铸铁管的影响最大,PE管第二,不锈钢管影响最小.
3) 生物膜的生物多样性对余氯衰减速率影响不大,而生物量与余氯衰减之间关系密切;流速对余氯衰减影响较大,初始氯质量浓度对余氯的稳定消耗阶段具有较大影响.
4) 高氯环境下培养的生物膜适应了氯的存在,具有一定抗氯性,这也可证明管网内耐氯菌存在的可能性.
| [1] |
袁一星, 赵洪宾, 赵明. 给水管网生长环的研究[J].
哈尔滨建筑大学学报, 1998, 31(1): 72-76.
YUAN Yixing, ZHAO Hongbin, ZHAO Ming. Study on growth ring in water supply system[J]. Journal of Harbin University of Civil Engineering and Architecture, 1998, 31(1): 72-76. |
| [2] |
李欣, 王郁萍, 赵洪宾, 等. 给水管道生长环的防治与冲洗[J].
哈尔滨建筑大学学报, 2002, 35(6): 30-32.
LI Xin, WANG Yuping, ZHAO Hongbin, et al. Control and flush of growth ring[J]. Journal of Harbin University of Civil Engineering and Architecture, 2002, 35(6): 30-32. |
| [3] |
李爽, 张晓健. 给水管壁生物膜的生长发育及其影响因素[J].
中国给水排水, 2003, 19(13): 49-52.
LI Shuang, ZHANG Xiaojian. Formation and influences of biofilm in pipe walls[J]. China Water and Wastewater, 2003, 19(13): 49-52. |
| [4] |
吴红伟, 刘文君, 贺北平, 等. 配水管网中管垢的形成特点和防治措施[J].
中国给水排水, 1998, 14(3): 37-40.
WU Hongwei, LIU Wenjun, HE Beiping, et al. Formation and contral of pipe scale in WDN[J]. China Water and Wastewater, 1998, 14(3): 37-40. |
| [5] |
祝万鹏, 杨志华, 蒋展鹏, 等. 城市自来水系统碳酸盐平衡与阻垢技术[J].
水处理技术, 1994, 20(3): 156-162.
ZHU Wanpeng, YANG Zhihua, JIANG Zhanpeng, et al. Carbonate balance and scale inhibition of WDN[J]. Water Treatment Technology, 1994, 20(3): 156-162. |
| [6] |
袁一星, 钟丹. 速率系数可变模型的建立及其性能研究[J].
哈尔滨工业大学学报, 2010, 42(10): 1559-1563.
YUAN Yixing, ZHONG Dan. Establishment and performance of variable rate coefficient model[J]. Journal of Harbin Institute of Technology, 2010, 42(10): 1559-1563. DOI: 10.11918/j.issn.0367-6234.2010.10.009 |
| [7] |
BOCCELLI D L, TRYBY M E, UBER J G, et al. A reactive species model for chlorine decay and THM formation under rechlorination conditions[J].
Water Research, 2003, 37(11): 2654-2666.
DOI: 10.1016/S0043-1354(03)00067-8 |
| [8] |
OSTFEID A. Enhancing water distribution system security through modeling[J].
Journal of Water Resources Planning and Management, 2006, 132(4): 209-210.
DOI: 10.1061/(ASCE)0733-9496(2006)132:4(209) |
| [9] |
国家环保总局.
水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.
State Environmental Protection Administration. Monitoring and analysis method of water and wastewater[M]. 4th ed. Beijing: China Environmental Science Press, 2002. |
| [10] |
钟丹. 给水管网余氯衰减规律及影响因素研究[D]. 哈尔滨: 哈尔滨工业大学, 2009.
ZHONG Dan. Chlorine decay variation and influential factors in water distribution network[D]. Harbin: Harbin Institute of Technology, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10213-2011016066.htm |
| [11] |
JONKERGOUWA P M R, KHU S T, SAVIC D, et al. A variable rate coefficient chlorine decay model[J].
Environ Sci Technol, 2009, 43(2): 408-414.
DOI: 10.1021/es8012497 |
| [12] |
NDIONGUE S, HUCK P M, SLAWSON R M. Effects of temperature and biodegradable organic matter on control of biofilms by free chlorine in a model drinking water distribution system[J].
Water Research, 2005, 39(6): 953-964.
DOI: 10.1016/j.watres.2004.12.019 |
| [13] |
KOOIJ VAN DER D, VEENENDAAL H R, SCHEFFER W J. Biofilm formation and multiplication of Legionella in a model warm water system with pipes of copper, stainless steel and cross-linked polyethylene[J].
Water Research, 2005, 39(13): 2789-2798.
DOI: 10.1016/j.watres.2005.04.075 |
| [14] |
MARTINY A C, JøRGENSEN T M, ALBRECHTSEN H J, et al. Long-term succession of structure and diversity of a biofilm formed in a model drinking water distribution system[J].
Applied and Environmental Microbiology, 2003, 69(11): 6899-6907.
DOI: 10.1128/AEM.69.11.6899-6907.2003 |
| [15] |
管运涛, 赵婉婉, 蒋展鹏, 等. 给水系统附生生物膜发育的生物量和种群结构[J].
清华大学学报(自然科学版), 2007, 47(6): 818-821.
GUAN Yuntao, ZHAO Wanwan, JIANG Zhanpeng. Biomass and community structure of biofilm development in drinking water distribution system[J]. J Tsinghua Univ(Sci & Tech), 2007, 47(6): 818-821. |
| [16] |
CHAVES S L, VIEIRA S M, JOÃO M. Influence of the diversity of bacterial isolates from drinking water on resistance of biofilms to disinfection[J].
Applied and Environmental Microbiology, 2010, 76(19): 6673-6679.
DOI: 10.1128/AEM.00872-10 |
| [17] |
陈雨乔. 饮用水系统中耐氯性细菌消毒特性及机理研究[D]. 北京: 清华大学, 2011: 37-38.
CHEN Yuqiao. Disinfection characteristics and mechanisms of chlorine resistant bacterial in drinking water system[D]. Beijing: Tsinghua Univ, 2011:37-38. http://cdmd.cnki.com.cn/Article/CDMD-10003-1012036159.htm |
| [18] |
尤作亮, 徐洪福, 曲志军. 配水管网中水质变化规律及主要影响因素分析[J].
给水排水, 2005, 31(1): 21-26.
YOU Zuoliang, XU Hongfu, QU Zhijun. Water quality variations and its influences[J]. Water Supply and Drainage, 2005, 31(1): 21-26. |
| [19] |
FREDERIK H, CORDULA B, OLIVER K, et al. Assessing biological stability of drinking water without disinfectant residuals in a full-scale water supply system[J].
Journal of Water Supply: Research and Technology—AQUA, 2010, 59(1): 31-40.
DOI: 10.2166/aqua.2010.052 |
| [20] |
张晓健, 唐峰, 王生辉. 给水管网内生物膜影响化合氯消耗的研究[J].
中国给水排水, 2006, 22(17): 1-4.
ZHANG Xiaojian, TANG Feng, WANG Shenghui. Influence of biofilm on combined chlorine consumption[J]. China Water and Wastewater, 2006, 22(17): 1-4. DOI: 10.3321/j.issn:1000-4602.2006.17.001 |
 2017, Vol. 49
2017, Vol. 49


