药物与个人护理用品(简称PPCPs)广泛应用于人类和兽类医药、农业及水产养殖业中.其通过医疗废水与生活污水处理厂排放的出水到达生态环境,并以垃圾渗滤液、制造过程残余等方式进入环境,导致地表水、地下水、饮用水中多次检测出PPCPs母体化合物及其代谢产物[1].双氯芬酸钠是一种典型的PPCP类物质,尽管毒性较低,但当其与其他药物共存时产生耦合作用,毒性将被增强.然而污水处理厂和自来水厂常规处理工艺并不能有效地去除双氯芬酸钠,且传统生物处理技术与化学氧化技术降解可生化性差、相对分子质量较大、难氧化的有机物时较困难且去除效率低,难以满足要求,所以,研究双氯芬酸钠在高级氧化工艺中的降解和转化对保障水质安全具有重要的意义.1987年Glaze等[2]将可以产生大量羟基自由基从而净化水质的水处理技术定义为高级氧化技术(advanced oxidation process, AOPs),主要包括Fenton法、湿式氧化法、超临界水法、电解氧化法、O3氧化法与光化学氧化法等.近年来,利用激活过硫酸盐的高级氧化技术降解难降解有机物成为一个新的研究热点.紫外光(UV)辐照作为饮用水消毒技术,实践证明为一种高效且相对绿色的工艺.而基于UV的高级氧化水处理技术已经被广泛运用于有机污染物去除的研究和运用中.本文利用UV激活过硫酸盐对水环境中的双氯芬酸钠进行降解,从不同PS投量、底物质量浓度、溶液pH、水中阴离子质量浓度和腐植酸投加量方面对反应效果进行试验研究,为UV活化过硫酸盐降解水环境中PPCPs类有机污染物的应用提供技术理论支撑.
1 实验 1.1 实剂与装置双氯芬酸钠(纯度≥98%,HPLC级别)购自aladdin公司;HPLC所用流动相试剂乙醇(EtOH,纯度≥99.7%)、乙腈(色谱纯)和甲酸(色谱纯)购自美国Sigma-Aldrich公司;腐植酸(纯度≥99.5%)、过硫酸盐(纯度≥99.5%)、碳酸氢钠、氯化钠、磷酸氢二钠和磷酸二氢钠均购自上海国药集团化学试剂有限公司;如无特殊说明,试验中涉及的其他化学物质均为分析纯.试验中所有溶液均使用超纯水配制(Milli-Q净水系统制备,电导率为18 MΩ·cm).
1.2 实验方法在考察溶液pH对该工艺降解双氯芬酸钠影响的试验中,溶液pH变化范围为3至11,通过磷酸氢二钠和磷酸二氢钠调节pH,研究其他因素对反应的影响时pH均保持初始pH不作调整.本试验以2个直径为90 mm的玻璃皿为反应容器,紫外光源(主波长为254 nm)利用功率为75 W的低压汞灯提供.为保证反应时紫外光照射强度稳定,试验开始前将紫外辐照装置开启预热60 min.试验时向反应容器中加入100 mL一定质量浓度的双氯芬酸钠溶液,在一定量的过硫酸盐溶液加入反应器时反应开始,当反应进行至5、10、20、30、45和60 min时利用注射器取样1 mL,每次预先在棕色的液相小瓶中加入50 μL乙醇作为淬灭剂终止反应继续进行.
1.3 分析方法采用HPLC测定双氯芬酸钠含量,UV检测器检测波长为230 nm,流动相采用乙腈与甲酸溶液(质量分数为0.10%),两者体积比为60:40,流动速率1.0 mL/min,柱温为35 ℃.高效色谱仪配UV检测器(VWD-FLD),色谱柱采用岛津公司产品Symmol/Letry C18色谱柱(250 mm×4. 6 mm×5 μm).LC-MS/MS分析产物过程中HPLC条件:流动相为乙腈和含0.1%甲酸溶液,流动相流速为0.2 mL/min,柱温35 ℃,进样体积10 μL.质谱的分析条件:采用全扫模式对双氯芬酸钠的降解产物进行检测分析,扫描范围的m/z为50~500,质谱电离源为加热电喷雾电离正源(ESI+).采用二级碰撞解离模式(CID),载气为高纯氮气,碰撞气为氩气(体积分数为99.999%),碰撞温度为300 ℃.高效液相色谱串联质谱(LC-MS/MS),配有MGIII C18色谱柱(100 mm×2.1 mm×5 μm).试验中涉及的所有物质的质量使用电子天平(FA1004) 进行称量;溶液的pH与温度均使用梅特勒-托利多(Mettler Toledo)pH计测定.
1.4 反应动力学在紫外光照射下,PS在水溶液中会被激活产生可迅速将大多数目标污染物降解使其矿化成二氧化碳、水和无机酸等的活性基团SO4-· [3-4],并且引发一系列的链式反应生成多种活性物质[5-7].反应式如下:
| $ {{\rm{S}}_2}{\rm{O}}_8^{2-} + {\rm{hv}} \to {\rm{2SO}}_4^-\cdot, $ | (1) |
| $ {\rm{S}}{{\rm{O}}_4}^ - \cdot + {\rm{S}}{{\rm{O}}_4}^ - \cdot \to {{\rm{S}}_2}{{\rm{O}}_8}^{2 - }, $ | (2) |
| $ {\rm{S}}{{\rm{O}}_4}^ - \cdot + {{\rm{S}}_2}{{\rm{O}}_8}^{2 - } \to {\rm{S}}{{\rm{O}}_4}^{2 - } + {{\rm{S}}_2}{{\rm{O}}_8}^ - , $ | (3) |
| $ {\rm{S}}{{\rm{O}}_4}^ - \cdot + {{\text{H}}_2}{\text{O}}\overset {} \leftrightarrows \cdot {\text{OH + }}{{\text{H}}^ + } + {\rm{S}}{{\rm{O}}_4}^{2 - }, $ | (4) |
| $ {\rm{S}}{{\rm{O}}_4}^ - \cdot + \cdot {\rm{OH}} \to {\rm{HS}}{{\rm{O}}_5}^ - , $ | (5) |
| $ {\rm{S}}{{\rm{O}}_4}^ - \cdot + {\rm{HS}}{{\rm{O}}_5}^ - \to {\rm{S}}{{\rm{O}}_5}^ - \cdot + {\rm{HS}}{{\rm{O}}_4}^ - , $ | (6) |
| $ \cdot{\rm{OH}} + {\rm{HS}}{{\rm{O}}_5}^ - \to {\rm{S}}{{\rm{O}}_5}^ - \cdot + {{\rm{H}}_2}{\rm{O}}, $ | (7) |
| $ 2{\rm{S}}{{\rm{O}}_5}^ - \cdot \to {{\rm{S}}_2}{{\rm{O}}_8}^{2 - } + {{\rm{O}}_2}, $ | (8) |
| $ \cdot{\rm{OH}} + {{\rm{S}}_2}{{\rm{O}}_8}^{2 - } \to {{\rm{S}}_2}{{\rm{O}}_8}^ - \cdot + {\rm{O}}{{\rm{H}}^ - }. $ | (9) |
在UV激活过硫酸盐过程中,各种活性物质都会与目标污染物发生反应,使得动力学反应较为复杂,但其他活性物质与SO4-·相比含量较少,可忽略不计,从而利用拟一级动力学描述.底物质量浓度ρ的变化利用准一级动力学反应式-dρ/dt=kobs·ρ来表示,在紫外活化PS过程中,ρ表示反应中任意时刻双氯芬酸钠的质量浓度,ρ0表示双氯芬酸钠初始的质量浓度,kobs为拟一级速率常数(min-1),可由下式描述:
| $ -{\rm{d}}\rho /{\rm{d}}t = {k_{{\rm{obs}}}} \cdot \rho \;或\;-\ln \left( {\rho /{\rho _0}} \right) = {k_{{\rm{obs}}}} \cdot t. $ | (10) |
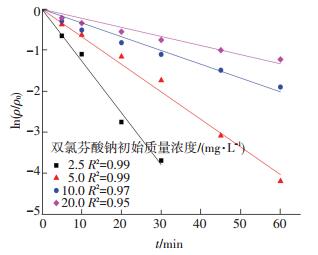
反应控制PS投加量为1.0 mmol/L,反应底物质量浓度分别为2.5、5.0、10.0和20.0 mg/L时,对UV激活PS降解双氯芬酸钠的影响如图 1、2所示.图中R2为相关系数,kobs为准一级反应速率常数.研究发现,在不同的目标污染物质量浓度下,PS投加量为1.0 mmol/L时,所有反应均符合准一级动力学模型(R2≥0.95).当双氯芬酸钠初始质量浓度为2.5、5.0、10.0和20.0 mg/L时,该反应60 min时的去除率分别为100% (45 min时双氯芬酸钠质量浓度已低于仪器检出限)、98.5%、85.8%和70.6%.随着底物初始质量浓度递增,去除率逐渐减小.与此同时,该反应的准一级反应速率常数也从0.126 3 min-1减小到0.022 2 min-1.这主要是由于过硫酸盐投加量和UV辐照强度相同,从而产生了几乎等量的SO4-·,但双氯芬酸钠初始质量浓度的降低使得单位体积内的双氯芬酸钠分子数量减少,所以单个双氯芬酸钠分子接触到的SO4-·数量越多,进而使得该反应去除率随着底物质量浓度的降低而增加.高乃云等[8]的研究中也报道了类似结果,在UV激发条件下,S2O82-产生了SO4-·并和底物安替比林进行反应.
|
图 1 双氯芬酸钠初始质量浓度对反应的影响 Figure 1 Effect of initial concentration of diclofenac sodium |

|
图 2 双氯芬酸钠初始质量浓度与去除率及kobs的关系 Figure 2 Effect of initial concentration of diclofenac sodium on the removal rate and kobs |
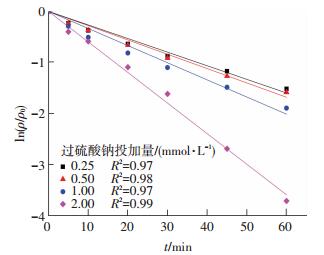
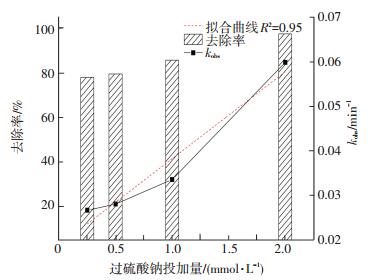
反应控制双氯芬酸钠质量浓度为10.0 mg/L,向反应液中加入不同物质量的过硫酸盐使得过硫酸盐投加量分别为0.25、0.50、1.00和2.00 mmol/L.过硫酸盐投加量对UV激活过硫酸盐降解双氯芬酸钠的影响如图 3所示.可以看出,不同的过硫酸盐投加量下,双氯芬酸钠质量浓度为10.0 mg/L时,所有反应均符合准一级动力学模型.随着过硫酸盐投加量的增加反应速率常数与去除率均逐步增加.当过硫酸盐投加量由0.25 mmol/L增加到2.00 mmol/L时,该反应的反应速率常数由0.026 7增加到0.059 9 min-1,去除率由78.1%增加到97.6%.这主要是因为随着氧化剂过硫酸盐投加量的增加系统中产生了更多的SO4-·自由基,从而更有效地降解了目标污染物.同时,通过拟合反应速率常数与氧化剂投加量发现,过硫酸盐投加量与反应速率常数呈线性关系(R2=0.95),结果如图 4所示.Zhang等[9]在研究UV/H2O2工艺对17α-乙炔基雌二醇的降解中也发现底物的降解速率常数和氧化剂投加量符合线性关系.
|
图 3 过硫酸盐投加量对双氯芬酸钠降解的影响 Figure 3 Effect of different sodium persulfate dosages |
|
图 4 过硫酸盐投加量与反应去除率及kobs的关系 Figure 4 Effect of different sodium persulfate dosages on the removal rate and kobs |
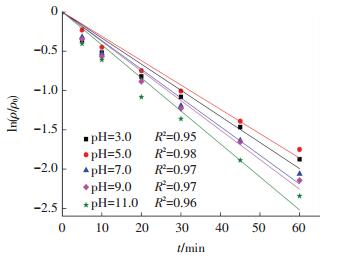
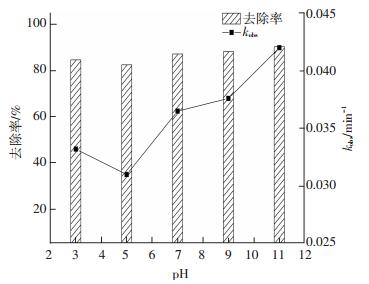
反应控制双氯芬酸钠质量浓度为10.0 mg/L,过硫酸盐投加量为1.0 mmol/L,利用磷酸氢二钠和磷酸二氢钠缓冲盐调节溶液pH分别为3.0、5.0、7.0、9.0和11.0.UV激活过硫酸盐降解双氯芬酸钠体系去除效果随pH变化见图 5、6.
|
图 5 pH对双氯芬酸钠降解的影响 Figure 5 Effect of pH on diclofenac sodium degradation |
|
图 6 pH与反应去除率及kobs的关系 Figure 6 Effect of pH on the removal rate and kobs |
由图 5可知,pH在3.0至11.0的范围内变化时,UV激活过硫酸盐去除双氯芬酸钠的反应均符合准一级在动力学模型(R2≥0.95).由图 6可知,当反应时间为60 min时,随着pH从3.0增加到5.0,反应中kobs值从0.033 2 min-1减小到0.031 0 min-1,但在pH逐步从5.0增至7.0、9.0和11.0的过程中,kobs值随之逐渐增加到0.036 5、0.037 6和0.042 0 min-1.试验同时表明,该工艺对双氯芬酸钠的降解效率也呈现先减小再增大的趋势,去除率分别为84.7%、82.6%、87.3%、88.3%和90.4%.显然,在60 min后利用UV激活过硫酸盐在不同的pH条件下都可以有效降解水体中的双氯芬酸钠.并且该反应总体的趋势是随pH的增加去除率与反应速率常数逐步增大,在pH=5.0时的小幅下降也许是因为试验或仪器检测误差所致.随着pH的升高,溶液碱性增强,双氯芬酸钠降解速率增大的主要原因为:pH越高溶液碱性越强,过硫酸盐会发生碱激活从而生成一定量的硫酸根自由基[10];在氢氧根存在条件下,硫酸根自由基会和氢氧根反应生成羟基自由基,而羟基自由基具有比硫酸根自由基更高的氧化还原电位(E(·OH)=2.80 V),因此,对底物的去除效率更高[11].
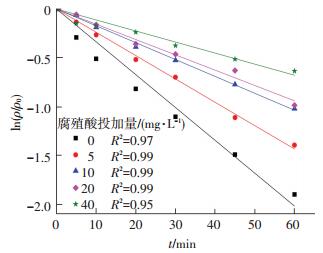
2.4 腐殖酸的影响在实际水体中存在有各种有机物,对目标污染物的降解去除产生重要影响.因此,在溶液中投加一定量的腐殖酸模拟实际水体对研究该高级氧化技术具有重要意义.在双氯芬酸钠初始质量浓度为10.0 mg/L、过硫酸盐投加量为1.0 mmol/L的条件下,考察当溶液中腐殖酸质量浓度分别为0、5.0、10.0、20.0和40.0 mg/L时UV/PS工艺对双氯芬酸钠的降解情况.如图 7、8所示,UV激活过硫酸盐降解双氯芬酸钠与准一级动力学模型相符.该工艺降解双氯芬酸钠的反应速率常数随腐殖酸投加量的增加不断减小.在腐殖酸投加量为0、5.0、10.0、20.0和40.0 mg/L时,对应的反应速率常数为0.033 6、0.023 9、0.017 3、0.015 7和0.011 3 min-1.同时, 对双氯芬酸钠的去除率也随腐殖酸投加量从0 mg/L增加到40.0 mg/L而由85.8%降低至47.0%.研究结果表明,腐殖酸会和目标污染物发生反应,如吸附、催化及竞争等,从而影响底物的降解[12].显见,在该反应中主要是因为腐殖酸与双氯芬酸钠竞争溶液中产生的SO4-·,并且随着腐殖酸投加量的加大其竞争能力增强,从而导致双氯芬酸钠去除率的迅速降低.Roshani等[13]在研究电子射辐照激活过硫酸盐降解苯并三氮唑研究中也发现,腐殖酸的存在会明显抑制对目标污染物的降解反应.
|
图 7 腐殖酸投加量对双氯芬酸钠降解的影响 Figure 7 Effect of HA dosages on diclofenac sodium degradation |

|
图 8 腐殖酸投加量与反应去除率及kobs的关系 Figure 8 Effect of HA dosages on the removal rate and kobs |
自然水体中广泛存在各种阴离子,其对高级氧化技术去除污染物有一定影响,因此,选取两种在水体中最常见的氯离子与碳酸氢根离子作为影响因素,研究不同的氯离子与碳酸氢根离子质量浓度对UV激活过硫酸盐降解双氯芬酸钠的影响.反应控制双氯芬酸钠质量浓度为10.0 mg/L,过硫酸盐投加量为1.0 mmol/L,将一定物质量的NaCl与NaHCO3投加至溶液中使得两种阴离子浓度分别为0、25.0、50.0、100.0和200.0 mmol/L.试验结果如表 1所示.
| 表 1 两种阴离子对双氯芬酸钠去除率和kobs的影响 Table 1 Effects of anions on the removal rate and kobs |
由表 1可知:无论是在溶液中加入氯离子还是碳酸氢根离子,随着阴离子浓度的升高,双氯芬酸钠的去除率与kobs都呈现比较复杂的变化.对于加入氯离子,其对UV激活过硫酸盐降解双氯芬酸钠主要起到抑制作用,试验中加入的氯离子浓度范围内去除率下降幅度小于6%.双氯芬酸钠降解被抑制主要可能是因为氯离子与双氯芬酸钠竞争硫酸根自由基,使得与双氯芬酸钠反应的硫酸根数量减少;并且氯离子与硫酸根自由基反应产生的氯自由基氧化还原电位又明显低于硫酸根自由基,导致了降解双氯芬酸钠的反应速率常数与去除率降低[14].Anipsitakis等[15]在研究中也发现了类似的现象.而碳酸氢根离子对该系统降解双氯芬酸钠总体起促进作用,在碳酸氢根离子浓度为25.0 mmol/L时达到最大,此时去除率为91.8%,kobs达0.043 3 min-1.但随着碳酸氢根离子浓度的进一步增加至200.0 mmol/L,kobs与去除率分别逐步下降至0.037 3 min-1与87.0%.导致这一现象也许是因为一定量碳酸氢根离子的加入使得溶液pH升高,产生碱激活从而促进反应的进行;但随着碳酸氢根离子浓度的进一步增加,过高的离子强度降低了溶液中自由基等活性物质的活性,从而去除效果有了小幅的下降[16].
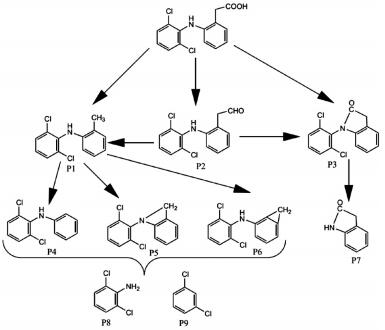
2.6 降解产物分析之前的文献报道主要是围绕氯氧化、臭氧氧化、辐照降解等方式,分析双氯芬酸钠的降解产物与中间降解过程,并未涉及硫酸根自由基对于双氯芬酸钠降解产物的分析.本研究利用LC-MS/MS分析结果与相关文献报道,得出了紫外激活过硫酸盐降解双氯芬酸钠过程中产生的中间产物以及可能的降解路径.结果如图 9所示,各物质名称见表 2.
|
图 9 UV激活过硫酸盐去除双氯芬酸钠可能的降解路径 Figure 9 Proposed diclofenac sodium transformation pathways in UV/PS system |
| 表 2 主要中间产物名称 Table 2 List of major intermediate products |
由图 9可知,UV激活过硫酸盐降解双氯芬酸钠系统中检测出9种中间产物,主要有1-(2, 6-二氯苯基) -2吲哚酮、N-苯基-2, 6-二氯苯胺、2-二氢吲哚酮及醛类物质等.UV激活水中的过硫酸盐产生大量SO4-·及其他活性基团,这些活性基团将快速与目标污染物发生加成、取代及羧化等反应.双氯芬酸钠在SO4-·的作用下,发生去羧基反应与去羟基反应分别生成产物P1, P2.刘群等[17]在研究辐照降解水中双氯芬酸钠时也发现了同样的中间产物P1, P2.产物P3是底物在SO4-·等活性物质作用下脱水或在P2产物的基础上脱氢生成的吲哚酮类物质.Hartmann等[18]在超声降解水中双氯芬酸的研究中也发现了产物P3.产物P4可能是产物P1经过脱甲基反应生成的,而产物P5、P6是产物P1发生脱氢反应形成的.当P3、P4等中间产物中C—N键在SO4-·等活性基团的作用下断裂,可能会生成P7、P8和P9等产物.
3 结论1) UV激活过硫酸盐去除双氯芬酸钠与一级反应动力学规律相符,随着双氯芬酸钠初始质量浓度的增加,反应速率常数逐步减小,并且双氯芬酸钠的去除率在一定的范围内随PS投加量的增加而增大.
2) 溶液不同的pH对该工艺降解双氯芬酸钠具有一定影响,在pH从酸性到碱性的过程中,反应速率常数的总体趋势是逐步增大的.
3) UV活化过硫酸盐去除双氯芬酸钠时,溶液中存在的腐殖酸对反应具有抑制作用,且随腐殖酸投加量的加大,对反应的抑制作用愈加明显.
4) 溶液中的氯离子和碳酸氢根离子都会对UV激活过硫酸盐工艺降解双氯芬酸钠产生影响,碳酸氢根离子总体呈促进作用,而氯离子呈抑制作用.
5) SO4-·与双氯芬酸钠分子发生去羧基、去甲基、脱水与羧化等反应,主要生成1-(2, 6-二氯苯基) -2吲哚酮、N-苯基-2, 6-二氯苯胺、2-二氢吲哚酮及醛类物质等中间产物.
| [1] |
LAVILLE N, AIT-AISSA S, GOMEZ E, et al. Effects of human pharmaceuticals on cytotoxicity, EROD activity and ROS production in fish hepatocytes[J].
Toxicology, 2004, 196(1/2): 41-55.
|
| [2] |
GLAZE W H, KANG J W, CHAPIN D H. The chemistry of water treatment processes involving ozone, hydrogen peroxide and ultraviolet radiation[J].
Ozone: Science & Engineering, 1987, 9(4): 335-352.
|
| [3] |
GU X, LU S, QIU Z, et al. Photodegradation performance of 1, 1, 1-trichloroethane in aqueous solution: In the presence and absence of persulfate[J].
Chemical Engineering Journal, 2013, 215/216: 29-35.
DOI: 10.1016/j.cej.2012.09.132 |
| [4] |
GAO Y, GAO N, DENG Y, et al. Ultraviolet (UV) light-activated persulfate oxidation of sulfamethazine in water[J].
Chemical Engineering Journal, 2012, 195/196: 248-253.
DOI: 10.1016/j.cej.2012.04.084 |
| [5] |
LIANG C J, HUANG S C. Kinetic model for sulfate/hydroxyl radical oxidation of methylene blue in a thermally-activated persulfate system at various pH and temperatures[J].
Sustainable Environment Research, 2012, 22(4): 199-208.
|
| [6] |
GUAN Y H, MA J, LI X C, et al. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfate system[J].
Environment Science & Technology, 2011, 45(21): 9308-9314.
|
| [7] |
WALDEMER R H, TRATNYEK P G, JOHNSON R L, et al. Oxidation of chlorinated ethenes by heat-activated persulfate: Kinetics and products[J].
Environmental Science & Technology, 2006, 41(3): 1010-1015.
|
| [8] |
高乃云, 肖雨亮, 朱延平, 等. UV和UV/过硫酸盐工艺降解安替比林的对比研究[J].
中南大学学报, 2014(9): 3308-3314.
GAO Naiyun, XIAO Yuliang, ZHU Yanping, et al. Comparative study of antipyrine degradation by UV and UV/persulfate system[J]. Journal of Central South University, 2014(9): 3308-3314. |
| [9] |
ZHANG Z, FENG Y, LIU Y, et al. Kinetic degradation model and estrogenicity changes of EE2 (17α-ethinylestradiol) in aqueous solution by UV and UV/H2O2 technology[J].
Journal of Hazardous Materials, 2010, 181(1/2/3): 1127-1133.
|
| [10] |
FURMAN O S, TEEL A L, WATTS R J. Mechanism of base activation of persulfate[J].
Environment Science & Technology, 2010, 44(16): 6423-6428.
|
| [11] |
SANTIAGO E, JAIME G, SANDRA C, et al. Comparison of different advanced oxidation processes for phenol degradation[J].
Water Research, 2002, 36(4): 1034-1042.
DOI: 10.1016/S0043-1354(01)00301-3 |
| [12] |
LATIFOGLU A, GUROL M D. The effect of humic acids on nitrobenzene oxidation by ozonation and O3/UV processes[J].
Water Research, 2003, 37(8): 1879-1889.
DOI: 10.1016/S0043-1354(02)00583-3 |
| [13] |
ROSHANI B, KARPEL V, LEITNER N. Effect of persulfate on the oxidation of benzotriazole and humic acid by e-beam irradiation[J].
Journal of Hazardous Materials, 2011, 190(1/2/3): 403-408.
|
| [14] |
郭佑罗, 关小红, 高乃云, 等. 紫外/过硫酸盐工艺降解水中氯贝酸的研究[J].
中国环境科学, 2016, 36(7): 2014-2019.
GUO Youluo, GUAN Xiaohong, GAO Naiyun, et al. Kinetics of clofibric acid degradation by UV/persulfate system in aqueous solution[J]. China Environmental Science, 2016, 36(7): 2014-2019. |
| [15] |
ANIPSITAKIS G P, DIONYSIOU D D, GONZALEZ M A. Cobalt-mediated activation of peroxymonosulfate and sulfate radical attack on phenolic compounds, implications of chloride ions[J].
Environmental Science & Technology, 2005, 40(3): 1000-1007.
|
| [16] |
HUANG K C, COUTTENYE R A, HOAG G E. Kinetics of heat-assisted persulfate oxidation of methyl tert-butyl ether (MTBE)[J].
Chomosphere, 2002, 49(4): 413-420.
DOI: 10.1016/S0045-6535(02)00330-2 |
| [17] |
刘群, 郑正, 罗兴章, 等. 双氯芬酸钠水溶液的辐照降解[J].
环境化学, 2011, 30(10): 1700-1704.
LIU Qun, ZHENG Zheng, LUO Xingzhang, et al. Irradiation induced degradation of diclofenac in aqueous solution[J]. Environmental Chemistry, 2011, 30(10): 1700-1704. |
| [18] |
HARTMANN J, BARTELS P, MAU U, et al. Degradation of the drug diclofenac in water by sonolysis in presence of catalysts[J].
Chemosphere, 2008, 70(3): 453-461.
DOI: 10.1016/j.chemosphere.2007.06.063 |
 2017, Vol. 49
2017, Vol. 49


